Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2021, № 2, стр. 78-87
Особенности роста кристаллических пленок п-кватерфенила из капель раствора на подложках
Г. А. Юрасик a, *, А. А. Кулишов a, П. В. Лебедев-Степанов a, О. В. Борщев b, В. А. Постников a, **
a ФНИЦ “Кристаллография и фотоника” РАН
119421 Москва, Россия
b Институт синтетических полимерных материалов им. Н.С. Ениколопова РАН
117393 Москва, Россия
* E-mail: yurasik.georgy@yandex.ru
** E-mail: postva@yandex.ru
Поступила в редакцию 18.03.2020
После доработки 17.05.2020
Принята к публикации 20.05.2020
Аннотация
В условиях медленного изотермического испарения растворителя исследованы закономерности образования и роста кристаллических пленок п-кватерфенила из капли раствора на подложке. Исследования влияния температурного фактора показали, что наиболее крупные кристаллические пленки формируются при температуре около 45°С. Установлено, что применение высококипящего растворителя с высоким поверхностным натяжением (1,2,4-трихлорбензола) позволяет формировать монокристаллические пленки значительно большего масштаба, чем при использовании низкокипящего растворителя с более низким поверхностным натяжением (толуола). Методами висячей и сидячей капель исследованы и проанализированы поверхностные свойства растворов в сравнении с чистыми растворителями.
ВВЕДЕНИЕ
Линейные сопряженные полупроводниковые олигомеры представляют большой интерес для органической электроники по причине способности к формированию крупных монокристаллических пластин или пленок в процессе роста из растворов [1–3]. Для развития планарных оптоэлектронных технологий тонкопленочные кристаллические структуры имеют большой потенциал, поскольку по электротранспортным характеристикам не существенно уступают объемным кристаллам [4]. Нанесение на подложку сверхтонких кристаллических пленок органических полупроводников толщиной в один или несколько монослоев можно осуществить с помощью техники Ленгмюр–Блоджетт. В сформированных таким образом кристаллических структурах удается комбинировать эффективный перенос зарядов и люминесценцию [5, 6]. При изготовлении оптоэлектронных устройств большой интерес представляют струйные технологии формирования тонкопленочных полупроводниковых покрытий на основе органических сопряженных олигомеров [7, 8]. Недавно было установлено, что линейные сопряженные олигомеры при высыхании капель раствора на поверхности подложки (метод сидячей капли) способны кристаллизоваться на границе раздела фаз в виде обширных монокристаллических пленок толщиной от одного до нескольких монослоев [9–11]. Сформированные данным способом монокристаллические ультратонкие пленки характеризуются более высокой подвижностью электрических зарядов [10] в отличие от полидисперсных пленок, полученных с помощью техники Ленгмюр–Блоджетт [5]. Однако поверхностно-опосредованная 2D-кристаллизация сопряженных олигомеров на межфазных границах в целом еще явление малоизученное, поэтому недостатком данного подхода являются практически не контролируемое образование центров кристаллизации, слабоуправляемый процесс роста кристаллов в длину и по толщине и связанное с этим отсутствие четкой локализации осажденной кристаллической пленки в заданном месте на подложке. Известно, что нуклеация, приводящая к росту 2D-кристаллов, может происходить как на контактной линии капли с последующим формированием монокристаллической пленки на поверхности раздела раствор–воздух и дальнейшим ее осаждением на подложку при движении контактной линии в результате испарения растворителя (механизм, описанный в [10]), так и на поверхности подложка–раствор вдали от контактной линии [11]. Относительно влияния свойств среды и внешних условий на формирование крупных тонкопленочных кристаллов имеются следующие сведения. Высокие поверхностное натяжение раствора и вязкость способствуют образованию и росту на границе раздела фаз раствор–воздух кристаллических пленок, а при низких значениях данных величин в основном формируются мелкие объемные кристаллики [9, 10]. В работе [11] сообщается, что с ростом температуры увеличивается длина и уменьшается толщина тонкопленочных кристаллов. Однако систематические исследования влияния температурного фактора на особенности роста кристаллических пленок на основе сопряженных линейных олигомеров в литературе практически отсутствуют.
Данная работа посвящена исследованию роста монокристаллических пленок п-кватерфенила (4P) при медленном испарении сидячей капли раствора на стеклянной подложке в зависимости от температуры окружающей среды и типа растворителя. Исследования роста из растворов и кристаллической структуры объемных монокристаллических пленок и пластин 4Р недавно были представлены в работе [3]. В настоящем исследовании п-кватерфенил выступает в качестве модельного объекта как линейный сопряженный олигомер сo сравнительно низкой растворимостью в нормальных условиях (~0.2 г/л в толуоле при 20°С). В дальнейшем запланированы исследования производных 4Р с различными концевыми заместителями, улучшающими растворимость и адсорбционную активность вблизи поверхностного слоя жидкой фазы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для ростовых исследований был использован п-кватерфенил, синтезированный по методике, описанной ранее в работе [3]. Растворы вещества в толуоле (ОСЧ) и 1,2,4-трихлорбензоле (ХЧ) с начальной концентрацией 0.18 г/л подготавливались в стеклянных флаконах объемом 10 мл с помощью ультразвуковой ванны Сапфир-2.8 ТТЦ (Россия) при 50°C до полного исчезновения осадка. После охлаждения до комнатной температуры растворы фильтровались с помощью одноразовых нейлоновых фильтров с диаметром пор 0.16 мкм. По одной капле отфильтрованного раствора 4P объемом 15 мкл наносили на предварительно очищенные изопропанолом (ЧДА) предметные стекла (“Стеклоприбор”, Россия) и высушивали под колпаком в термостатируемых условиях при температурах 25, 35, 45, 55 и 70°C. Для каждого температурного эксперимента было подготовлено по 3 образца подложек с каплями растворов толуола и 1,2,4-трихлорбензола (3ХБ).
Анализ осушенной поверхности подложек был проведен с использованием люминесцентного микроскопа Olympus IX81 (Япония). С помощью программного пакета Fiji на микроизображениях производилась оценка средней площади пяти наиболее крупных монокристаллических областей. Морфологию поверхности и толщину кристаллических пленок п-кватерфенила исследовали с помощью лазерного сканирующего конфокального микроскопа Olympus LEXT OLS3100 и атомно-силовых микроскопов (АСМ) NTEGRA и Solver BIO (NT-MDT, Россия).
Исследования поверхностного натяжения чистых растворителей и растворов, а также краевого угла смачивания капель поверхности стеклянных подложек проводили по методам висячей и сидячей капли на оптическом приборе OCA 15EC (Data Physics Instruments, Германия) при 20°С.
РЕЗУЛЬТАТЫ
Рост кристаллических пленок
В предварительных исследованиях установлено, что при высыхании на стеклянных подложках капель раствора 4Р в толуоле при комнатной температуре наблюдается формирование осажденных кристаллических структур типа “кофейных колец” (coffe-ring stains), соответствующих контуру скачкообразно сжимающейся капли [12–14]. При этом кольцевая структура по периметру капли формируется при закреплении (пиннинге) контактной линии на подложке и практически не формируется при ее перемещении. В качестве примера на рис. 1а представлено конфокальное микроизображение участка осушенной поверхности подложки с двумя кольцевыми структурами (стрелками указано направление движения капли), сформированными из мелкодисперсного кристаллического осадка и кристаллических пленок длиной в несколько сот микрон и толщиной 30–50 нм (рис. 1б). В редких случаях наблюдалось образование крупных монокристаллических пленок длиной до 3 мм (рис. 1в), которые из-за чрезвычайно низкой толщины хорошо различимы только в отраженных лучах в условиях глубокого фазового контраста при использовании DIC-призмы Номарского. В структуре таких пленок характерно наличие пустых ячеек размером в несколько мкм (рис. 1г).
Рис. 1.
Конфокальные микроизображения кристаллических пленок п-кватерфенила на стеклянных подложках: а – кристаллические пленки, сгруппированные в виде кольцевых структур; б – увеличенное изображение кристаллических пленок на рис. 1а; в – крупные кристаллические пленки; г – увеличенное изображение края пленки на рис. 1в.

Морфология и толщина тонких кристаллических пленок п-кватерфенила, представленных на рис. 1в, 1г, была исследована методом атомно-силовой микроскопии. На рис. 2 представлены АСМ-топограммы участка пленки со скоплением полых ячеек (темные пятна). Как видно из приведенного справа на данном рисунке профиля поперечного сечения выделенной на АСМ-топограмме ячейки, толщина пленки составляет около 10 нм. На рис. 2б приведена АСМ-топограмма краевого участка кристаллической пленки на границе с подложкой толщиной 18 нм (судя по представленному справа профилю сечения вдоль выделенного на изображении отрезка). Согласно структурным сведениям [3], кристаллические пленки 4Р ориентированы относительно плоскости (001). В качестве примера на рис. 3 представлена проекция модели кристаллической структуры п-кватерфенила с фрагментами двух монослоев. Толщина мономолекулярного слоя d001 ≈ 1.8 нм. Таким образом, рассматриваемые на рис. 2а, 2б кристаллические пленки имеют толщину около 5 и 10 монослоев соответственно.
Рис. 2.
Атомно-силовые топограммы участков поверхности кристаллических пленок п-кватерфенила и соответствующие им профили сечения (справа) вдоль выделенных на изображениях отрезков: а – участок пленки со скоплением пустых ячеек, б – граница пленки и подложки.

Для определения условий, способствующих формированию крупных монокристаллических пленок 4Р при высыхании капли раствора на подложке, проведены систематические ростовые исследования при различных температурах отжига образцов. Используемый наряду с толуолом 1,2,4‑трихлорбензол является более высококипящим растворителем и имеет более высокое поверхностное натяжение (табл. 1). Полученные результаты по росту кристаллов из капель раствора толуола выявили значительное влияние температурного фактора на характер их осаждения и средние размеры. В качестве примера на рис. 4 представлена серия люминесцентных микроизображений поверхности стеклянных подложек после высыхания капель раствора толуола при различных температурах. Как видно из рисунка, при температуре 25°С (рис. 4а) по всей площади пятна капли выпадает обильный мелкокристаллический осадок, формирующий слабовыраженные кольцевые структуры по границам капли в периоды стояния (пиннинга) ее контактной линии. В условиях температур 35°С (рис. 4б) и 45°С (рис. 4в) средний размер кристаллов заметно увеличивается, а округлая форма пятна капли становится более четко выраженной. В данном случае по характеру морфологии можно выделить две категории кристаллических пленок: 1 – сосредоточенные на внешнем контуре пятна более толстые (до 2 мкм в толщину) с четкой боковой огранкой (рис. 4д); 2 – расположенные во внутренней области пятна капли более тонкие (до 100 нм) с округленной формой, вытянутые в направлении движения контактной линии капли (рис. 4е). Для второй категории пленок характерно наличие дендритных ответвлений (рис. 4е). На рис. 5а представлена АСМ-топограмма краевого участка кристалла второй категории (выделенная белым квадратом на рис. 4е область). Как видно из приведенного на рис. 5б внизу профиля поперечного сечения, толщина пленки составляет около 19 нм (10–11 монослоев). Из рис. 5а видно, что на подложке рядом с кристаллом второй категории также присутствует сеть нитевидных кристаллов, толщина которых – на уровне 1–2 монослоев (верхний профиль сечения на рис. 5б, соответствующий отрезку 1 на рис. 5а).
Таблица 1.
Поверхностные свойства чистых растворителей и растворов п-кватерфенила (0.16 г/л) при 20°С: σL – поверхностное натяжение жидкой фазы, θS – краевой угол смачивания каплей подложки, σLS – межфазное поверхностное натяжение на границе жидкой фазы и подложки
Рис. 4.
Люминесцентные микроизображения кристаллических пленок, сформированных в результате высыхания капель растворов 4P в толуоле при различных температурах: 25°С (а), 35°С (б), 45°С (в) и 55°С (г). Увеличенные люминесцентные микроизображения кристаллических пленок 4Р на периферии (д) и внутри (е) пятна осушенной капли (35°C).

Рис. 5.
Атомно-силовая топограмма выделенного на рис. 4е участка (белый квадрат) (а). Профили сечений вдоль выделенных на изображении (а) соответствующих отрезков 1 и 2.

При температуре 55°C формирование кристаллов в основном происходит на периферии пятна капли, во внутренней области концентрация кристаллического осадка незначительна, в результате чего на подложке наблюдается практически сплошная и узкая кольцевая структура (рис. 4г). В данном случае средние размеры кристаллических пленок значительно ниже, чем для температур 35 и 45°С. При 70°С за счет быстрого испарения толуола выпадение кристаллического осадка происходило еще до того, как капля принимала равновесную форму после нанесения, из-за чего результаты оказались плохо воспроизводимыми.
Иная картина наблюдается при росте кристаллов 4Р из капель раствора 3ХБ. В качестве примера на рис. 6а–6д приведены люминесцентные микроизображения кристаллических пленок, сформированных на месте высыхания капель раствора при различных температурах. В данном случае не наблюдается формирования кольцевых структур из осажденных кристаллов по периметру капли. Как видно, монокристаллические пленки в целом более крупные, а их количество существенно меньше, чем при кристаллизации из капель раствора толуола. Пленки имеют четкую внешнюю огранку (рис. 6е) и морфологически подобны крупным кристаллам 4Р первой категории, формирующимся из раствора толуола на периферии капли (рис. 4д). Толщина пленок достигает 1 мкм.
Рис. 6.
Люминесцентные микроизображения кристаллических пленок, сформированных в результате высыхания капель растворов 4P в 3ХБ при 25°С (а), 35°С (б), 45°С (в), 55°С (г) и 70°С (д). Увеличенное люминесцентное микроизображение краевого участка кристаллической пленки, выделенного на рис. 6а (25°С), (е).

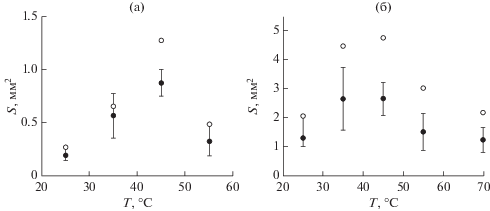
Чтобы произвести оценку влияния температуры на размеры монокристаллических пленок, на каждом из образцов подложек было выделено по 5 наиболее крупных монокристаллов и определено среднее значение их площади. Графики зависимости средней площади S наиболее крупных монокристаллических пленок от температуры, сформированных из растворов толуола и 3ХБ, приведены на рис. 7а и 7б соответственно. Как видно из рис. 7, на зависимости S = f(T) наблюдается максимум в районе 45°C. Для данной температуры средняя площадь наиболее крупных монокристаллов, выросших из раствора 3ХБ, почти в 3 раза выше, чем для раствора толуола.
Исследование поверхностных свойств
Измеренные значения поверхностного натяжения σL и краевого угла смачивания θS капель растворителей и исследуемых растворов с одинаковой концентрацией 0.16 г/л приведены в табл. 1. Как видно из табл. 1, наличие п-кватерфенила в растворе практически не влияет на поверхностное натяжение капель ЗХБ, но для капель толуола величина σL заметно снижается (приблизительно на 6.5%) в сравнении с чистым растворителем. Смачивание толуолом поверхности стеклянной подложки заметно лучше, чем для 3ХБ, что выражается в более низком значении контактного угла θS. Для раствора 3ХБ наблюдается незначительное (в пределах погрешности) уменьшение контактного угла, а для раствора толуола величина θS снижается более чем в два раза.
Для определения межфазного поверхностного натяжения σLS на границе жидкой фазы и подложки было использовано уравнение Юнга [16]:
где σS – поверхностная энергия подложки на границе с воздухом. Величина σ определена из модифицированного уравнения Юнга с использованием экспериментально измеренных значений краевого угла смачивания дистиллированной водой:(2)
${\text{cos}}{{\theta }_{S}} = {{ - {\text{1}} + {\text{2}}{{{\left( {{{\sigma }_{S}}\sigma _{L}^{d}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}} \mathord{\left/ {\vphantom {{ - {\text{1}} + {\text{2}}{{{\left( {{{\sigma }_{S}}\sigma _{L}^{d}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}} {{{\sigma }_{L}}}}} \right. \kern-0em} {{{\sigma }_{L}}}},$ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Из анализа люминесцентных оптических микроизображений на рис. 4 и рис. 6 можно заключить, что при использовании раствора 3ХБ в процессе высыхания капли на подложке формируется значительно меньшее количество центров роста кристаллов 4Р, и их размеры намного больше, чем при кристаллизации из капель раствора толуола. Число центров роста N характеризуется величиной скорости зародышеобразования I, которая является экспоненциальной функцией пересыщения раствора. Как более низкокипящий растворитель (в соответствующих условиях), толуол испаряется более интенсивно, чем 3ХБ, а значит, капли раствора толуола будут пересыщаться быстрее, чем капли раствора 3ХБ. Известно, что испарение капли в области контактной линии происходит более интенсивно, чем в ее центре, при условии, что краевой угол капли меньше, чем 90° [18, 19], при этом, чем меньше величина краевого угла, тем сильнее данный эффект [19]. Из-за более высокой скорости испарения на краю капли, а также из-за вызванного испарением охлаждения раствора зародышеобразование кристаллов в пограничной зоне раствор толуола–подложка–воздух будет происходить более интенсивно, чем в центральной области капли (краевой угол 13°, табл. 1), что и приводит к формированию из осажденных кристаллов по периметру капли кольцевой структуры, на которой происходит пиннинг контактной линии. Дополнительным фактором, способствующим росту кольцевой структуры в случае растворов толуола, является дрейф образующихся в объеме капли кристаллических зародышей к ее краю в результате воздействия на них радиальных компенсационных потоков жидкости, возникающих при пиннинге контактной линии [12, 13]. В свою очередь, при увеличении объема выпадающего кристаллического осадка в области кольцевой структуры увеличивается время пиннинга контактной линии капли [20].
Как показали исследования, из капель раствора толуола формируются две основные категории кристаллов: более толстые с четкой внешней огранкой по внешнему контуру пятна капли и тонкие, вытянутые в направлении отхода жидкости пленки без четкой боковой огранки с предельно низкой толщиной (несколько монослоев), локализующиеся внутри области пятна капли (рис. 4е). Пленки второй категории, судя по всему, формируются на межфазной границе жидкость–воздух на этапе, когда значительная часть растворителя уже испарилась, капля по высоте значительно просела, и контактная линия начала перемещаться от начального положения к центру капли. На данном этапе в условиях быстрого пересыщения раствора за счет стремительного уменьшения объема капли кристаллические пленки преимущественно разрастаются на поверхности жидкой фазы вдоль плоскости 001 (2D-кристаллизация), а их толщина лимитируется относительно низкой скоростью послойного роста и ограниченным количеством вещества.
Процессы формирования кристаллических пленок и осаждения кристаллического осадка на межфазных границах тесно связаны с поверхностными свойствами ростовой среды. Адсорбция или самопроизвольное концентрирование растворенного вещества в поверхностном слое жидкой фазы на границе с воздухом происходит в результате стремления свободной энергии системы к минимуму. Согласно определению Гиббса, величина адсорбции растворенного компонента Г (удельная адсорбция) определяется как избыток рассматриваемого компонента, приходящийся на единицу площади поверхности раздела фаз [16]. Для идеального раствора двухкомпонентной системы адсорбционное уравнение Гиббса записывается в виде:
где с – концентрация растворенного компонента [16]. Применительно к полученным результатам по поверхностным свойствам растворов толуола и 3ХБ с помощью уравнения (3) можно сделать следующий вывод. Исходя из того, что в растворе 3ХБ изменение поверхностного натяжения капли в сравнении с чистым растворителем в пределах погрешности практически не наблюдается, а для раствора толуола с аналогичной объемной долей п-кватерфенила величина σL снижается почти на 6.5% (табл. 1), то в последнем случае адсорбция 4Р в приповерхностном слое жидкой фазы наиболее интенсивна. По этой причине пересыщение в приповерхностном слое будет происходить быстрее, а процессы образования и роста кристаллов тем самым интенсивнее для раствора толуола, чем для 3ХБ при равной объемной концентрации растворенного п-кватерфенила.Для капли раствора 4P в 3ХБ из-за более высоких значений поверхностного натяжения и краевого угла (26°) разница в интенсивности испарения растворителя в центре и в области контактной линии меньше, чем для капли раствора толуола, соответственно процесс зародышеобразования кристаллов вблизи границы раздела фаз имеет более высокий потенциальный барьер. Более низкая скорость испарения 3ХБ соответственно обуславливает более медленную кинетику роста образованных кристаллов, тем самым положительно влияя на их морфологическое качество. Сравнительно более слабое адгезионное взаимодействие между подложкой и 4P в 3ХБ препятствует адсорбции кристаллического осадка на ее поверхности, что затрудняет пиннинг контактной линии в процессе испарения капли, в результате чего образования кольцевых структур не наблюдается. Указанные выше факторы, по всей видимости, являются причиной формирования из капли раствора 3ХБ относительно небольшого количества более крупных кристаллических пленок в сравнении с раствором толуола.
ЗАКЛЮЧЕНИЕ
На примере растворов толуола и 1,2,4-трихлорбензола показано, что на процессы образования и роста кристаллических пленок п-кватерфенила значительное влияние оказывают поверхностные свойства жидкой фазы и температура кипения растворителя. Высокая температура кипения, большое значение поверхностного натяжения 3ХБ и низкая адсорбционная активность молекул 4Р в приповерхностном слое жидкости дает существенно более низкую скорость образования зародышей кристаллов и более устойчивый их дальнейший рост при медленном высыхании капли (в сравнении с раствором толуола). Напротив, низкое значение поверхностного натяжения жидкой фазы, более высокая адсорбционная активность молекул растворенного вещества в приповерхностном слое в совокупности с низкой температурой кипения растворителя обеспечивают высокую скорость образования центров кристаллизации по периферии высыхающей капли раствора 4P в толуоле, что обуславливает формирование из осажденного вещества структур типа “кофейных колец”. Наличие максимума на зависимости площади наиболее крупных кристаллических пленок от температуры (рис. 7) при Т ≈ 45°С указывает на оптимальное в данных условиях соотношение ряда физико-химических параметров (растворимость, поверхностное натяжение, скорость испарения и др.) для формирования наиболее крупных монокристаллических образцов.
Список литературы
Inada Y., Yamao T., Inada M., Itami T., Hotta S. // Synthetic Metals. 2011. V. 161. P. 1869. https://doi.org/10.1016/j.synthmet.2011.06.026
Postnikov V.A., Odarchenko Y.I., Iovlev A.V., Bruevich V.V., Pereverzev A.Y., Kudryashova L.G., Sobornov V.V, Vidal L., Chernyshov D., Luponosov Y.N., Borshchev O.V., Surin N.M., Ponomarenko S.A., Ivanov D.A., Paraschuk D.Y. // Cryst. Growth Design. 2014. V. 14. P. 1726. https://doi.org/10.1021/cg401876a
Постников В.А., Сорокина Н.И., Алексеева О.А., Гребенев В.В., Лясникова М.С., Борщев О.В., Сурин Н.М., Свидченко Е.А., Пономаренко С.А., Волошин А.Э. // Кристаллография. 2018. Т. 63. № 1. С. 152. https://doi.org/10.7868/S0023476118010150
Dinelli F., Murgia M., Levy P., Cavallini M., Biscarini F., Leeuw D.M. // Rev. Lett. 2004. V. 92. P. 116802. https://doi.org/10.1103/PhysRevLett.92.116802
Sizov A.S., Anisimov D.S., Agina E.V., Borshchev O.V., Bakirov A.V., Shcherbina M.A., Grigorian S., Bruevich V.V., Chvalun S.N., Paraschuk D.Y., Ponomarenko S.A. // Langmuir. 2014. V. 30. P. 15327. https://doi.org/10.1021/la504037b
Agina E.V., Mannanov A.A., Sizov A.S., Vechter O., Borshchev O.V., Bakirov A.V., Shcherbina M.A., Chvalun S.N., Konstantinov V.G., Bruevich V.V., Kozlov O.V., Pshenichnikov M.S., Paraschuk D.Y., Ponomarenko S.A. // Appl. Mater. Interfaces. 2017. V. 9. P. 18 078. https://doi.org/10.1021/acsami.7b01919
Li Y., Ji D., Liu J., Yao Y., Fu X., Zhu W., Xu C., Dong H., Li J., Hu W. // Scientific Reports. 2015. V. 5. 13195. https://doi.org/10.1038/srep13195
Kumagai S., Yamamura A., Makita T., Tsurumi J., Lim Y.Y., Wakimoto T., Isahaya N., Nozawa H., Sato K., Mitani M., Okamoto T., Watanabe S., Takeya J. // Scientific Reports. 2019. V. 9. 15 897. https://doi.org/10.1038/s41598-019-50294-x
Vladimirov I., Kellermeier M., Gebner T., Molla Z., Grigorian S., Pietsch U., Schaffroth L.S., Kuhn M., May F., Weitz R.T // Nano Lett. 2018. V. 18. № 1. P. 9. https://doi.org/10.1021/acs.nanolett.7b03789
Bruevich V.V., Glushkova A.V., Poimanova O.Y., Fedorenko R.S., Luponosov Y.N., Bakirov A.V., Shcherbina M.A., Chvalun S.N., Sosorev A.Y., Grodd L., Grigorian S., Ponomarenko S.A., Paraschuk D.Y. // Appl. Mater. Interfaces. 2019. V. 11. P. 6315. https://doi.org/10.1021/acsami.8b20700
Cao M., Zhang C., Cai Z., Xiao C., Chen X., Yi K., Yang Y., Lu Y., Wei D .// Nature Comm. 2019. 10. 756.https://doi.org/10.1038/s41467-019-08573-8
Deegan R.D., Bakajin O., Dupont T.F., Huber G., Nagel S.R., Witten T.A. // Nature. 1997. V. 389. P. 827. https://doi.org/10.1038/39827
Lebedev-Stepanov P.V., Vlasov K.O. // Colloids and Surfaces A: Physicochem. Eng. Aspects. 2013. V. 432. P. 132. https://doi.org/10.1016/j.colsurfa.2013.05.012
Лебедев-Cтепанов П.В. Введение в самоорганизацию и самосборку ансамблей наночастиц. М.: НИЯУМИФИ, 2015. 304 с.
Yaws C.L. Thermophysical Properties of Chemicals and Hydrocarbons. William AndrewInc.: Beaumont. TX, 2008.
Щукин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия. М: Высшая школа, 2004. 445 с.
Джейкок М., Парфит Д. Химия поверхностей раздела фаз. М.: Мир, 1984. 269 с.
Popov Y.O. // Phys. Rev. E. 2005. V. 71. № 3. P. 36 313. https://doi.org/10.1103/PhysRevE.71.036313
Hu H., Larson R.G. // J. Phys. Chem. B. 2002. V. 106. № 6. P. 1334. https://doi.org/10.1021/jp0118322
Молчанов С.П., Ролдугин В.И., Чернова-Хараева И.А., Юрасик Г.А. // Коллоидный журн. 2017. Т. 79. № 2. С. 182. https://doi.org/10.7868/S0023291217020082
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования