Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2021, № 4, стр. 19-24
Исследование структуры бислоя димиристоилфосфатидилхолина методом нейтронной рефлектометрии
М. А. Киселев a, b, c, *, Д. Н. Селяков a
a Объединенный институт ядерных исследований
141980 Московская область, Дубна, Россия
b Государственный университет “Дубна”
141982 Московская область, Дубна, Россия
c Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: kiselev@jinr.ru
Поступила в редакцию 27.07.2020
После доработки 22.10.2020
Принята к публикации 25.10.2020
Аннотация
Методом рефлектометрии нейтронов апробирована методика осаждения липидного бислоя на поверхность кремния из раствора однослойных везикул. Измерена рефлектометрическая кривая от липидного бислоя димиристоилфосфатидилхолина в избытке воды. Анализ рефлектометрической кривой, выполненный в приближении ступенчатой функции распределения плотности длины рассеяния нейтрона на поверхности раздела кремний–жидкость, позволил расчитать толщину липидного бислоя 45 ± 6 Å при температуре 30°C.
ВВЕДЕНИЕ
Липидный бислой представляет собой термодинамически выгодную форму ассоциации полярных липидов в водной среде, при которой обладающие свойством амфифильности молекулы липидов ориентированы таким образом, что их полярные головки обращены в сторону водной фазы и формируют две гидрофильные поверхности, а углеводородные цепи образуют между ними гидрофобную область [1]. Липидный бислой играет важнейшую роль в жизнедеятельности клеток, осуществляя защитную функцию, то есть отделяя ее от внешней среды, и обеспечивая и регулируя поступление молекул и ионов в клетку и их выход наружу. Основой липидного бислоя биологических мембран являются фосфолипиды [2]. Они составляют 40–90% от общего количества липидов в мембране. Иследование структуры фосфолипидов осуществляется в основном методами дифракции и малоуглового расеяния нейтронов и рентгеновских лучей [3]. При различной концентрации фосфолипидов в воде, температуре среды и других факторах они могут образовывать различные типы жидкокристаллических структур [4]. Доказано методом малоуглового рассеяния нейтронов, что структура изогнутого бислоя малых везикул (радиус несколько сотен ангстрем) отличается от структуры плоского бислоя [5, 6].
Первая информация о структуре частично гидратированного липидного бислоя фосфолипидов получена методом дифракции нейтронов на многослойных мембранах ориентированных на кварцевых подложках в 70-ых годах XX в. [7–10]. В последующем основная часть информации о структуре и свойствах липидного бислоя фосфолипидов была получена методов дифракции рентгеновских лучей на многослойных везикулах в избытке воды [11].
В рентгеновских синхротронных экспериментах всегда возникает вопрос об идентичности структуры невзаимодействующего (одного) липидного бислоя структуре липидного бислоя в системе взаимодействующих между собой слоев многослойной везикулы. Низкие потоки нейтронных источников, по сравнению с синхротронными, не позволяют проводить эксперименты на многослойных везикулах в избытке воды. Нейтронный эксперимент может быть успешно реализован при применении ориентированных на кварцевых подложках (размером примерно 2 × × 5 см2) многослойных липидных мембран, помещаемых в камеру с заданной влажностью воздуха. В таких условиях липидная мембрана частично гидратирована и ее структура отличается от полностью гидратированной мембраны, находящейся в избытке воды.
С точки зрения идентичности образца биологической мембране, наиболее подходящим объектом исследования является плоский липидный бислой в избытке воды. Такая геометрия методически соответствует рефлектометрии нейтронов. Сильное поглощение фотонов материалами камеры, в которой осаждается липидный бислой, делает невозможным проведение аналогичных экспериментов на синхротронных источниках. В синхротронных экспериментах возможны рефлектометрические измерения кривых отражения только от липидного монослоя на поверхности воды [12].
Создание липидного бислоя на границе твердое тело–вода является сложной методической задачей. Нейтронные рефлектометрические эксперименты, выполненные на установке D17 в Институте Лауэ-Ланжевена (Гренобль, Франция), по исследованию кинетики образования липидного бислоя димиристоилфосфатидилхолина (ДМФХ) на поверхности кремния показали, что время осаждения липидного бислоя на поверхность кремния из везикулярной фазы составляет 100 мин [13]. Нейтронная рефлектометрия также эффективна для исследования структуры олигослойных мембран фосфолипидов в процессе их набухания под воздействием различных веществ, когда невозможно получить качественный дифракционный спектр. Такой подход использовался при исследовании раздвижки липидных бислоев олигослойной мембраны ДМФХ под действием молекул гиалуроновой кислоты [14].
Исследования структуры липидных мембран в избытке воды методом нейтронной рефлектометрии возможно только при горизонтальном расположении образца, что требует применения метода времени пролета для измерения коэффициента отражения в широком интервале векторов рассеяния. На стационарных источниках нейтронов метод времени пролета реализуется за счет применения прерывателя пучка. На импульсных источниках нейтронов с низкой частотой следования импульсов (5–10 Гц) установка прерывателя не требуется, что увеличивает поток нейтронов на образце. Создание на импульсном реакторе ИБР-2 нейтронного рефлектометра ГРЭИНС требует развития методик измерения липидных бислоев на границе твердое тело–вода и, прежде всего, методик нанесения липидного бислоя на поверхность вода–твердое тело.
Эксперименты по образованию липидного бислоя фосфолипидов на границе раздела диоксид кремния–вода и измерения нейтронных рефлектометрических кривых были выполнены методом нейтронной рефлектометрии на установке AMOR на ускорительном источнике нейтронов SINQ в Институте Пауля Шеррера в Швейцарии [15].
ЭКСПЕРИМЕНТ
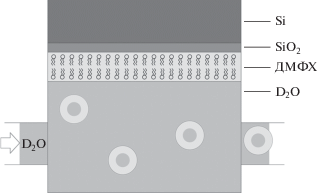
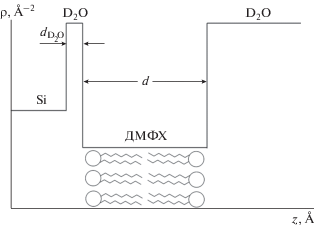
Однослойные везикулы димиристоилфосфатидилхолина (ДМФХ) изготавливались методом экструзии многослойных везикул через ядерные фильтры диаметром 500 Å [16]. Везикулы вводились в камеру с тяжелой водой (D2O). Использование D2O вместо обычной воды (H2O) обусловлено тем, что тяжелая вода создает больший контраст (разность плотностей длин рассеяния (ПДР)) между ней и липидным бислоем ДМФХ, чем обычная вода, что необходимо для удачного рефлектометрического эксперимента, в том числе из-за того, что водород создает сильный некогерентный фон [5]. Далее происходил процесс осаждения однослойных везикул на твердую гидрофильную поверхность двуокиси кремния (SiO2). Слой гидрофильного двуокиси кремния заранее создавался методом окисления [13], что является важной частью эксперимента ввиду невозможности образования липидного бислоя на поверхности гидрофобного кремния. В результате осаждения везикул, на поверхности двуокиси кремния должен образоваться липидный бислой, однако данный процесс является не регулируемым. Проконтролировать окончательный результат экспериментально возможно, в том числе, анализом рефлектометрической кривой. Везикулы, не принявшие участие в образовании бислоя (не осажденные на поверхность двуокиси кремния), были вымыты из камеры потоком D2O (рис. 1).
Рис. 1.
Схема экспериментальной камеры: Si – кремний; SiO2 – диоксид кремния; ДМФХ – бислой димиристоилфосфатидилхолина: D2O – тяжелая вода.
Эксперимент проводился при температуре 30°C. Поток нейтронов падал на образец под углом, отраженные лучи фиксировались на детекторе. Первоначально была измерена зависимость коэффициента отражения от вектора рассеяния (q) для слоя диоксида кремния на кремниевой подложке в тяжелой воде в отсутствии липидного бислоя. Целью являлось проверка работы инструмента, измерение плотности длины рассеяния тяжелой воды и измерение толщины диоксида кремния, с целью повышения точности обработки данных следующего этапа эксперимента. Были получены рефлектометрические кривые для структур: кремний–диоксид кремния–тяжелая вода (Si–SiO2–D2O) и кремний–диоксид кремния–бислой ДМФХ–тяжелая вода (Si–SiO2–DMPC–D2O). Аппроксимация спектров осуществлялось в программе Sasview 3.0.0 [17].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Распределение плотности длины рассеяния для структуры Si–SiO2–D2O имеет вид ступенчатой функции (рис. 2).
Рис. 2.
Распределение (профиль) плотности длины рассеяния нейтрона для структуры кремний–диоксид кремния–тяжелая вода (Si–SiO2–D2O).
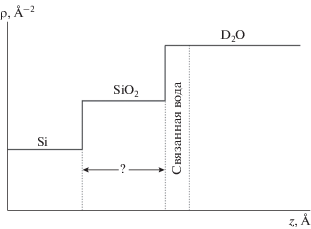
При построении модели распределения плотности длины рассеяния для данной системы, выяснилось, что, при исключении из нее диоксида кремния, в соответствующей ей рефлектометрической кривой существенных изменений не происходит, что может быть связано как с неполным созданием слоя SiO2, так и с тем, что за счет гидратации его средняя плотность длины рассеяния увеличивается до значения, при котором он становится “невидимым” для подобного эксперимента. Измерение толщины слоя диоксида кремния оказалось невозможным, но исключение его из модели упростило процесс обработки экспериментальных данных при невысоком снижении точности.
Тогда, для границы раздела тяжелая вода–кремний теоретическая рефлектометрическая кривая представляет собой френелевскую кривую отражения, вычисляемую по формуле [18]:
(1)
$R(q) = {{\left| {\frac{{1 - \sqrt {1 - {{{\left( {\frac{{{{q}_{c}}}}{q}} \right)}}^{2}}} }}{{1 + \sqrt {1 - {{{\left( {\frac{{{{q}_{c}}}}{q}} \right)}}^{2}}} }}} \right|}^{2}}.$Рис. 3.
Сравнение экспериментальной рефлектометрической кривой (зависимости коэффициента отражения от вектора рассеяния) для структуры кремний–диоксид кремния–тяжелая вода (Si–SiO2–D2O) с френелевской кривой для структуры кремний–тяжелая вода (Si–D2O). Точки – эксперимент, кривая – теория.
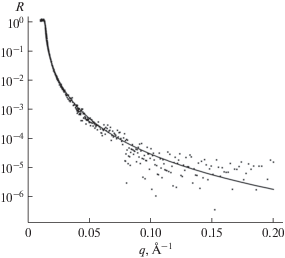
В результате компьютерной обработки данного спектра была получена плотность длины рассеяния тяжелой воды (${{\rho }_{{{{{\text{D}}}_{{\text{2}}}}{\text{O}}}}}$ = (6.3 ± 0.6) × 10–6 Å–2). Данное значение является известной табличной величиной, его определение в рамках данного эксперимента обусловлено как необходимостью проверки тяжелой воды на чистоту (возможно наличие H2O или каких-либо примесей), так и проверки правильностью работы электроники установки в режиме метода времени пролета.
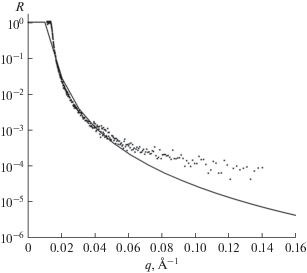
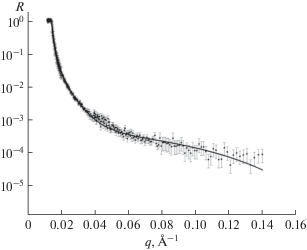
Прежде чем приступать к определению толщины бислоя димиристоилфосфатидилхолина, необходимо доказать, что бислой образовался. На рис. 4 изображено сравнение экспериментальной кривой для структуры Si–SiO2–ДМФХ–D2O с френелевской кривой для Si–D2O. Видно, что полученный спектр отличается от френелевской кривой, что говорит о том, что липидный бислой димиристоилфосфатидилхолина (ДМФХ) образовался.
Рис. 4.
Сравнение экспериментальной рефлектометрической кривой (зависимости коэффициента отражения от вектора рассеяния) для структуры кремний – диоксид кремния–бислой димиристоилфосфатидилхолина–тяжелая вода (Si–SiO2–ДМФХ–D2O) френелевской кривой для структуры кремний–тяжелая вода (Si–D2O). Точки – эксперимент, кривая – теория.
Необходимая для определения толщины липидного бислоя плотность длины рассеяния молекулы димиристоилфосфатидилхолина рассчитана как отношение суммы длин рассеяния ядер составляющих ее атомов (bi) к полному объему молекулы ДМФХ (V). В качестве объема молекулы ДМФХ использовалось значение объема не гидратированной молекулы ДМФХ в жидкокристаллической фазе – 1101 Å [11]. Длины рассеяния нейтронов ядрами элементов являются табличными величинами. Было получено следующее значение ПДР:
(2)
${{\rho }_{{{\text{ДМФХ}}}}} = \frac{{\sum {{b}_{i}}}}{V} = \frac{{3.065 \times {{{10}}^{{ - 4}}}{\text{{\AA}}}}}{{1101{\text{\;}}{{{\text{{\AA}}}}^{3}}}} = 0.278 \times {{10}^{{ - 6}}}{{{\text{{\AA}}}}^{{ - 2}}}.$При обработке полученных в ходе эксперимента данных использовалась модель однородной ПДР, что означает, что в рамках каждого слоя ПДР остается постоянной. Реальная плотность длины рассеяния бислоя больше, чем показанное выше теоретическое значение (2), так как бислой гидратируется, а плотность длины рассеяния молекулы тяжелой воды выше, чем у бислоя ДМФХ. Рассматривать более сложную модель, учитывающую различие ПДР “хвостов” и “голов” молекулы ДМФХ не представляется возможным ввиду низкой накопленной статистики эксперимента в конце рефлектометрической кривой.
Для итогового расчета использовалось значение ПДР гидратированного бислоя ДМФХ, определенное в работе Т. Гутберлета и др. [13]. Данное значение было получено в ходе рефлектометрического эксперимента в аналогичных условиях: ρДМФХ = 1.053 × 10–6 Å–2.
В ходе обработки экспериментальных данных в профиль плотности длины рассеяния исследуемого образца (рис. 5) между слоями диоксида кремния и ДМФХ был добавлен небольшой слой тяжелой воды толщиной 5 Å, который соответствует тяжелой воде, гидратирующей двуокись кремния.
Рис. 5.
Распределение (профиль) плотности длины рассеяния для структуры кремний–тяжелая вода–бислой димиристоилфосфатидилхолина–тяжелая вода (Si–D2O–ДМФХ–D2O).
Расчет рефлектометрической кривой от липидного бислоя ДМФХ, нанесенного на кремневую подложку, проводился в программе Sasview 3.0.0 с использованием рекурентного алгоритма Парратта для системы слоев различной плотности длины рассеяния, представленной на рис. 5 [18]. Результат подгонки расчетной кривой к экспериментальной представлен на рис. 6. Спектр измерен для относительно маленьких значений вектора рассеяния q, на кривой отсутствуют ярко выраженные осцилляции. Несмотря на это, экспериментальные данные обработаны с достаточной точностью: χ2 = 1.46. В результате подгонки расчетного спектра к экспериментальному было получено значение толщины бислоя димиристоилфосфатидилхолина: d = (45 ± 5) Å, которое хорошо совпадает с величиной 45.5 ± 0.6 Å, полученной методом малоуглового рассеяния нейтронов для толщины липидного бислоя однослойных везикул димиристоилфосфатидилхолина диаметром 900 Å при температуре 30°C [5].
Рис. 6.
Сравнение экспериментальной рефлектометрической кривой (зависимости коэффициента отражения от вектора рассеяния) для структуры кремний–диоксид кремния–бислой димиристоилфосфатидилхолина – тяжелая вода (Si–SiO2–ДМФХ–D2O) с соответствующей теоретической кривой, полученной в программе Sasview 3.0.0. Точки – эксперимент, кривая – теория.
ЗАКЛЮЧЕНИЕ
Методом нейтронной рефлектометрии показана возможность осаждения липидного бислоя димиристоилфосфатидилхолина в жидкокристаллической фазе из везикулярного состояния на поверхность кремниевой подложки. Исследована методом нейтроной рефлектометрии структура липидного бислоя димиристоилфосфатидилхолина. Полученная толщина липидного бислоя ДМФХ 45 ± 6 Å соответствует литературным данным [11]. Анализ рефлектометрических кривых для двуокиси кремния и липидного бислоя ДМФХ демонстрирует невозможность определить толщину образуемой пленки двуокиси кремния на поверхности кристаллического кремния по причине сильной гидратации двуокиси кремния и полярных голов ДМФХ тяжелой водой. Толщина гидратационного слоя тяжелой воды на границе кремний–ДМФХ была оценена как 5 Å.
Эксперимент показал, что использование кристаллического кремния как подложки для осаждения липидного бислоя не является удачным. Слой липида толщиной 45 Å слишком мал для того, чтобы измерить характерные осцилляции рефлектометрической кривой [18]. Полученные результаты говорят о необходимости усложнения структуры кремниевых подложек. Здесь наиболее перспективным направлением развития является использование гетерогенных подложек с различной от кремния плотностью длины рассеяния нейтрона и толщиной неоднородностей в несколько сот ангстрем.
Одна из задач, направленных на улучшение качества эксперимента, является поиск других материалов, которые можно использовать в качестве подложки для бислоя и которые будут иметь достаточно большую разность плотности длины рассеяния с гидратированным бислоем. Эксперимент с более хорошей статистикой позволит использовать более сложные модели распределения плотности длины рассеяния бислоя ДМФХ. В данной работе применялось приближение равномерного распределения ПДР внутри бислоя, т.е. не учитывалась разница ПДР “голов” и “хвостов” молекул ДМФХ. В будущем такая работа будет выполнена на рефлектометре Грэинс реактора ИБР-2, интенсивность пучка которого превышает интенсивность пучка источника нейтронов SINQ в Швейцарии. Развитие методики измерения структуры липидных бислоев методом рефлектометрии представляется перспективной задачей для исследования структуры липидных бислоев из соевых фосфолипидов со встроенными лекарствами.
Список литературы
Ивков В.Г., Берестовский Т.Н. Динамическая структура липидного бислоя. М.: Наука, 1981. 292 с.
Геннис Р. Биомембраны. Молекулярная структура и функции. М.: Мир, 1997. 622 с.
Kiselev M.A., Lombardo D. // Biochim. Biophys. Acta. 2017. V. 186. P. 3700.
Болдырев А.А., Кяйвяряйнен Е.И., Илюха В.А. Биомембранология. Петрозаводск: Изд-во Кар НЦ РАН, 2006. 226 с.
Kiselev M.A., Zemlyanaya E.V., Aswal V.K. et al. // Europ. Biophys. J. 2006. V. 35. № 6. P. 477.
Schmiedel H., Joerchel P., Kiselev M. et al. // J. Phys. Chem. B. 2001. V. 105. P. 111.
Schoenborn B.P., Nunes A.C. // Ann. Rev. Biophys. Bioeng. 1972. V. 1. P. 529.
Schoenborn B.P. // Biochim. Biophys. Acta. 1976. V. 457. P. 41.
Worcester D.L. // Brookhaven Symp. Biol. 1976. V. 27. P. III-37.
Franks N.P., Lieb W.R. // J. Mol. Biol. 1979. V. 133. P. 469.
Nagle J.F., Tristram-Nagle S. // Biochim. Biophys. Acta. 2000. V. 1469. P. 159.
Schalke M., Kruger P., Weygand M. et al. // Biochim. Biophys. Acta. 2000. V. 1464. P. 113.
Gutberlet T., Steitz R., Fragneto G. et al. // J. Phys.: Condens. Matter. 2004. V. 16. P. S2469.
Kreuzer M., Strobe M., Reinhard M. et al. // Biochim. Biophys. Acta. 2012. V. 1818. P. 2648.
Gupta M., Gutberlet T., Stahn J. et al. // J. Phys. 2004. V. 63. P. 57.
MacDonald R.C., MacDonald R.I., Menco B.P. et al. // Biochim. Biophys. Acta. 1991. V. 1061. P. 297.
http://www.sasview.org/
Russell T.P. // Mater. Sci. Rep. 1990. V. 5. P. 171.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


