Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2022, № 2, стр. 71-79
Гибридные оксидные покрытия на поверхности углеродной ткани: электроосаждение и исследование структуры
А. В. Храменкова a, *, А. И. Изварин a, Е. А. Яценко a
a Южно-Российский государственный политехнический университет (НПИ) им. М.И. Платова
346428 Новочеркасск, Россия
* E-mail: anna.vl7@yandex.ru
Поступила в редакцию 29.04.2021
После доработки 22.07.2021
Принята к публикации 30.07.2021
- EDN: ENNQTT
- DOI: 10.31857/S1028096022020042
Аннотация
Показана возможность получения гибридных покрытий на основе оксидов марганца, молибдена, кобальта, железа и вольфрама на поверхности углеродной ткани с использованием метода нестационарного электролиза. Проведено исследование морфологии и структуры поверхности разработанных покрытий с помощью растровой электронной микроскопии. По данным рентгенофлуоресцентного микроанализа основными элементами гибридных оксидных покрытий являются Mn, Mo, Co, Fe, W. Методом рентгеновской фотоэлектронной спектроскопии изучено зарядовое состояние элементов в поверхностном слое гибридного оксидного покрытия и установлено, что кислорода достаточно для окисления металлов до высших оксидов. Молибден окислен преимущественно до состояния +6, железо до +2 и +3, марганец не ниже +3, а также доказано формирование на поверхности углеродной ткани промежуточного слоя – интермедиата из оксидов вольфрама на стадии подготовки поверхности.
ВВЕДЕНИЕ
Большой практический интерес в области современной электрохимической энергетики представляет разработка новых систем преобразования и накопления энергии, одновременно обладающих высокими удельными характеристиками, длительным сроком службы, безопасностью и экологичностью [1–3]. Весьма перспективны с этой точки зрения электрохимические суперконденсаторы, широко используемые в самых различных отраслях – от бытовой электроники до авиакосмической промышленности [4, 5].
Известно, что электрохимические свойства суперконденсаторов напрямую зависят от физико-химических свойств используемых электродных материалов, которые должны обладать высокой удельной поверхностной электропроводностью, низкой стоимостью и длительной электрохимической стабильностью [6]. Весьма перспективны для этих целей оксиды переходных металлов благодаря их высокой удельной поверхности и значительной удельной емкости [4]. Однако одиночные оксиды переходных металлов имеют достаточно ограниченные электрохимические характеристики [7]. Поэтому для создания суперконденсаторов с высокой плотностью энергии большой интерес представляют многофазные композиционные материалы на основе оксидов d-металлов [8, 9]. Особенно перспективны среди них оксидные соединения марганца, молибдена и вольфрама. Так, высокой теоретической емкостью наряду с низкой стоимостью обладает диоксид марганца MnO2, причем известно, что электрохимические характеристики MnO2 во многом зависят от его кристаллической структуры и увеличиваются в последовательности β-MnO2 < λ-MnO2 < γ-MnO2 < < δ-MnO2 ≈ α-MnO2 как для суперконденсаторов, так и для литий-ионных аккумуляторов [10]. Известно, что оксид молибдена(VI) MoO3 характеризуется высокой псевдоемкостью и циклируемостью, а оксид молибдена(IV) MoO2 обладает прочной металлической связью Mo–Mo, что придает ему металлоподобную проводимость при комнатной температуре [11, 12]. Оксидные соединения вольфрама также обладают множественными валентными состояниями, что делает возможным протекание обратимых окислительно-восстановительных реакций, приводящих к быстрому накоплению энергии в суперконденсаторах [4]. Однако плохая электропроводность данных оксидов значительно снижает электрохимические характеристики [13, 14].
В то же время используемые в качестве электродов суперконденсаторов материалы на основе углерода обладают высокой проводимостью, химической стабильностью и большой удельной площадью поверхности. Однако они характеризуются более низкой теоретической емкостью [7, 15, 16]. В связи с этим весьма перспективным видится создание гибридных покрытий на основе оксидов переходных металлов на поверхности углеродной ткани, что обеспечит хороший контакт активного материала и его высокую адгезию с токосъемником, а также благодаря положительному синергетическому эффекту позволит добиться уникальной удельной емкости и циклической стабильности [17–19].
Следует отметить [20], что на электрохимические свойства электродных материалов значительное влияние может оказывать пористость. Также к важным параметрам, влияющим на удельную емкость, следует отнести распределение пор по размерам и площадь удельной поверхности, поэтому исследование данных характеристик является неотъемлемой частью создания новых электродных материалов.
Среди методов направленного синтеза материалов подобного рода особого внимания заслуживает метод нестационарного электролиза, который позволяет проводить синтез в одну стадию, а также регулировать физико-химические свойства получаемых электродных материалов в широком интервале посредством варьирования технологических параметров. Кроме того, гибридные материалы и покрытия, получаемые на токе переменной полярности, отличаются от покрытий, полученных на постоянном токе, микроструктурой, пористостью, чистотой поверхности и улучшенными механическими свойствами [21].
Поэтому наибольший интерес для использования в качестве электродных материалов представляют оксиды молибдена, марганца, вольфрама, совмещенные с углеродным носителем. Однако уникальная особенность получения покрытий на основе соединений молибдена и вольфрама из водных растворов состоит в том, что они не могут быть получены в чистом виде, а их электрохимическое осаждение носит индуцированный характер. Наиболее частыми элементами таких покрытий являются Co, Ni, Fe, оказывающие каталитическое действие на процесс электрохимических реакций молибдат-ионов [22].
Одновременное присутствие нескольких оксидов металлов в одном материале определенно представляет интерес ввиду возможной синергии их свойств. Поскольку, как следует из проведенного литературного обзора, оксиды молибдена, марганца, кобальта и железа перспективны для применения в качестве электродных материалов, ожидаемую величину емкости такого гибридного материала в первом приближении можно будет рассматривать как линейную комбинацию составляющих материал активных компонентов, превышающую аналогичные характеристики индивидуальных компонентов. Поскольку поверхностные свойства также оказывают не менее значительное влияние на электрохимические характеристики таких материалов, важно иметь полную информацию о физико-химии поверхности получаемых покрытий.
Целью настоящей работы было получение гибридных покрытий на основе смешанных оксидов молибдена, марганца, кобальта, железа и вольфрама на поверхности углеродной ткани с использованием метода нестационарного электролиза и исследование их структурных особенностей.
МЕТОДИКА
Электрохимической ячейкой служил стеклянный термостатированный электролизер емкостью 250 мл, в который помещали рабочий электрод, противоэлектрод и магнитную мешалку. В качестве рабочего электрода использовали макроэлектроды из углеродной ткани марки Урал Т-22Р размером 30 × 20 мм (с обеих сторон), противоэлектрода – из нержавеющей стали. В состав электролита входили следующие компоненты: сульфат железа(II) (FeSO4·7H2O) – 12.0; сульфат кобальта (CoSO4·7H2O) – 80.0; сульфат марганца (Mn SO4·5H2O) – 30.0; гептамолибдат аммония ((NH4)6Mo7O24·4H2O) – 30.0; борная кислота (H3BO3) – 30.0; лимонная кислота (C6H8O7) – 3.0 г ⋅ л–1. Покрытие формировали в условиях нестационарного электролиза, основанного на поляризации рабочего электрода переменным асимметричным током промышленной частоты (50 Гц), который описывается двумя полусинусоидами разной амплитуды. Средняя плотность тока составляла 0.5–1.1 А ⋅ дм–2. Коэффициент асимметрии β (соотношение плотностей средних за период катодного и анодного токов) составил 2.2. Температура 60–65°С, рН 4–5. Время электролиза 40 мин было выбрано на основании предварительных исследований ввиду наибольшей массы осадка (1.84 г ⋅ дм–2).
Морфологию и структуру полученных на поверхности углеволокнистого носителя гибридных оксидных покрытий исследовали с помощью растрового электронного микроскопа (РЭМ) Quanta 200 с системой рентгеновского микроанализа EDAX Genesis XVS 30 при постоянной энергии электронного зонда 30 эВ.
Полученные гибридные оксидные покрытия изучали методом рентгеновской фотоэлектронной спектроскопии (РФЭС) на модернизированном электронном спектрометре ЭС-2401 с возбуждением на длине волны MgKα при постоянной энергии пропускания полусферического анализатора 50 эВ. Обработку экспериментальных данных проводили с использованием программного обеспечения CasaXPS (ЦКП УдмФИЦ УрО РАН).
Исследование пористости и удельной поверхности гибридных оксидных покрытий осуществляли с помощью адсорбционного анализатора удельной поверхности и пористости ASAP 2020MР (ЦКП РХТУ им. Д.И. Менделеева).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гибридные оксидные покрытия наносили на предварительно подготовленную поверхность углеродной ткани (рис. 1а). Как видно, углеродные волокна исходной ткани преимущественно имеют круглое сечение и фибриллярное строение. Диаметр каждого моноволокна, так называемого филамента, 5–7 мкм. Известно, что филаменты обычно состоят из фибрилл диаметром 150–250 нм, которые расположены параллельно друг другу.
Рис. 1.
РЭМ-изображения поверхности: а – исходной углеродной ткани; б – после стадии катодного обезжиривания; в – углеродной ткани, допированной оксидами вольфрама на стадии катодного обезжиривания.

Перед нанесением гибридного оксидного покрытия углеродную ткань подвергали обработке в щелочном электролите, что не привело к существенному изменению структуры ее поверхности (рис. 1б). В то же время для моделирования электрохимического поведения разрабатываемых гибридных оксидных покрытий задавали сложную структуру поверхности, формируя переходный слой между покрытием и подложкой. Для этого поверхность углеродной ткани предварительно модифицировали путем допирования оксидами вольфрама на стадии подготовки, вводя в растворы электролита вольфрамат натрия Na2WO4·7H2O. Это приводило к структурной модификации поверхности углеродной ткани и образованию промежуточного слоя – интермедиата из оксидов вольфрама. Вероятно, белые вкрапления на поверхности филаментов на РЭМ-изображении соответствуют вольфраму как элементу с наибольшим порядковым номером (рис. 1в).
Как видно из рис. 2, структура полученного на поверхности углеродной ткани гибридного покрытия резко меняется. Однако, несмотря на ярко выраженный трещинообразный характер, она характеризуется достаточной однородностью. Как показал рентгеноспектральный микроанализ с участка поверхности 460 × 410 × 2 мкм гибридного оксидного покрытия (табл. 1), основными элементами гибридного оксидного покрытия являются марганец, молибден, кобальт, железо, углерод и кислород.
Таблица 1.
Данные рентгеноспектрального микроанализа гибридного оксидного покрытия
| Элемент | C | O | Mn | Fe | Co | Mo |
|---|---|---|---|---|---|---|
| Содержание, ат. % | 25.9 | 59.5 | 2.1 | 0.8 | 4.0 | 7.7 |
| Содержание, маcс. % | 13.0 | 39.8 | 4.8 | 1.9 | 9.7 | 30.8 |
Согласно результатам рентгеноспектрального микроанализа гибридного оксидного покрытия, допированного оксидами вольфрама (табл. 2, рис. 3а), его основными элементами являются марганец, молибден, кобальт, железо, вольфрам. Из анализа РЭМ-изображения гибридного покрытия видно, что на его поверхности присутствуют белые включения, которые носят разупорядоченный характер.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для исследования поверхностного слоя полученных гибридных оксидных покрытий снимали рентгеновские электронные спектры. Как видно из рис. 4, на обзорном рентгеновском электронном спектре гибридного оксидного покрытия в основном присутствуют пики и группы линий углерода, кислорода, молибдена. Признаки железа, вольфрама, марганца в явном виде на обзорном спектре не отслеживаются, однако при многократном накоплении отдельных соответствующих участков спектра данные элементы в малом количестве все же выявляются (табл. 3, 4). Пик, соответствующий Co2p (780–793 эВ), можно выделить на рис. 4 только вблизи 782 эВ, но вторая обязательная линия в области 793–794 эВ отсутствует. Таким образом, отношение концентрации кислорода к суммарной концентрации обнаруженных металлических компонентов составляет не менее двух. Это позволяет сделать вывод, что кислорода достаточно для окисления металлов до высших оксидов.
Таблица 3.
Данные элементного анализа гибридных оксидных покрытий, полученные методом РФЭС
| Элемент | С | O | Mn | Fe | Mo | W |
|---|---|---|---|---|---|---|
| Содержание, ат. % | 38 | 50.4 | 0.3 | 0.7 | 10.9 | 0.03 |
Таблица 4.
Данные элементного анализа гибридных оксидных покрытий, полученные методом РФЭС, без учета углерода
| Элемент | O | Mn | Fe | Mo | W |
|---|---|---|---|---|---|
| Содержание, ат. % | 71.9 | 0.8 | 1.7 | 25.6 | 0.06 |
Спектр С1s (рис. 5) характерен для мелкодисперсного или разупорядоченного углерода, а также низкоразмерных углеродных волокон. Пик 284.6 эВ – пик, близкий к С–С-связи в графитоподобных структурах (sp2-гибридизация). Пик с Есв = 285.7 эВ также относится к С–С-связи. Уширение С1s-спектров в области 285–286 эВ и компоненты в этой области спектра характерны для аморфного углерода, углерода с сильно разупорядоченной или искаженной структурой. Пики в области 287–288 эВ связаны с наличием вблизи атомов углерода атомов кислорода или его соединений.
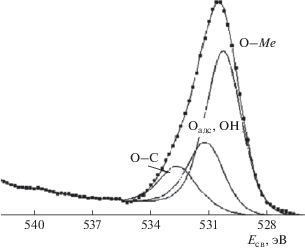
Спектр кислорода (рис. 6) также многокомпонентный. Основная наиболее интенсивная компонента в области 530.5 эВ – кислород в химической связи O–Me (Ме – металл) (~60% от общего количества). Положение Есв пика O1s в случае простых оксидов металлов “плавает” в зависимости от типа металла, а особенно это характерно для оксидов с участием катионов нескольких металлов. В данном случае наиболее вероятно взаимодействие с обнаруженными металлами Fe, Mn, Mo, W. Все вышеперечисленные металлы имеют высокое сродство к кислороду (молибден и вольфрам в меньшей степени). Минимальное сродство к кислороду имеет кобальт. В то же время известно, что при окислении многокомпонентных металлических систем на поверхности наблюдается сегрегация наиболее окисляемых компонентов, а наименее окисляемые (например, кобальт) могут оказаться в глубине вещества. В этом случае даже при наличии в объеме в тонких нанометровых приповерхностных слоях оксидов кобальта может не оказаться. Пик вблизи 531.4 эВ – адсорбированный кислород или кислород в группах –ОН, пик при больших значениях энергии связи (533 эВ) обусловлен взаимодействием кислорода с углеродсодержащими соединениями или непосредственно с углеродом.
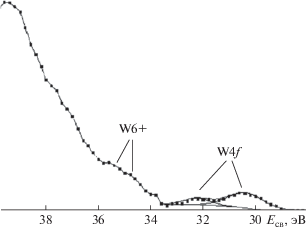
Наиболее интенсивные спектры из всех металлических компонентов характерны для молибдена (рис. 7). По положению составляющих компонентов и по их интенсивностям основная доля молибдена окислена до +6 (МоО3). Меньшая часть молибдена – в формальной степени окисления +4. Металлический молибден не обнаружен. Карбидов молибдена в чистом виде также нет. При многократном сканировании по участку 28–38 эВ был выделен спин-дублет W4f (рис. 8). Концентрация этого металла в исследуемых слоях невелика, поэтому экспериментально наблюдается спектр очень малой интенсивности. Оксидные составляющие если и есть, то попадают в область интенсивного спектра Mo4p и в явном виде выделены быть не могут. Тем не менее особенность в области 35–36 эВ (W6+) имеет место.
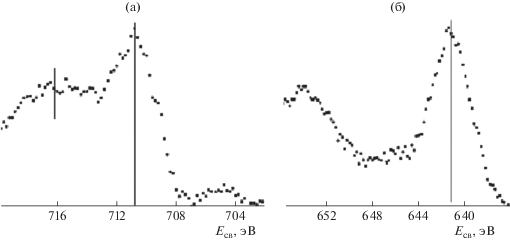
На рис. 9 приведены спектры железа (Fe2p3/2) и марганца (Mn2p3/2). Как и ожидалось, спектры данных элементов полностью соответствуют их окисленному состоянию. Железо окислено до состояний +3 и +2 с высокой долей Fe2+, о чем говорит интенсивный широкий сателлит со стороны бóльших значений энергии связи (716 эВ). В то же время можно утверждать, что параметры спектра Mn2p3/2 соответствует марганцу в степени окисления не менее +3.
Поскольку полученные на поверхности углеродной ткани оксидные соединения, согласно литературным данным [20], могут представлять интерес в качестве электродных материалов, было проведено исследование их удельной поверхности и пористости (совместно с углеродистым носителем) как одних из важных характеристик. Удельная поверхность Sуд, рассчитанная по уравнению Брунауэра–Эммета–Теллера (БЭТ), составила 1.0547 ± 0.0024 м2 · г–1.
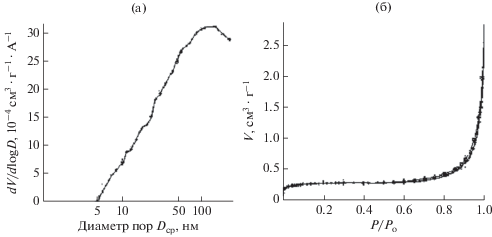
На основании представления данных исследования пористости гибридных оксидных покрытий в виде дифференциального распределения (рис. 10а) можно сделать вывод, что в покрытии преобладают поры, имеющие средний диаметр порядка 50–100 нм, однако более полную картину распределения пор по размерам можно увидеть из анализа данных, представленных в табл. 5.
Таблица 5.
Распределение пор по размерам, полученное методом адсорбции Баррета–Джойнера–Халенды
| Диаметр пор, нм | Средний диаметр пор d, нм | Удельный объем пор Vуд, см3 · г–1 | Кумулятивный удельный объем пор VудΣ, см3 · г–1 | Удельная поверхность пор Sуд, м2 · г–1 | Кумулятивная удельная поверхность пор SудΣ, м2 · г–1 |
|---|---|---|---|---|---|
| 316.5–191.0 | 224.23 | 0.000637 | 0.000637 | 0.0114 | 0.0114 |
| 191.0–129.9 | 149.10 | 0.000524 | 0.001161 | 0.0141 | 0.0254 |
| 129.9–98.3 | 109.72 | 0.000377 | 0.001538 | 0.0137 | 0.0392 |
| 98.3–79.3 | 86.73 | 0.000283 | 0.001820 | 0.0130 | 0.0522 |
| 79.3–65.1 | 70.79 | 0.000243 | 0.002063 | 0.0137 | 0.0659 |
| 65.1–49.3 | 55.03 | 0.000324 | 0.002388 | 0.0236 | 0.0895 |
| 49.3–39.7 | 43.44 | 0.000222 | 0.002610 | 0.0204 | 0.1099 |
| 39.7–33.2 | 35.82 | 0.000166 | 0.002776 | 0.0185 | 0.1285 |
| 33.2–28.4 | 30.38 | 0.000132 | 0.002908 | 0.0174 | 0.1459 |
| 28.4–24.9 | 26.41 | 0.000103 | 0.003011 | 0.0156 | 0.1615 |
| 24.9–22.2 | 23.37 | 0.000078 | 0.003089 | 0.0133 | 0.1748 |
| 22.2–19.9 | 20.89 | 0.000066 | 0.003154 | 0.0126 | 0.1874 |
| 19.9–16.5 | 17.89 | 0.000106 | 0.003260 | 0.0236 | 0.2111 |
| 16.5–14.2 | 15.15 | 0.000076 | 0.003336 | 0.0200 | 0.2310 |
| 14.2–12.3 | 13.10 | 0.000057 | 0.003393 | 0.0174 | 0.2485 |
| 12.3–10.9 | 11.53 | 0.000047 | 0.003440 | 0.0162 | 0.2646 |
| 10.9–9.8 | 10.28 | 0.000035 | 0.003474 | 0.0135 | 0.2781 |
| 9.8–7.7 | 8.48 | 0.000060 | 0.003534 | 0.0282 | 0.3063 |
| 7.7–6.3 | 6.84 | 0.000035 | 0.003569 | 0.0205 | 0.3268 |
| 6.3–5.3 | 5.67 | 0.000015 | 0.003584 | 0.0108 | 0.3375 |
| 5.3–4.5 | 4.80 | 0.000000 | 0.003585 | 0.0003 | 0.3379 |
| 4.5–1.8 | 1.88 | 0.000001 | 0.003586 | 0.0022 | 0.3401 |
По полученной изотерме адсорбции (рис. 10б) можно сделать вывод о ее принадлежности к IV типу по классификации Брунауэра, Деминга, Деминга и Теллера, что с учетом относительно небольшого увеличения количества сорбированного азота на начальном участке изотермы свидетельствует о преимущественном наличии мезопор. Кроме того, как видно из рис. 10б, петля гистерезиса практически отсутствует, что указывает на весьма низкую пористость гибридных оксидных покрытий; петля гистерезиса соответствует типу Н3 по классификации ИЮПАК, что может указывать на наличие щелевидных пор.
Наиболее важным результатом настоящей работы следует считать факт совместного осаждения покрытия на основе смешанных оксидов молибдена, кобальта, марганца, железа и вольфрама сложного состава на поверхности углеродной ткани марки Урал Т-22Р с использованием метода нестационарного электролиза.
При сравнительном анализе количественного химического состава полученного покрытия по глубине (до 2 мкм) и состава поверхностных слоев (до 4 нм) можно сделать вывод, что молибден преимущественно находится в поверхностном слое. Причем следует отметить, что возможно и образование оксидных соединений молибдена нестехиометрического состава. Это благоприятный фактор, так как известно, что с ростом количества дефектов структуры и степени отклонения соединения от стехиометрии увеличивается его электрохимическая активность при потенциальном использовании в качестве электродных материалов. Также обнаружено, что на поверхности вольфрам осаждается в очень малых количествах, его концентрация низка и составляет менее десятой доли процента, в то время как по толщине покрытия она увеличивается.
По данным рентгеновского микроанализа в составе покрытия на углеродной ткани обнаружен кобальт. Предполагается, что кобальт как наименее окисляемый элемент расположен в более глубоких слоях оксидного покрытия и отсутствует в сверхтонком нанометровом поверхностном слое.
Так как известно, что оксиды молибдена, кобальта, марганца, железа и вольфрама характеризуются электрохимической активностью, можно сделать предположение, что разработанные гибридные оксидные покрытия на поверхности углеродной ткани, несмотря на довольно невысокие значения удельной поверхности, могут являться перспективными гибкими электродными материалами для суперконденсаторов без использования каких-либо проводящих добавок и связующего, что требует дальнейшего глубокого исследования.
ЗАКЛЮЧЕНИЕ
Показана возможность формирования на поверхности углеродной ткани гибридных оксидных покрытий на основе оксидов переходных металлов (Mo, Co, Mn, W) с использованием метода нестационарного электролиза.
По данным РФЭС основу слоев гибридных оксидных покрытий на углеродной ткани составляют оксиды молибдена с незначительным содержанием железа, марганца, вольфрама. Молибден окислен преимущественно до состояния +6, железо – до +2 и +3, марганец – не ниже +3.
Установлено, что полученные гибридные оксидные покрытия характеризуются преимущественно мезопорами, а величина удельной поверхности Sуд, рассчитанная по уравнению БЭТ, составила 1.0547 ± 0.0024 м2 · г–1.
Список литературы
Cakici M., Reddy K.R., Alonso-Marroquin F. // Chem. Eng. J. 2017. V. 309. P. 151. https://doi.org/10.1016/j.cej.2016.10.012
Mukkabla R., Meduri P., Deepa M., Ghosa P. // Chem. Eng. J. 2016. V. 303. P. 368. https://doi.org/10.1016/j.cej.2016.05.146
Kang L., Sun S.X., Kong L.B. et al. // Chin. Chem. Lett. 2014. V. 25. № 6. P. 957. https://doi.org/10.1016/j.cclet.2014.05.032
Peng H., Cui S., Xie X. et al. // Electrochim. Acta. 2019. V. 322. P. 1. https://doi.org/10.1016/j.electacta.2019.134759
Klimont A.A., Stakhanova S.V., Semushin K.A. et al. // J. Surf. Invest.: X-ray, Synchrotron Neutron Tech. 2017. V. 11. № 5. P. 940. https://doi.org/10.1134/S1027451017050081
Kim D.-K., Kim S.-J., Lee Y.-W. et al. // Electrochim. Acta. 2015. V. 163. P. 132. https://doi.org/10.1016/j.electacta.2015.02.121
Wang G., Zhang L., Zhang J. // Chem. Soc. Rev. 2012. V. 41. № 2. P. 797. https://doi.org/10.1039/C1CS15060J
Bendi R., Kumar V., Bhavanasi V. et al. // Adv. En. Mater. 2016. V. 6. № 3. P. 1. https://doi.org/10.1002/aenm.201501833
Peng H., Wei C., Wang K. et al. // ACS Appl. Mater. Interfaces. 2017. V. 9. № 20. P. 17067. https://doi.org/10.1021/acsami.7b02776
Lee S., Nam G., Sun J. et al. // Ang. Chem. Int. Ed. 2016. V. 55. № 30. P. 8599. https://doi.org/10.1002/anie.201602851
Kariper I.A., Meydaneri Tezel F. // Ceram. Int. 2019. V 45. P. 3478. https://doi.org/10.1016/j.ceramint.2018.11.004
Huang L., Yao B., Sun J. et al. // J. Mater. Chem. A. 2017. V. 5. № 6. P. 2897. https://doi.org/10.1039/c6ta10433a
Wu F., Wang X., Zheng W. et al. // Electrochim. Acta. 2017. V. 245. P. 685. https://doi.org/10.1016/j.electacta.2017.05.165
Chen L., Wang Z., He C. et al. // ACS Appl. Mater. Interfaces. 2013. V. 5. № 19. P. 9537. https://doi.org/10.1021/am402368p
Tang K., White R.J., Mu X. et al. // ChemSusChem. 2013. V. 5. № 2. P. 400. https://doi.org/10.1002/cssc.201100609
Wang Z., Zhang X., Zhang Z. et al. // J. Colloid Interface Sci. 2015. V. 460. P. 303. https://doi.org/10.1016/j.jcis.2015.08.067
Wang Y.-X., Lim Y.-G., Park M.-S. et al. // J. Mater. Chem. A. 2014. V. 2. № 2. P. 529. https://doi.org/10.1039/C3TA13592F
Cai Y., Wang Y., Deng S. et al. // Ceram. Int. 2014. V. 40. № 3. P. 4109. https://doi.org/10.1016/j.ceramint.2013.08.065
Shiva K., Rajendra H.B., Subrahmanyam K.S. et al. // Chem. Eur. J. 2012. V. 18. № 15. P. 4489. https://doi.org/10.1002/chem.201200352
Vol’fkovich Yu.M., Rychagov A.Yu., Kiselev M.R. et al. // Russ. J. Phys. Chem. A. 2020. V. 94. № 4. P. 864. https://doi.org/10.1134/S0036024420040251
Bespalova Zh.I., Khramenkova A.V. // Phys. Chem. Math. 2016. V. 7. № 3. P. 433. https://doi.org/10.17586/2220-8054-2016-7-3-433-450
Васько А.Т. Электрохимия молибдена и вольфрама. Киев: Наукова Думка, 1974. 256 с.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования