Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2022, № 8, стр. 11-18
Оптимизация параметров томографических исследований биоразлагаемых полимеров
А. Ю. Григорьев a, *, А. В. Бузмаков a
a Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
119333 Москва, Россия
* E-mail: grigartu@gmail.com
Поступила в редакцию 10.12.2021
После доработки 20.01.2022
Принята к публикации 21.01.2022
- EDN: TVWZGK
- DOI: 10.31857/S1028096022080076
Аннотация
В настоящее время широкое применение в различных областях науки и техники, в частности медицине, нашли биополимеры на основе полилизиновых кислот. Такие биоразлагаемые полимеры также используются в пищевой промышленности в качестве упаковочного материала. С увеличением их распространенности возникает необходимость исследования таких полимеров и процессов, происходящих в них, не инвазивными методами, одним из которых является рентгеновская микротомография. В настоящей работе был проведен ряд исследований модельного объекта при различной степени монохроматизации излучения с использованием кристалла монохроматора и алюминиевых фильтров различной толщины для отсекания низкоэнергетической части полихроматического спектра рентгеновской трубки и при различном времени экспозиции. В результате экспериментов были получена серия томограмма и создано программное обеспечение для расчета морфологических параметров исследуемых объектов. В основе программы обработки данных лежат алгоритм бинаризации Оцу для разделения образца и фона на изображении, метод Хафа для выделения границ образца и метод медианной фильтрации для уменьшения влияния импульсных шумов. Предложены оптимизированные параметры проведения микротомографических измерений для уменьшения времени и повышения качества исследования пористой структуры образцов биоразлагаемых полимеров.
ВВЕДЕНИЕ
Биоразлагаемые полимеры – полимеры, которые постепенно разлагаются в организме, не нанося урон живому существу. В настоящее время широкое применение нашли биополимеры на основе оксикарбоновых кислот [1–3]. Например, они используются в хирургии в качестве шовного материала, имплантатов, матриксов, шурупов, стержней, шин. В фармакологии – как основа обеспечения пролонгированного усвоения медикаментов и контролируемой доставки лекарственного средства. Из биоразлагаемых полимеров делают искусственные органы и ткани, взамен утраченных путем создания гибридных тканеинженерных конструкций [4, 5]. Чтобы выполнять полезные функции, пористые полимерные структуры должны обладать рядом биологических и физико-химических свойств: низкой цитотоксичностью, высокой биосовместимостью и механической прочностью, взаимосвязанными порами для обеспечения беспрепятственного прорастания живых клеток вглубь матрикса и доставку питательных веществ к ним, а также оптимальной скоростью биодеградации с образованием нетоксичных компонентов [6]. Такие полимеры или схожие с ними по структуре объекты исследуют методом рентгеновской микротомографии с использованием синхротронного излучения [7–9] или на лабораторных установках [10, 11], в том числе в лаборатории рефлектометрии и малоуглового рассеяния в ФНИЦ “Кристаллография и фотоника” РАН [12]. Однако раньше проведение исследований занимало порядка 120 мин на каждый объект без учета восстановления томограммы и расчетов пористости и размеров объекта. Так как в большинстве случаев полимеры, применяемые в медицине, исследуют в процессе разложения, во время длительного эксперимента могут возникать изменения исследуемого образца. Это может повлиять на качество томограммы и расчетов, например, привести к появлению артефактов движения [13, 14].
ЭКСПЕРИМЕНТ И МЕТОДИКА ЕГО ПРОВЕДЕНИЯ
Объект исследования
На рис. 1 представлено изображение образца, исследуемого пористого полилактидного матрикса, полученное с помощью растровой электронной микроскопии (РЭМ). Параметры образующейся пористости можно менять, варьируя режимы сверхкритической флюидной пластификации полимера и давление CO2 [12].
Экспериментальная установка
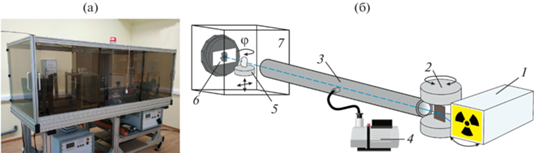
Исследования проводили на микротомографе (рис. 2), разработанном в лаборатории рефлектометрии и малоуглового рассеяния ФНИЦ “Кристаллография и фотоника” РАН [15]. Источником излучения служила рентгеновская трубка с молибденовым анодом. Использование ускоряющего напряжения 45 кВ и ток 40 мА позволило получить рентгеновское излучение не слишком низкой интенсивности, чтобы избежать полного поглощения объектом, и не слишком высокой интенсивности для создания контрастного изображения объекта. Для получения томограммы снимали 400 изображений в угловом диапазоне 0°–200° с шагом 0.5°, использовали рентгеновский детектор XIMEA xiRAY11 с размером пикселя 9 × 9 мкм. Величина переполнения такого детектора – 4000 отсчетов, зарегистрированных одним пикселем. Для отсекания низкоэнергетической части полихроматического спектра рентгеновской трубки применяли алюминиевые пластинки толщиной 500, 700, 1000, 1200, 1380 мкм.
Рис. 2.
Рентгеновский микротомограф (а) и его схема (б): 1 – рентгеновская трубка; 2 – кристалл-монохроматор; 3 – вакуумный объем; 4 – форвакуумный насос; 5 – координатный стол с гониометрическим устройством для вращения образца; 6 – рентгеновский детектор XIMEA xiRAY11; 7 – биозащита [12].
Выбор параметров зондирующего излучения
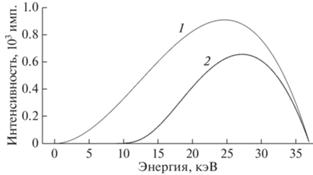
Получать изображения методом рентгеновской томографии можно с использованием двух видов излучения: полихроматического и монохроматического. К достоинствам монохроматического излучения относятся возможность получения количественно коэффициента поглощения образца и определение материала, из которого он состоит [15]. Среди недостатков – прежде всего, более низкая интенсивность по сравнению с полихроматическим излучением при тех же параметрах источника. Отсюда следует основное преимущество полихроматического излучения – высокая интенсивность. Полихроматическое излучение содержит весь спектр излучения рентгеновской трубки, а не только малую его часть, хоть и самую яркую, выделяемую монохроматором [16]. Интегральная интенсивность спектра тормозного излучения оказывается существенно выше. Однако полихроматическое излучение тоже обладает недостатками. Первым недостатком является возможность лишь качественной оценки полученных изображений, т.е. только понимание строения объекта без определения его коэффициента поглощения, что не дает информации, из какого материала состоит исследуемый объект. Существуют методы [17], позволяющие устранить этот недостаток, однако они опираются на грубые приближения, что сказывается на их точности. Вторым существенным недостатком полихроматического излучения является возникновение “чашевидного артефакта” [18].
В настоящей работе измерения проведены с использованием полихроматического излучения. Так как задача не сводится к поиску материала полимера, а лишь к определению его пористости, достаточно будет определить его пространственное строение, не узнавая точный коэффициент поглощения.
Устранение “чашевидного” артефакта
Из-за того, что исследуемый полимер обладает пористой структурой, алгоритм анализа изображения может принять часть полимера за пору, т.е. элемент класса “фон”, если его коэффициент поглощения окажется ниже порога бинаризации. Это приведет к завышению расчетной итоговой пористости образца.
Для уменьшения воздействия “чашевидного” артефакта применяли метод физической фильтрации. На пути хода пучка был помещен алюминиевый фильтр, который поглощал низкоэнергетическую часть тормозного спектра рентгеновской трубки (рис. 3). В результате больше излучения проникало внутрь образца и не происходило искусственного увеличения коэффициента поглощения внешней части полимера.
Компьютерная обработка томограмм
Для расчета пористости образца и оценки качества восстановленных томограмм был написан специальный алгоритм. В первом блоке алгоритма срез был обработан медианным (цифровым) фильтром. На рис. 4 можно заметить, что при такой обработке изображения значительно уменьшается уровень шумов, однако само изображение размывается. Если размытие после использования медианной фильтрации с окном 3 × 3 пикселя не столь заметно, то при использовании медианной фильтрации с окном 5 × 5 пикселей детали на границах образец–фон пропадают, в то время как “шумность” изображения практически не изменяется. Поэтому для предобработки изображения была выбрана медианная фильтрация с окном 3 × 3 пикселя.
Выделение образца
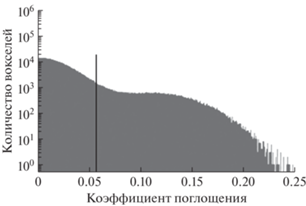
Во втором блоке алгоритма проводилась пороговая бинаризация методом Оцу [19]. Изображение слоя разделялось на два класса: “объект” и “фон”. Здесь в класс “объект” входят все пиксели, которые должны принадлежать исследуемому образцу, а в класс” фон” входят все пиксели, которые принадлежат пустому пространству. В дальнейшем такое разделение поможет выделить области, где присутствует исследуемый образец.
Метод Оцу основан на анализе гистограммы яркости пикселей на изображении. На рис. 5 представлена гистограмма, построенная на основе одной из восстановленных томограмм. Вертикальной линией обозначен порог бинаризации, рассчитанный методом Оцу. Все пиксели со значениями ниже данного порогового значения (расположенные на гистограмме слева от вертикальной линии) принимают за фоновые, все пиксели со значениями выше порогового (расположенные справа) принимают в качестве объекта.
Автоматическое определение границ образца
Так как дальнейшие расчеты проведены только в объеме образца, необходимо локализовать объект исследования на томограмме. В силу того, что полимер имеет цилиндрическую форму, на каждом горизонтальном срезе необходимо выделить окружность, внутри которой он будет находиться. На начальных этапах это делали вручную, задавая центр окружности и ее радиус. Затем заданную окружность наносили на изображение среза. Если обнаруживалась неточность локализации, центр окружности и радиус изменяли, и все повторялось до тех пор, пока образец не оказывался полностью в окружности.
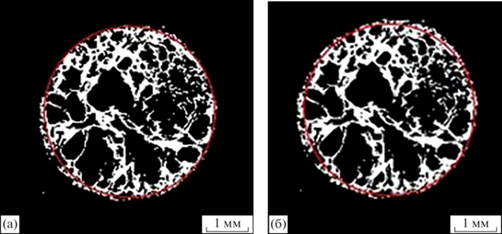
Однако результат томографии включает в себя порядка 400–500 срезов, поэтому обрабатывать каждый образец вручную крайне трудоемко по времени. К тому же человеческое зрение не идеально, в связи с этим при такой локализации образца существует риск захватить области, в которых не присутствует исследуемый объект. Это приведет к неточным расчетам параметров образца и к их несоответствию у различных экспериментаторов. Поэтому возникла необходимость автоматизации процесса. После изучения различных способов локализации образца на изображениях был выбран метод Хафа [20].
Основными недостатками этого метода является его ресурсоемкость и неточность при работе с изображениями с высоким уровнем шума. Первый недостаток не представляет проблемы из-за высокой вычислительной мощности сервера, на котором проводятся расчеты: обработка одной томограммы занимает порядка 2–3 с. Второй недостаток более существенный, однако его влияние было уменьшено при помощи медианной фильтрации.
На рис. 6 представлен результат работы метода Хафа и локализация объекта экспериментатором. На обоих изображениях части образца находятся за пределами выделенной зоны, однако видно, что алгоритму удалось автоматически локализовать образец точнее. Большая часть образца, обозначенного белым цветом, находится внутри выделенной области, что повышает точность расчетов пористости.
Расчет пористости
После определения границы образца внутри нее проводили расчет пористости полимера. Отдельно суммировали количество фоновых пикселей и пикселей, которые определены как объект.
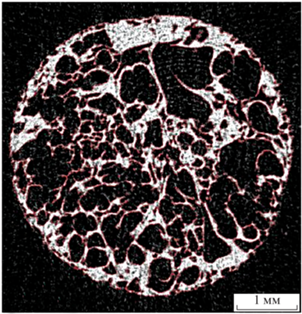
На рис. 7 представлен срез, на котором сплошными линиями выделены границы объект–фон. Можно заметить, что весь полимер находится внутри разграничивающих линий, значит алгоритм работает без ошибок и правильно определяет пиксели, относящиеся к фону и к объекту.
Рис. 7.
Срез с разделением объекта (белый цвет) и фона (черный цвет), границы выделены сплошными линиями.
После суммирования осуществляют расчет пористости по формуле:
где Np – число пикселей класса “фон”, Nо – число пикселей класса “объект”. Параметр P является одним из факторов оценки качества, полученных томограмм.Оценка уровня шума на реконструкции изображения
Вторым критерием оценки качества восстановленного изображения служило среднеквадратичное отклонение уровня шума в объеме пустого пространства над образцом. Так как это пространство заполнено воздухом, его коэффициент поглощения должен быть один и тот же по всему объему. Однако вследствие возникновения импульсных шумов однородность нарушается, и чем больше уровень шума, тем выше отклонение коэффициентов поглощения от среднего значения.
Наиболее близкой к эталонной томограмме, снятой с использованием монохроматического излучения, получилась томограмма при 3000 отсчетах детектора. Однако разработанный алгоритм практически с такой же точностью локализует объект и рассчитывает его параметры при 2000 отсчетах. При падении интенсивности меньше 2000 импульсов из-за возникающих шумов алгоритм совершает ошибки в локализации объекта и, как следствие, некорректно рассчитывает параметры исследуемого объекта.
Методика проведения исследования
Исследование можно разделить на четыре этапа.
1. Определение минимальной интенсивности излучения прямого рентгеновского пучка (числа квантов), при которой возникающие шумы не будут мешать корректной работе алгоритмов восстановления и обработки изображения, основанных на методах Оцу и Хафа.
2. Подбор толщины алюминиевого фильтра для времени экспозиции от 1.5 до 4 с так, чтобы интенсивность рентгеновского излучения соответствовала минимальному числу квантов.
3. Предварительное исследование объекта, состоящего из одного и того же вещества по всему объему, с различными фильтрами для определения зависимости величины “чашевидного” артефакта от толщины алюминиевого фильтра.
4. Исследование образцов с использованием оптимизированных параметров.
Определение минимальной достаточной интенсивности излучения
Необходимо по возможности уменьшить негативное воздействие рентгеновского излучения на образец. Следовательно, требуется понять, каково минимально возможное число отсчетов детектора, при котором разработанный алгоритм будет работать корректно. Для определения этого параметра была проведена серия экспериментов на одном и том же исследуемом полимере с использованием полихроматического излучения с одинаковой экспозицией 4 с в диапазоне 1000–4000 отсчетов детектора. Средний шаг изменения интенсивности излучения составлял 200 импульсов. 4000 отсчетов – это предел измерения детектора XIMEA xiRAY11, поэтому большее количество импульсов не измеряли, так как в основе детектора лежит аналого-цифровой преобразователь с размерностью 12 бит, и большее количество импульсов переполняло бы канал. В результате снимок томограммы представлял собой практически однородное засвеченное изображение.
На рис. 8 представлены центральные томограммы, полученные при 1600, 2000 и 3000 отсчетах детектора при использовании полихроматического излучения, и эталонная томограмма, полученная для монохроматического изучения при 2000 отсчетах детектора. На представленных срезах визуально можно определить сходство эталонной томограммы и томограммы при 3000 отсчетах детектора. Срезы при 1600 и 2000 отсчетах детектора изобилуют точками, окрашенными в белый цвет, присущий веществу образца, но им не являются.
Рис. 8.
Центральные срезы исследуемого образца, полученные методом томографии с использованием полихроматического излучения при 1600 (а), 2000 (б), 3000 (в) импульсах и при 2000 импульсах (г) с использованием монохроматического излучения и эталонного образца. Сплошными линиями обозначены границы объект–фон по расчетам программы.

Точность восстановленных томограмм оценивали по отклонению рассчитанной пористости полимера в выделенном объеме от плотности в таком же объеме полимера при съемке с использованием монохроматического излучения. Для этого был разработан алгоритм, состоящий из блоков, который обрабатывал каждый срез отдельно. По результатам оценки точности восстановленных томограмм минимально необходимое число отсчетов детектора составляет 2000.
Определение оптимальной толщины алюминиевого фильтра
Для определения оптимальной толщины алюминиевого фильтра была поставлена вторая серия экспериментов. В ней толщина фильтра изменялась со средним шагом 200 мкм. Экспозицию подбирали таким образом, чтобы детектор регистрировал необходимые для максимальной точности 2000 импульсов. Толщина фильтра, подобранная экспозиция и рассчитанные значения пористости и шума представлены в табл. 1.
Таблица 1.
Результаты серии экспериментов по подбору оптимальной толщины алюминиевого фильтра
| Экспозиция, с | Толщина фильтра, мкм | Пористость, % | Среднеквадратичное отклонение |
|---|---|---|---|
| 3.6 | 1380 | 82.52 | 0.30 |
| 3.0 | 1200 | 88.67 | 0.25 |
| 2.3 | 1000 | 88.14 | 0.20 |
| 1.8 | 700 | 88.15 | 0.23 |
| 1.5 | 500 | 88.70 | 0.017 |
| 1.0 | 210 | 88.16 | 0.255 |
| Монохроматическое | |||
| 4.0 | Отсутствует | 88.71 | 0.03 |
Увеличение толщины фильтра и экспозиции практически на каждом шаге приводило к увеличению уровня шума. В последней строке табл. 1 приведены параметры режима съемки, принятого за эталонный: монохроматическое излучение, экспозиция 4 с, без алюминиевого фильтра. Разница между значениями пористости, полученными в результате проведенной серии экспериментов и в “эталонном режиме”, с увеличением толщины фильтра и экспозиции также увеличивалась. Однако качество съемки при экспозиции 3 с и толщине фильтра 1200 мкм близко к эталонному, но не так точно, как при съемке с экспозицией 1.5 с и толщиной фильтра 500 мкм.
ЗАКЛЮЧЕНИЕ
В ходе работы была оптимизирована методика проведения исследований биорезорбируемых полимеров. После серии экспериментов при различном времени экспозиции и с использованием алюминиевых фильтров различной толщины были определены оптимальные параметры съемки. Для исследования полилактидных биоразлагаемых полимеров с минимальным негативным воздействием на них рентгеновского излучения и сохранением контрастности и точности определения пространственной структуры наилучшим является использование полихроматического излучения с применением алюминиевого фильтра толщиной 500 мкм. Рассчитанные значения пористости при таком зондировании отличались от измерений с применением эталонного излучения (монохроматического с экспозицией 4 с) на 0.01%, а среднеквадратичное отклонение, используемое в качестве оценки уровня шума на изображении, оказалось меньше эталонного практически в два раза. Это позволяет сделать вывод, что такой способ дает возможность проводить более точные измерения полилактидных полимеров с меньшим воздействием на них. Полученные результаты могут быть использованы для дальнейших исследований пространственной структуры биорезорбируемых полимеров и ее изменения со временем.
Список литературы
Bogorodski S.E., Krotova L.I., Mironov A.V., Popov V.K. // Russ. J. Phys. Chem. B. 2013. V. 7. № 8. P. 916. https://doi.org/10.1134/S1990793113080034
Smith R. Biodegradable Polymers for Industrial Applications. Boca Raton–Boston–N.Y.–Washington: Woodhead Publishing Limited, 2005. 531 p.
Léonard A., Calberg C., Kerckhofs G et al. // J. Porous Mater. 2008. V. 15. P. 397. https://doi.org/10.1007/s10934-006-9094-y
Kunduru K.R., Basu A., Domb A.J. Biodegradable Polymers: Medical Applications. // Encyclopedia of Polymer Science and Technology. John Wiley& Sons, 2016. https://doi.org/10.1002/0471440264.pst027.pub2
Севастьянов В.И. // Вестн. трансплантологии и искусственных органов. 2014. Т. 26. № 3. С. 93.
Karageorgiou V., Kaplan D. // Biomaterials. 2005. V. 26. № 27. P. 5474. https://doi.org/10.1016/j.biomaterials.2005.02.002
Tanaka T., Uesugi K., Takeuchi A. et al. // Polymer. 2007. V. 48. № 20. P. 6145. https://doi.org/10.1016/j.polymer.2007.07.063
Müller B., Beckmann F., Huser M. et al. // Biomol. Engin. 2002. V. 19. № 2–6. P. 73. https://doi.org/10.1016/S1389-0344(02)00014-X
Buzmakov A.V., Dunaev A.G., Krivonosov Y.S., Zolotov D.A., Dyachkova I.G., Krotova L.I., Volkov V.V., Bodey A.J., Asadchikov V.E., Popov V.K. // Polymers. 2021. V. 13. № 7. P. 1021. https://doi.org/10.3390/polym13071021
Mönkäre J., Pajander J., Hakala R.A. et al. // Eur. J. Pharm. Sci. 2012. V. 47. № 1. P. 170. https://doi.org/10.1016/j.ejps.2012.05.013
Potter K., Sweet D.E., Anderson P. et al. // Bone. 2006. V. 38. № 3. P. 350. https://doi.org/10.1016/j.bone.2005.08.025
Кривоносов Ю.С., Чукалина М.В., Бузмаков А.В., Асадчиков В.Е., Русаков А.А., Мариянац А.О., Попов В.К., Занин И.О., Кулик В.Л. // Заводская лаборатория. Диагностика материалов. 2020. Т. 86. № 1. С. 26.
Davis G.R., Elliott J.C. // Mater. Sci. Technol. 2006. V. 22. № 9. P. 1011. https://doi.org/10.1179/174328406X114117
Barrett J.F., Keat N. // Radiographics. 2004. V. 24. № 6. P. 1679.
Бузмаков А.В., Асадчиков В.Е., Золотов Д.А. и др. // Кристаллография. 2018. Т. 63. № 6. С. 1007. https://doi.org/10.1134/S0023476118060073
Buzug T.M. // Springer Handbook of Medical Technology. Berlin–Heidelberg: Springer, 2011. P. 311.
Ingacheva A., Chukalina M., Buzmakov A., Nikolaev D. // Proc. SPIE. 2020. V. 11433. P. UNSP 1143331. Twelfth Int. Conf. on Machine Vision (ICMV 2019). Amsterdam, 2019. https://doi.org/10.1117/12.2557167
Hunter A.K., McDavid W.D. // Dentomaxillofacial Radiol. 2012. V. 41. № 3. P. 217. https://doi.org/10.1259/dmfr/19015946
Otsu N. // IEEE Trans. Systems, Man, Cybernetics. 1979. V. 9. № 1. P. 62.
Gonzalez R.C., Woods R.E. Digital Image Processing. Pearson–Prentice Hall, 1993. 976 p.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования