Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2023, № 3, стр. 92-97
Исследование морфологии поверхности каналов микрофлюидных чипов с помощью рентгеновской томографии и растровой электронной микроскопии
С. В. Чапек a, И. А. Панкин a, *, Д. В. Ходакова b, А. А. Гуда a, А. С. Гончарова b, А. В. Солдатов a
a Международный исследовательский институт интеллектуальных материалов, Южный федеральный университет
344090 Ростов-на-Дону, Россия
b НМИЦ онкологии Минздрава России
344037 Ростов-на-Дону, Россия
* E-mail: pankin@sfedu.ru
Поступила в редакцию 25.06.2022
После доработки 12.08.2022
Принята к публикации 12.08.2022
- EDN: LGOIBS
- DOI: 10.31857/S1028096023030032
Аннотация
Рассмотрена визуализация микрофлюидных чипов с целью исследования морфологии поверхности каналов и оценки качества печати микрофлюидных устройств с помощью технологии 3D печати методом цифровой световой проекции. Визуализация выполнена с помощью рентгеновской микротомографии с использованием различных контрастирующих веществ на основе йодсодержащих препаратов, а также методом растровой электронной микроскопии. Результаты показали, что микро-КТ-визуализация позволяет осуществить контроль качества печати устройства относительно основных геометрических параметров моделей, заданных на этапе прототипирования устройств, а также визуализировать трехмерную модель канала и морфологию поверхности. Пространственное разрешение метода растровой электронной микроскопии превосходит размер пикселя печати и позволяет уточнить наличие локальных дефектов, обусловленных неравномерным затвердеванием смолы при промывке образцов.
ВВЕДЕНИЕ
Микрофлюидика является современной междисциплинарной областью знаний, находящейся на стыке физики, химии, биологии, микрогидродинамики, микроэлектроники и материаловедения. В таких устройствах малые объемы и потоки жидкостей ограничены субмиллиметровыми масштабами, что позволяет осуществлять прецизионный контроль рабочих объемов вплоть до пиколитров и находит применение в ряде процессов в области химии, медицины, фармакологии, биологии и других научно-технических областях [1–5]. Микрофлюидные устройства нашли свое применение в контролируемом смешивании компонентов химических реакций, разделении или обнаружении примесей [6, 7]. В зависимости от функциональных особенностей микрофлюидные устройства можно использовать в качестве микрореакторов [8–10], лабораторий на чипе [11–13] или органов на чипе [14].
С развитием аддитивных технологий традиционные методы изготовления микрофлюидных устройств (микрофрезеровка, микролитье, горячее тиснение, литье под давлением), которые считали “золотым стандартом” последние 30 лет, начинают терять свою актуальность. Перечисленные выше методы имеют ряд недостатков, таких как трудоемкие, дорогостоящие процессы и сложность внесения изменений в конструкцию. Кроме того, для данных методов часто необходимы “чистые помещения”, что влечет за собой соответствующие сложности производства [8–10].
Будучи многообещающей альтернативной для изготовления микрофлюидных устройств, 3D печать призвана изменить подходы к их производству. Технологии на основе стереолиторгафии SLA (Steriolitography), DLP (Digital Light Processing), послойного наплавления филамента, а также струйной 3D печати – наиболее широко используемые методы аддитивных технологий для прототипирования и создания микрофлюидных устройств [15, 16]. Однако актуальные исследования в области 3D печати микрофлюидных устройств отдают предпочтение технологиям цифровой световой проекции, что является одним из вариантов стереолитографии [17–20].
Для уменьшения количества реагентов, вступающих в реакцию, повышения удельной площади поверхности смешиваемых жидкостей, уменьшения инертности нагрева исследователи стремятся уменьшать диаметр каналов чипа. На масштабах 10–100 мкм пространственная разрешающая способность метода печати оказывает существенное влияние на геометрию каналов, шероховатость поверхности стенок, что в свою очередь влияет на гидродинамические характеристики потоков жидкостей.
Классические методы оптической микроскопии позволяют исследовать планарные структуры каналов на чипе, при этом визуализация внутреннего объема каналов, а также исследование морфологии их внутренних стенок остаются затруднительными. Проникающая способность рентгеновского излучения позволяет исследовать трехмерную структуру микрофлюидных каналов при использовании подходящего контрастного вещества [21]. Однако, несмотря на широкое применение метода рентгеновской компьютерной микротомографии для исследования структуры микроразмерных объектов, в том числе микроканалов в различных геологических объектах [22], данный метод не получил широкого распространения для визуализации каналов микрофлюидных устройств. Так, в [23] с помощью рентгеновской томографии исследовали границы раздела фаз жидкость–жидкость и жидкость–газ в тонких капиллярах (размер поперечного сечения составил несколько миллиметров), а в [24] микрофлюидные устройства, полученные с помощью технологии 3D печати c поперечным размером каналов около 400 мкм, в комбинации с методами томографии использовали для исследования процесса формирования тромбов в кровеносных сосудах.
В настоящей работе была проведена двумерная и трехмерная визуализация микрофлюидных устройств с поперечным сечением каналов 125 и 500 мкм с помощью рентгеновской компьютерной микротомографии с применением различных контрастирующих агентов. Исследована морфология поверхности микрофлюидных каналов и проведена оценка качества 3D печати микрофлюидных устройств. Полученные данные сравнивали с результатами визуализации поверхности боковых стенок микрофлюидных каналов методом растровой электронной микроскопии (РЭМ).
МЕТОДЫ
Описание методики 3D печати микрофлюидных устройств
В качестве модели для исследований морфологии поверхности микрофлюидных каналов в настоящей работе была выбрана наиболее распространенная топология микрофлюидных устройств – микромиксер в геометрии меандра (рис. 1a). Для исследований методами микро-КТ была спроектирована и реализована модель закрытого чипа, а для исследований методом РЭМ были изготовлены модели чипов с открытыми каналами (рис. 1б). 3D модель микрофлюидных устройств, состоящая из тела и канала квадратного сечения, была спроектирована с использованием CAD-системы Fusion 360 (Autodesk, США). Основные параметры микрофлюидных устройств приведены в табл. 1. Подготовку и отправку модели на 3D печать проводили при помощи программного обеспечения ASIGA Composer (Cидней, Австралия). Основные параметры 3D печати обеих моделей микрофлюидных устройств приведены в табл. 2. Следует отметить, что указанный в табл. 2 параметр скорости отрыва платформы был подобран экспериментальным путем, он влияет на равномерность распределения незатвердевшей фотополимерной смолы внутри канала, а также на качество верхней поверхности микрофлюидного канала. Для печати микрофлюидного устройства был использован 3D принтер ASIGA UV MAX (Сидней, Австралия). В качестве материала для печати брали фотополимерную смолу FunToDo Nano clear (Утрехт, Нидерланды).
Рис. 1.
3D модели микрофлюидных устройств в геометрии меандра на этапе прототипирования: а – чип закрытого типа для микро-КТ-визуализации; б – чип открытого типа для визуализации методом РЭМ.
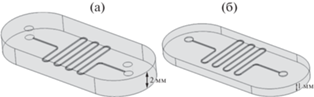
Таблица 1.
Геометрические параметры размера корпуса и внутренних каналов микрофлюидных устройств, заданные при формировании 3D модели устройства
| Образец микрофлюидного устройства | Размеры X × Y × Z, мм | Размер поперечного сечения канала, мкм | Длина канала, мм | Объем канала, мл | Наличие закрывающего слоя |
|---|---|---|---|---|---|
| РЭМ | 19 × 8 × 1 | 124 | 52 | 0.06 | Нет |
| Микро-КТ | 19 × 8 × 2 | 124 | 52 | 0.06 | Да |
| Микро-КТ | 24 × 8 × 2 | 500 | 52 | 0.24 | Да |
Таблица 2.
Параметры 3D печати исследуемых микрофлюидных устройств
| Образец микрофлюидного устройства | Высота слоя, мкм | Время экспозиции одного слоя, с | Время экспозиции двух слоев, с | Скорость отрыва платформы, мм/с | Интенсивность УФ-лампы, % | Время построения, мин |
|---|---|---|---|---|---|---|
| РЭМ | 25 | 20 | 1 | 10 | 95 | 6 |
| Микро-КТ | 25 | 20 | 1 | 10 | 95 | 10 |
| Микро-КТ-500 | 25 | 20 | 1 | 10 | 95 | 10 |
Описание параметров рентгеновской микро-КТ-визуализации
Микрокомпьютерная рентгеновская томография чипов была выполнена на лабораторном приборе Quantum GX microCT (производство Perkin Elmer, США). Параметры рентгеновской трубки: напряжение 90 кВ, сила тока 88 мкА. Сканирование проводили в различных режимах с варьируемым разрешением. При наилучшем разрешении размер вокселя составил 20 мкм, вращение гентри 360° (изображение было получено в 427 проекциях), время накопления данных составило 14 мин для одного измерения. С целью улучшения контраста и лучшей визуализации границ, объема и морфологии поверхности микрофлюидных каналов использовали контрастирующие жидкости на основе йода, а именно фармацевтический препарат на основе спиртового 10%-го раствора йода – бетадин, а также контрастирующий препарат на основе органически связанного йода, используемый для микро-КТ визуализации живых организмов, – препарат Optiray (производство Mallincrodt, Канада), где концентрация йода составляет 350 мг/мл (при заполнении каналов Optiray был разбавлен дистиллятом в отношении 1 : 10). Реконструкция трехмерных изображений путем анализа совокупности полученных в ходе микро-КТ-визуализации проекций была выполнена в программном комплексе RadiAnt.
Растровая электронная микроскопия
Визуализацию морфологии поверхности стенок микрофлюидных каналов методом РЭМ осуществляли с помощью микроскопа FEI Teneo на базе ООО “СМА”. Для проведения измерений образцы помещали на углеродную ленту, их поверхность предварительно покрывали тонким слоем золота с целью нейтрализации электростатического заряда. Рабочую камеру микроскопа откачивали до давления менее 10–3 Па в режиме высокого вакуума. Ускоряющее напряжение и ток электронного пучка составили 10 кВ и 0.10 нА соответственно. Для регистрации изображений использовали детектор обратно рассеянных электронов типа ETD (Everhart–Thornley detector) [25].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Визуализация методом рентгеновской компьютерной томографии
В рамках первого подхода визуализация микрофлюидных устройств была выполнена с помощью, сканирующей рентгеновской микротомографии с разрешением вокселя 20 мкм. Интересно, что ввиду достаточного отличия коэффициента поглощения рентгеновских лучей μ воздуха, который в единицах КT (или так называемых единицах Хаунсфилда) равен –1000 и μ материала смолы (–6.4 ± 7.1), применяемой для 3D печати микрофлюидных устройств, можно визуализировать каналы микрофлюидных устройств даже в отсутствие контрастирующего агента (рис. 2б). В то же время стоит отметить, что большинство методов синтеза подразумевает использование водных растворов реагентов (так называемые гидротермальные синтезы). Как показано на рис. 2a, коэффициенты поглощения рентгеновских лучей дистиллированной воды и смолы, используемой для печати микрофлюидных устройств, оказываются очень близкими, что не обеспечивает должного контраста для визуализации.
Рис. 2.
Результаты 2D визуализации в двух проекциях – “вид сверху” и “вид с торца” – для микрофлюидного чипа с заданным поперечным сечением каналов 124 мкм, заполненных: а – дистиллированной водой; б – воздухом; в – бетадином; г – Optiray; д – распределение рентгеновской плотности в микрофлюидном чипе, заполненном контрастным веществом на основе Optiray для серии поперечных сечений (вдоль линии в верхней части рис. г) и продольного сечения канала (вдоль линии в нижней части рис. г).
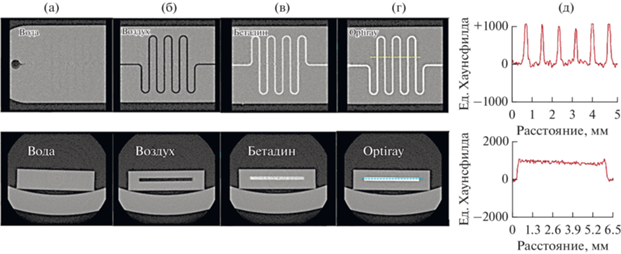
С целью более четкой визуализации каналы микрофлюидного устройства заполняли растворами йодсодержащих препаратов. Результаты визуализации, полученные при заполнении чипа бетадином (спиртовой раствор йода) и коммерческим контрастным веществом на основе органически связанного йода Optiray, используемым для контрастирования при клинических исследованиях, представлены на рис. 2в, 2г соответственно. Наконец, на рис. 2д показано распределение рентгеновской плотности вещества при заполнении микрофлюидного устройства контрастом на основе Optiray вдоль поперечных (верхняя часть) и продольного (нижняя часть) сечений каналов. Приведенные данные позволяют оценить однородность заполнения каналов жидким контрастирующим веществом и количественно оценить геометрические параметры исследуемых микрофлюидных устройств. Так, продольное сечение канала составляет примерно 6 мм, усредненное значение поперечных сечений ~100 ± 20 мкм, что соответствует параметрам печати микрофлюидных устройств с заданным поперечным сечением каналов 124 мкм (табл. 2).
На следующем этапе была выполнена реконструкция 3D моделей каналов микрофлюидных устройств с поперечным сечением каналов 124 и 500 мкм (рис. 3), заполненных контрастирующим веществом Optiray. В обоих случаях можно видеть, что по результатам микро-КТ-визуализации и последующей реконструкции 3D изображений можно установить особенности морфологии поверхности микрофлюидных каналов. Поверхность боковых стенок канала сечением 500 мкм более абразивная по сравнению с вертикальными поверхностями, что может быть связанно с тем, что разрешение печати вдоль слоя, формирующего боковые стенки каналов, составляет 25 × 62 мкм, в то время как разрешение печати вдоль слоя, формирующего горизонтальные плоскости, составило 62 × 62 мкм (т.е. обусловлено большим зерном печати в горизонтальной плоскости).
Визуализация методом РЭМ
Микрофлюидные устройства с поперечным размером сечения каналов 124 мкм были исследованы с помощью РЭМ. На рис. 4 показаны различные конструктивные элементы исследуемого чипа. Как можно видеть из рис. 4б, 4в, размер поперечного сечения в прямой части канала и области петли варьируется от 90 до 125 мкм соответственно. Результаты визуализации демонстрируют различную степень неоднородности поверхности боковых стенок каналов по внешнему и внутреннему радиусам изгиба. На рис. 4б стрелками указаны выступы, размер которых приблизительно соответствует заданному размеру пикселя 62.4 мкм в плоскости XY.
Рис. 4.
РЭМ-изображения боковых стенок каналов микрофлюидного чипа топологии меандра: а – петля канала, увеличение 400×; б, в – петля канала, увеличение 800×; г – прямой участок канала.

Более и менее выраженные неоднородности в изгибах каналов могут быть связаны с неоднородностью промывки (удаления остаточной жидкой смолы из полости каналов) и, как результат, неоднородным затвердеванием смолы. Этот эффект отчетливо наблюдается при визуализации входного порта микрофлюидного чипа округлой формы, показанного на рис. 5, где в правой части отверстия боковая стенка выглядит более пологой.
Рис. 5.
РЭМ-изображения входного порта микрофлюидного чипа с различным увеличением: а – 200×; б – 400×. Темными отрезками указаны слои печати вдоль оси X. Усредненный размер пикселя вдоль оси X составляет 66 мкм, что соответствует заданным параметрам печати (табл. 2).

Также на рис. 4а, 4в видны вкрапления во внутренней части каналов, которые могут быть связаны как с загрязнением микрофлюидных устройств с каналами открытого типа инородными объектами, так и с центрами кристаллизации при затвердевании смолы. На рис. 5б при визуализации входного порта отчетливо видны неоднородности и микротрещины в боковой стенке отведенного канала, а также четко визуализируется пиксельный характер печати. Усредненный размер пикселя вдоль оси X, оцененный по РЭМ-изображению с 400-кратным увеличением, составляет ~66 мкм.
В целом стоит отметить, что метод РЭМ позволяет проводить более детальный анализ и контроль качества печати микрофлюидных чипов в рамках используемой технологии DLP 3D печати. Однако данный метод ограничен тем, что может быть применен только для чипов открытого типа. Или же микрофлюидный чип закрытого типа должен быть подвержен поперечному разрезу, что неизбежно приведет к дополнительным деформациям, и анализ полученных в последующем РЭМ-изображений не будет объективным касательно качества печати и морфологии стенок каналов микрофлюидных устройств. Однако рентгеновская компьютерная микротомография применима для визуализации микрофлюидных чипов закрытого типа. Более того, при формировании стационарных потоков микро-КТ-диагностика может быть применима для исследования процессов микрогидродинамики и позволит проводить 3D визуализацию процессов смешивания жидкостей в микрофлюидных каналах.
ВЫВОДЫ
В работе рассмотрена визуализация каналов микрофлюидных чипов, получаемых с помощью 3D печати методами цифровой световой проекции, рентгеновской микротомографии и РЭМ. В первом случае удается визуализировать структуру каналов даже без использования контрастирующих веществ ввиду достаточного контраста границы раздела смола–воздух. Методами микро-КТ визуализации удается оценить геометрические параметры микрофлюидных каналов, таких как размеры продольного и поперечного сечений. Реконструкция 3D изображений из серии микро-КТ-срезов с разрешением 20 мкм позволяет заключить, что поверхность боковых стенок каналов более абразивная, что может быть связано с более высоким разрешением печати в вертикальном направлении (размер пикселя 25 мкм по оси Z) в сравнении с горизонтальным (размер пикселя 62 мкм по осям X и Y). Пространственное разрешение РЭМ-изображений позволило получить более детальную информацию о морфологии поверхности боковых стенок микрофлюидных каналов для чипов “открытого” типа и наблюдать локальные артефакты печати, которые, вероятно, обусловлены неравномерным затвердеванием смолы при промывке микрофлюидных устройств.
Список литературы
Song Y., Kumar H.J., Kumar C.S.S.R. // Small. 2008. V. 4. № 6. P. 698.https://doi.org/10.1002/smll.200701029
Lai X., Lu B., Zhang P., Zhang X., Pu Z., Yu H., Li D. // ACS Biomater. Sci. Eng. 2019. V. 5. № 12. P. 6801.https://doi.org/10.1021/acsbiomaterials.9b00953
Ma J., Lee S, Yi M.Y., Li. C. // Lab Chip. 2017. V. 17. № 2. P. 209.https://doi.org/10.1039/C6LC01049K
Noviana E., Ozer T., Carrell C.S., Link J.S., McMahon C., Jang I., Henry C.S. // Chem. Rev. 2021. V. 121. № 19. P. 11835.https://doi.org/10.1021/acs.chemrev.0c01335
Niculescu A.-G., Chircov C., Bîrcă A.C., Grumezescu A.M. // Int. J. Mol. Sci. 2021. V. 22. № 4. P. 2011.https://doi.org/10.3390/ijms22042011
Hwang J., Cho Y.H., Park M.S., Kim B.H. // Int. J. Precis. Eng. Manuf. 2019. V. 20. № 3. P. 479.https://doi.org/10.1007/s12541-019-00103-2
Hamdallah S.I, Zoqlam R., Erfle P., Blyth M., Alkilany A.M., Dietzel A., Qi S. // Int. J. Pharm. 2020. № 584. P. 119408.https://doi.org/10.1016/j.ijpharm.2020.119408
Wang Y., Seidel M. // Sensors. 2021. V. 21. № 7. P. 2290. https://doi.org/10.3390/s21072290
Hakke V., Sonawane S., Anandan S., Sonawane, Ashokkumar S. // Nanomaterials. 2021. V. 11. № 1. P. 98.https://doi.org/10.3390/nano11010098
Shrimal P., Jadeja G., Patel S. // Chem. Eng. Res. Des. 2020. V. 153. P. 728. https://doi.org/10.1016/j.cherd.2019.11.031
Srikanth S., Dudala S., Jayapiriya U.S., Mohan J.M., Raut S., Dubey S.K., Ishii I., Goel J.A. // Sci. Rep. 2021. V. 11. № 1. P. 9750. https://doi.org/10.1038/s41598-021-88068-z
Schaap A., Koopmans D., Holtappels M., Dewar M., Arundell M., Papadimitriou S., Hanz R.,Monk S., Mowlem M., Loucaides S. // Int. J. Greenh. Gas Control. 2021. V. 110. P. 103427. https://doi.org/10.1016/j.ijggc.2021.103427
Narayanamurthy V., Jeroish Z.E., Bhuvaneshwari K.S., Bayat P., Premkumar R., Samsuri F., Yusoff M.M. // RSC Adv. 2020. V. 10. № 20. P. 11652. https://doi.org/10.1039/D0RA00263A
Tymm C., Zhou J., Tadimety A., Burklund A., Zhang J.X.J. // Cell. Mol. Bioeng. 2020. V. 13. № 4. P. 313. https://doi.org/10.1007/s12195-020-00642-z
Bressan L.P., Lima T.M., da Silveira G.D., da Silva J.A.F. // Appl. Sci. V. 2. № 5. P. 984. https://doi.org/10.1007/s42452-020-2768-2
Gonzalez G,. Roppolo I., Pirri C.F., Chiappone A. // Additive Manufacturing. V. 55. P. 102867. https://doi.org/10.1016/j.addma.2022.102867
De Costa B.M., Griveau S, Bedioui F., Orlye F., da Silva J.A.F., Varenne A. // Electrochim. Acta. 2022. № 407. P. 139888. https://doi.org/10.1016/j.electacta.2022.139888
Nguyen H.Q., Seo T.S. // Anal. Chim. Acta. 2022. № 1192. P. 339344. https://doi.org/10.1016/j.aca.2021.339344
Fritschen A., Bell A.K., Königstein I., Stühn L., Stark, Blaeser R.W. // Biomater. Sci. 2022. V. 10. № 8. P. 1981. https://doi.org/10.1039/D1BM01794B
Van der Linden P.J.E.M., Popov A.M., Pontoni // Lab. Chip. 2020. V. 20. № 22. P. 4128. https://doi.org/10.1039/D0LC00767F
Jahanbakhsh A., Wlodarczyk K.L., Hand D.P., Maier R.R.J., Maroto-Valer M.M. // Sensors. 2020. V. 20. № 14. P. 4030. https://doi.org/10.3390/s20144030
Kumar M., Knackstedt M.A., Senden T.J., Sheppard A.P., Middleton J.P. // Petrophys. 2010. V. 51. № 05. P. SPWLA-2010-v51n5a4. https://onepetro.org/petrophysics/article-abstract/171223/Visualizing-And-Quantifying-the-Residual-Phase?redirectedFrom=fulltext,
Schuler J., Kockmann N. // AIChE J. 2020. V. 66. № 4. P. 16890.https://doi.org/10.1002/aic.16890
Costa P.F., Albers H.J., Linssen J.E.A., Middelkamp H.H.T., van der Hout L., Passier R., van den Berg A., Malda J., Van der Meer A. // Lab. Chip. 2017. V. 17. № 16. P. 2785. https://doi.org/10.1039/C7LC00202E
Everhart T.E., Thornley R.F. // J. Sci. Instrum. 1960. V. 37. № 7. P. 246. https://doi.org/10.1088/0950-7671/37/7/307
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования



