Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2023, № 4, стр. 83-89
Исследование кристаллической структуры Nd5Mo3O16 + δ в диапазоне давлений 0–5.9 Гпа
К. А. Чебышев a, *, В. А. Турченко b, **, С. Е. Кичанов b, ***
a Донецкий национальный университет
283001 Донецк, Россия
b Объединенный институт ядерных исследований
141980 Дубна, Россия
* E-mail: chebyshev.konst@mail.ru
** E-mail: turchenko@jinr.ru
*** E-mail: ekich@nf.jinr.ru
Поступила в редакцию 15.08.2022
После доработки 28.10.2022
Принята к публикации 28.10.2022
- EDN: JXNHLA
- DOI: 10.31857/S1028096023040039
Аннотация
Молибдат неодима с кубической флюоритоподобной структурой получен твердофазным синтезом из оксидов металлов. Формирование конечного продукта происходит через образование при 700°С моноклинной структуры типа Ln2MoO6 (пр. гр. C2/c), вероятно, содержащей вакансии в решетках неодима и кислорода. Полученный при 900°С молибдат неодима кристаллизуется в пр. гр. Pn$\bar {3}$n с параметром ячейки a ≈ 11.03 Å. Проведены исследования кристаллической структуры молибдата неодима, полученного при 700°С и 900°С, методами нейтронной дифракции и атомистического моделирования с использованием программы GULP в диапазоне давлений 0–5.9 ГПа, которые продемонстрировали устойчивость кубической структуры при повышенном давлении.
ВВЕДЕНИЕ
Молибдаты редкоземельных элементов (РЗЭ) Ln5Mo3O16 + δ (Ln = La–Tb) с флюоритоподобной структурой и твердые растворы на их основе исследуют в последнее время благодаря наличию каталитических [1, 2] и люминесцентных [3, 4] свойств. Также молибдаты неодима и празеодима обладают высокой ионной проводимостью при средних температурах [5–7], что делает их интересными объектами изучения ввиду возможности применения в качестве материалов твердооксидных топливных элементов.
Данные соединения образуются в восстановительных условиях для РЗЭ от лантана до тербия [5, 8, 9], а в атмосфере воздуха – только для празеодима и неодима [10, 11], что демонстрирует влияние кислородной стехиометрии на устойчивость кристаллической структуры. Согласно [5] содержание кислорода в соединениях состава Ln5Mo3O16 + δ может изменяться от δ = 0 в восстановительных условиях и до δ = 0.5 в окислительных, причем при окислении восстановленных составов наблюдается разложение (для молибдата лантана) или изменение кристаллической структуры (для РЗЭ от самария до тербия).
Кристаллическая структура молибдата неодима описана пр. гр. Pn$\bar {3}$n с параметром элементарной ячейки, равным удвоенному параметру решетки флюорита [12]. Кратное увеличение элементарной ячейки обусловлено сверхструктурным упорядочением катионов неодима и молибдена в кристаллической решетке. Неодим занимает два положения с кратностью 12 и 8 и имеет искаженное кубическое окружение, а молибден формирует тетраэдры MoO4, располагаясь в позиции 12d.
Ранее было показано, что в системах Nd5 –xLnx · · Mo3O16 + δ [13–15], где Ln = Sm, Y, Er, введение РЗЭ с меньшим ионным радиусом по сравнению с неодимом приводит к уменьшению параметра кубической элементарной ячейки в структуре молибдата неодима. При достижении предела замещения реализуется морфотропный переход кубической фазы в моноклинную (пр. гр. С2/с). Молибдаты Ln5Mo3O16 + δ имеют моноклинную структуру в случае лантаноидов с меньшим, чем у неодима, ионным радиусом и, вероятно, входят в область гомогенности молибдатов Ln2MoO6. Возможно, что аналогичное изменение кристаллической структуры молибдата неодима будет происходить и при уменьшении параметра элементарной ячейки, вызванном высоким давлением. Для установления влияния давления на кристаллическую структуру молибдата Nd5Mo3O16 + δ были проведены нейтронографические эксперименты на приборе ДН-6 на импульсном реакторе ИБР-2 (г. Дубна) в диапазоне давлений 0–5.9 ГПа.
МЕТОДЫ И МАТЕРИАЛЫ
Синтез
Молибдат неодима получали твердофазным методом из стехиометрических смесей предварительно прокаленных оксидов неодима и молибдена с использованием реакции:
Гомогенизацию проводили с добавлением этанола в течение 30 мин, после чего смесь исходных компонентов прокаливали при 500, 700 и 900°С в течение 5 ч с промежуточной гомогенизацией и контролем прохождения реакции методом рентгенофазового анализа.Рентгенофазовый анализ
Прохождение реакции контролировали методом рентгенофазового анализа на дифрактометре ДРОН-2 (CuKα-излучение, Ni-фильтр) в диапазоне углов 2θ 10°–140° с шагом 0.05° и экспозицией 3 с.
Дифракция нейтронов
Эксперименты по дифракции нейтронов проводили на спектрометре DN-6 импульсного реактора ИБР-2 (ЛНФ им. И.М. Франка, ОИЯИ, Дубна, Россия) с использованием камеры высокого давления с сапфировыми наковальнями в диапазоне давлений 0–5.9 ГПа при комнатной температуре. Дифрактограммы измеряли при углах рассеяния 2θ = 90° с разрешением Δd/d = 0.025 на длине волны λ = 2 Å [16].
Дифрактограммы с разрешением Δd/d ≈ 0.001, которое практически не зависит от межплоскостного расстояния в широком интервале dhkl, получены с использованием фурье-дифрактометра высокого разрешения на импульсном реакторе ИБР-2М (г. Дубна) [17]. Нейтронограммы записывали с помощью детекторов, расположенных под средними углами рассеяния ±152° в диапазоне межплоскостных расстояний от 0.6 до 3.6 Å.
Для исследований на фурье-дифрактометре высокого разрешения образцы готовили в виде цилиндров диаметром 7 мм, высотой примерно 20 мм. Масса образца каждого состава составляла около 10 г. Образец помещали в ванадиевый контейнер, время съемки составляло около 2 ч.
Уточнение кристаллической структуры по данным дифракции нейтронов и рентгеновских лучей проводили с использованием программы FULLPROF с графическим интерфейсом WinPLOTR [18, 19]. В качестве исходной модели для уточнения использовали данные кристаллической структуры молибдата неодима состава Nd5Mo3O16 [12].
Атомистическое моделирование
Путем минимизации энергии межатомных взаимодействий оптимизирована кристаллическая структура молибдата неодима в диапазоне давлений 0–5.9 ГПа с помощью программы GULP 4.0 (General Utility Lattice Program) [20]. Парные межатомные взаимодействия описывали потенциалом Букингема, поляризуемость анионов – с помощью модели “остов–оболочка”. Используемые параметры межатомных потенциалов приведены в табл. 1.
Таблица 1.
Параметры потенциалов парных взаимодействий, а также заряды остовов (c) и оболочек (s) атомов
| Взаимодействие | Потенциал | Параметры потенциалов | Атом | Заряд | ||
|---|---|---|---|---|---|---|
| A, эВ | λ, Å | c, эВ/Å | ||||
| Ndc–Os | Buck | 6352.172 | 0.26856 | 0.0 | Ndc | 2.55 |
| Moc–Os | Buck | 945.947 | 0.366617 | 0.0 | Moc | 4.81667 |
| Os–Os | Buck | 598.837 | 0.314838 | 26.8965 | Oc | 0.7465 |
| Oc–Os | Spring | χ = 56.5628 эВ/Å2 | Os | –2.4997 | ||
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
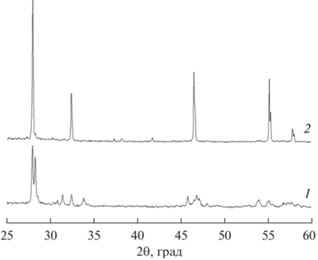
Согласно результатам рентгенофазового анализа, твердофазным синтезом из оксидов металлов при 700°С получен молибдат неодима с моноклинной структурой (рис. 1, кривая 1).
Методом дифракции нейтронов высокого разрешения показано (рис. 2a), что моноклинная структура молибдата неодима аналогична структуре оксимолибдатов Ln2MoO6, Ln = Sm–Lu, пр. гр. С2/с [21, 22]. На экспериментальной нейтронограмме не обнаружено рефлексов примесей, однако следует отметить плохую кристалличность молибдата неодима, полученного при данной температуре, что может мешать идентификации плохо окристаллизованных примесных фаз.
Рис. 2.
Экспериментальные (точки), расчетные (линия) дифрактограммы (1), их разности (3) и положения рефлексов (2) образца Nd5Mo3O16 + δ после прокаливания: a – при 700°С, пр. гр. C2/c; б – при 900°С, пр. гр. Pn$\bar {3}$n.
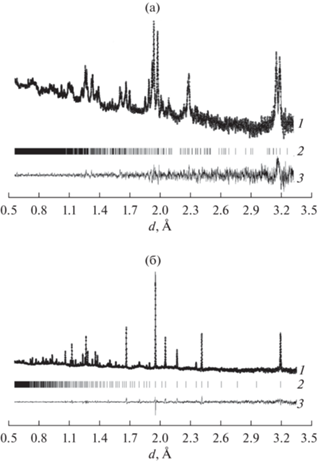
В табл. 2 приведены координаты атомов и заселенности кристаллографических позиций в структуре молибдата неодима, полученного при 700°С, после уточнения структуры методом Ритвельда. Наблюдается частичное заселение положений Nd2 и O6 соответствующими атомами, что согласуется с несоответствием состава молибдата неодима Nd5Mo3O16 + δ (для δ = 0.5n(Nd) : n(Mo) : : n(O) = 1.667 : 1 : 5.5) количеству позиций в элементарной ячейке, которые соотносятся как n(Nd) : n(Mo) : n(O) = 2 : 1 : 6. Факторы достоверности уточнения составили RB = 10.4%, Rf = 3.94%, Rp = 4.40%, Rwp = 2.21%, Rexp = 2.36%, χ2 = 0.877.
Таблица 2.
Координаты атомов, изотропные тепловые параметры (Biso) и заселенности кристаллографических позиций (q) после уточнения структуры Nd5Mo3O16 + δ при 700°С
| Позиция | x/a | y/b | z/c | Biso, Å2 | q |
|---|---|---|---|---|---|
| Nd1 (4e) | 0 | 0.3903(4) | 0.25 | 1.43(8) | 4 |
| Nd2 (4e) | 0 | 0.8659(5) | 0.25 | 0.80(10) | 3.35(10) |
| Nd3 (8f) | 0.3292(3) | 0.1212(4) | 0.1082(9) | 2.44(7) | 8 |
| Mo (8f) | 0.1562(3) | 0.1412(4) | 0.4565(9) | 2.25(7) | 8 |
| O1 (8f) | 0.2284(3) | 0.0531(4) | 0.3592(10) | 2.37(8) | 8 |
| O2 (8f) | 0.0796(3) | 0.0372(3) | 0.4808(7) | 1.57(7) | 8 |
| O3 (8f) | 0.2297(4) | 0.2033(5) | 0.7470(13) | 3.05(10) | 8 |
| O4 (8f) | 0.1087(3) | 0.2228(4) | 0.1459(9) | 1.78(8) | 8 |
| O5 (8f) | 0.0732(3) | 0.2614(3) | 0.5756(9) | 1.58(6) | 8 |
| O6 (8f) | 0.5915(5) | 0.0198(5) | 0.5803(13) | 0.85(13) | 5.06(17) |
После увеличения температуры прокаливания до 900°С получен однофазный молибдат неодима с кубической структурой, что подтверждается данными дифракции рентгеновских лучей (рис. 1б) и нейтронов (рис. 2б). Узкие рефлексы с высокой интенсивностью свидетельствуют о хорошей кристалличности продукта.
В ходе уточнения структуры по данным дифракции нейтронов высокого разрешения получен параметр элементарной ячейки кубической модификации молибдата неодима a = 11.03919(16) Å, который хорошо согласуется с литературными данными для образцов, синтезированных в воздушной атмосфере [10, 23, 24]. Координаты атомов и изотропные тепловые параметры, полученные в результате уточнения, приведены в табл. 3. Следует отметить большие значения изотропных тепловых параметров атомов Nd2 в позиции 8c, для которой предполагалось расщепление в [23] и атомов O2 (48i) которые, вероятно, участвуют в ионном транспорте [24]. В работе использование моделей с расщеплением позиций не привело к получению значимых результатов.
Таблица 3.
Координаты атомов и изотропные тепловые параметры для Nd5Mo3O16 + δ при 900°С
| Позиция | x/a | y/b | z/c | Biso, Å2 |
|---|---|---|---|---|
| Nd1 (12e) | 0.0087(3) | 0.25 | 0.25 | 0.92(4) |
| Nd2 (8c) | 0 | 0 | 0 | 1.58(10) |
| Mo1 (12d) | 0 | 0.75 | 0.25 | 1.69(6) |
| O1 (16f) | 0.1194(2) | 0.1194(2) | 0.1194(2) | 1.19(4) |
| O2 (48i) | 0.5834(2) | 0.36477(15) | 0.82431(18) | 2.10(3) |
Сравнение объемов, приходящихся на формульную единицу флюорита (MeO2, где Me – катионы неодима и молибдена), полученных как частное от деления объема элементарной ячейки на ее кратность (количество всех катионов в ячейке) (V(MeO2) = V/Z(MeO2)), показывает, что в моноклинной фазе на единицу MeO2 приходится меньший объем (табл. 4). Это согласуется с общей закономерностью формирования менее плотных и более разупорядоченных модификаций различных соединений при увеличении температуры. Данный факт позволяет предположить, что увеличение давления может привести к обратному переходу из кубической в моноклинную фазу.
Таблица 4.
Параметры элементарных ячеек моноклинной и кубической модификаций молибдата неодима
| Модификация | Моноклинная | Кубическая |
|---|---|---|
| Пр. гр. | C2/c | Pn$\bar {3}$n |
| a, b, c, Å | 16.7457(17), 11.3881(14), 5.5201(6) | 11.03919(16) |
| β, град | 108.259(7) | |
| V, Å3 | 999.7(3) | 1345.28(4) |
| Z(MeO2) | 24 | 32 |
| V/Z(MeO2), Å3 | 41.65(1) | 42.04(1) |
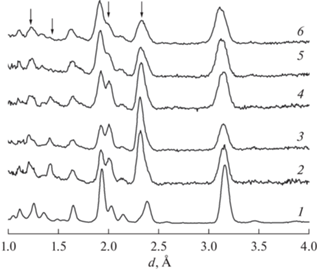
Нейтронограммы молибдата неодима Nd5Mo3 ·· O16 + δ, полученные при комнатной температуре в диапазоне давлений 0–5.9 ГПа, приведены на рис. 3. На них кроме отражений, принадлежащих кубической сингонии (пр. гр. Pn$\bar {3}$n), также наблюдаются рефлексы, относящиеся к инструментальному окружению образца. Таким образом, в исследованном диапазоне давлений фазовый переход в моноклинную фазу не был зафиксирован.
Рис. 3.
Нейтронограммы молибдата неодима при давлении: 0 (1); 1 (2); 2 (3); 3 (4); 4.5 (5); 5.9 ГПа (6). Стрелками отмечены рефлексы, относящиеся к инструментальному окружению образца.
На рис. 4 приведена зависимость параметра элементарной ячейки молибдата неодима, полученного в ходе уточнения структуры методом Ритвельда, от приложенного давления. Следует отметить несколько меньшее значение параметра элементарной ячейки, полученное по данным дифракции низкого разрешения, по сравнению с результатами уточнения нейтронограммы высокого разрешения. Увеличение давления приводит к монотонному уменьшению параметра элементарной ячейки молибдата неодима. Экспериментальная зависимость параметра коррелирует с зависимостью, полученной в результате расчета с использованием межатомных потенциалов.
Рис. 4.
Зависимость параметра элементарной ячейки Nd5Mo3O16 + δ от давления: точки – эксперимент; линия – расчет GULP.

Межатомные расстояния рассчитаны для оптимизированной методом межатомных потенциалов структуры молибдата неодима. При увеличении давления наблюдается линейное уменьшение расстояний в полиэдрах Nd1 и Nd2, а расстояния в тетраэдре MoO4 практически не изменяются. Более длинные расстояния в искаженных кубах NdO8 (Ln2–O2 и Ln1–O2) сильнее уменьшаются под действием давления (рис. 5). Подобные закономерности наблюдаются в молибдатах РЗЭ состава Ln2MoO6, Ln = Dy, Ho, Er, Tm, Yb, Y [22], в которых сжатие элементарной ячейки при переходе от диспрозия к иттербию сопровождается уменьшением связей Ln–O, но не приводит к изменению средней длины связи Mo–O. Авторы объясняют данный факт уменьшением перекрывания электронных орбиталей молибдена и кислорода за счет увеличения взаимодействия лантанид–кислород при сжатии ячейки. И наоборот, увеличение расстояний Ln–O приводит к увеличению ковалентной составляющей связи Mo–O, что препятствует ее увеличению.
Рис. 5.
Зависимость некоторых межатомных расстояний в структуре Nd5Mo3O16 + δ от давления: 1 – Nd1–O2; 2 – Nd2–O1; 3 – Nd1–O1; 4 – Nd2–O2.
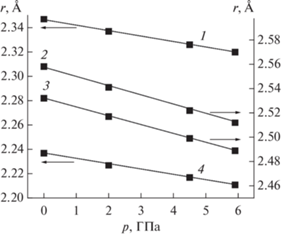
При увеличении давления элементарная ячейка молибдата неодима уменьшается без фазовых переходов. Данный факт можно объяснить тем, что моноклинная структура предполагает наличие вакансий в решетках неодима и кислорода ввиду несоответствия состава Nd5Mo3O16 + δ (в пересчете на один атом молибдена Nd5/3MoO(16 + δ)/3) стехиометрии неискаженных моноклинных молибдатов состава Ln2MoO6. Образование вакансий энергетически не выгодно при низких температурах и высоких давлениях, что, вероятно, и является причиной устойчивости кубической структуры, которая вакансий не содержит.
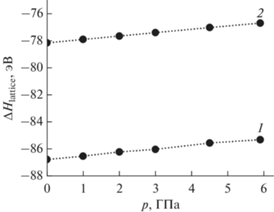
Для оптимизированных структур рассчитана энтальпия кристаллической решетки кубической и моноклинной модификаций молибдата неодима. На рис. 6 приведены зависимости энтальпии решетки от давления, пересчитанные на формульную единицу флюорита MeO2 путем деления на кратность элементарной ячейки по отношению к флюориту (Zкуб = 32, Zмон = 24). Увеличение давления приводит к повышению значений энтальпии решетки обеих модификаций, тем не менее кубическая структура энергетически более выгодна во всем диапазоне изученных давлений, что подтверждают данные дифракции нейтронов.
ВЫВОДЫ
Методом дифракции нейтронов показано, что молибдат неодима Nd5Mo3O16 + δ в диапазоне давлений 0–5.9 ГПа не претерпевает фазовых переходов. Параметр элементарной ячейки кубической структуры Nd5Mo3O16 + δ уменьшается с увеличением давления. Межатомные расстояния в тетраэдре MoO4 практически не изменяются, а расстояния Nd–O уменьшаются, причем набольшее уменьшение наблюдается для больших расстояний Ln2–O2 и Ln1–O2. Согласно данным атомистического моделирования, устойчивость кубической структуры по сравнению с моноклинной подтверждается меньшими значениями энтальпии решетки.
Конфликт интересов: Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Smet F.D., Devillers M., Poleunis C., Bertrand P. // J. Chem. Soc. Faraday Trans. 1998. V. 94. P. 941. https://doi.org/10.1039/A707883H
Lopez Nieto J.M., Bielsa R., Kremenic G., Fierro J.L.G. // Studies Sur. Sc. Catalysis. 1990. V. 55. P. 295. https://doi.org/10.1016/S0167-2991(08)60160-3
Yu R., Fan A., Yuan M., Li T., Tu Q., Wang J., Rotello V. // Opt. Mater. Express. 2016. V. 6. № 7. P. 3469. https://doi.org/10.1364/OME.6.002397
Qi S., Xie H., Huang Y., Kim S.I., Seo H. // Opt. Mater. Express. 2014. V. 4. № 2. P. 190. https://doi.org/10.1364/OME.4.000190
Tsai M., Greenblatt M., McCarroll W. // Chem. Mater. 1989. V. 1. № 2. P. 253. https://doi.org/10.1021/CM00002A017
Voronkova V.I., Kharitonova E.P., Belov D.A. // Solid State Ionics. 2012. V. 225. № 4. P. 654. https://doi.org/10.1016/J.SSI.2012.03.002
Voronkova V.I., Leonidov I.A., Kharitonova E.P., Belov D.A., Patrakeev M.V., Leonidova O.N., Koz- hevnikov V.L. // J. Alloys Compd. 2014. V. 615. № 5. P. 395. https://doi.org/10.1016/j.jallcom.2014.07.019
Hubert P.-H. // Chemie Minerale. C. 1970. V. 271. P. 1179.
Cortese A.J., Abeysinghe D., Wilkins B., Smith M.D., Rassolov V., Loye H. // Cryst. Growth Des. 2016. V. 16. № 8. P. 4225. https://doi.org/10.1021/ACS.CGD.6B00201
Biendicho J.J., Playford H.Y., Rahman S.M.H., Norberg S.T., Eriksson S.G., Hull S. // Inorg. Chem. 2018. V. 57. № 12. P. 7025. https://doi.org/10.1021/acs.inorgchem.8b00734
Martínez-Lope M.J., Alonso J.A., Sheptyakov D., Pomjakushin V. // J. Solid State Chem. 2010. V. 183. P. 2974. https://doi.org/10.1016/J.JSSC.2010.10.015
Hubert P.-H., Michel P., Thozet A. // Compt. Rend. Acad. Sc. Paris. 1973. V. 276. P. 1779.
Chebyshev K.A., Get’man E.I., Pasechnik L.V., Ardanova L.I., Korotina D.V. // Inorg. Mater. 2015. V. 51. № 10. P. 1033. https://doi.org/10.1134/S0020168515100040
Чебышев К.А., Гетьман Е.И., Игнатов А.В., Пасечник Л.В., Селикова Н.И. // Вестн. Донецкого нац. ун-та. Сер. А. 2017. № 4. С. 114.
Чебышев К.А., Игнатов А.В., Пасечник Л.В., Селикова Н.И. // Вестн. ВГУ. Сер. Химия. Биология. Фармация. 2021. № 4. С. 25.
Kozlenko D., Kichanov S., Lukin E., Savenko B. // Crystals. 2018. V. 8. № 8. P. 331. https://doi.org/10.3390/cryst8080331
Balagurov A.M. // Neutron News. 2005. V. 16. P. 8. https://doi.org/10.1080/10446830500454346
Rodriguez–Carvajal J. // Physica B. 1993. V. 192. № 1–2. P. 55. https://doi.org/10.1016/0921-4526(93)90108-I
Roisnel T., Rodriguez-Carvajal J. // Mat. Sci. Forum. Proc. Seventh Eur. Powder Diffraction Conf. (EPDIC 7). Barcelona, 2000. P. 118.
Gale J.D., Rohl A.L. // Mol. Simul. 2003. V. 29. P. 291. https://doi.org/10.1080/0892702031000104887
Brixner L.H., Sleight A.W., Licis M.S. // J. Solid State Chem. 1972. V. 5. P. 186. https://doi.org/10.1016/0022-4596(72)90027-8
Alonso J., Rivillas F., Martínez-Lope M.J., Pomjakushin V. // J. Solid State Chem. 2004. V. 177. № 7. P. 2470. https://doi.org/10.1016/j.jssc.2004.03.046
Alekseeva O., Gagor A., Pietraszko A., Sorokina N., Bolotina N., Artemov V., Kharitonova E., Voronkova V. // Z. Kristallogr. 2012. V. 227. № 12. P. 869. https://doi.org/10.1524/zkri.2012.1563
Ishikawa Y., Danilkin S.A., Avdeev M., Voronkova V.I., Sakuma T. // Solid State Ionics. 2016. V. 288. P. 303. https://doi.org/10.1016/j.ssi.2015.12.005
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования