Приборы и техника эксперимента, 2021, № 6, стр. 93-101
ИСПОЛЬЗОВАНИЕ ЛАЗЕРНОГО ИНТЕРФЕРЕНЦИОННОГО МИКРОСКОПА ДЛЯ ОЦЕНКИ ФЛУКТУАЦИЙ И ЭКВИВАЛЕНТНОЙ КОНСТАНТЫ УПРУГОСТИ МЕМБРАН КЛЕТОК
А. И. Юсипович a, Е. Ю. Паршина a, А. А. Байжуманов a, С. К. Пирутин a, b, А. Д. Иванов c, *, В. Л. Минаев d, e, Г. Г. Левин d, Г. В. Максимов a
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт экспериментальной и теоретической биофизики РАН
142290 Пущино, Московской обл., ул. Институтская, 3, Россия
c Национальный исследовательский технологический университет “МИСиС”
119049 Москва, Ленинский просп., 4, Россия
d ВНИИ оптико-физических измерений
119361 Москва, ул. Озерная, 46, Россия
e Национальный исследовательский университет “Высшая школа экономики”
101000 Москва, ул. Мясницкая, 20, Россия
* E-mail: Academi@ya.ru
Поступила в редакцию 26.04.2021
После доработки 01.06.2021
Принята к публикации 24.06.2021
Аннотация
Описано применение автоматизированного интерференционного микроскопа для определения среднеквадратичной амплитуды флуктуаций живых клеток in vitro. Измеренные оптические разности хода световых волн использованы для расчета геометрических толщин клеток. Оценены эквивалентные константы упругости таких клеток. Полученные значения среднеквадратичной амплитуды флуктуаций оптической разности хода составили 0.3–2.7 нм, что соответствует 4–40 нм среднеквадратичной амплитуды флуктуаций мембраны. Показано, что амплитуды флуктуаций распластанных клеток (клетки эндотелия и макрофаги) меньше, чем неприкрепленные клетки (эритроциты и лимфоциты in vitro). При этом амплитуда флуктуаций распластанных на подложках опухолевых клеток линии HeLa больше амплитуды флуктуаций клеток эндотелия и макрофагов, также распластанных на подложке. Полученные экспериментальные данные соответствуют результатам, измеренным ранее с помощью других оптических методов.
1. ВВЕДЕНИЕ
Живые клетки характеризуются локальными флуктуациями мембраны в диапазоне 0.1–30 Гц [1]. Несмотря на длительную историю исследований таких колебаний, молекулярные и клеточные механизмы данного явления до конца не изучены. Не подвергается сомнению тот факт, что амплитуда этих флуктуаций зависит от состояния как мембраны, так и цитоскелета клетки.
Флуктуации мембраны могут иметь отношение к важным физиологическим свойствам клеток, таким как эндо- и экзоцитоз, регуляция объема, способность к деформации, определяющая возможность прохождения клеток крови через мелкие кровеносные сосуды; также было показано влияние флуктуаций на адгезию и агломерацию клеток [2]. Так, например, было установлено, что уменьшение амплитуды флуктуаций (увеличение натяжения) приводит к увеличению адгезии [3]. Возможно, совокупность локальных колебаний комплекса, состоящего из мембраны и цитоскелета, который иногда называют просто мембраной, в итоге приводит к изменению таких макроскопических параметров клетки, как форма и объем. В ряде случаев при этом изменяется жесткость мембранно-спектринового комплекса, которая может быть обусловлена агрегацией и иммобилизацией денатурированных молекул спектрина [4]. Для количественной оценки колебания мембран (клеток) используют среднеквадратичную амплитуду флуктуаций (с.а.ф.). При этом квадрату с.а.ф. толщины мембран обратно пропорциональна эквивалентная константа упругости клеточных мембран, что позволяет оценить механические характеристики этих клеток, в частности эффективную величину поверхностного натяжения [5].
Для исследования колебаний клеточных мембран используется целый набор методов, основанных на различных видах рассеяния видимого света, рентгеновского или нейтронного излучения, а также на различных видах микроскопии [2, 6, 7]. Однако наиболее эффективными в этом случае являются методы на основе интерференционной микроскопии (см., например, [8, 9]), позволяющие неинвазивно и без использования красителей количественно оценивать флуктуации мембран. Для этого измеряется амплитуда изменения оптической разности хода (о.р.х.), а затем вычисляется амплитуда колебаний. Однако это требует модификации методик получения фазовых изображений именно для оценки флуктуаций мембраны. Следует учитывать, что о.р.х. включает в себя не только геометрическую толщину клетки, но и показатель преломления, зависящий от концентрации вещества в ней. Поэтому локальные значения о.р.х. внутри клетки могут изменяться в результате процессов транспорта везикул, эндоцитоза и т.д. При этом мембрана и примембранный цитоскелет вносят небольшой вклад в толщину клетки (их общая толщина составляет ~100–200 нм [10], менее 10% толщины клетки). Основной вклад в толщину клетки вносят цитоплазма, ядро и другие органеллы. Таким образом, по измеренному значению о.р.х. можно оценить динамические процессы во всей толщине клетки, поскольку даже незначительные локальные изменения толщины и (или) показателя преломления клетки могут повлиять на регистрируемое значение о.р.х.
Цель настоящей работы – оценить возможность использования и границы применения метода лазерной интерференционной микроскопии для измерения среднеквадратичной амплитуды флуктуаций о.р.х. и эквивалентных констант упругости некоторых фиксированных и живых клеток in vitro.
2. ТЕОРЕТИЧЕСКОЕ ОПИСАНИЕ
2.1. Метод лазерной интерференционной микроскопии
Фазовое изображение биологического объекта представляет собой двумерное распределение сдвига фазы φ(x, y) светового излучения, проходящего через объект. Для прозрачных объектов оно вычисляется по формуле [11]:
где Δ(x, y) – двумерное распределение о.р.х.; λ – длина волны света источника излучения.В каждой точке изображения о.р.х. определяется как [12]:
где ni – среднее значение показателя преломления клетки в точке i; zi – толщина клетки в точке i; n0 – показатель преломления окружающей среды.В общем случае показатель преломления n клетки линейно зависит от концентрации С вещества в ней [13]:
где α – экспериментально определяемый параметр.Таким образом, изменение показателя преломления вещества отражает изменение концентрации вещества в клетке. При этом на фазовом изображении клетки зарегистрированные значения о.р.х. можно представить как сумму двух величин:
(4)
${{\Delta }}(х,y) = \Delta {{(х,y)}_{{{\text{кл}}}}} + \Delta {{(х,y)}_{{{\text{пр}}}}}{\text{,}}$В качестве меры оценки флуктуаций клетки используется среднее значение с.а.ф. о.р.х., определенных в каждой точке фазового изображения клетки в течение времени измерений [14]:
где sпр, s – средние значения экспериментально измеренных с.а.ф. Δ(x, y)пр и Δ(x, y) соответственно, полученных за определенное время. Величина sпр измеряется на участке фазового изображения, лишенном клеток, а величина s – на участке фазового изображения с клеткой.Найденные значения s, sпр можно представить в виде следующих соотношений:
где τ – общее время измерений; X, Y – общее число пикселей по горизонтали и вертикали; Δ(x, y, t)τ, Δпр(x, y, t)τ – экспериментально измеренные значения о.р.х. в точке фазового изображения с клеткой и без нее соответственно; Δср(x, y, t), Δпр ср(x, y, t) – средние значения о.р.х. в точке фазового изображения на участках фазового изображения с клеткой и без нее соответственно.2.2. Влияние показателя преломления различных компонентов клетки на величину с.а.ф. о.р.х.
В статических условиях величина показателя преломления (а точнее разница показателей преломления клетки и окружающей среды – рефрактерность) влияет на значение о.р.х. как простой множитель, см. формулу (2). При этом вклад мембраны с цитоскелетом в суммарное значение о.р.х. клетки мал из-за малой толщины мембраны по сравнению с толщиной слоя цитоплазмы клетки (включая находящиеся там органеллы). Так, например, для эритроцитов толщина мембраны с цитоскелетом составляет ~100–200 нм, а толщина слоя цитоплазмы ~2 мкм. Однако в случае динамических измерений может наблюдаться увеличение вклада мембраны и цитоплазмы в регистрируемую величину с.а.ф. в результате локальных изменений показателя преломления, связанных с локальными изменениями концентрации вещества (см. формулу (3)) в цитоскелете и цитоплазме.
Для оценки потенциального вклада цитоплазмы в экспериментально регистрируемое значение о.р.х. клетки можно представить общее значение о.р.х. как сумму двух о.р.х., одна из которых зависит только от мембраны с прилежащим цитоскелетом, а другая – только от цитоплазмы:
(8)
${{\Delta }_{i}} = ({{n}_{{\text{м}}}} - {{n}_{0}}){{z}_{{\text{м}}}} + ({{n}_{{{\text{цит}}}}} - {{n}_{0}}){{z}_{{{\text{цит}}}}}.$Таким образом, в регистрируемое значение о.р.х. клетки могут вносить вклад толщина zм и рефрактерность (nм – n0) мембраны, а также толщина zцит и рефрактерность (nцит – n0) цитоплазмы.
Компоненты уравнения (8) можно рассматривать как функцию четырех переменных: nм – n0 = A; zм = B; nцит– n0 = C; zцит = D. Тогда с.а.ф. такой функции будет представлять собой сложное выражение [15]:
(9)
${{s}_{{{\text{кл}}}}} = \sqrt {A_{{{\text{ср}}}}^{2}B_{{{\text{ср}}}}^{2}(s_{A}^{2}{\text{/}}A_{{{\text{ср}}}}^{2} + s_{B}^{2}{\text{/}}B_{{{\text{ср}}}}^{2}) + C_{{{\text{ср}}}}^{2}D_{{{\text{ср}}}}^{2}(s_{C}^{2}{\text{/}}C_{{{\text{ср}}}}^{2} + s_{D}^{2}{\text{/}}D_{{{\text{ср}}}}^{2})} ,$Локальные изменения показателя преломления могут возникать либо в случае диффузии молекул мембраны или цитоплазмы (например, структурных белков и липидов), а также перестройки цитоскелета (например, сборки или разборки микротрубочек), либо в результате транспорта элементов цитоскелета, различных везикул, органелл, например митохондрий, как с помощью, так и без помощи микротрубочек. Кроме того, в случае механических повреждений клетки или ее органелл возможно не только изменение геометрии, но и локальные изменения показателя преломления. Поскольку фазовое изображение представляет собой двумерную проекцию клетки, оценивалась только двумерная диффузия.
Толщина мембраны без цитоскелета составляет около 10 нм, показатель преломления такой мембраны – 1.427 [16]. Толщина мембраны находится на пределе разрешения прибора, что не позволяет корректно регистрировать локальные изменения показателя преломления (концентрацию вещества) внутри этого объекта. Однако, если учитывать примембранный цитоскелет (кортекс), толщина мембраны составляет около 100–200 нм. Основной вклад в эту величину вносит относительно рыхлая трехмерная сеть из белковых трубочек диаметром 6–8 нм с достаточно высокой скоростью сборки-разборки (порядка 0.1–1 мкм/с). В экспериментах время получения одного фазового изображения составило 0.04 с, расстояние между соседними точками фазового изображения – 0.28 мкм, т.е. за время регистрации фазового изображения теоретически можно обнаружить изменение о.р.х., обусловленное разницей локальной концентрации вещества внутри клеток размером ≥10 мкм в результате диффузии или транспорта. Если бы сборка и разборка трубочек осуществлялись одновременно, компактно и однонаправленно, то это могло бы повлиять на регистрируемые колебания о.р.х. клетки. Хаотическое разнонаправленное движение молекул и органелл уменьшает локальное изменение концентрации в цитоплазме (компонента nм − n0 в уравнении (8)) и приводит к усреднению локальных значений о.р.х. и уменьшению с.а.ф. Таким образом, в нормальных условиях в случае мембран основной вклад в регистрируемое значение о.р.х. будут вносить только их геометрические колебания.
Цитоплазма обладает значительной толщиной, а внутри нее возможны как латеральная диффузия молекул, так и перемещение (транспорт) элементов цитоскелета, различных везикул, органелл, например митохондрий, и т.д. со скоростью 0.1–2 мкм/с [17]. Если бы, как и в случае примембранного цитоскелета, подобные перемещения осуществлялись одновременно и однонаправленно в большом объеме цитоплазмы, то это могло бы повлиять на регистрируемые колебания о.р.х. клетки. В обычных условиях наблюдается хаотическое разнонаправленное движение молекул и органелл, приводящее к усреднению локальных значений о.р.х. и, соответственно, уменьшению с.а.ф. При этом не предполагались регулярные изменения размеров цитоплазмы (компонента zцит в уравнении (8)), аналогичные флуктуациям мембраны zм. Однако в состоянии покоя, при отсутствии одновременных и однонаправленных массовых перемещений компонентов клетки, на s воздействуют только геометрические колебания мембран.
2.3. Расчет эквивалентной константы упругости
По значению sкл рассчитывается среднеквадратическая амплитуда sт флуктуаций толщины клетки [14]:
где n – усредненный показатель преломления клетки, зависящий от всех компонентов, входящих в клетку.Эквивалентная константа ke упругости мембраны обратно пропорциональна $s_{{\text{т}}}^{2}$ и определяется по формуле:
где kB – константа Больцмана; T, К – температура.В общем случае:
где κ – модуль изгиба; σ – коэффициент поверхностного натяжения; q – координата, описывающая положение мембраны [1].Согласно данным [11], κ = 0.70 ± 0.12 ⋅ 10–20 Дж/м2, σ = 3.5 ± 0.6 ⋅ 10–7 Дж/м2. Заметно, что значение σ во много раз превышает значение κ. Таким образом, в обычных условиях основной вклад в kе вносит поверхностное натяжение.
3. МЕТОДИКИ ВЫДЕЛЕНИЯ КЛЕТОК
Приготовление образцов эритроцитов in vitro. Данная методика подробно описана в работе [8]. При проведении измерений оценивали размеры и величину колебания мембран только у дискоцитов.
Получение образцов фиксированных эритроцитов. Эритроциты фиксировали по методу [18]. Все операции проводили при комнатной температуре. Клетки наносили в виде капли на зеркальное предметное стекло и высушивали на воздухе в течение 12 ч. Затем на препарат наносили 5–10 мкл смеси глицерин–вода в соотношении по объему 1:1, накрывали покровным стеклом и оставляли в горизонтальном положении еще на 12 ч, после чего препарат был готов к измерениям.
Получение образцов теней эритроцитов. Образцы получали согласно методике, описанной в работе [19]. Тени эритроцитов хранили при температуре –80°С. После разморозки 1–2 мкл суспензии теней эритроцитов наносили на зеркальное предметное стекло и накрывали покровным стеклом.
Получение фракции белых клеток крови (лимфоцитов). Выделение фракции белых клеток крови (главным образом лимфоцитов) проводили методом лизиса эритроцитов, основанным на способности изотонического раствора хлорида аммония гемолизировать эритроциты [20]. Полученную суспензию (1–2 мкл) наносили на зеркальное предметное стекло и накрывали покровным стеклом.
Выделение перитонеальных макрофагов мышей. Данная методика описана в работе [21]. Перед проведением измерений покровное стекло, содержащее клетки, помещали на зеркальную подложку (клетками к зеркалу).
Выделение клеток эндотелия. Клетки эндотелия выделяли из пупочных вен человека путем промывания их раствором коллагеназы, согласно стандартному протоколу [22]. Перед проведением измерений покровное стекло с нанесенными клетками помещали на зеркальную подложку (клетками к зеркалу).
Приготовление образцов, содержащих клетки HELA. В экспериментах использовалась культура клеток линии HELA аденокарциномы шейки матки человека, полученная из репозитория клеточных культур American Type Culture Collection (Роквилл, США). Получение культуры осуществлялось, согласно стандартным протоколам. Перед проведением измерений покровное стекло с нанесенными клетками помещали на зеркальную подложку (клетками к зеркалу).
4. ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ
4.1. Измерения с.а.ф. о.р.х. методом лазерной интерференционной микроскопии
Для определения с.а.ф. о.р.х. использовали автоматизированный интерференционный микроскоп МИА-Д (ВНИИОФИ, Россия) [23] с высокоскоростной (300 кадров/с) черно-белой видеокамерой FastVideo 300B (SPA ASTEK, Россия) с матрицей 1/2 дюйма (6.33 × 4.75 мм2) разрешением 640 × 480 пикселей и микрообъективом 33×/0.65NA. Размер изображений объекта 180 × 135 мкм. Управление прибором и получение фазовых изображений по интерферограммам осуществляли с помощью программы “WinPhast”. При реконструкции одного фазового изображения использовали десять интерференционных изображений, что позволяло регистрировать фазовые изображения с частотой до 30 Гц. Образец освещали диодным лазером с длиной волны 659 нм и мощностью 20 мВт, при этом мощность, приходящаяся на 1 клетку, составляла <2 мВт. Лазерный луч был направлен перпендикулярно плоскости клетки. Согласно описанию микроскопа, погрешность вдоль оптической оси составляла 1.9 нм, а в плоскости XY – 0.5 мкм, повторяемость результатов измерений s составляла <0.1 нм.
Для обработки изображений и визуализации клеток было использовано открытое программное обеспечение Open Source package FIJI [24]. Схема измерения и расчета значения s приведена на рис. 1. Во время эксперимента записывали последовательность из 512-ти фазовых изображений на частоте 25 Гц. Далее выделяли изображение отдельной клетки, проводили процедуру выравнивания серии изображений (используя алгоритм StackReg, присутствующий в программе FIJI). После этого рассчитывали с.а.ф. временных осцилляций о.р.х. в каждой точке изображения клетки, отступив от ее края 2 пикселя для компенсации влияния латеральных колебаний. В точке k с.а.ф. колебаний sk вычисляли по формуле:
(12)
${{s}_{k}} = \sqrt {{{{(\tau - 1)}}^{{ - 1}}}\sum\limits_{\tau = 1} {{{{({{\Delta }_{\tau }} - {{\Delta }_{{avg}}})}}^{2}}} .} $Рис. 1.
Расчет среднего значения с.а.ф. о.р.х. s одиночной клетки. Шаг 1 – запись серии фазовых изображений (512 изображений с частотой 25 кадров/с), на вставке показаны временные осцилляции о.р.х. в точке k; шаг 2 – получение z-проекции клетки, представляющей собой с.а.ф. временных осцилляций о.р.х. в каждой точке изображения, приведена формула для расчета с.а.ф. колебаний в точке k (sk), белая линия – граница клетки; шаг 3 – определение значения s для всей клетки, исключая край эритроцита (2 пикселя на изображении от границы клетки) во избежание вклада латеральных колебаний края клетки.
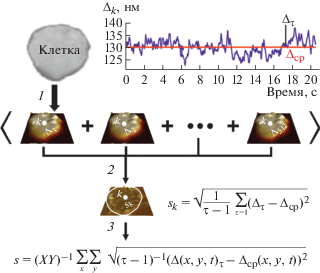
Затем рассчитывали среднее значение с.а.ф. колебаний s для всей клетки по формуле (6). Значение sпр рассчитывали по аналогичной процедуре на участке образца без клеток по формуле (7).
При проведении измерений также оценивали статические параметры фазовых изображений клеток: площадь Sкл; среднее значение о.р.х. клетки (среднее арифметическое всех значений о.р.х. клетки, зависящее от толщины клетки и количества вещества в ней); максимальное значение о.р.х. клетки (зависит от толщины клетки и количества вещества, входящего в нее; косвенно, особенно в случае эритроцитов, может отражать морфологию клетки; у клеток, содержащих ядро, может отражать состояние ядра).
4.2. Статистическая обработка экспериментальных данных
Статистическую обработку и визуализацию экспериментальных данных проводили при помощи демоверсии программы Graphpad Prism v8.4 (GraphPad Software, La Jolla, Калифорния, США). Результаты анализа приведены ниже в табл. 1 и 2. Типичные значения стандартного отклонения флуктуаций мембраны по толщине и (или) эквивалентной константы упругости представлены в табл. 1 в виде: “среднее ± стандартное отклонение”. В сводной табл. 2 экспериментальные данные представлены в виде: медиана [нижний квартиль; верхний квартиль].
Таблица 1.
Типичные значения среднеквадратичной амплитуды флуктуаций о.р.х. sкл, толщины sт и эквивалентной константы упругости ke мембран клеток
| Тип клеток | Метод иссле-дования | sт, нм | sкл, нм | ke · 106, Дж/м2 | Ссылка |
|---|---|---|---|---|---|
| Мышиные макрофаги in vitro | RICM | 5.5 ± 1 | ~0.3 ± 0.1 | ~100 | [3] |
| Эритроциты in vitro | SDPM | 35 ± 15 | 2.2 ± 0.9 | около 3.5 | [25] |
| WFDI | 35 ± 15 | 2.2 ± 0.9 | около 3.5 | ||
| Эритроциты фиксированные | SDPM | 4.5 (предел измерения) | около 0.3 | – | |
| WFDI | 14.5 (предел измерения) | ~0.9 | – | ||
| Эритроциты in vitro (диСАФциты) | sHPM | ~53.4* | ~0.6 | ~(1.5 ± 0.2) | [11] |
| Эритроциты in vitro (эхиноциты) | sHPM | ~32.5* | ~0.4 | ~(4.05 ± 1.1) | |
| Эритроциты in vitro (сфероциты) | sHPM | ~22.8* | ~0.3 | ~(8.25 ± 1.06) | |
| Клетки эпителия кишечника (норма) | IPM | – | 1.6 ± 0.4 | – | [26] |
| Клетки эпителия кишечника (рак) | IPM | – | 2.1 ± 0.8 | – | |
| Эритроциты in vitro | DHM | 35.9 ± 8.9 | 2.2 ± 0.6 | – | [14] |
* Значения рассчитывались из соответствующего значения ke по формуле (11)
Таблица 2.
Измеренные параметры клеток
| Sкл, мкм2 | Средняя о.р.х., нм | Максимальная о.р.х., нм | |
|---|---|---|---|
| Эритроциты фиксированные | 61.4 [54.7; 69.0] | 78.1 [75.0; 83.7] | 138.0 [126.1; 152.8] |
| Тени эритроцитов | – | 5.0 [4.7; 35.7] | 54.6 [54.8; 62.0] |
| Клетки эндотелия | 597.3 [497.8; 698.6] | 31.3 [25.9; 37.6] | 64.33 [49.0; 90.22] |
| Макрофаги | 156.4 [140.5; 163.9] | 337.8 [253.7; 375.4] | 74.30 [57.57; 82.34] |
| Клетки линии HeLa | 434.9 [343.7; 516.7] | 162.5 [147.5; 181.7] | 273.1 [238.6; 321.5] |
| Лимфоциты человека | 64.05 [47.60; 69.72] | 139.1 [133.2; 184.5]] | 334.5 [257.8; 370.7] |
| Эритроциты in vitro | 69.7 [68.0; 87.0] | 70.0 [63.4; 91.5] | 128.7 [110.0; 154.3] |
Статистически значимую разницу между измеренными флуктуациями (эквивалентными константами упругости) клеток различных типов оценивали по критерию Краскелла–Уоллеса с апостериорным анализом Данна (р < 0.05).
Достоверные различия между измеренными флуктуациями клеток и соответствующими значениями шума на подложке оценивали при помощи одновыборочного критерия Вилкоксона (р < 0.05).
4.3. Результаты
В табл. 1 приведены значения sт, а также эквивалентные константы упругости ke для эритроцитов in vitro, фиксированных эритроцитов, нормальных и раковых клеток эпителия кишечника, полученные другими различными методами: reflection interference contrast microscopy (RICM), low-coherence spectral-domain phase microscopy (SDPM), wide-field digital interferometry (WFDI), stabilized Hilbert phase microscopy (sHPM), wide-field interferometric phase microscopy (IPM), digital holographic microscopy (DHM). Для удобства последующего cравнения (при наличии необходимой для этого информации в цитируемой работе) приведенные в табл. 1 значения sт пересчитаны в sкл по формуле (10).
В настоящей работе для иллюстрации возможностей метода лазерной интерференционной микроскопии были использованы некоторые наиболее часто анализируемые типы клеток: свободноплавающие эритроциты in vitro; фиксированные эритроциты (у которых сшиты белки внутри цитоплазмы); тени эритроцитов, которые представляют собой клетки с удаленной цитоплазмой (фактически биологическую мембрану с цитоскелетом); лимфоциты, выделенные из плазмы; культуры клеток эндотелия; опухолевые клетки линии HeLa, прикрепленные к подложке in vitro; активированные макрофаги, прикрепленные к подложке. Эти объекты являются примерами наиболее часто используемых вариантов для исследования клеток.
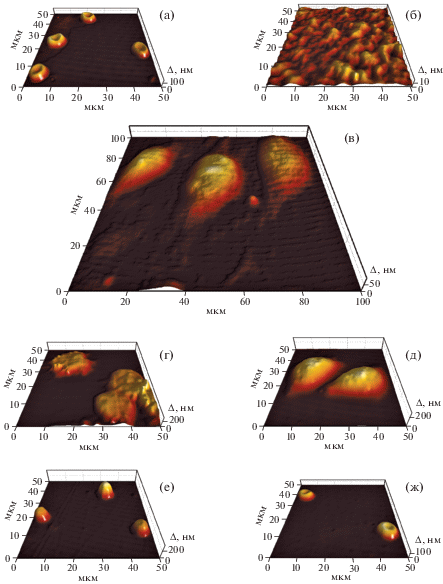
Типичные фазовые изображения измеренных клеток представлены на рис. 2. В целом изображения согласуются с соответствующими изображениями клеток из литературных источников [5, 8, 18]. Средние размеры площади, среднего и максимального значения о.р.х. фазовых изображений клеток представлены в табл. 2. Показатель преломления клеток изменяется в интервале 1.37–1.42 [14], что позволяет, используя экспериментально измеренные средние значения Δср, оценивать толщину клеток по формуле (2). Средняя геометрическая толщина теней эритроцитов на подложке составляет около 54 нм (при показателе преломления мембраны 1.427 и показателе преломления раствора 1.335), что соответствует примерно пяти слоям мембран эритроцитов.
Рис. 2.
Типичные фазовые изображения фиксированных эритроцитов (а), теней эритроцитов (б), клеток эндотелия (в), макрофагов (г), клеток линии HeLa (д), лимфоцитов (е), эритроцитов in vitro (ж).
На рис. 3 представлены средние значения sкл и ke. Значения sкл составляют 0.3–2.7 нм о.р.х., что соответствует колебаниям мембран приблизительно 3–40 нм. В целом, результаты настоящей работы соответствуют типичным данным, полученным другими интерференционными методами (см. табл. 1). Среднеквадратичная амплитуда флуктуаций для фиксированных эритроцитов меньше, чем для эритроцитов in vitro. Значения sкл не прикрепленных к подложке эритроцитов и лимфоцитов достоверно больше, чем у прикрепленных нормальных клеток (клетки эндотелия и макрофаги), а sкл прикрепленных к подложке опухолевых клеток линии HeLa больше, чем у нормальных клеток, прикрепленных к подложке, и соответствуют свободноплавающим лимфоцитам in vitro.
Рис. 3.
Среднеквадратичная амплитуда флуктуаций о.р.х. (а) и эквивалентная константа упругости (б) различных клеток. Линии – медианы результатов измерений с интерквартильным размахом, точки – сами результаты. Цифры по горизонтальной оси: 1 – фиксированные эритроциты; 2 – тени эритроцитов; 3 – клетки эндотелия; 4 – макрофаги; 5 – клетки линии HeLa; 6 – лимфоциты; 7 – эритроциты in vitro. Достоверные отличия: между фиксированными эритроцитами и другими клетками (*); между тенями эритроцитов и другими клетками (#); между клетками эндотелия и другими клетками ($); между макрофагами и другими клетками (&); между выборкой клеток линии HeLa и другими клетками (^); между измеренными флуктуациями клеток и соответствующими значениями шума на подложке (@).

При этом измеренные медианы с.а.ф. для фиксированных клеток и теней эритроцитов достоверно не отличаются от соответствующих значений шума на подложке (см. рис. 2), в отличие от значений, измеренных для клеток других типов. Значения sпр в экспериментах для различных типов клеток колебались в диапазоне 0.25–0.35 нм о.р.х. Не удалось обнаружить достоверных коррелляций между размерами клеток и их с.а.ф. (см. табл. 2).
5. ОБСУЖДЕНИЕ
Таким образом, величина sкл для фиксированных клеток и теней эритроцитов находится на уровне шума прибора, что не позволяет оценить величину с.а.ф. в данном случае. Однако в случае клеток, как прикрепленных к подложке, так и свободно плавающих, оценивать величину флуктуаций методом лазерной интерференционной микроскопии вполне возможно.
При этом отсутствие корреляций между размерами (в первую очередь толщин, обусловленных главным образом цитоплазмой) клеток и величиной их с.а.ф. позволяет предположить, что цитоплазма не вносит существенного вклада в величину флуктуаций. Регистрируемая величина с.а.ф. обусловлена главным образом флуктуациями клеточных мембран, что также согласуется с рассуждениями, изложенными в разделе 2.2.
Можно заметить, что клетки крови, использованные в работе (как эритроциты, так и лимфоциты in vitro), имеют значительно бо́льшие значения флуктуаций, чем прикрепленные клетки (макрофаги и клетки эндотелия). Вероятно, это связано с выполняемыми ими в организме функциями, поскольку они перемещаются внутри сосудов и им необходимо деформироваться в капиллярах, что, по-видимому, и определяет их более низкую жесткость. В случае прикрепленных клеток, возможно, микротрубочки, соединяясь с субстратом, фиксируют мембраны распластанных клеток у подложки, препятствуя таким образом ее флуктуациям. При этом флуктуации, зарегистрированные на клетках линии HeLa, достоверно больше флуктуаций, измеренных на клетках эндотелия и макрофагах, несмотря на то что эти клетки распластаны на подложке. Такой результат, возможно, связан с особенностями опухолевых клеток, характеризующихся более высокими флуктуациями мембран (см., например, [6]).
5. ЗАКЛЮЧЕНИЕ
Используя лазерный интерференционный микроскоп, можно оценивать флуктуации живых клеток in vitro путем регистрации среднеквадратичной амплитуды флуктуаций о.р.х. Зарегистрированные значения квадратичной амплитуды флуктуаций о.р.х. составили 0.3–2.7 нм о.р.х., что приблизительно соответствует квадратичной амплитуде флуктуаций толщины клетки 4–40 нм. Это соответствует результатам, полученным другими оптическими методами. Кроме того, возможно оценивать эквивалентную константу жесткости таких клеток. При этом в обычных условиях оцениваемая величина sкл обусловлена главным образом колебаниями мембраны клеток, хотя при определенных условиях в sкл могут внести вклад колебания о.р.х., обусловленные локальными изменениями показателя преломления в цитоплазме, которые также возможно зарегистрировать при помощи лазерной интерференционной микроскопии.
Список литературы
Brochard-Wyart F., Lennon J.F. // J. Phys. (France). 1975. V. 36. P. 1035. https://doi.org/10.1051/jphys:0197500360110103500
Monzel C., Sengupta K. // Journal of Physics D: Applied Physics. 2016. V. 49 . 243002. https://doi.org/10.1088/0022-3727/49/24/243002
Zidovska A., Sackmann E. // Physical Review Letters. 2006. V. 96. 048103. https://doi.org/10.1103/PhysRevLett.96.048103
Yamaikina M.V., Mansurov V.A., Ivashkevich É.V. // Journal of Engineering Physics and Thermophysics. 1996. V. 69. P. 283. https://doi.org/10.1007/bf02606946
Popescu G., Park Y., Choi W., Dasari R.R., Feld M.S., Badizadegan K. // Blood Cells, Molecules, and Diseases. 2008. V. 41. P. 10. https://doi.org/10.1016/j.bcmd.2008.01.010
Majeed H., Sridharan S., Mir M., Ma L., Min E., Jung W., Popescu G. // Journal of Biophotonics V. 10. 2017. P. 177. https://doi.org/10.1002/jbio.201600113
Mechanobiology of Cell-Cell and Cell-Matrix Interactions. Boston, MA: Springer, 2011.
Yusipovich A.I., Parshina E.Y., Brysgalova N.Y., Brazhe A.R., Brazhe N.A., Lomakin A.G., Levin G.G., Maksimov G.V. // Journal of Applied Physics. 2009. V. 105. P. 102037. https://doi.org/10.1063/1.3116609
Tychinsky V.P., Tikhonov A.N. // Cell Biochem. Biophys. 2010. V. 58. P. 107. https://doi.org/10.1007/s12013-010-9114-z
Svitkina T.M. // Trends in Cell Biology. 2020. V. 30. P. 556. https://doi.org/10.1016/j.tcb.2020.03.005
Popescu G., Ikeda T., Goda K., Best-Popescu C.A., Laposata M., Manley S., Dasari R.R., Badizadegan K., Feld M.S. // Physical Review Letters. 2006. V. 97. 218101. https://doi.org/10.1103/PhysRevLett.97.218101
Yusipovich A.I., Novikov S.M., Kazakova T.A., Erokhova L.A., Brazhe N.A., Lazarev G.L., Maksimov G.V. // Quantum Electron. 2006. V. 36. P. 874. https://doi.org/10.1070/QE2006v036n09ABEH013408
Barer R., Joseph S. // Quarterly Journal of Microscopical Science. 1954. V. 95. P. 399.
Rappaz B., Barbul A., Hoffmann A., Boss D., Korenstein R., Depeursinge C., Magistretti P.J., Marquet P. // Blood Cells Mol. Dis. 2009. V. 42. P. 228. https://doi.org/10.1016/j.bcmd.2009.01.018
NIST/SEMATECH e-Handbook of Statistical Methods. NIST, 2013. https://doi.org/10.18434/M32189
Yusipovich A.I., Cherkashin A.A., Verdiyan E.E., Sogomonyan I.A., Maksimov G.V. // Laser Physics Letters. 2016. V. 13. P. 085601. https://doi.org/10.1088/1612-2011/13/8/085601
Lomakin A.Y., Nadezhdina E.S. // Biochemistry (Moscow). 2010. V. 75. P. 7. https://doi.org/10.1134/S0006297910010025
Parshina E.Y., Yusipovich A.I., Brazhe A.R., Silicheva M.A., Maksimov G.V. // Journal of Biological Physics. 2019. V. 45. P. 367. https://doi.org/10.1007/s10867-019-09533-5
Luneva O.G., Sidorenko S.V., Ponomarchuk O.O., Tverskoy A.M., Cherkashin A.A., Rodnenkov O.V., Alekseeva N.V., Deev L.I., Maksimov G.V., Grygorczyk R., Orlov S.N. // Cell Physiol Biochem. 2016. V. 39. P. 81. https://doi.org/10.1159/000445607
Лимфоциты. Методы. М.: Мир, 1990.
Turovetskii V.B., Zolotilin S.A., Sarycheva N.I., Kalikhevich V.N., Kamenskii A.A. // Biull. Eksp. Biol. Med. 1994. V. 117. P. 265.
Tverskoi A.M., Sidorenko S.V., Klimanova E.A., Akimova O.A., Smolyaninova L.V., Lopina O.D., Orlov S.N. // Biochemistry (Moscow). 2016. V. 81. P. 876. https://doi.org/10.1134/S0006297916080083
Левин Г.Г., Вишняков Г.Н., Минаев В.Л. // ПТЭ. 2014. № 1. С. 79. https://doi.org/10.7868/S0032816214010066
Schindelin J., Arganda-Carreras I., Frise E., Kaynig V., Longair M., Pietzsch T., Preibisch S., Rueden C., Saalfeld S., Schmid B., Tinevez J.Y., White D.J., Hartenstein V., Eliceiri K., Tomancak P., Cardona A. // Nature Methods. 2012. V. 9. P. 676. https://doi.org/10.1038/nmeth.2019
Shock I., Barbul A., Girshovitz P., Nevo U., Korenstein R., Shaked N.T. // J. Biomed. Opt. 2012. V. 17. 101509. https://doi.org/10.1117/1.Jbo.17.10.101509
Bishitz Y., Gabai H., Girshovitz P., Shaked N.T. // Journal of Biophotonics. 2014. V. 7. P. 624. https://doi.org/10.1002/jbio.201300019
Дополнительные материалы отсутствуют.
Инструменты
Приборы и техника эксперимента


