Приборы и техника эксперимента, 2022, № 2, стр. 138-141
УСТАНОВКА НА ОСНОВЕ СО2-ЛАЗЕРА С ОБРАТНОЙ СВЯЗЬЮ ДЛЯ АВТОМАТИЗИРОВАННОГО ПРЕЦИЗИОННОГО ВЫПАРИВАНИЯ БИОЛОГИЧЕСКИХ ТКАНЕЙ
А. К. Дмитриев a, А. Н. Коновалов a, *, В. Н. Кортунов a, В. А. Ульянов a
a Институт фотонных технологий ФНИЦ “Кристаллография и фотоника” РАН
108840 Москва, Троицк, ул. Пионерская, 2, Россия
* E-mail: ank27.ift@mail.ru
Поступила в редакцию 14.10.2021
После доработки 26.10.2021
Принята к публикации 27.10.2021
- EDN: EZGQSY
- DOI: 10.31857/S0032816222020033
Аннотация
Разработана установка на основе CO2-лазера с обратной связью для автоматизированного прецизионного выпаривания биологических тканей. Прецизионное послойное выпаривание осуществляется с использованием гальванометрического сканатора внутри заранее определяемой зоны, которая может быть любой формы, задаваемой с помощью компьютера. Установка позволяет в процессе выпаривания записывать автодинный сигнал и его производные (мощность сигнала и средневзвешенную частоту в заданном частотном диапазоне) и одновременно осуществлять видеозапись процесса выпаривания с помощью цифрового микроскопа. Созданная установка может быть использована для исследований и отработки новых подходов к прецизионным малотравматичным лазерным операциям с применением роботизированных хирургических систем с обратной связью.
ВВЕДЕНИЕ
Современной тенденцией развития и совершенствования медицинских технологий является создание и применение в хирургии автоматизированных и роботизированных систем [1, 2]. Такой подход обеспечивает высокую точность проведения операций, минимально инвазивный подход, контроль за ходом хирургического вмешательства в реальном времени, снижает риски человеческого фактора, а в итоге дает возможность быстрой послеоперационной реабилитации пациентов.
Широкое распространение в качестве одного из хирургических инструментов получили одномодовые СО2-лазеры (10.6 мкм) с накачкой активной среды пачками радиоимпульсов (в диапазоне частот от десятков до сотен мегагерц) с переменной скважностью (далее – импульсно-периодическая (и.п.) накачка) [3, 4]. Такие лазеры характеризуются компактностью, долговременной стабильностью рабочих характеристик и высоким ресурсом. В частности, СО2-лазерный скальпель находит применение в широко известном хирургическом роботе Da Vinci [5], а также совместно со сканирующими системами используется для послойного автоматизированного лазерного испарения пораженных тканей. В последнем случае наиболее известным представителем является хирургический СО2-лазер AcuPulse 40 ST (LumenisInc., США), оснащенный сканером SurgiTouch [6]. Эта система позиционируется как роботизированный лазерный хирургический комплекс и позволяет хирургу в автоматизированном режиме задавать форму, область испаряемой ткани и пошаговую глубину ее испарения. Лазерная система SmartXide2 СО2 с хирургическим сканером и высокоточным микроманипулятором показала перспективные результаты при испарении различных опухолей головного и спинного мозга с минимальным тепловым повреждением здоровых тканей [7].
Наиболее полно возможности проведения прецизионных органосохранных операций с помощью лазерного скальпеля могут быть реализованы при организации обратной связи в хирургической системе. Однако такие хирургические системы, как правило, базируются в основном на тактильной обратной связи хирурга и различных методах визуализации операционного поля. В наших предыдущих работах был предложен и исследован способ организации обратной связи в CO2-лазерах на основе автодинного эффекта, возникающего в процессе лазерного испарения биотканей [8, 9]. Эффект заключается в том, что рассеянное от внешнего движущегося объекта излучение попадает обратно в резонатор лазера и инициирует модуляцию выходной мощности (автодинный сигнал) на доплеровской частоте. Автодинный сигнал может служить источником оперативной информации о ходе лазерного выпаривания биотканей и тем самым являться своего рода “сенсором” для организации обратной связи в хирургической установке. Оперативная диагностика процессов лазерного испарения биотканей по автодинному сигналу и его производным (например, доплеровскому спектру, площади спектра, его средневзвешенной частоте) состоит в выявлении различий и характерных особенностей амплитудно-частотных характеристик автодинного сигнала для различных типов испаряемых биотканей.
Нами установлено, что автодинный эффект возникает и в коммерчески выпускаемых CO2-лазерах с и.п.-накачкой, которые используются в современных хирургических аппаратах. Для уверенного приема автодинного сигнала лазерный излучатель должен обладать определенными характеристиками по стабильности. Нами показано, что наилучшей стабильностью обладают излучатели на основе CO2-лазера компаний Coherent и Synrad, которые позволяют получать максимальные отношения сигнал/шум при приеме автодинного сигнала [9, 10]. Нами были разработаны алгоритмы обработки для получения информационной доплеровской составляющей автодинного сигнала для таких лазеров с и.п.-накачкой [11].
Ниже представлены результаты по созданию хирургической экспериментальной установки на основе одномодового СО2-лазера с и.п.-накачкой активной среды компании Coherent с системой объективного контроля и управления качеством автоматизированного лазерного хирургического вмешательства. Для организации оптико-информационного канала обратной связи в такой установке использован автодинный эффект, а для прецизионного перемещения лазерного пучка и послойного удаления ткани – сканатор.
ОПИСАНИЕ УСТАНОВКИ
Созданная установка (рис. 1) состоит из лазерного блока 3 с обратной связью, шестизвенного шарнирно-зеркального манипулятора 4 длиной 1.2 м для вывода излучения в операционное поле и двухкоординатного гальвано-сканатора (5) JS1105 GalvoScanner (Sino-GalvoTechnologyCo., Китай), который состыкован с шарнирно-зеркальным манипулятором. Также в состав установки входят аналого-цифровой преобразователь (2) Лан-12USB (ООО “Руднев-Шиляев”, Россия) для оцифровки автодинного сигнала, поступающего от лазерного блока, цифровой микроскоп 6 для отображения области воздействия и видеозаписи процесса лазерного выпаривания и ноутбук Lenovo 1 для управления работой сканатора, а также обработки и выделения информационной составляющей автодинного сигнала.
Рис. 1.
Лазерная установка по автоматизированному выпариванию биотканей: a – схема установки (1 – компьютер, 2 – аналого-цифровой преобразователь, 3 – лазерный блок, 4 – шарнирно-зеркальный манипулятор, 5 – гальвано-сканатор, 6 – микроскоп, 7 – образец, 8 – излучатель на основе СО2-лазера, 9 – блок питания лазера, 10 – контроллер управления лазерным модулем, 11 – оптический блок); б – фотография лазерной установки; в – изображения разных форм на поверхности образцов (под углом к поверхности) из агара, полученные при сканировании лазерным пучком со скоростью 15 мм/с и мощности лазерного излучения 5 Вт; г – фотография среза области сканирования образца из агара.
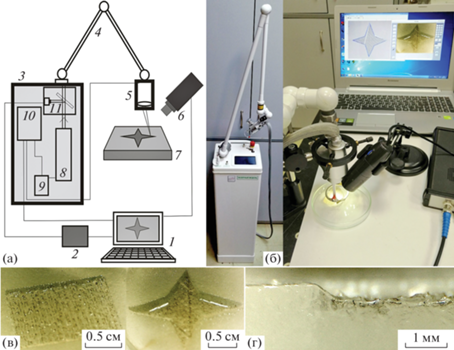
Лазерный блок выполнен в виде мобильного напольного моноблока портального типа (см. фотографию установки на рис. 1б) размером 26 × 26 × × 90 см. В моноблок входят СО2-лазер (8) C-20A (Coherent, США) с высокочастотной накачкой мощностью до 20 Вт, высокостабильный блок питания (9) WS 1000-48 (TDK-Lambda), красный диодный лазер подсветки с длиной волны 0.65 мкм для визуализации оптического пути основного излучения, быстродействующий HgCdTe-фотоприемник для регистрации автодинного сигнала и система управления режимами работы установки с жидкокристаллическим сенсорным экраном.
Установка может работать в трех режимах генерации лазерного излучения: “основной”, “импульсный” и “суперпалс”. “Основной” – это режим импульсно-периодической генерации излучения с фиксированной частотой 10 кГц. В этом режиме средняя выходная мощность излучения варьируется путем изменения скважности импульсов. “Импульсный” – это режим, в котором генерация в режиме “основной” периодически прерывается. При этом длительность импульсов и паузы между импульсами задаются в диапазоне 10–2000 мс. Режим “суперпалс” – это генерация коротких импульсов в диапазоне 10–1000 мкс с паузами между импульсами 0.5–50 мс. В этом режиме CO2-излучатель способен выдавать пиковую мощность 30–50 Вт, что в 1.5–2.5 раза превышает максимальную мощность, которая достигается в непрерывном режиме генерации для лазера C-20A (20 Вт). Режимы генерации и их параметры могут быть установлены с пульта управления через выведенный сенсорный жидкокристаллический дисплей.
Блок управления сканатором и специально разработанная программа позволяют задавать любые формы области выпаривания в пределах размеров 20 × 20 мм, а также скорость перемещения лазерного пучка и плотность заполнения площади штриховкой. Скорость перемещения пучка может быть задана в пределах 1–50 мм/с, а расстояние между линиями штриховки – в пределах 150–2000 мкм с шагом 150 мкм.
Цифровой микроскоп используется для исследования структуры и топологии выпариваемой зоны с целью обеспечения равномерного поверхностного испарения и для видеозаписи процесса выпаривания при определении соответствия между автодинным сигналом и типом испаряемой ткани.
РЕЗУЛЬТАТЫ
Для отработки режимов сканирования и выпаривания биотканей нами были использованы биомодели из агара с водой. Получаемые образцы представляли собой желеобразную однородную структуру, жесткость которой зависела от содержания агара. Нами были использованы образцы с содержанием агара 1, 2 и 5%. Такие образцы могут хорошо моделировать реальные мягкие биологические ткани, которые более чем на 80% состоят из воды. На рис. 1в и 1г приведены примеры выпаривания образцов из агара (2% агара и 98% воды). При мощности лазерного излучения 5 Вт со скоростью сканирования 15 мм/c и при расстоянии между штрихами 300 мкм глубина выпаривания составляла 0.4 мм. Эксперименты показали, что глубина выпариваемого слоя практически не зависит от содержания агара. Это связано с тем, что основным компонентом, поглощающим лазерное излучение с длиной волны 10 мкм, является вода, содержание которой в наших образцах слабо различается (99, 98 и 95%).
Разработанная установка позволяет в процессе сканирования лазерного пучка и выпаривания поверхностного слоя образца детектировать и обрабатывать автодинный сигнал, возникающий при попадании в лазерный излучатель обратно рассеянного излучения. Эксперименты продемонстрировали, что мощность автодинного сигнала меняется для образцов с разным содержанием агара. По-видимому, это связано с тем, что, хотя образцы в основном и состоят из воды, они различаются по своим физическим параметрам (упругость, жесткость, прочность и др.). Это приводит к разным процессам массопереноса, происходящим в зоне лазерного воздействия.
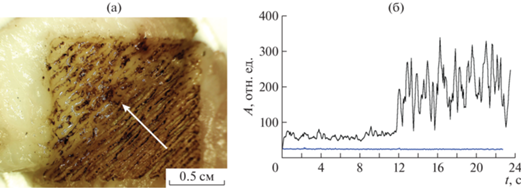
Также нами были проведены эксперименты по выпариванию образцов тканей свиньи in vitro c одновременной регистрацией автодинного сигнала. Эксперименты продемонстрировали, что разные ткани дают разный автодинный сигнал. На рис. 2 в качестве примера приведен автодинный сигнал, возникающий в процессе выпаривания жировой и мышечной тканей. Для моделирования ситуации, приближенной к реальному хирургическому вмешательству, нами использовался образец из соединенных между собой жировой и мышечной тканей (рис. 2), что моделирует выпаривание участка с неоднородной структурой тканей. Видно, что при переходе от выпаривания мышечной ткани к выпариванию жировой в процессе сканирования лазерного пучка происходит заметное увеличение мощности автодинного сигнала (см. рис. 2б).
Рис. 2.
Лазерное выпаривание биотканей жира и мышцы: а – фотография составного образца из биотканей жира и мышцы после одного скана, стрелкой показано направление сканирования; б – динамика мощности автодинного сигнала в процессе сканирования лазерного пучка по участку составного образца, нижний график (синяя линия) – шумы (в отсутствие обратного рассеяния); мощность лазерного излучения P = 5 Вт, скорость сканирования 15 мм/с.
Разработанная нами установка может быть использована для создания алгоритмов и технологий автоматизированного прецизионного селективного выпаривания биотканей для задач органосохранных и малотравматичных операций.
ЗАКЛЮЧЕНИЕ
Представлена многофункциональная установка на основе CO2-лазера с обратной связью для исследований и прецизионного автоматизированного выпаривания биологических тканей. Установка позволяет:
1) осуществлять послойное выпаривание биотканей внутри области любой формы (в пределах размеров 25 × 25 мм), задаваемой компьютером со скоростью сканирования от 1 до 50 мм/с;
2) записывать как исходный автодинный сигнал в процессе сканирования, так и его производные (площадь спектра в выбранном диапазоне частот и средневзвешенная частота);
3) осуществлять видеозапись зоны лазерного воздействия в процессе лазерного выпаривания для сопоставления с автодинным сигналом;
4) проводить микроскопический анализ формы, глубины и топологию выпариваемой зоны в зависимости от условий воздействия.
Выполненные эксперименты по выпариванию образцов с разным содержанием агара и разных тканей свиньи in vitro показали, что установка позволяет находить взаимосвязь между особенностями процессов лазерного выпаривания и особенностями автодиного сигнала в CO2-лазере. Созданная установка может быть использована для исследований и отработки новых подходов к прецизионным малотравматичным лазерным операциям в роботизированных хирургических системах с обратной связью.
Список литературы
Peters B.S., Armijo P.R., Krause C., Choudhury S.A., Oleynikov D. // Surgical Endoscopy. 2018. V. 32. Issue 4. P. 1636. https://doi.org/10.1007/s00464-018-6079-2
Guillermo Maza, Arun Sharma // Otolaryngologic Clinics of North America. 2020. V. 53. Issue 6. P. 935. https://doi.org/10.1016/j.otc.2020.07.005
Pogorelsky S.L., Lazukin V.F., Maiboroda V.F., Barmashov A.M. // Proc. SPIE. 2002. V. 5137. P. 5137. https://doi.org/10.1117/12.518088
Grossman J.G., Casperson L.W., Stafsudd O.M. // Appl. Optics. 1983. V. 22. № 9. P. 1298. https://doi.org/10.1364/AO.22.001298
Solares C.A., Strome M. // Laryngoscope. 2007. V. 117 (5). P. 817. https://doi.org/10.1097/MLG.0b013e31803330b7
https://lumenis.com/medical/co2-products/acupulse-30-40-st/
Colasanti R., Giannoni L., Dallar S., Liverotti V., Aiudi D., Rienzo A., Rossi F., Iacoangeli M. // World Neurosurgery. 2021. V. 153. P. e250. https://doi.org/10.1016/j.wneu.2021.06.085
Konovalov A.N., Ul’yanov V.A. // Appl. Optics. 2012. V. 51. № 17. P. 3900. https://doi.org/10.1364/AO.51.003900
Dmitriev A.K., Konovalov A.N., Kortunov V.N., Ulyanov V.A. // Journal of Laser Applications. 2020. V. 32. P. 022073-1. https://doi.org/10.2351/7.0000015
Dmitriev A., Konovalov A., Kortunov V., Ulyanov V. // J. Biomed. Photonics Eng. 2019. V. 5 (3). P. 1. https://doi.org/10.18287/jbpe19.05.030301
Konovalov A.N., Ulyanov V.A. // Advanced Biomedical Engineering. 2021. V. 10. P. 129. https://doi.org/10.14326/abe.10.129
Дополнительные материалы отсутствуют.
Инструменты
Приборы и техника эксперимента


