Приборы и техника эксперимента, 2022, № 3, стр. 108-116
ИССЛЕДОВАНИЕ НЕКОТОРЫХ СВОЙСТВ МИНЕРАЛЬНЫХ УДОБРЕНИЙ С ИСПОЛЬЗОВАНИЕМ ГАММА- И РЕНТГЕНОВСКОЙ ФЛУОРЕСЦЕНТНОЙ СПЕКТРОМЕТРИИ
a Department of Mathematics and Science Education, Faculty of Education,
Akdeniz University
07058 Antalya, Turkey
* E-mail: caneleke@hotmail.com
** E-mail: ceke@akdeniz.edu.tr
Поступила в редакцию 19.12.2021
После доработки 09.01.2022
Принята к публикации 11.01.2022
- EDN: ADNWNM
- DOI: 10.31857/S0032816222030144
Аннотация
Представлены результаты исследования минеральных удобрений с использованием гамма- и рентгеновской флуоресцентной спектроскопии (Energy Dispersive X-ray Fluorescence – EDXRF). Исследовано восемь типов минеральных удобрений. Измерения проводились спектрометром с германиевым детектором высокой чистоты (HPGe), длительность измерения – один день. Анализ спектров проводился компьютерными программами. В результате получены значения удельной активности радионуклидов, активности в радиевом эквиваленте, индексов опасности внутреннего и внешнего облучений и индекс гамма-облучения. Проведено сравнение с данными в научной литературе. Содержание основных макро- и микроэлементов определялось с использованием EDXRF. Размеры и форма (гранул) изучались с помощью сканирующего электронного микроскопа. 226Ra был обнаружен только в одном образце, а 40K – во всех. 232Th и 137Cs не обнаружены ни в одном из образцов. Во всех образцах, за исключением образцов № 2 и № 3, концентрация 40K и дозы выше, чем предельные значения, указанные в соответствующей литературе.
ВВЕДЕНИЕ
Минеральные удобрения используются в сельском хозяйстве для повышения содержания питательных веществ [1]. Удобрения обычно содержат три основных и множество второстепенных химических компонентов. Основными компонентами являются азот (N), пентоксид фосфора (P2O5) и оксид калия (K2O), макрокомпонентами – натрий (Na), кальций (Ca), сера (S), магний (Mg), следовыми компонентами – например, железо (Fe), сера (S), марганец (Mn), цинк (Zn), молибден (Mo) и медь (Cu) [2–4].
Азот используется в форме солей аммония, нитратов и органических соединений азота. Эти компоненты влияют на вегетативный рост растений через азотсодержащие белки и хлорофилл. При недостатке азота окраска листьев растений становится желтой, избыток азота препятствует достижению спелости [4, 5].
Основным материалом фосфорных удобрений является фосфоритная руда (фторапатит). Химическая формула – 3Ca3(PO4)2 ⋅ CaF2 (фторфосфат кальция). Если отделить фосфоритную руду с помощью серной кислоты, получается суперфосфат, содержащий 18–20% пятиокиси фосфора (P2O5). Если фосфоритная руда разлагается фосфорной кислотой, получается тройной суперфосфат, который содержит 48% пятиокиси фосфора (P2O5). Фосфаты стимулируют рост растений, обеспечивают устойчивость к болезням, дают более сильные всходы и ускоряют созревание сельскохозяйственных культур [4, 5]. Однако фосфорные удобрения являются значительными источниками газообразного радона, который является продуктом распада 238U [6].
Калий входит в состав многих смешанных удобрений. Он участвует во всех метаболических процессах, поэтому является важным элементом для всех растущих растений. Если некоторые культуры содержат нежелательно высокие концентрации хлоридов, сульфат калия или нитрат калия является эффективным средством. Когда сельскохозяйственные угодья лежат под паром, минералы калия медленно диссоциируют и из года в год выделяют растениям значительное количество поташа. Часть поташа, поглощаемого растениями, остается в вегетационных зонах [4, 5].
Концентрация естественных радионуклидов в почве меняется от одной области к другой из-за крупномасштабного использования минеральных удобрений. Именно они являются основным источником радиоактивности в почве [7, 8]. При высокой концентрации радионуклидов в почвах растет риск попадания их в организм человека через подземные воды, питьевую воду и пищевую цепь [9, 10]. Если радиоактивность, выделяемая минеральными удобрениями (плюс естественная радиация из окружающей среды), превышает допустимый уровень, это может вызвать рак и другие проблемы со здоровьем. Поэтому отслеживание удельной активности естественных радионуклидов актуально с точки зрения радиационной защиты [11].
Во многих работах естественные радионуклиды (в первую очередь 40K, а также цепочки распада 238U, 232Th) в минеральных удобрениях определяли с помощью гамма-спектрометрии [6, 7, 11–15]. Для определения основных, макро-, микро- и токсичных элементов использовали также и другие атомные и ядерные методы. Например, в двух разных лабораториях наличие 35-ти элементов в шести различных импортных удобрениях, содержащих азот/фосфор/калий (NPK), азот/фосфор (NP) и калий (K), было определено с помощью оптической эмиссионной спектрометрии (ICP-OES – Inductively Coupled Plasma Optical Emission Spectrometry), а в работе [1] – с помощью инструментального нейтронно-активационного анализа (INAA – Instrumental Neutron Activation Analysis). Фосфаты удобрений природного и промышленного происхождения, включая три стандартных образца (NBS-SRM 120b, BCR-SRM № 32 и № 33), были исследованы с помощью INAA [3]. Концентрация основных компонентов удобрений (Al2O3, SiO2, P2O5, SO3, Cl, K2O, Fe2O3) определялась с помощью рентгеновской флуоресценции (XRF – X-ray Fluorescence), а также методом дифракции рентгеновских лучей (XRD – X-ray Diffraction) [14, 16]. Калийсиликатные удобрения изучались методами порошковой рентгеновской дифракции и рентгенофлуоресцентной спектроскопии (EDXRF – Energy Dispersive X-ray Fluorescence) [17]. Химический состав удобрения из диаммонийфосфата (DAP) был проведен с помощью лазерно-искровой эмиссионной спектроскопии (LIBS – Laser-Induced Breakdown Spectroscopy), были обнаружены элементы Mg, Al, P, Ti, Cr, Mn, Fe, Co, Ni, Mo, Pb и следы U [18]. Для многоэлементного анализа образцов использовался метод LIBS с последующей обработкой результатов методом частичных наименьших квадратов (PLS) [19]. Калийные удобрения изучали с помощью LIBS [20], фосфор в коммерческих удобрениях определяли с помощью атомно-абсорбционной спектроскопии (ААS – Atomic Absorption Spectroscopy) [21]. И последнее, но не менее важное: концентрации K, Na и Zn в качестве основных элементов, Ni и Co в качестве второстепенных элементов и Pb, Cd, Cr и Cu в качестве загрязнителей окружающей среды или токсичных элементов определялись методом ААS в 14-ти коммерческих фосфатных удобрениях, поставляемых на рынок Ирака [22].
Целью данного исследования являлось: 1) определение удельной активности природных радионуклидов; 2) получение информации о значениях радиационной опасности; 3) проведение элементного анализа химических удобрений с использованием рентгеновской флуоресцентной спектроскопии (EDXRF). Для этого были рассчитаны показатели естественной радиоактивности 238U, 232Th и 40K в широко используемых в Анталии химических удобрениях, а также активности в радиевом эквиваленте (Raeq), индексы внутренней и внешней опасности (Hin и Hex). Полученные значения были сопоставлены со значениями, указанными в литературе. Ниже приведены описания материалов и методологии, а также представлены результаты этого исследования.
МАТЕРИАЛЫ И МЕТОДЫ
Минеральные удобрения восьми различных типов, выбранные на рынке удобрений в Анталии (Турция), были изучены с помощью гамма- и EDXRF-спектроскопии. Для измерения концентрации естественных радионуклидов образцы были помещены в пластиковые стаканчики объемом 100 мл, промаркированы и запечатаны. Масса образцов определялась взвешиванием. Диаметр и высота чашек составляли 61 и 53 мм соответственно. Масса образцов варьировалась от 104 до 148 г. Для расчета удельной активности естественных радионуклидов (238U и 232Th) образцы выдерживались 5 недель для достижения равновесия радия и радона. Удельную активность 40K определяли без выдержки, потому что этот нуклид не производит цепочку распада, подобную 238U и 232Th.
Измерение концентрации естественных радионуклидов в каждом образце проводилось в течение 86400 с (1 день) с использованием германиевого детектора высокой чистоты (HPGe, относительная эффективность 40%, p-тип, электрическое охлаждение; разрешение: 1.85 кэВ при 1332 кэВ, 768 эВ при 122 кэВ). Детектор HpGe расположен на факультете физики Akdeniz University. Калибровка по энергии проверялась с помощью точечных γ-источников.
Перед измерением активности образцов в течение 86 400 с измеряли фоновое излучение, чтобы вычесть фон из спектров удобрений. Спектры каждого образца набирали с помощью компьютерного программного обеспечения Maestro-32 [23]. Собранные спектры удобрений и фоновый спектр анализировались автоматически с помощью компьютерной программы Gamma-W [24].
Минимально детектируемую активность (MDA) вычисляли, согласно Currie [25, 26], по соотношению
где σ – стандартное отклонение числа отсчетов фонового спектра; t – время измерения; ε – эффективность детектора; Iγ – вероятность γ-излучения; m – масса образца. Были рассчитаны MDA радионуклидов 214Pb (351.93 кэВ), 214Bi (609.32 кэВ), 228Ac (911.20 кэВ), 40K (1460.82 кэВ) и 37Cs (661.66 кэВ) в образце массой 1 кг и для времени измерения 50398 с с учетом фонового спектра. МDА 226Ra была определена с использованием среднего значения 214Pb и 214Bi.Удельную активность природных радионуклидов А, Бк/кг, в минеральных удобрениях вычисляли по хорошо известному соотношению [27]:
где N – общий счет в пике после вычитания фона; m, кг – масса образца; t, с – время счета образца; ε – эффективность детектора, Iγ – вероятность γ‑излучения по литературным данным.Мертвое время нашей экспериментальной установки не учитывалось, так как оно меньше 5% [27]. Кроме того, для расчета удельной активности радионуклидов учитывалось самопоглощение в образцах. Поправочный коэффициент самопоглощения (SACF) минеральных удобрений был рассчитан с использованием метода пропускания Cutshall [28]. Подробности можно найти в [29].
Неопределенность удельной активности естественных радионуклидов рассчитывалась по следующему уравнению [30]:
(3)
$\Delta A = A\sqrt {{{{\left( {\frac{{\Delta N}}{N}} \right)}}^{2}} + {{{\left( {\frac{{\Delta t}}{t}} \right)}}^{2}} + {{{\left( {\frac{{\Delta {{\varepsilon }}}}{{{\varepsilon }}}} \right)}}^{2}} + {{{\left( {\frac{{\Delta {{I}_{{{\gamma }}}}}}{{{{I}_{{{\gamma }}}}}}} \right)}}^{2}} + {{{\left( {\frac{{\Delta m}}{m}} \right)}}^{2}} + {{{\left( {\frac{{\Delta f}}{f}} \right)}}^{2}}} ,$Значения концентрации природных радионуклидов использовались также для оценки индексов радиологической опасности, таких как активность в радиевом эквиваленте, дополнительный риск рака в течение жизни от наружной радиации, внутренний и внешний индексы опасности минеральных удобрений.
Активность в радиевом эквиваленте Raeq, Бк/кг, определяет внешнее облучение γ-квантами от 226Ra, 232Th и 40K. Эквивалент рассчитывался с использованием следующего уравнения [31]:
(6)
${\text{\;R}}{{{\text{a}}}_{{{\text{eq}}}}} = {{A}_{{{\text{Ra}}}}} + 1.43{{A}_{{{\text{Th}}}}} + 0.077{{A}_{{{\text{K}}~}}},$Индексы опасности внешнего (Hex) и внутреннего (Hin) облучения от естественного γ-излучения, испускаемого 226Ra, 232Th и 40K, рассчитывались с использованием следующих уравнений [31, 32]:
(7)
${{H}_{{{\text{ex}}}}} = \frac{{{{A}_{{{\text{Ra}}}}}}}{{370}} + \frac{{{{A}_{{{\text{Th}}}}}}}{{259}} + \frac{{{{A}_{{\text{K}}}}}}{{4810}};$(8)
${{H}_{{{\text{in}}}}} = \frac{{{{A}_{{{\text{Ra}}}}}}}{{185}} + \frac{{{{A}_{{{\text{Th}}}}}}}{{259}} + \frac{{{{A}_{{\text{K}}}}}}{{4810}},$Индекс γ-излучения (I), являющийся одним из индексов опасности, рассчитывался по уравнению [33]:
(9)
$I = \frac{{{{A}_{{{\text{Ra}}}}}}}{{300}} + \frac{{{{A}_{{{\text{Th}}}}}}}{{200}} + \frac{{{{A}_{{\text{K}}}}}}{{3000}}.$Содержание компонентов определяли, используя EDXRF-спектроскопию, в Basic Sciences Application and Research Center in Erzincan Binali Yildirim University.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
MDA (минимально детектируемая активность) составила 1.10 Бк/кг для 226Ra, 1.23 Бк/кг для 214Pb, 0.97 Бк/кг для 214Bi, 3.12 Бк/кг для 228Ac (232Th), 0.94 Бк/кг для 137Cs и 8.91 Бк/кг для 40K. Как показано в табл. 1, удельные активности 226Ra и 40K выше, чем MDA этих радионуклидов. В минеральных удобрениях не были обнаружены 226Ra (за исключением образца № 1), 232Th, а также искусственный радионуклид 137Cs, а 40К был обнаружен во всех образцах. Удельная активность радия (180 ± 19 Бк/кг) выше, чем предельное значение (33 Бк/кг) по данным UNSCEAR (United Nations Scientific Committee on the Effects of Atomic Radiation) [34]. Удельная активность 40К варьируется от 34 ± 8 до 28065 ± 2705 Бк/кг. Среднее значение удельной активности 40K составило 17294 Бк/кг, что значительно выше, чем предельное значение, указанное UNSCEAR [34] (420 Бк/кг), за исключением образцов № 2 и № 3. Напротив, средняя удельная активность 40K образцов № 2 и № 3 (35 Бк/кг) ниже предельного значения, указанного UNSCEAR, примерно на один порядок величины и, таким образом, незначительна (см. табл. 1).
Таблица 1.
Удельная активность радионуклидов 226Ra и 40K в минеральных удобрениях (232Th и 137Cs не детектируются)
| Номер образца | 226Ra, Бк/кг | 40K, Бк/кг |
|---|---|---|
| № 1 | 180 ± 19 | 9028 ± 897 |
| № 4 | н.д. | 18595 ± 1791 |
| № 5 | н.д. | 28065 ± 2705 |
| № 6 | н.д. | 25350 ± 2459 |
| № 7 | н.д. | 13010 ± 1296 |
| № 8 | н.д. | 9713 ± 970 |
| Среднее 1 | – | 17294 ± 1686 |
| № 2 | н.д. | 36 ± 5 |
| № 3 | н.д. | 34 ± 8 |
| Среднее 2 | – | 35 ± 7 |
Значения активности в радиевом эквиваленте (Raeq), индексов опасности внутреннего (Hin) и внешнего (Hex) облучения и индекса γ-излучения (I) для минеральных удобрений представлены в табл. 2.
Таблица 2.
Оценки параметров облучения от химических удобрений
| Номер образца | Raeq, Бк/кг | Hin | Hex | I |
|---|---|---|---|---|
| № 1 | 874.94 | 2.85 | 2.36 | 3.61 |
| № 4 | 1431.82 | 3.87 | 3.87 | 6.20 |
| № 5 | 2160.97 | 5.83 | 5.83 | 9.35 |
| № 6 | 1951.97 | 5.27 | 5.27 | 8.45 |
| № 7 | 1001.76 | 2.70 | 2.70 | 4.34 |
| № 8 | 747.94 | 2.02 | 2.02 | 3.24 |
| Среднее 1 | 1361.57 | 3.76 | 3.68 | 5.88 |
| № 2 | 2.73 | 0.01 | 0.01 | 0.01 |
| № 3 | 2.62 | 0.01 | 0.01 | 0.01 |
| Среднее 2 | 2.68 | 0.01 | 0.01 | 0.01 |
Согласно данным табл. 2:
– значения Raeq для образцов № 1, № 4–8 превышают 370 Бк/кг, что является допустимым предельным значением [31];
– значения Hin и Hex соответственно для образцов № 1, № 4–8 больше единицы, но должны быть <1 [31];
– значения I образцов № 1–3, № 7 и № 8 ниже 6 (что является допустимым предельным значением [33]), а значения выборок № 4, № 5 и № 6 больше 6.
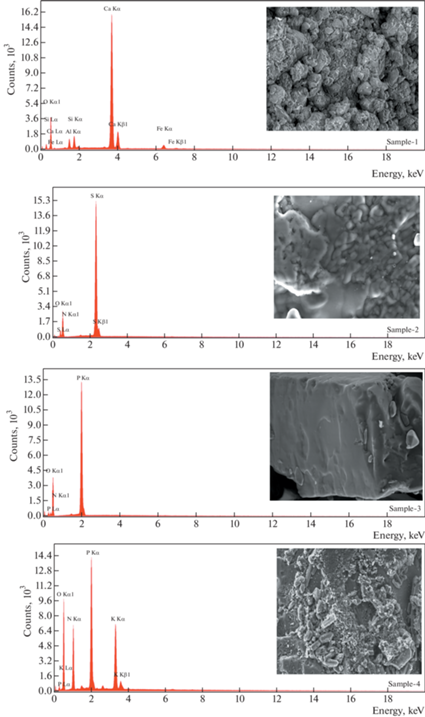
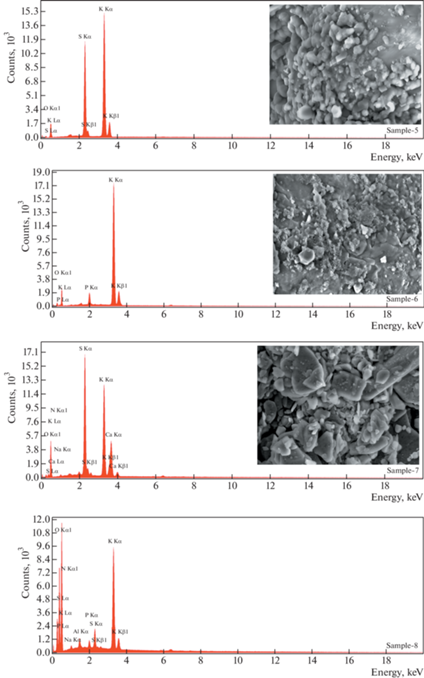
Результаты анализа минеральных удобрений с использованием EDXRF приведены в табл. 3, а их EDXRF-спектры и микрофотографии, полученные с помощью сканирующего электронного микроскопа (SEM), показаны на рис. 1. N, P и K являются основными питательными веществами, Ca, Mg и S – макроэлементами, а Fe, Mn, Cu, Zn, B и Mo – микроэлементами для растений в почве. Ca и Mg играют важную роль в установлении pH почвы [1].
Таблица 3.
Результаты анализа состава минеральных удобрений с использованием EDXRF для образцов № 1–8
| Элемент | Весовая концентрация, % (относительная неопределенность, %) для образцов | |||||||
|---|---|---|---|---|---|---|---|---|
| № 1 | № 2 | № 3 | № 4 | № 5 | № 6 | № 7 | № 8 | |
| O | 57.61 (10.10) | 49.36 (10.26) | 54.69 (9.53) | 49.64 (8.67) | 40.28 (10.93) | 55.50 (10.24) | 47.99 (10.19) | 56.11 (9.67) |
| Al | 2.57 (8.74) | н.д. | н.д. | н.д. | н.д. | н.д. | н.д. | 0.74 (8.91) |
| Si | 2.68 (7.12) | н.д. | н.д. | н.д. | н.д. | н.д. | н.д. | н.д. |
| Ca | 35.27 (1.10) | н.д. | н.д. | н.д. | н.д. | н.д. | 7.30 (3.25) | н.д. |
| Fe | 1.86 (6.35) | н.д. | н.д. | н.д. | н.д. | н.д. | н.д. | н.д. |
| S | н.д. | 27.15 (2.12) | н.д. | н.д. | 20.33 (2.56) | н.д. | 14.17 (2.57) | 0.87 (3.65) |
| Na | н.д. | н.д. | н.д. | 22.95 (8.69) | н.д. | н.д. | 1.15 (13.12) | 1.85 (11.02) |
| N | н.д. | 23.49 (10.74) | 16.40 (11.16) | н.д. | н.д. | н.д. | 14.96 (11.79) | 34.57 (7.73) |
| P | н.д. | н.д. | 28.90 (3.09) | 18.02 (4.74) | н.д. | 3.57 (5.15) | н.д. | 0.39 (7.68) |
| K | н.д. | н.д. | н.д. | 9.39 (2.88) | 39.39 (2.54) | 40.93 (1.22) | 14.43 (2.25) | 5.46 (1.22) |
Минеральные удобрения подразделяются на три категории, а именно: удобрения с одним питательным веществом (N, P или K), удобрения с двумя питательными веществами (NP, NK или PK) и удобрения с несколькими питательными веществами (NPK или NPK + S) [35]. Образец № 2 представляет собой азотное удобрение, образец № 3 – удобрение NP, образцы № 4 и № 6 – PK-удобрения, образец № 5 – удобрение K, образец № 7 – удобрение NK, образец № 8 – удобрение NPK. Образцы № 1 и № 5 представляют собой удобрения с одним питательным веществом, образцы № 3, № 4, № 6 и № 7 – бинарные удобрения и только образец № 8 является мультиэлементным удобрением.
Есть 16 элементов, стимулирующих рост и выживание растений. Они входят в состав минеральных и неминеральных удобрений. Тринадцать питательных веществ содержатся в почве, Н и С присутствуют и в воздухе, и/или в воде, а O присутствует повсеместно. Кроме того, минеральные питательные вещества в соответствии с их потреблением растением дополнительно разделены на две категории – макроэлементы и микроэлементы, которые необходимы для роста растения. Калий и кальций – основные элементы, необходимые для роста и улучшения растений.
Образцы № 1 и № 8 содержат алюминий и железо, которые действуют как второстепенные и следовые компоненты. Оксиды этих элементов играют важную роль в почвенных агрегатах [36], поскольку они положительно влияют на физические свойства почвы, повышая однородность агрегата, проницаемость, хрупкость, пористость и гидравлическую проводимость, а также уменьшая пухлость, дезинтеграцию глины, плотность и модули разрушения [37].
Кремний (Si) был обнаружен только в образце № 1 как питательный микроэлемент. Кремний присутствует в земной коре в форме диоксида кремния и является вторым по распространенности элементом после кислорода. Кремний считается одним из важнейших питательных веществ для жизни растений [38]. Он оказывает положительное влияние на их рост и развитие, создает внешний защитный слой, состоящий из отложений кремнезема. Абсорбированный кремний имеет увеличенную реакционную способность с ионами тяжелых металлов и другими содержащимися в почве компонентами, что усиливает метаболические функции кремния [39].
Кальций (Ca) был обнаружен в образце № 1 как основной элемент и как второстепенный элемент – в образце № 7. Кальций играет важную роль в производстве высококачественных культур. Добавка кальция увеличивает прочность и толщину клеточной стенки [40].
Железо (Fe) обнаружено только в образце № 1 как микроэлемент. Железо является необходимым микроэлементом для всех живых организмов, поскольку оно играет важную роль в биологических процессах, таких как дыхание, фотосинтез, синтез дезоксирибонуклеиновой кислоты (ДНК), фиксация и ассимиляция азота [41, 42]. Кроме того, он играет важную роль в синтезе хлорофилла и необходим для структурирования и функционирования хлоропластов. Низкое количество железа в растениях снижает качество питания растений и урожай. Таким образом, недостаток железа препятствует здоровому росту растений [42].
Сера (S) была обнаружена в образцах № 2, № 5 и № 7 как макроэлемент и в образце № 8 как микроэлемент. Сера является компонентом метионина, цистеина и цистина, трех из 20-ти аминокислот, которые являются основными строительными блоками белков. Обычно метионин и цистин содержатся в растениях [43, 44]. Кроме того, сера участвует в синтезе витаминов, ферментных реакциях и связывании металлов в растении и необходима для образования хлорофилла. Сера абсорбируется корнями растений в форме сульфата (${\text{SO}}_{4}^{{2 - }}$) или тиосульфата (${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$); листья поглощают небольшое количество SO2 [45].
Натрий (Na) был обнаружен как макроэлемент в образце № 4 и как микроэлемент – в образцах № 7 и № 8. Натрий считается функциональным питательным веществом для растений. Однако только ограниченному количеству растений с фотосинтезом типа C4 необходимо регулировать концентрацию углекислого газа. Функции натрия для растений: поддержка синтеза хлорофилла, замена функций калия, регулировка внутреннего осмоса, поддержка устьичных функций, обеспечение ионного баланса, активация ферментов и улучшение роста растений [46, 47]. Дефицит натрия наблюдается только у растений с фотосинтезом С4, поскольку натрий необходим для этих растений [46].
Азот (N) был обнаружен как макроэлемент в образцах № 2, № 3, № 7 и № 8. Азот является незаменимым элементом для целых организмов, он входит в состав белков, нуклеиновых кислот (ДНК и РНК), мембранных липидов, аденозинтрифосфата (АТФ), НАДН, НАДФН, коферментов, фотосинтетических пигментов, вторичных метаболитов и др. соединений. Неорганические соединения азота получают путем минерализации органического материала, выделения из органических отходов или химических удобрений. Азот забирается из почвы в виде аммония (${\text{NH}}_{4}^{ + }$) и нитрата (${\text{NO}}_{3}^{ - }$), которые являются основными формами азота, но органический азот абсорбируется подобно аминокислотам [48].
Фосфор (P) был обнаружен как макроэлемент в образцах № 3 и № 4, как второстепенное питательное вещество – в образце № 6 и как микроэлемент – в образце № 8. Фосфор является важным элементом для роста и созревания растений и, наконец, необходим для всего жизненного цикла растений. Фосфор абсорбируется в виде ${{{\text{H}}}_{2}}{\text{PO}}_{4}^{ - }$ и ${\text{HPO}}_{4}^{{2 - }}$ корнями растений из почвы. Фосфор играет роль в фотосинтезе, дыхании, хранении и передаче энергии посредством АДФ (аденозиндифосфат), АТФ, DPN (дифосфопиридин) и TPN (трифосфопиридин). Он важен для сохранения и передачи генетической информации (ДНК и РНК), при делении клеток, развитии корней, зарождении цветков, развитии семян и плодов. Фосфор повышает устойчивость растений к болезням и качество сельскохозяйственных культур [49].
Калий (K) был обнаружен как макроэлемент в образцах № 5, № 6 и № 7, а как второстепенное питательное вещество – в образцах № 4 и № 8. Калий – незаменимый элемент почти для всех растений. Калий является активатором ферментов при метаболизме, помогает растениям использовать воду для устьичных регуляций, поддерживает равновесие электрических зарядов в процессе генерации АТФ при фотосинтезе, регулирует транспорт сахара при фотосинтезе, обеспечивает синтез белка, крахмала и целлюлозы для стимулирования производства АТФ, развивает устойчивость к болезням растений, увеличивает размер зерен и семян, а также качество фруктов и овощей [49, 50].
ЗАКЛЮЧЕНИЕ И ПЕРСПЕКТИВЫ
Содержание природных радионуклидов (нуклидов из цепочек распада 226Ra и 232Th, а также 40K) и искусственного радионуклида 137Cs в восьми образцах различных минеральных удобрений было изучено с помощью гамма-спектрометрии и EDXRF (см. рис. 1). 226Ra, за исключением образца № 1, обнаружен не был. 232Th и 137Cs не были обнаружены ни в одном из образцов минеральных удобрений, а 40K обнаружен во всех. Радиевый эквивалент активности, индексы опасности внутреннего и внешнего облучения, а также индекс активности для минеральных удобрений были рассчитаны и сопоставлены с предельными значениями, указанными в литературе. За исключением образцов № 2 и № 3, полученные значения выше, чем указано в литературе. Размер и внешняя структура компонентов минеральных удобрений показаны на микрофотографиях, сделанных с помощью SEM (см. рис. 1). Есть различия между содержанием компонентов, определенных производителем, и результатами EDXRF. Некоторые ожидаемые следовые элементы не были обнаружены с помощью EDXRF, поэтому необходимы дальнейшие экспериментальные работы с использованием других ядерных и атомных методов, таких как нейтронно-активационный анализ (NAA), фотонный активационный анализ (PAA), атомно-абсорбционная спектрометрия (AAS) и т.д. Тем не менее, γ-спектрометрия и EDXRF могут использоваться для определения радиоактивности окружающей среды и элементного анализа образцов соответственно. Это исследование дает предварительную информацию об ориентировочном загрязнении окружающей среды минеральными удобрениями. Из-за цепочки питания “удобрение–растение–животное–человек” это исследование особенно важно.
Список литературы
El-Ghawi, U., Patzay, G., Vajda, N. Bodizs, D., J. Radioanal. Nucl. Chem., 1999, vol. 243, no. 3, p. 693, https://doi.org/10.1007/BF02347381
El-Bahi, S.M., El-Dine, N.W., El-Shershaby, A. Sroor, A., Health Phys., 2004, vol. 86, no. 3, p. 303, https://doi.org/10.1097/00004032-200403000-00007
Niedergesass, R., Schnier, C. Pepelnik, R., J. Radional. Nucl. Chem., 1993, vol. 168, no. 2, p. 317, https://doi.org/10.1007/BF02040512
Shreve, R.N., The chemical process industries, Second Edition, NY.: McGraw-Hill Book Company Inc., 1956.
Alam, M.N., Chowdhury, M.I., Kamal, M., Ghose, S., Banu, H., Chakraborty, D., App. Radiat. Isot., 1997, vol. 48, no. 8, p. 1165. https://doi.org/10.1016/S0969-8043(97)00019-5
Ioannides, K.G., Mertzimekis, T.J., Papachristodoulou, C.A., Tzialla, C.E., Sci. Total Environ., 1997, vol. 196, p. 63. https://doi.org/10.1016/S0048-9697(96)05390-9
Boukhenfouf, W., Boucenna, A. J. Environ. Radioact., 2011, vol. 102, p. 336, https://doi.org/10.1016/j.jenvrad.2011.01.006
Abbady, A., El-Arabi, A.M., Abbady, A.E., and Taha, S., In International conference on radioecology and environmental radioactivity, Norway, Bergen, 2007.
Morovic, G., Sencar, J., J. Radioanal. Nucl. Chem., 1995, vol. 200, no. 1, p. 9, https://doi.org/10.1007/BF02164816
Righi, S., Lucialli, P., Bruzzi, L., J. Environ. Radioact., 2005, vol. 82, p. 167, https://doi.org/10.1016/j.jenvrad.2004.11.007
Hassan, N.M., Chang, B.U., Tokonomi, S., J. Chem., 2017, vol. 2017, Article ID 9182768, https://doi.org/10.1155/2017/9182768
Khan, K., Khan, H.M., Tufail, M., Khatibeh, A.H., Ahmad, N., J. Environ. Radioactiv., 1998, vol. 38, no. 1, p. 77, https://doi.org/10.1016/S0265-931X(97)00018-0
Hassan, N.M., Mansour, N.A., Fayez-Hassan, M., Sedqy, E., J. Taibah Univ. Sci., 2016, vol. 10, p. 296, https://doi.org/10.1016/j.jtusci.2015.08.009
Chauhan, P., Chauhan, R.P., Gupta, M., Microchem J. 2013, vol. 106, p. 73, https://doi.org/10.1016/j.microc.2012.05.007
El-Zakla, T., Abdel-Ghny, H.A., Hassan, A.M., Rom. Journ. Phys. 2007, vol. 52, no. 5, p. 731.
Chauhan, P., Chauhan, R.P., J. Radioanal. Nucl. Chem., 2013, vol. 295, p. 1097, https://doi.org/10.1007/s10967-012-2244-6
Yao, Y., Hamada, E., Sato, K., Akiyama, T., Yoneyama, T., ISIJ International., 2014, vol. 54, no. 4, p. 990, https://doi.org/10.2355/isijinternational.54.990
Farooq, W.A., Al-Mutairi, F.N., Khater, A.M., Al-Dwayyan, A.S., AlSalhi, M.S., Atif, M., Optics and Spectroscopy., 2012, vol. 112, no. 6, p. 874, https://doi.org/10.1134/S0030400X12060082
Yao, S., Lu, J., Li, J., Chen, K., Li, J., Dong, M., J. Anal. At. Spectrom., 2010, vol. 25, p. 1733, https://doi.org/10.1039/C0JA00027B
Groisman, Y., Gaft, M., Spectrochim. Acta, Part B, 2010, vol. 65, p. 744, https://doi.org/10.1016/j.sab.2010.03.019
Hoft, D., Oxman, J., Gurira, R.C., J. Agric. Food Chem., 1979, vol. 27, no. 1, p. 145. https://doi.org/10.1021/jf60221a047
Rauof, A.M., Hammud, K.K., Ahmed, A.N., Thabit, M.K., Archives of Applied Science Research., 2014, vol. 6, no. 5, p. 90,
Maestro-32, Multi-channel analyser software, A65-B32 model, Ortec., 2008, https://www.ortec-online. com/-/media/ametekortec/manuals/a65-mnl.pdf. [Accessed 20 September 2018]
Gamma-W, http://www.westmeier.com/3gammawfeatures.htm. [Accessed 20 September 2018]
Currie, L., J. Anal.Chem., 1968, vol. 40, p. 586, https://doi.org/10.1021/ac60259a007
Knoll, G., Radiation detection and measurement, 3rd Edition, United States of America, John Wiley and Sons, 2000.
Lakehal, C., Ramdhane, M., Boucenna, A., J. Environ. Radioact., 2010, vol. 101, p. 377, https://doi.org/10.1016/j.jenvrad.2010.02.008
Cutshall, N., Larsen, I., Olsen, C., Nucl. Instrum. Methods Phys. Res. 1983, vol. 206, p. 309, https://doi.org/10.1016/0167-5087(83)91273-5
Eke, C., Yildirim, A., Bulletin of the Russian Academy of Sciences: Physics, 2020, vol. 84, p. 1012, https://doi.org/10.3103/S1062873820080122
ISO-GUM, International Organization for Standardization-Guide to the Expression of Uncertainty in Measurement, 2018, https://www.bipm.org/en/publications/guides/. [Accessed 30 September 2018]
Beretka, J.J., Mathew, P., Journal of Health Physics, 1985, vol. 48, p. 87, https://doi.org/10.1097/00004032-198501000-00007
Mohery, M., Baz, S., Kelany, A.M., Abdallah, A.M., Radit. Phys. Chem., 2014, vol. 97, p. 16, https://doi.org/10.1016/j.radphyschem.2013.10.007
Radiation protection 112, Radiological protection principles concerning the natural radioactivity of building material. European Comission, Finland, 1999.
UNSCEAR, United nations scientific committee on the effect of atomic radiation. sources and effects of ionizing radiation. report to general assembly, with scientific annexes. United Nations, NY, 2000.
Doan, T., Fertilizer Industry Report. Fpt Securities, Vietnam, 2015.
Mbagwu, J.C., Schwertmann, U., Int. Agrophysics., 2006, vol. 20, p. 23.
Goldberg, S., Commun. in Soil Sci. Plant Analysis. 1989, vol. 20, no. 11–12, p. 1181, https://doi.org/10.1080/00103629009368144
Tubana, B.S., Babu, T., Datnoff, L.E., Soil Science, 2016, vol. 181, no. 9-10, p. 393, https://doi.org/10.1097/SS.0000000000000179
Tubana, B.S., Heckman, J.R., Silicon in Soils and Plants. In: Silicon and Plant Diseases, F. Rodrigues, L. Datnoff (eds). Springer, Cham. 2015, p. 7, https://doi.org/10.1007/978-3-319-22930-0_2
Easterwood, G., Fluid Journal, 2002, p. 1–3.
Briat, J.F. Bull. Acad. Natl. Med., 2005, vol. 189, no. 8, p. 1609.
Rout, G.R., Sahoo, S., Reviews in Agricultural Science. 2015, vol. 3, p. 1, https://doi.org/10.7831/ras.3.1
Hell, R., Khan, M.S., Wirtz, M., Cellular biology of sulfur and its functions in plants, in Cell Biology of Metals and Nutrients. R. Hell, R.R. Mendel (eds), Berlin Heidelberg, 2010, pp. 243–279, https://doi.org/10.1007/978-3-642-10613-2_11
Jordan, H.V., Ensminger, L.E., Advaces in Agronomy, 1959, vol. 10, p. 407. https://doi.org/10.1016/S0065-2113(08)60071-1
Lucheta, A.R., Lambais, R., Revista Brasileira de Ciência do Solo, 2012, vol. 36, p. 1369, https://doi.org/10.1590/S0100-06832012000500001
Subbarao, G.V., Ito, O., Berry, W.L., Wheeler, R.M., Critical Reviews in Plant Sciences. 2003, vol. 22, no. 5, p. 391, https://doi.org/10.1080/07352680390243495
Maathuis, F.J.M., Journal of Experimental Botany, 2014, vol. 65, no. 3, p. 849, https://doi.org/10.1093/jxb/ert326
Ohyama, T., Nitrogen as a major essential element of plants, in Nitrogen Assimilation in Plants, Kerela, India, Research Signpost, 2010, p. 1.
Uchida, R., Essential Nutrients for Plant Growth: Nutrient Functions and Deficiency Symptoms. Plant Nutrient Management in Haeaii’s Soils, Approaches for Tropical and Subtropical Agriculture, College of Tropical Agriculture and Human Resources, University of Hawaii at Manoa, Hawaii, Manoa, 2000, p. 31.
Wang, M., Zheng, Q., Shen, Q., Guo, S., Int. J. Mol. Sci., 2013, vol. 14, p. 7370, https://doi.org/10.3390/ijms14047370
Дополнительные материалы отсутствуют.
Инструменты
Приборы и техника эксперимента