Приборы и техника эксперимента, 2022, № 3, стр. 117-120
ЛАБОРАТОРНАЯ УСТАНОВКА ДЛЯ ХРОМАТОГРАФИЧЕСКОГО ВЫДЕЛЕНИЯ 186Re БЕЗ НОСИТЕЛЯ ИЗ ОБЛУЧЕННЫХ МИШЕНЕЙ ИЗ ВОЛЬФРАМА
Е. Б. Фуркина a, *, А. В. Курочкин a, Р. А. Алиев a, В. А. Загрядский a, Т. Ю. Маламут a, В. И. Новиков a, В. Н. Унежев a
a НИЦ “Курчатовский институт”
123182 Москва, пл. Академика Курчатова, 1, Россия
* E-mail: furkina-k@yandex.ru
Поступила в редакцию 29.11.2021
После доработки 09.12.2021
Принята к публикации 10.12.2021
- EDN: CURYYV
- DOI: 10.31857/S0032816222030016
Аннотация
Разработана лабораторная установка для выделения радиоизотопов рения из облученной вольфрамовой мишени с помощью экстракционной хроматографии. Работа установки протестирована с помощью мишени из металлического вольфрама естественного изотопного состава, облученной дейтронами на циклотроне У-150 НИЦ “Курчатовский институт”. Показана возможность полного отделения рения от больших количеств (сотни миллиграмм) вольфрама. При разделении рений концентрируется в минимальном объеме (5 мл) итогового раствора, обеспечивая высокую удельную активность, необходимую для дальнейших экспериментов по созданию радиофармпрепарата.
ВВЕДЕНИЕ
В настоящее время в мире активно ведутся разработки радиофармпрепаратов (РФП) на основе 186Re [1–3]. Радионуклид 186Re без носителя может быть получен на циклотроне по реакциям 186W(p, n)186Re [4, 5] и 186W(d, 2n)186Re [6, 7]. Процесс выделения рения из облученной вольфрамовой мишени можно осуществить различными способами: экстрагировать в виде $\operatorname{Re} {\text{O}}_{4}^{ - }$ из раствора мишени кислородсодержащими экстрагентами, например метилэтилкетоном [8], или использовать термический метод сухой отгонки [9]. Однако, в основном, для разделения применяют хроматографические методы с использованием оксида алюминия или анионообменных смол в качестве неподвижной фазы [10]. На практике для терапии онкологических заболеваний применяют РФП с активностью 186Re ~ 100 МБк. Для наработки такой активности 186Re используют циклотронные мишени с массой 186W несколько сотен миллиграмм. В технологическом процессе переработки высокоактивных циклотронных мишеней с целью минимизации радиологического воздействия на персонал применяют локальные средства автоматизации.
Настоящая статья посвящена разработке и тестированию лабораторной установки для хроматографического выделения 186Re из облученных вольфрамовых мишеней. Приведена схема установки, изложен принцип и последовательность ее работы. Проведено тестирование работы установки в ходе эксперимента по масштабированию и автоматизации разработанной авторами хроматографической методики выделения рения из облученной вольфрамовой мишени. Показано, что с помощью разработанной установки можно в рамках одной технологической операции полностью извлекать рений из вольфрамовой мишени массой несколько сотен миллиграмм. Подобраны оптимальные условия элюирования и необходимые объемы растворов для данной установки. Конструкция созданной установки позволяет проводить разделение в защитном боксе с использованием дистанционного управления, что существенно снижает радиологическое воздействие на персонал.
СХЕМА УСТАНОВКИ
Принципиальная схема установки представлена на рис. 1. Установка состоит из четырех подающих 1−4 и четырех приемных 5−8 емкостей из полипропилена с химическими реагентами, хроматографической колонки К из полипропилена сечением 0.65 см2, перистальтического насоса PP компании LongerPump BT100-2J с головкой YZ1515X и двух пятиходовых клапанов-переключателей А и B компании Swagelok SS-43ZFS2 с электрическим приводом Swagelok MS-142DCZE. Клапаны изготовлены из нержавеющей стали марки 316 с фторопластовыми уплотнениями. Управление клапанами осуществляется дистанционно.
Рис. 1.
Схема установки для выделения рения из раствора облученной вольфрамовой мишени. А, В − пятиходовые клапаны-переключатели; К – экстракционная колонка с трехходовыми кранами и байпасной трубкой для удаления воздуха; РР − перистальтический насос. 1−4 − емкости для подачи к клапану А: рабочего раствора после растворения W-Re в 3M NaOH, затем – 3М NaOH для элюирования (1), дистиллированной воды (2), 4М HNO3 (3), 8М HNO3 (4); 5−8 − емкости для подачи от клапана В: элюата нанесения с основной массой вольфрама (5), элюата промывки водой (6), фракции с рением (7), сброса отходов (8).

Установка размещена в защитном вытяжном шкафу. Хроматографическая колонка объемом 1 мл заполнена экстракционно-хроматографической смолой TEVA Resin (TE-B25-A 100−150 мкм) компании Трискем. Смола TEVA представляет собой алифатический четвертичный амин Aliquat 336, нанесенный на полимерную смолу Amberchrom CG-71. Смолу в колонке удерживал фильтр из стекловолокна. Расчетная скорость потока растворов через насос составляла 1 мл/мин. При создании установки были рассчитаны объемы подводящих и отводящих трубок. Эти объемы учитывались при проведении разделения и при расчете требуемых объемов каждого элюента. До и после колонки установлены трехходовые краны с байпасной линией для удаления воздуха из коммуникаций перед началом работы.
РЕЗУЛЬТАТЫ ТЕСТИРОВАНИЯ РАБОТЫ УСТАНОВКИ
Для тестирования работы установки использован порошок металлического вольфрама природного изотопного состава, облученный на циклотроне У-150 НИЦ “Курчатовский институт” дейтронами с энергией 28 МэВ. Мишень облучали до достижения интегрального заряда 0.1 мкА ⋅ ч. В качестве индикаторов наличия в растворах вольфрама и рения использовали наработанные в вольфраме радиоизотопы 187W (T1/2 = 23.9 ч) и 181Re (T1/2 = 20 ч). Активности 187W и 181Re определяли на γ-спектрометре фирмы ORTEC с детектором из сверхчистого германия: активность 187W − по γ-линии c Eγ = 686 кэВ, а активность 181Re − по γ-линии c Eγ = 366 кэВ. К извлеченному из облученной мишени порошку металлического вольфрама массой 153 мг осторожно, по каплям, добавляли 1200 мкл 60%-го раствора H2O2 при нагревании до 80°С. В связи с тем, что раствор очень сильно пенится, растворение проводили в стакане большого (100 мл) объема. После окончания реакции и растворения вольфрама к получившемуся раствору осторожно, по каплям, добавляли 1800 мкл 6 М NaOH. При добавлении щелочи раствор окрашивался в желтый цвет, затем становился прозрачным. При растворении еще больших количеств вольфрама после добавления перекиси возможно образование белого осадка, который растворялся после добавления щелочи. Далее раствор выдерживали до полного разложения щелочи и прекращения газообразования, так как пузырьки газа при попадании в колонку замедляют процесс разделения. Выдержка занимала около 1 ч.
Полученный раствор перерабатывали на созданной установке.
Перед началом работы на установке освобождали трассы от воздуха, заполняя их раствором 3 М щелочи минуя колонку. Колонку подготавливали, промывая ее раствором 3 М щелочи (2−3 колоночных объема).
При пропускании рабочего раствора через колонку рений сорбировался на колонке, а вольфрам проходил через нее. Элюировали вольфрам раствором 3 М NaOH до полного удаления его с колонки. Содержание вольфрама в элюате контролировали с помощью γ-спектрометрии. Затем удаляли щелочь, пропуская дистиллированную воду через трассы и колонку. Контроль удаления щелочи осуществляли измерением рН раствора с помощью индикаторной бумаги. Элюировали рений раствором 4 М HNO3. Содержание рения в элюате контролировали с помощью γ-спектрометрии. Затем для полной очистки сорбента колонку промывали сначала раствором 8 М HNO3, после чего − дистиллированной водой и консервировали до следующего эксперимента.
Гамма-спектры от образцов элюата измеряли в одной и той же геометрии по отношению к детектору. Все γ-спектры были проанализированы на наличие характерных γ-линий вольфрама и рения. При обнаружении соответствующих γ-линий в образцах элюата были проведены расчеты активности искомых радионуклидов.
По результатам измерений построены кривые элюирования вольфрама и рения, представленные на рис. 2. По горизонтальной оси на рис. 2 указаны объемы пропущенных через экстракционную колонку растворов: 0−11 мл для раствора 3 М NaOH, 12−26 мл для дистиллированной воды при смене среды, 27−37 мл для раствора 4 М HNO3 и 38−43 мл для раствора 8 М HNO3. Вертикальная шкала соответствует относительному выходу радионуклида − отношению активности радионуклида в отдельной пробе к суммарной активности радионуклида в границах пика элюирования.
Рис. 2.
Результаты элюирования вольфрама и рения в процессе автоматизированной переработки облученной вольфрамовой мишени.
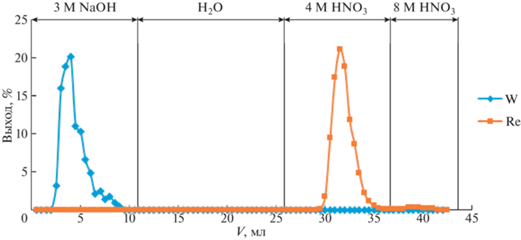
Согласно рис. 2, на созданной лабораторной установке удалось достичь полного разделения вольфрама и рения: γ-линий рения не обнаружено в спектре вольфрамового элюата, соответственно γ-линий вольфрама не обнаружено в спектрах рениевых образцов. Весь вольфрам выходит в первых десяти миллилитрах элюата, основная часть рения выходит в пяти миллилитрах (с 30 по 35 мл) элюата. Ширина пика выхода вольфрама зависит от исходного объема раствора, направляемого на экстракционную колонку. Чем меньше будет объем раствора, тем в меньшем объеме будет выходить вольфрам. Ширина пика выхода рения не зависит от объема исходного раствора. Она обусловлена исключительно коэффициентом удерживания рения на сорбенте в данной среде. Можно предположить, что, даже при значительно больших активностях рения (вплоть до единиц кюри), весь рений будет элюироваться в данном минимальном объеме.
ЗАКЛЮЧЕНИЕ
1. Разработана, изготовлена и протестирована автоматизированная лабораторная установка для хроматографического выделения 186Re без носителя из облученных вольфрамовых мишеней.
2. Подобраны оптимальные режимы элюирования и необходимые объемы растворов для данной установки.
3. Показано, что с помощью разработанной установки можно в рамках одной технологической операции полностью извлекать рений из вольфрамовой мишени с массой несколько сотен миллиграмм.
4. Общее время переработки мишени на созданной лабораторной установке, включая время растворения и время выдержки после растворения, не превышает двух часов.
Список литературы
Lam M.G., de Klerk J.M., van Rijk P.P. // European Journal of Nuclear Medicine and Molecular Imaging. 2004. V. 31. № S1. P. S162. https://doi.org/10.1007/s00259-004-1539-4
Knut L. // World Journal of Nuclear Medicine. 2015. V. 14. P. 10.https://doi.org/10.4103/1450-1147.150509
Kinuya S., Yokoyama K., Izumo M., Sorita T., Obata T., Mori H., Shiba K., Watanabe N., Shuke N., Michigishi T., Tonami N. // Cancer Letters. 2005. V. 219. P. 41. https://doi.org/10.1016/j.canlet.2004.08.033
Khandaker M.U., Uddin M.S., Kim K., Lee M.W., Kim K.S., Lee Y.S., Kim G.N., Cho Y.S., Lee Y.O. // Nucl. Instrum. and Methods in Phys. Research B. 2008. V. 266. P. 1021. https://doi.org/10.1016/j.nimb.2008.02.037
Bonardi M., Groppi F., Persico E., Manenti S., Abbas K., Holzwart U., Simonelli F., Alfassi Z.B. // Radiochim. Acta. 2011. V. 99. P. 1. https://doi.org/10.1524/ract.2011.1789
Khandaker M.U., Nagatsu K., Minegishi K., Wakui T., Zhang Ming-Rong, Otuka N. // Nucl. Instrum. and Methods in Phys. Research B. 2017. V. 403. P. 51. https://doi.org/10.1016/j.nimb.2017.04.087
Zagryadskii V.A., Latushkin S.T., Makoveeva K.A., Malamut T.Yu., Novikov V.I., Ogloblin A.A., Unezhev V.N. // At Energy. 2020. V. 128. P. 162. https://doi.org/10.1007/s10512-020-00668-6
Moustapha M.E., Ehrhardt G.J., Smith C.J., Szajek L.P., Eckelman W.C., Jurisson S.S. // Nucl. Medicine and Biology. 2006. V. 33. Issue 1. P. 81. https://doi.org/10.1016/j.nucmedbio.2005.09.006
Загрядский В.А., Кравец Я.М., Латушкин С.Т., Маламут Т.Ю., Новиков В.И., Рыжков А.В., Удалова Т.А., Унежев В.Н., Чувилин Д.Ю. // ПТЭ. 2021. № 4. С. 125. https://doi.org/10.31857/S0032816221040297
Aliev R.A., Kormazeva E.S., Furkina E.B., Moiseeva A.N., Zagryadskii V.A. // Nanotechnol Russia. 2020. V. 15. P. 428. https://doi.org/10.1134/S1995078020040023
Дополнительные материалы отсутствуют.
Инструменты
Приборы и техника эксперимента


