Прикладная биохимия и микробиология, 2019, T. 55, № 1, стр. 51-55
Оптимизация способа получения 9α-гидрокси-андрост-4-ен-3,17-диона – ключевого интермидиата в синтезе высокоактивных фторированных кортикостероидов из фитостеринов
Н. В. Карпова 1, Т. С. Стыценко 1, В. В. Ядерец 1, В. А. Андрюшина 1, *, В. В. Джавахия 1
1 Институт биоинженерии, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: andryushina@rambler.ru
Поступила в редакцию 13.04.2018
После доработки 16.07.2018
Принята к публикации 25.07.2018
Аннотация
Разработан способ трансформации фитостеринов до 9α-гидрокси-андростендиона с использованием смешанных культур актинобактерий Mycobacterium neoaurum Ac-1634 и Rhodococcus erythropolis Ac-1740 при высоких нагрузках стероидного субстрата. Внесение 9α-гидроксилирующей культуры после первых 70 ч трансформации позволило повысить селективность процесса и исключить применение дорогостоящего и трудно регенерируемого метилциклодекстрина.
В настоящее время самым дешевым и перспективным источником сырья для синтеза фармацевтических стероидов являются фитостерины (ФС). В предыдущей работе [1] был разработан эффективный метод выделения и очистки ФС из побочного продукта производства соевого масла. Также предложены оригинальные способы расщепления боковой цепи стеринов до 17-кетоандростанов: андрост-4-ен-3,17-диона (АД), андроста-1,4-диен-3,17-диона (АДД) и 9α-гидрокси-АД (9α-ОН-АД), которые представляют собой ключевые интермедиаты для получения практически всех стероидных лекарственных препаратов [2–10]. Так, АДД считается идеальным промежуточным продуктом для синтеза эстрогенов, анаболиков и гестагенов 19-норстероидного ряда, АД – синтеза половых гормонов (андрогенов и прегнановых гестагенов) [11–14], а 9α-ОН-АД – наиболее удобным полупродуктом для промышленного получения фторированных кортикоидов нового поколения на основе модифицированной стероидной молекулы, содержащей атомы фтора при С9, С6 и в диоксиацетоновой цепи, таких как триамцинолон, дексаметазон, бетаметазон, флуоцинолон, мометазон и флутиказон с высокой противовоспалительной, антиаллергической, иммунодепрессивной и противошоковой активностью при минимальных побочных эффектах [15–18]. Использование в качестве ключевого полупродукта 9α-ОН-АД обеспечивает наиболее короткий и простой способ получения фторированных аналогов стероидов, так как позволяет за счет легко осуществимой дегидратации 9α-ОН-группы исключить из технологического процесса трудоемкую и неэкономичную стадию микробиологического 11-гидроксилирования.
В настоящее время 9α-ОН-АД получают из стеринов животного и растительного происхождения двумя способами. Первый способ включает двухстадийный процесс получения АД из стеринов методом микробиологической трансформации бактериями рода Mycobacterium [19–21], а затем образовавшийся AД 9α-гидроксилируют бактериальными культурами [4, 7, 8, 20, 22]. Второй – трансформацию стеринов до 9α-ОН-АД мутантными штаммами микроорганизмов с блокированным синтезом 1,2-дегидрогеназы [23–25]. Таким образом, для получения 9α-ОН-АД можно последовательно подвергать стероидную молекулу действию различных микроорганизмов и выделять промежуточные продукты, или изменять эту молекулу последовательной трансформацией микроорганизмами, минуя стадию выделения [26], или проводить процесс со смешанными культурами микроорганизмов. Для последних двух случаев необходимо, чтобы применяемые микроорганизмы-трансформаторы не были антагонистами [27, 28].
Впервые в стероидном синтезе смесь двух микроорганизмов была применена в 1939 г. [27]. При трансформации АД культурами Bacillus putrificus и Saccharomyces cerevisiae восстанавливались обе кетогруппы и двойная связь с образованием 5α-андростан-3β,17β-диола [27]. Действие на АД бактерии Corynebacterium equi и Trichomonas foetis позволяет в одну стадию ввести Δ1-связь и восстановить 17-кетогруппу до 1,2-дегидротестостерона. Также 1,2-дегидротестостерон образовывался (c выходом 60%) при трансформации АД смешанными культурами Fusarium lateritium и Saccharomyces cerevisiae [27]. При трансформации 9α-фторгидрокортизона в Δ1-дегидро-16α-гидрокси-фторгидрокортизон (триамцинолон) использовали метод трансформации со смешанными культурами Arthrobacter simplex и Streptomyces roseochromogenus. Бактериальная культура A. simplex осуществляла реакцию 1,2-дегидрирования, а грибная культура S. roseochromogenus – 16α-гидроксилирования [28].
Проведение микробиологических трансформаций стероидов с использованием смешанных культур позволяет упростить и снизить стоимость технологического процесса, поскольку при этом осутствуют дополнительные стадии выделения и очистки полупродуктов.
Цель работы – усовершенствование метода получения 9α-OH-АД из ФС для использования в промышленном производстве фторированных кортикостероидов.
МЕТОДИКА
Микроорганизмы. В работе были использованы следующие штаммы микроорганизмов: Mycobacterium neoaurum Ac-1634, расщепляющий боковую цепь стеринов животного и растительного происхождения с образованием АД [2], и Rhodococcus erythropolis Ac-1740, выполняющий 9α-гидроксилирование Δ4-3-кетостероидов [4, 29]. Все указанные штаммы депонированы в ВКПМ.
Среды и условия культивирования. Актинобактерии хранили на агаризованных средах приведенного ниже состава. Для M. neoaurum использовали среду I, pH 6.8–7.0, содержащую (г/л) глюкозу – 10.0, соевую муку – 5.0, лимонную кислоту – 2.2, мочевину – 0.5, NH4Cl – 1.0, KH2PO4 – 0.5, M-gSO4 – 0.5, FeSO4 – 0.05 и CaCO3 – 1.5. Для R. erythropolis использовали среду II, рН 6.8–7.2, следующего состава (г/л): глюкоза – 10.0, кукурузный экстракт – 15.0 и К2НРО4 – 1.0.
Биомассу M. neoaurum в возрасте 5–7 сут, полученную смывом со скошенной агаризованной среды, переносили в конические колбы объемом 750 мл со 100 мл среды I и выращивали в течении 90–96 ч на качалке при перемешивании со скоростью 220 об/мин и 28°С. Далее посевной материал M. neoaurum в стерильных условиях концентрировали в 2 раза.
Биомассу R. erythropolis в возрасте 4–5 сут, полученную смывом со скошенной агаризованной среды, переносили также в конические колбы объемом 750 мл со 100 мл среды II и выращивали в течении 70–72 ч на качалке при перемешивании со скоростью 220 об/мин и 28°С.
Полученный инокулят R. erythropolis в количестве 10% (об.) переносили в аналогичные колбы со средой II и выращивали в течение 24 ч в условиях, указанных выше.
Биомассу R. erythropolis для 2 стадии трансформации отстаивали в течение 24 ч при 4–5°С. Затем посевной материал R. erythropolis в стерильных условиях концентрировали в 2 раза.
Культивирование бактерии M. neoaurum для стадии трансформации стеринов в АД осуществляли в аналогичных колбах с отбойником в среде III, рН 7.0–7.2. содержавшей (г/л) глюкозу – 20.0, соевую муку 18%-ной жирности – 20.0, лимонную кислоту – 3.0, мочевину – 0.65, (NH4)2HPO4 – 2.0, MgSO4 – 0.65, FeSO4 – 0.065, CaCO3 – 3.0 и ФС с размером частиц 5–15 мкм – 30.0, рН 7.0–7.2. Раствор глюкозы и посевной материал подавали дробно: 0 ч – 20%, через 48 ч – 10%, 96 ч – 10%.
Концентрированную биомассу R. erythropolis в количестве, соответствующем весу 0.4–0.5 г сухого вещества, переносили в колбы с 100 мл культуральной жидкости, полученной через 70 ч трансформации ФС культурой M. neoaurum.
Оценка количества продуктов трансформации. Количество АД и 9α-ОН-АД в культуральной жидкости оценивали методом ТСХ. Стероиды извлекали экстракцией этилацетатом. Для анализа использовали пластинки Sorbfil (“Imid Ltd”, Россия) и систему бензол–ацетон 3 : 1. Аликвоты культуральной жидкости (1мл) отбирали с интервалом, определяемом целями эксперимента. Экстракцию стероидов из проб осуществляли 4-кратным объемом этилацетата. Разделение стероидных соединений проводили в системе растворителей бензол/ацетон (3 : 1). Количественную оценку продуктов биоконверсии в пробах проводили визуально в УФ-свете на хроматоскопе ХЛ-6 (Россия) сравнением интенсивности поглощения пятен при длине волны 254 нм с пятнами стандартов известной концентрации.
Выделение. Из 200 мл культуральной жидкости 6 г 95%-ного ФС экстрагировали стероиды 3 раза равными объемами этилацетата. Объединенные экстракты осветляли 1 г активированного угля при перемешивании в течение 15 мин. Уголь отфильтровывали, а фильтрат упаривали в вакууме. Полученный остаток обрабатывали 10 мл диэтилового эфира при перемешивании в течение 30 мин. Осадок отфильтровывали, промывали диэтиловым эфиром и сушили. Получено 2.69 г 9α-ОН-АД (выход 64.3% на ФС).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
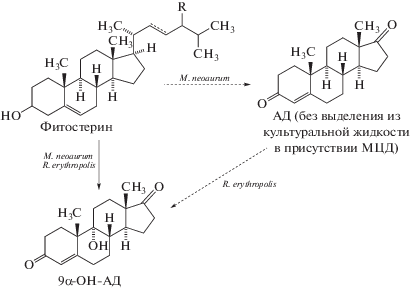
В предыдущей работе [7] был описан разработанный и усовершенствованный метод получения 9α-ОН-АД из ФС при совместном культивировании актинобактерий М. neoaurum и R. erythropolis, при котором трансформация ФС до 9α-ОН-АД смешанными культурами проводилась в две последовательные стадии без выделения из культуральной жидкости образовавшегося на первой стадии АД.
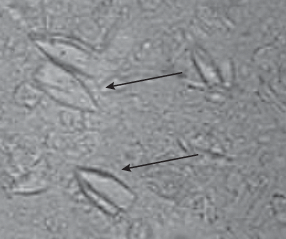
Использование метода смешанных культур позволил упростить и удешевить технологию получения стероидных веществ. Однако, АД, накапливающийся на первом этапе после расщепления боковой цепи ФС с повышенной нагрузкой (30 г/л или выше) в виде крупных кристаллов (рис. 1), многократно превышающих размером бактериальные клетки, становился труднодоступным для дальнейшей трансформации до 9α‑ОН-АД.
Для решения этой проблемы в процессе трансформации ФС использовали метил-β-циклодекстрин (МЦД) в весовом соотношении 1 : 5, который образовывал водорастворимый комплекс включения с АД, образующимся при расщеплении стерина, и далее АД трансформировался в 9α-ОН-АД (рис. 2) [7].
Однако МЦД является дорогостоящим и трудно регинерируемым реагентом, поэтому в дальнейшем были предприняты попытки получить аналогичные по выходу результаты без использования МЦД при такой же нагрузке субстрата.
Для предотвращения процесса укрупнения образующихся кристаллов АД, в значительной степени зависящего от концентрации стероида, 9α‑гидроксилирующую культуру R. еrythropolis вносили на 70 ч трансформации, что соответствовало экспоненциальной фазе роста культуры М. neoaurum и процессу интенсивного накапливания АД (рис. 3а). При достижении его концентрации выше 10 г/л в культуральной жидкости образовывались кристаллические структуры (рис. 1), недоступные для дальнейшего введения гидроксильной группы в 9α-положение стероидной молекулы, катализируемого культурой R. еrythropolis.
Рис. 3.
Динамика накопления АД и потребления глюкозы при трансформации 30 г/л ФС культурой М. neoaurum.
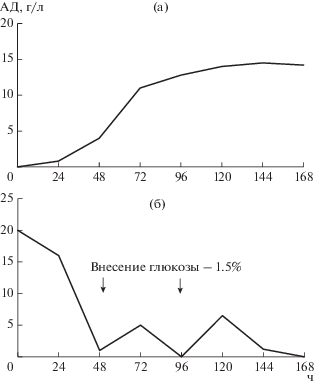
Для интенсификации микробиологических трансформаций применяли дробное внесение инокулята и раствора глюкозы. Как видно на рис. 3б, после 48 и 96 ч проведения процесса биоконверсии запас глюкозы оказывался полностью исчерпанным, поэтому в стерильных условиях вносили растворы глюкозы в количестве 1.5 об.% и инокулята M. neoaurum – 10 об.%.
Таким образом, добавление на 70 ч трансформации бактерии R. erythropolis способствовало тому, что образующийся АД сразу гидроксилировался до 9α-ОН-АД. Время трансформации при нагрузке ФС 30 г/л в отсутствии солюбилизатора составило 168 ч, а выход 9α-ОН-АД – 64–65%.
Помимо снижения стоимости процесса за счeт проведения его без дорогостоящего МЦД, к преимуществу данного метода можно отнести его высокую селективность без образования побочных продуктов, а образующееся в качестве побочного продукта незначительное количество тестостерона гидроксилировалось культурой R. erythropolis с образованием также 9α-ОН-АД [8].
Таким образом, удалось разработать эффективный способ трансформации ФС до 9α-ОН-АД с использованием метода смешанных культур актинобактерий М. neoaurum и R. erythropolis при высоких нагрузках стероидного субстрата.
Работа выполнена при финансовой поддержке Программы Президиума РАН “Разработка новых биотехнологических методов получения высокоактивных фторированных кортикостероидов противоспалительного и антиаллергического действия по совмещенной схеме из фитостеринов через 9α‑гидрокси-АД с использованием в процессе биотрансформации вновь созданных иммобилизованных биокатализаторов” (проект № 1201371077).
Список литературы
Савинова Т.С., Diep N.T., Войшвилло Н.Е., Андрюшина В. А., Карпова Н.В., Белецкая И.П., Luu D. Huy // Хим.-фарм. журн. 2012 Т. 46. № 3. С. 34–38.
Пaтeнт PФ. 2004. № 2231553.
Пaтeнт PФ. 2007. № 2297455.
Пaтeнт PФ. 2009. № 2351645.
Молчанова М.А., Андрюшина В.А., Савинова Т.С., Стыценко Т.С., Родина Н.В., Войшвилло Н.Е. // Биоорг. химия. 2007. Т. 33. № 3. С. 379–384.
Родина Н.В., Молчанова М.А., Войшвилло Н.Е., А-ндрюшина В.А., Стыценко Т.С. // Прикл. биохимия и микробиология. 2008. Т. 44. № 1. С. 56–62.
Андрюшина В.А., Родина Н.В., Стыценко Т.С., Лью Дук Хи, Дружинина А.В., Ядерец В.В., Войшвилло Н.Е. // Прикл. биохимия и микробиология. 2011. Т. 47. № 3. С. 297–301.
Карпова Н.В., Андрюшина В.А., Ядерец В.В., Дружинина А.В., Стыценко Т.С., Шаскольский Б.Л., Л-озинский В.И., Лью Дук Хи, Войшвилло Н.Е. // Прикл. биохимия и микробиология. 2011. Т. 47. № 4. С. 429–435.
Andryushina V.A., Rodina N.V., Stytsenko T.S., Luu Duc H., Voyshvillo N.E. // 3rd Annual World Congress of Industrial Biotechnology. China: Da lian. 2010. P. 21.
Andryushina V.A., Luu Duc Huy, Rodina N.V., Truong Nam Hai, Nguyen Thi Quy, Nguyen Thi Diep, Voyshvillo N.E. // Inter Sci. Conference on Chemistry for Developmernt and Integration. Hanoi.: Full Sci. Report. Hanoi. 2008. P. 191–194.
Пaтeнт PФ. 2001. № 2170740.
Пaтeнт PФ. 2000. № 2156255.
Пaтeнт PФ. 2000. № 2156256 .
Пaтeнт PФ. 2001. № 2163606.
Fernandes P., Cruz A., Angelova B., Pinheiro H.M., Cabral J.M.S. // Enz. Microb. Technol. 2003. V. 32. № 6. P. 688–705.
Kapur J.C., Marx A.F., Verweij J. // Steroids. 1989. V. 54. №1. P. 181–185.
Batist J.N.M., Slobbe A.F.M., Marx A.F. // Steroids. 1989. V. 54. № 2. P. 321–329.
Batist J.N.M., Barendse M.C.M.E., Marx A.F. // Steroids. 1990. V. 55. № 1. P. 109–120.
Malaviya A., Gomes J. // Appl. Biochem. Biotechnol. 2009. V. 158. № 2. P. 374–386.
Haq Nawaz Bhatti, Rasheed Ahmad // Steroids. 2012. V. 77. № 4. P. 1267–1290.
Wang F., Yao K., Wei D. // Appl. Environ. Microbiol. 2010. V. 76. № 13. P. 4578–4582.
Wei Wei, Shuyue Fa, Fengqing Wang, Dongzhi Wei // Appl. Biochem Biotechnol. 2010. V. 162. № 6. P. 1446–1456.
Sukhodolskaya. G.V., Nikolayeva V.M., Khomutov S. M., Donova M.V. // Appl. Microbiol. Biotechnol. 2007. V. 74. № 4. P. 867–873.
Патент США. 1994. № 5298398.
Довбня Д.В., Хомутов С.М., Фокина В.В., Доно-ва М.В. // Журн. физ. химии. 2015. Т. 9. № 6. С. 38–47. (Dovbnya D.V., Khomutov S.M., Fokina V.V., Donova M.V. // Russian J. Physical Chem. В. 2015. V. 9. № 3. P. 436–444.)
Mazumder T.K., Sonomoto K., Tanaka A., Fukui S. // A-ppl. Microbiol. Biotechnol. 1985. V. 21. № 2. P. 154–161.
Ахрем А.А., Титов Ю.А. Стероиды и микроорганизмы. М.: Наука, 1970. 127 с.
Yoshida T. Sueki M., Taguchi H., Kulprecha S., Nilu-bol N. // Eur. J. Appl. Microbiol. Biotechnol. 1981. V. 11. № 1. P. 81–88.
Родина Н.В., Андрюшина В.А., Стыценко Т.С., Турова Т.П., Баслеров Р.В., Пантелеева А.Н., Войшвилло Н.Е. // Прикл. биохимия и микробиология. 2009. Т. 45. № 4. С. 439–445.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология