Прикладная биохимия и микробиология, 2019, T. 55, № 1, стр. 56-63
Бактерии рода Bacillus в регуляции устойчивости пшеницы к обыкновенной злаковой тле Schizaphis graminum Rond.
С. В. Веселова 1, *, Г. Ф. Бурханова 1, С. Д. Румянцев 1, Д. К. Благова 1, И. В. Максимов 1
1 Институт биохимии и генетики Уфимского федерального исследовательского центра РАН
450054 Уфа, Россия
* E-mail: veselova75@rambler.ru
Поступила в редакцию 14.02.2018
После доработки 14.07.2018
Принята к публикации 25.07.2018
Аннотация
Обнаружена способность бактерий Bacillus subtilis Cohn. (штамм 26Д) и Bacillus thuringiensis Berliner (штаммы B-6066 и B-5689) подавлять жизнедеятельность обыкновенной злаковой тли Schizaphis graminum Rond. Защитный эффект изученных штаммов Bacillus spp. проявлялся в прямой афицидной активности и в опосредованной индукции системной устойчивости в растениях посредством регуляции генерации перекиси водорода, активности пероксидазы и каталазы. Анализ накопления транскриптов генов белков защитного ответа НАДФН-оксидазы, ингибиторов протеиназ (PR-6) и пероксидазы (PR-9), показал, что штаммы В. thuringiensis индуцировали гены жасмонат-зависимого, а штамм B. subtilis – салицилат-зависимого сигнальных путей. Обнаружено аддитивное влияние композиции изученных штаммов Bacillus spр. на устойчивость пшеницы к вредителю, что предполагает возможность создания на их основе биопрепарата против злаковой тли.
Среди насекомых-вредителей, наносящих значительный ущерб сельскому хозяйству, на долю отряда Полужесткокрылые (Hemiptera), куда относится обыкновенная злаковая тля (Schizaphis graminum Rond.), приходится очень много экономически важных вредителей [1, 2]. Меры борьбы против тли ограничиваются использованием системных высокотоксичных инсектицидов, а при применении биопрепаратов на основе стимулирующих рост растений бактерий (СРРБ) (PGPB, plant growth promoting bacteria) возникают некоторые трудности, разрешить которые возможно, как предполагается, только посредством использования эндофитных штаммов бактерий, (Bacillus spp., Pseudomonas spp.) [3, 4]. Среди представителей рода Bacillus идентифицировано много эндофитных штаммов [4, 5], обладающих такими свойствами как фунгицидная и стимулирующая рост растений активности [6], синтез антибиотиков и биосурфактантов [6], запуск системной индуцированной устойчивости (СИУ) против патогенов и вредителей [6, 7], а также инсектицидная и афицидная активности [4, 8]. Так, более 80 лет бактерии Bacillus thuringiensis используются как эффективные регуляторы численности насекомых, благодаря синтезу δ-эндотоксинов (Cry и Cyt) [9]. Ряд штаммов этого вида обладает, в том числе, афицидной активностью [10]. Обнаружены штаммы B. thuringiensis, запускающие в растениях СИУ к патогенам [11] и характеризующиеся определенной степенью эндофитности [12]. Однако вопрос о механизмах и метаболических путях этой индукции остается пока открытым. Вместе с тем, у ряда широко известных активаторов устойчивости растений к патогенам штаммов бактерий B. subtilis обнаружены инсектицидная активность и способность к усилению устойчивости растений к вредителям [8, 13], но такие работы немногочисленны.
Разработка биопрепаратов на основе СРРБ нацелена на комплексную защиту растений от широкого спектра патогенов и вредителей [5, 6], заключающуюся в прямом, непосредственном биоцидном воздействии бактерий, а также в их способности опосредованно усиливать рост растений и индуцировать системную устойчивость [5, 6]. Поскольку штаммы, используемые в качестве действующего начала биопрепаратов, характеризуются высокой специализацией, задача по комплексной защите растений от патогенов и вредителей эффективно решается путем создания композиций из различных штаммов или видов микроорганизмов [14]. Вместе с тем, механизмы аддитивного защитного действия композиций СРРБ на устойчивость растений до конца не раскрыты, но предполагается, что решающее значение в этом может иметь независимая индукция различных гормональных сигнальных путей в растениях [14]. Известно, что системно приобретенная устойчивость (СПУ) развивается по салицилат (СК)-зависимому пути и направлена против биотрофных и гемибиотрофных патогенов. СИУ, запускаемая СРРБ, развивается по жасмонат (ЖАК)/этилен-зависимому пути и направлена против некротрофов и вредителей, причем ЖАК-сигнальный путь считается основным в защите растений против насекомых-вредителей [6, 14]. Ранее было показано [3], что композиция трех штаммов рода Bacillus, аддитивно индуцировала как СК-, так и ЖАК-зависимые гены защитного ответа, формирующие устойчивость растений пшеницы к гемибиотрофному патогену Septoria nodorum Berk.
Цель работы − изучение формирования механизмов устойчивости растений пшеницы к обыкновенной злаковой тле Schizaphis graminum под влиянием штаммов B. subtilis 26Д, B. thuringiensis B-6066 и B-5689 и их композиции.
МЕТОДИКА
Объекты исследования. Обыкновенную злаковую тлю (Schizaphis graminum Rond.) для экспериментов размножали на молодых проростках мягкой яровой пшеницы (Triticum aestivum L.) сорта Салават Юлаев (селекция Башкирского государственного аграрного университета, Россия), выращенных в изолированных сосудах с прогретой при 180°С почвой в климатической камере КС‑200 СПУ (“Смоленский СКТБ СПУ”, Россия) с 16-часовым световым периодом при температуре 20/24°С (ночь/день), интенсивность света 146 Вт/м2 (лампы Osram L 36W/77, Германия). Семена пшеницы предоставлены авторами сорта В.А. Зыкиним и Р.К. Кадиковым.
В экспериментах использовали штаммы B. thuringiensis (B-6066) и B. thuringiensis (B-5689), полученные из Всероссийской коллекции промышленных микроорганизмов (ВКПМ), а также штамм B. subtilis 26Д, выделенный из коммерческого биопрепарата Фитоспорин–М (“Башинком”, Россия). Штаммы выращивали на среде Луриа–Бертани (%, бактотриптон – 1.0, дрожжевой экстракт – 0.5, NaCl – 0.5) в ротационном инкубаторе при 200 об./мин и 28°С в течение 72 ч до полной споруляции. Семена пшеницы сорта Салават Юлаев перед посадкой обрабатывали суспензией клеток бактерий полусухим способом из расчета 20 мкл суспензии с конечным титром 108 кл./мл на 1 г семян. Варианты опыта включали обработку семян каждым штаммом в отдельности и в композиции. Соотношение бактерий в композиции было подобрано заранее, как описано в работе [15].
Для экспериментов семисуточные проростки пшеницы, выращенные в климатической камере КС-200 СПУ (“Смоленский СКТБ СПУ”, Россия) в условиях размножения обыкновенной злаковой тли, в изолированных пластиковых сосудах емкостью 1 л по 50–70 растений в 400 мл 10%-ного раствора Хогланда–Арнона на плотиках, обернутых стерильной фильтровальной бумагой, заселялись тлями. Для этого одинаковое количество тлей разных возрастов стряхивали в каждый сосуд с растениями так, чтобы нагрузка на одно растение составляла 10 особей тли [16]. Во избежание миграции тлей сосуды накрывались пластиковыми изоляторами, затянутыми пористым нетканым материалом.
Тест на антибиоз. В изолированных сосудах объемом 500 мл в 100 мл 10%-ного раствора Хогланда–Арнона на пластиковом плотике, обернутом стерильной фильтровальной бумагой, выращивалось по 5 растений одного варианта опыта в условиях, описанных для размножения обыкновенной злаковой тли. На трехсуточные всходы под изоляторы подсаживали личинок первого возраста из расчета 1 особь на растение. Через 28 сут подсчитывали абсолютное количество живых тлей, а также число погибших взрослых особей и личинок [16]. Коэффициент размножения рассчитывали по формуле: K = средняя плодовитость самки за время опыта/продолжительность опыта в днях [16]. Плодовитость и смертность выражали в % от общего количества тлей.
Тест на афицидность бактериальных штаммов. Отрезанные первые листья 7-суточных проростков пшеницы помещали в стеклянные пробирки на 50 мл с 5 мл бактериальной суспензии исследуемого штамма в концентрации 107 спор/мл. Контрольные пробирки содержали 5 мл стерильной воды. На каждый лист подсаживали по 10 бескрылых самок, пробирку закрывали ватной пробкой и помещали в условия, описанные для размножения обыкновенной злаковой тли. Через 5 сут в пробирках подсчитывали количество мертвых и живых тлей. Афицидность бактериального штамма по отношению к злаковой тле выражали в % смертности от общего числа тлей [12]. Коэффициент размножения при прямом воздействии бактериальной суспензии рассчитывали, как описано выше [16].
Тест на выносливость растений. Растения пшеницы исследуемых вариантов выращивали индивидуально в изолированных пластиковых сосудах объемом 500 мл в 100 мл 10%-ного раствора Хогланда–Арнона на пластиковом плотике, обернутом стерильной фильтровальной бумагой, в условиях описанных выше. В возрасте 3 сут измеряли длину проростков от уровня плотика до кончика листа, а затем каждое растение заселяли 20 бескрылыми самками и изолировали. Постоянную численность тлей поддерживали путем удаления через каждые 48 ч отрождающихся личинок в течение двух недель. В конце эксперимента проводили повторное измерение высоты первого и второго листьев растений незаселенных и заселенных тлями, результаты сравнивали с первоначальным измерением [16].
Биохимические параметры. Измерение генерации пероксида водорода (Н2О2) и активности ферментов пероксидазы (КФ 1.11.1.7) и каталазы (КФ 1.11.1.6) через 48 и 72 ч после заселения проростков пшеницы S. graminum проводили, как описано ранее [17].
Транскрипционная активность генов. Выделение тотальной РНК из контрольных и опытных растений пшеницы проводили с использованием реагента “Trizol” согласно протоколу фирмы-поставщика (“Sigma”, Германия) из листьев пшеницы, зафиксированных в жидком азоте, через 48 и 72 ч после заселения тлями. Концентрацию нуклеиновых кислот измеряли при А260/A280 на спектрофотометре Smart Spec Plus (“Bio-Rad”, США). Для синтеза кДНК проводили реакцию обратной транскрипции с использованием M-MuLV обратной транскриптазы (“Синтол”, Россия).
Анализ экспрессии генов PR-белков проводили методом количественной ПЦР в режиме реального времени на приборе “iCycler iQ5 Real-Time PCR Detection System” (“BioRad”, США) с использованием интеркалирующего красителя SYBR Green I (“Синтол”, Россия). Изменения в экспрессии интересующего гена определяли на основании вычисления уровня нормализованной экспрессии генов c помощью программного обеспечения “iCycler iQ5 Real-Time Detection System software” (“BioRad”, США). Использованные в работе гены приведены в табл. 1.
Статическая обработка. Все эксперименты повторяли 3 раза и проводили в 3 биологических и 3 аналитических повторностях (общее n = 9), кроме тестов на антибиоз и выносливость, где эксперименты включали в себя не менее 10 биологических повторов (общее n = 30). На рис. и в табл. приведены средние арифметические значения и их доверительные интервалы, рассчитанные по стандартным ошибкам.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В последние годы возрос интерес к СРРБ как альтернативе химических инсектицидов и удобрений [4, 7, 14]. Однако эффективность действия биопрепаратов на основе СРРБ зависит от многих факторов, решающим из которых может оказаться эндофитность, особенно в случае борьбы с тлями. Если по отношению к ряду штаммов B. subtilis эндофитность доказана [5], то в отношении B. thuringiensis сведения такого рода ограничены. Так, показано, что выделенные из растений хлопчатника эндофитные штаммы бактерий B. thuringiensis циркулировали по флоэме, попадали в кишечник насекомых и действовали на них напрямую [23]. Изученные в данной работе бактериальные штаммы B. subtilis 26Д и B. thuringiensis (B-5689 и B-6066) обладали свойством эндофитности, что было показано нами ранее в работе [3].
В настоящей работе исследована способность бактериальных штаммов B. subtilis 26Д и B. thuringiensis (B-5689 и B-6066) и их композиции влиять на жизнеспособность обыкновенной злаковой тли напрямую и опосредованно через растение. Тест на антибиоз показал, что плодовитость тлей, кормившихся на растениях пшеницы, обработанных клетками бактериальных штаммов B. subtilis 26Д и B. thuringiensis (B-5689 и B-6066) и их композицией, уменьшалась на 12–27%, а смертность, соответственно, увеличивалась (табл. 2). Как и ожидалось, воздействие штаммов B. thuringiensis (B-5689 и B-6066) на эти показатели было сильнее, чем штамма B. subtilis 26Д, а наилучший результат среди вариантов эксперимента показала композиция трех штаммов (табл. 2). Все использованные штаммы бацилл проявили афицидность по отношению к злаковой тле S. graminum, но в разной степени (табл. 2). Наибольшую афицидность к вредителю проявил штамм B. thuringiensis В-6066, вызывая смертность более 50% особей в популяции (табл. 2). Такие же результаты показала композиция трех штаммов и кроме того бактерии отрицательно влияли на коэффициент размножения вредителя (табл. 2). Предпосевная обработка семян пшеницы уменьшала коэффициент размножения тлей примерно в 2 раза, тогда как прямое воздействие суспензии бактериальных штаммов B. thuringiensis (В-5689 и В-6066) и смеси трех штаммов приводило к полному прекращению размножения вредителя (табл. 2). Вместе с тем, хотя при прямом действии штамма B. subtilis 26Д коэффициент размножения тлей снижался почти в 3 раза, часть насекомых продолжала свою жизнедеятельность (табл. 2).
Таблица 2.
Показатели выживаемости и размножения злаковой тли S. graminum под влиянием бактерий рода Bacillus и афицидность изученных штаммов Bacillus spp.
| Показатели | Вариант обработки бактериями | S. graminum | ||||
|---|---|---|---|---|---|---|
| вода | B. subtilis 26 Д | B. thuringiensis B-6066 | B. thuringiensis B-5689 | Композиция штаммов | ||
| Плодовитость, % | Предпосевная обработка семян | 87.8 ± 1.9 | 75.5 ± 2.2 | 63.7 ± 3.5 | 66.9 ± 5.2 | 60.5 ± 4.9 |
| Смертность, % | 12.2 ± 1.9 | 24.5 ± 2.2 | 36.3 ± 3.5 | 33.1 ± 5.2 | 39.5 ± 4.9 | |
| Коэффициент размножения тлей | 2.46 | 1.28 | 1.04 | 1.78 | 1.13 | |
| Коэффициент размножения тлей | Прямое влияние бактериальной суспензии | 2.33 | 0.73 | 0 | 0 | 0 |
| Афицидность штамма, % |
– | 33.8 ± 7.2 | 56.6 ± 4.5 | 43.3 ± 9.8 | 52.8 ± 6.2 | |
Известно отрицательное влияние бактерий B. thuringiensis, эффективных биоинсектицидов, на выживаемость насекомых, в том числе на тлей [4], связанное с выработкой этими бактериями δ-эндотоксинов (Cry и Cyt) [24]. Несмотря на то, что токсины Cry и Cyt активны против широкого спектра вредителей [4], относительно недавно были обнаружены специфичные именно для Hemiptera δ-эндотоксины и была показана их афицидность [24], которая редко достигала 100%, как это наблюдали по отношению к насекомым из семейств Lepidoptera и Coleoptera [24]. Смертность гороховой тли Acyrthosiphon pisum при действии токсина Cry1Aс составила около 70%, при действии Cry1Ab – 40%, а при действии Cry3A – 60% [10]. Кроме того, в последнее время появляются работы, в которых показано, что другие представители рода Bacillus (B. velezensis, B. amyloliquefaciens, B. solisalsi, B. pumilis, B. subtilis) могут эффективно сдерживать развитие вредителей на растениях и механизмы этого явления могут быть различными [25, 26], в том числе за счет продукции биосурфактантов [8]. Известно, что бактериальный штамм B. subtilis 26Д является эффективным продуцентом сурфактина [27]. Таким образом, прямое воздействие бактериальных штаммов B. subtilis 26Д и B. thuringiensis (B-5689 и B-6066) и их композиции на показатели жизнеспособности обыкновенной злаковой тли могло быть связано с выработкой токсинов Cry и Cyt и продукцией биосурфактантов.
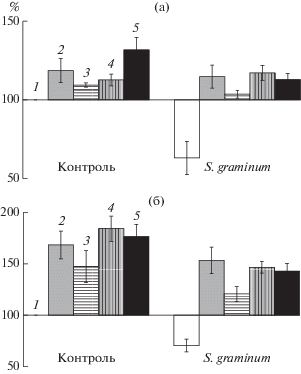
Опосредованное влияние СРРБ на показатели жизнедеятельности вредителей может выражаться в ростстимулирующем эффекте данных бактерий, приводящем к повышению выносливости растений к тлям [7]. Выносливость или толерантность растений к насекомым, питающимся флоэмным соком, заключается в быстроте восстановления фотосинтетической активности и ростовых процессов [2]. В наших экспериментах установлена низкая выносливость растений пшеницы по отношению к S. graminum, проявлявшаяся в торможении роста 1 и 2 листьев в течение всего эксперимента (рис. 1а, 1б). Обработка растений клетками бактериальных штаммов B. subtilis 26Д и B. thuringiensis (B-5689 и B-6066) и их композицией ускоряла рост 1 и 2 листьев пшеницы, как в норме, так и при заселении тлей (рис. 1). Стимулируя рост растений за счет известных механизмов – продукции метаболитов гормональной природы, способствующих росту и увеличению скорости фотосинтеза, повышения доступности воды и элементов минерального питания – СРРБ, вероятно, компенсируют потери при кормлении злаковой тли и формируют определенную степень толерантности растений к вредителю [2, 5, 7].
Рис. 1.
Влияние бактерий рода Bacillus на прирост первого (а) и второго (б) листьев растений пшеницы, заселенных злаковой тлей S. graminum: 1 –контроль, 2 – B. subtilis 26Д, 3 – В. thuringiensis B-6066, 4 – В. thuringiensis B-5689, 5 – композиция трех штаммов. Наблюдения проводили в течение 21 сут после заселения растений вредителем.
Другой механизм, способствующий формированию устойчивости растений пшеницы к обыкновенной злаковой тле, может быть связан с опосредованной индукцией штаммами бацилл СИУ против вредителя [4, 7, 14]. Защитные реакции при развитии СИУ, индуцированной СРРБ, характеризовались ранним накоплением активных форм кислорода (АФК), в том числе Н2О2, отложением каллозы, повышением пероксидазной активности в апопласте, укреплением клеточных стенок растений и продукцией различных метаболитов [13, 14, 25, 26]. С одной стороны, индуцированная СРРБ генерация АФК в инфицированных растениях, могла играть критическую роль при формировании СИУ [5]. С другой стороны, редокс-статус растения, заселенного тлей, является одним из важных показателей толерантности сорта [1, 2, 28], а окислительный взрыв в месте инфицирования тлей считается типичной реакцией формирования устойчивости растения к вредителю [29]. Так, на растениях ячменя, заселенных ячменной тлей Diuraphis noxia, и на растениях арабидопсиса, заселенных персиковой тлей Myzus persicae, окислительный взрыв был обнаружен только у устойчивых, а не у восприимчивых форм растений [28]. Защитная роль повышенной генерации Н2О2 в растениях в ответ на заселение тлями может заключаться: в прямом повреждающем действии высоких концентраций Н2О2 на тлей, приводящим к подавлению выживаемости вредителя [26, 28]; в опосредованном действии Н2О2 через регуляцию работы ферментов про-/антиоксидантной системы и синтеза токсических соединений, в том числе лигнина [1, 2]; в сигнальной функции Н2О2, запускающей СИУ [7, 14].
Изучение редокс-статуса растений пшеницы в наших экспериментах показало, что заселение контрольных растений пшеницы тлями приводило к уменьшению содержания Н2О2 на начальных этапах инфицирования (рис. 2а) и сопровождалось высокой плодовитостью тлей (табл. 2) и низкой выносливостью растений (рис. 1). Предпосевная обработка семян пшеницы штаммами B. subtilis 26Д и B. thuringiensis (B-5689 и B-6066) и их композицией приводила к резкому накоплению Н2О2 в листьях пшеницы, заселенных S. graminum (рис. 2а), что, возможно, обусловливало устойчивость таких растений к вредителю. Так, недавно было показано, что бактериальный штамм Bacillus velezensis YC7010 формировал устойчивость растений арабидопсиса к персиковой тле M. persicae посредством накопления Н2О2 в обработанных бактерией растениях [26].
Рис. 2.
Влияние бактерий рода Bacillus на генерацию Н2О2 (а), активность пероксидазы (б) и каталазы (в) в листьях растений пшеницы, заселенных злаковой тлей S. graminum: 1 – контроль, 2 – B. subtilis 26Д, 3 – В. thuringiensis B-6066, 4 – В. thuringiensis B-5689, – композиция трех штаммов.
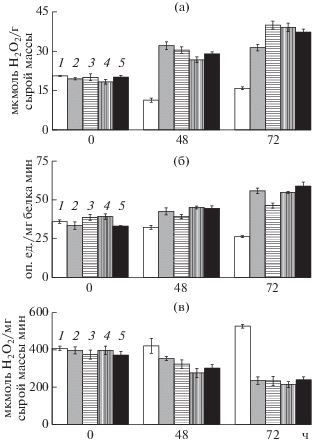
Показано, что повышенная генерация Н2О2 у иммунизированных и устойчивых фенотипов растений, заселенных тлей, приводила к изменению активности ряда про-/антиоксидантных ферментов [1, 30]. Причем эти изменения сохраняли гомеостаз между генерацией и утилизацией АФК, обеспечивающий как защитный ответ, так и высокую скорость фотосинтеза для компенсации потерь питательных веществ при питании насекомых флоэмным соком, то есть формировали выносливость растений к вредителю [2, 30]. Активация апопластных пероксидаз на фоне высокого содержания Н2О2 приводила к реорганизации и укреплению клеточных стенок растений за счет лигнификации, а также синтезу токсичных фенольных соединений, что может играть решающую роль в развитии устойчивости растений к тлям за счет детоксикации больших количеств АФК и ухудшения условий питания насекомых соответственно [1, 2]. Точно также, низкая активность каталазы у заселенных тлями устойчивых фенотипов злаков [30] и подавление транскрипционной активности гена каталазы у устойчивого генотипа арабидопсиса, инфицированного персиковой тлей M. persicae [28], способствовало окислительному взрыву и развитию устойчивости. Напротив, сдвиг баланса в сторону антиоксидантов и поддержание их высокого уровня связывают с ослаблением защиты против тлей и чаще наблюдают у восприимчивых фенотипов [1, 28, 30]. Так повышенную активность антиоксидантного фермента каталазы связывают с направленным уменьшением окислительного взрыва в растениях, что способствует поддержанию благоприятных условий для жизнедеятельности тлей [28].
В наших экспериментах у восприимчивых к S. graminum растений пшеницы на фоне уменьшения содержания Н2О2 обнаружено снижение активности пероксидаз (рис. 2б) и повышение активности каталаз (рис. 2в), что могло быть причиной ослабления устойчивости данных растений к тле. Напротив, растения, предварительно обработанные бактериальными штаммами B. subtilis 26Д и B. thuringiensis (B-5689 и B-6066) и их смесью, и затем инфицированные злаковой тлей S. graminum, отличались высоким уровнем генерации Н2О2 (рис. 2а), повышенной активностью пероксидаз через 72 ч после начала кормления тлей (рис. 2б) и низкой активностью каталаз в течение всего эксперимента (рис. 2в), что можно связать с формированием устойчивости таких растений к S. graminum. Подобные изменения генерации Н2О2, активности пероксидаз и каталаз в растениях под воздействием штаммов B. subtilis и В. thuringiensis ранее наблюдали при грибном и бактериальном патогенезах [31, 32]. В настоящей работе впервые показана способность штаммов B. subtilis 26Д и В. thuringiensis (B-5689 и B-6066) индуцировать устойчивость растений пшеницы к злаковой тле, влияя на редокс-статус растений, в частности, регулируя активности пероксидазы и каталазы. Особый интерес представляет тот факт, что изученные нами штаммы B. subtilis 26Д и В. thuringiensis (B-5689 и B-6066) аддитивно влияли на активность этих ферментов в композиции.
Кроме того, АФК, в особенности молекула Н2О2, при защите растений от тли выполняют также сигнальную функцию, активируя и регулируя гормональные сигнальные пути при развитии СИУ [1, 33]. Показано, что заселение тлями запускало в растениях как ЖАК/этилен-, так и СК-зависимые защитные ответы [1, 7]. Первым фактором, индуцирующим защитный ответ растений на инфицирование тлями, является механическое повреждение, которое, как полагают, запускает ЖАК-зависимую активацию липоксигеназ и ингибиторов протеиназ [1]. Затем растение реагирует на химические детерминанты, содержащиеся в слюне тлей, и приводит в действие защитный ответ схожий с устойчивостью к биотрофным патогенам, при этом активируется СК-зависимый сигнальный каскад [1]. Кроме того, многочисленные исследования показывают, что включение СК-сигнального пути может быть общим механизмом антибиоза и отпугивания тлей у устойчивых форм растений [1].
Защита растений от вредителей с помощью СРРБ широко изучается [7, 14, 25]. Однако механизмам активации СИУ, опосредованной СРРБ против тлей, особенно бактериям рода Bacillus, посвящено мало работ, где показано, что бактерии в растениях могут индуцировать как ЖАК-зависимые, так и ЖАК-независимые защитные пути [13].
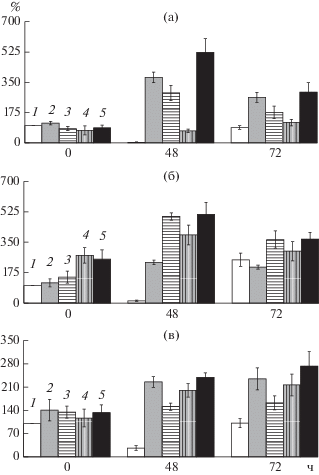
Для определения способности бактерий B. subtilis и В. thuringiensis регулировать СИУ в растениях пшеницы против обыкновенной злаковой тли S. graminum была изучена экспрессия генов, кодирующих PR-белки, маркеры и регуляторы СК- и ЖАК-сигнальных путей. Из изученных нами генов защитных белков ген TaRboh, кодирующий фермент НАДФН-оксидазу, регулировался СК-зависимым сигнальным каскадом [34]. С помощью мутантных растений арабидопсиса, лишенных гена RbohD было показано, что НАДФН-оксидаза играла ключевую роль в генерации АФК при повреждении растений тлями [33]. Ген PR-6, кодирующий ингибиторы протеиназ, регулировался ЖАК-зависимым сигнальным каскадом [34], а ген PR-9, кодирующий анионную пероксидазу, индуцировался как при развитии ЖАК-зависимых, так и СК-зависимых защитных реакций [34, 35]. Как видно из рис. 3, в проростках пшеницы через 48 ч после заселения тлей содержание транскриптов трех изученных генов резко уменьшалось (рис. 3). Через 72 ч после начала эксперимента наблюдали накопление мРНК только гена PR-6 (рис. 3б), а содержание транскриптов генов TaRboh и PR-9 выше контрольных значений не поднималось (рис. 3а, в). Такие результаты могут свидетельствовать об отключении под влиянием злаковых тлей системной устойчивости, особенно по СК-зависимому сигнальному пути. Обработка растений штаммами B. subtilis 26Д и В. thuringiensis (B-5689 и B-6066) и их композицией увеличивала содержание транскриптов всех изученных генов (рис. 3). Транскрипция маркерного гена СК-сигнального пути TaRboh сильнее активировалась при обработке штаммом B. subtilis 26Д (рис. 3а), тогда как транскрипция маркерного гена ЖАК-сигнального пути PR-6 при обработке штаммами В. thuringiensis (B-5689 и B-6066) (рис. 3б). Содержание мРНК гена анионной пероксидазы PR-9 было высоким при обработке растений всеми изученными штаммами (рис. 3в). Сходные результаты были получены ранее на растениях пшеницы инфицированных патогеном S. nodorum [3]. Интересно, что штамм В. thuringiensis B-6066 оказался способен транзиторно активировать транскрипцию гена TaRboh (СК-путь), а штамм B. subtilis 26Д - накапливать транскрипты гена PR-6, кодирующего ингибиторы протеиназ (ЖАК-путь) (рис. 3). Причем, максимальное накопление мРНК всех изученных генов (TaRboh, PR-6, PR-9) обнаружено в заселенных тлями растениях, обработанных композицией трех штаммов (рис. 3). Полученные результаты говорят об индукции СИУ под влиянием консорциума штаммов как по СК-, так и по ЖАК-зависимым сигнальным путям, проявлении аддитивного эффекта и согласуются с данными литературы о значительном повышении устойчивости растений к патогенам и вредителям при использовании композиции бактериальных штаммов, индуцирующих различные сигнальные пути [14].
Рис. 3.
Влияние бактерий рода Bacillus на содержание транскриптов генов защитных PR-белков (мРНК, % от контроля): НАДФН-оксидазы (а), PR-6 (ингибиторов протеиназ, (б) и PR-9 (анионной пероксидазы, (в) в листьях растений пшеницы, заселенных злаковой тлей S. graminum: 1 – контроль, 2 – B. subtilis 26Д, 3 – В. thuringiensis B-6066, 4 – В. thuringiensis B-5689, 5 – композиция трех штаммов.
Таким образом, созданная нами композиция бактериальных штаммов оказывала как прямое, так и опосредованное через растение воздействие на жизнеспособность обыкновенной злаковой тли S. graminum. Причем, наибольшую стимулирующую рост растений активность показали штаммы B. subtilis 26Д и В. thuringiensis B-5689, тогда как штамм В. thuringiensis B-6066 проявил наибольшую афицидность. Штаммы В. thuringiensis (B-5689 и B-6066) индуцировали гены ЖАК-зависимого защитного пути, а штамм B. subtilis 26Д индуцировал гены СК-зависимого защитного пути. Изученные штаммы не вызывали антагонистического интерферирующего эффекта при индукции защитных систем растений пшеницы, а напротив, проявляли аддитивный эффект. Защитные реакции в инфицированных растениях, опосредованные изученными бактериальными штаммами, развивались с участием компонентов про-/антиоксидантной системы, регулирующей редокс-статус растений, что показано нами впервые. Полученные данные предполагают возможность создания на основе штаммов бактерий рода Bacillus sрp. эффективного биопрепарата с комплексной защитой не только против гемибиотрофных патогенов [3], но и злаковой тли.
Работа выполнена в рамках госзадания по теме № 116020350027-7 (2016–2017), а также финансовой поддержке Министерства образования и науки РФ (соглашение № 14.604.21.0016, RFMEFI60414X0016) (2014-2015) и РФФИ в рамках научного проекта № 17-29-08014 с использованием оборудования ЦКП “Биомика” (Отделение биохимических методов исследований и нанобиотехнологии РЦКП “Агидель”) и УНУ “КОДИНК”.
Список литературы
Morkunas I., Mai V.C., Gabrys B. // Acta Physiol. Plant. 2011. V. 33. № 6. P. 2057–2073.
Koch K.G., Chapman K., Louis J., Heng-Moss T., Sa-rath G. // Front. Plant Sci. 2016. V. 7:1363.
Бурханова Г.Ф., Веселова С.В., Сорокань А.В., Благова Д.К., Нужная Т.В., Максимов И.В. // Прикл. биохимия и микробиология. 2017. Т. 53. № 3. С. 308–315. doi 10.7868/S0555109917030047
Araújo E.O. // Afr. J. Plant Sci. 2015. V. 9. № 9. P. 368–373.
Максимов И.В., Веселова С.В., Нужная Т.В., Сарварова Е.Р., Хайруллин Р.М. // Физиология растений. 2015. Т. 62. № 6. С. 763–775.
Pieterse C.M., Zamioudis C., Berendsen R.L., Weller D.M., van Wees S.C., Bakker P.A. // Annu. Rev. Phytopathol. 2014. V. 52. P. 347–375.
Rashid M.H., Chung Y.R. // Front. Plant Sci. 2017. V. 8:1816. doi 10.3389/fpls.2017.01816
Yang S.Y., Lim D.J., Noh M.Y., Kim J.C., Kim Y.C., Kim I.S. // Entomological Research. 2017. V. 47. № 1. P. 55–59. doi 10.1111/1748-5967.12200
Roh J.Y., Choi J.Y., Li M.S., Jin B.R., Je Y.H. // J. Microbiol. Biotechnol. 2007. V. 17. № 4. P. 547–559.
Porcar M., Grenier A.M., Federici B., Rahbe Y. // Appl. Environ. Microbiol. 2009. V. 75. 14. P. 4897–4900.
Hyakumachi M., Nishimura M., Arakawaa T., Asano Sh., Yoshida Sh., Tsushima S., Takahashi H. // Microbes Environ. 2013. V. 28. № 1. P. 128–134.
Melatti V.M., Praça L.B., Martins E.S., Sujii E., Berry C., Monnerat R.G. // BioAssay. 2010. V. 5. P. 1–4.
Valenzuela-Soto J.H., Estrada-Hernández M.G., Ibarra-Laclette E., Délano-Frier J.P. // Planta. 2010. V. 231. P. 397–410. doi 10.1007/s00425-009-1061-9
Pangesti N., Pineda A., Pieterse C.M., Dicke M., van Loon J.J. // Front. Plant Sci. 2013. V. 4:414. doi 10.3389/fpls.2013.00414
Пaтeнт PФ, 2018. № 265469.
Радченко Е.Е. // Злаковые тли. В кн.: Изучение генетических ресурсов зерновых культур по устойчивости к вредным организмам. Методическое пособие. М.: Россельхозакадемия, 2008. С. 214–257.
Веселова С.В., Бурханова Г.Ф., Нужная Т.В., Максимов И.В. // Физиология растений. 2016. Т. 63. № 5. С. 649–660.
Giovanini M.P., Puthoff D.P., Nemacheck J.A., Mittapalli O., Saltzmann K.D., Ohm H.W., Shukle R.H., Williams C.E. // Mol. Plant Microbe Interact. 2006. V. 19. № 9. P. 1023-33.
Adhikari T.B., Balaji B., Breeden J.D., Goodwin S.B. // Physiological and Molecular Plant Pathology. 2007. V. 71. P. 56–68.
Бурханова Г.Ф., Яруллина Л.Г., Максимов И.В. // Физиология растений. 2007. Т. 54. № 1. С. 104–110.
Giménez M.J., Pistón F., Atienza S.G. // Planta. 2011. V. 233. P. 163–173.
Zimmerman C., Klein K.C., Kiser P.K., Singh A.R., Firestein B.L., Riba S.C., Lingappa J.R. // Nature. 2002. V. 415. № 6867. P. 88–92.
Monerrat R.G., Soares C.M., Capdeville G., Jones G., Soares M.E., Praça L., Cordeiro B.A., Braz S.V., Dos Santos R.C., Berry C. // Microbial. Biotechnol. 2009. V. 2. P. 512–520.
Chougule N.P., Bonning B.C. // Toxins. 2012. V. 4. P. 405–429.
Zebelo S., Song Y., Kloepper J.W., Fadamiro H. // Plant, Cell and Environment. 2016. V. 39. P. 935–943.
Rashid M.H., Khan A., Hossain M.T., Chung Y.R. // Front. Plant Sci. 2017. V. 8:211. doi 10.3389/fpls.2017.00211
Бурханова Г.Ф., Черепанова Е.А., Благова Д.К., Максимов И.В. // Растения и микроорганизмы: биотехнология будущего. Материалы межд. научн. конф. PLAMIC 2018, Уфа. 2018. С. 15.
Lei J., Zhu-Salzman K. // Plant Signaling & Behavior. 2015. V. 10. № 4: e1010936
Moloi M.J., van der Westhuizen A.J. // J. Plant Physiol. 2006. № 11. V. 163. P. 1118–1125.
Zhu-Salzman K., Salzman R.A., Ahn J.-E., Koiwa H. // Plant Physiol. 2004. V. 134. P. 420–431.
Ahn I.P., Lee S.W., Kim M.G., Park S.R., Hwang D.J., Ba S.C. // Mol. Cells. 2011. V. 32. P. 7–14.
Veselova S.V., Nuzhnaya T.V., Maksimov I.V. // Jasmonic Acid: Biosynthesis, Functions and Role in Plant Development. Ch. 3. / Ed. L. Morrison. N.Y.: Nova Sci. Publ., 2015. P. 33–66.
Kerchev P.I., Fenton B., Foyer C.H., Hancock R.D. // Plant, Cell and Environment. 2012. V. 35. P. 441–453.
Van Loon L.C., Rep M., Pieterse C.M. // Annual Rev. Phytopathol. 2006. V. 44. P. 135–162.
Almagro L., Gomez Ros L.V., Belchi-Navarro S., Bru R., Ros Barcello A., Pedreno M.A. // J. Exp. Botany. 2009. V. 60. P. 377–390.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


