Прикладная биохимия и микробиология, 2019, T. 55, № 1, стр. 98-102
Применение пероксидной обработки для идентификации бактерий по спектрам гигантского комбинационного рассеяния
Д. С. Копицын 1, М. В. Горбачевский 1, Е. А. Бочкова 1, М. А. Быченко 1, А. А. Новиков 1, *
1 Российский государственный университет нефти и газа (национальный исследовательский университет)
им. И.М. Губкина
119991 Москва, Россия
* E-mail: novikov.a@gubkin.ru
Поступила в редакцию 16.04.2018
После доработки 19.07.2018
Принята к публикации 25.07.2018
Аннотация
Спектроскопия гигантского комбинационного рассеяния (ГКР) является перспективным методом детектирования и идентификации микроорганизмов. Описан метод регистрации спектров ГКР бактерий, в том числе с использованием мягкого окисления образца для дополнительного усиления сигнала ГКР. Предложен метод математической обработки спектров для вычисления характеристик сходства и различия спектров бактерий.
Экспрессные детектирование и идентификация микроорганизмов – важная задача в клинической диагностике, контроле качества питьевой воды и пищевых продуктов. Важность этой проблемы связана с возникновением больничных инфекций, вызываемых бактериями со множественной устойчивостью к антибиотикам, образующими биопленки [1–3]. Традиционные методы диагностики, основанные на культивировании бактерий или на проведении ПЦР, достаточно эффективны, однако, как правило, требуют предварительной информации о возможной природе патогенов, занимают значительное время и довольно дороги в реализации, что во многих случаях лимитирует их доступность. В связи с этим, задача разработки экспрессного, доступного по стоимости и охватывающего широкий ряд детектируемых микроорганизмов метода остается весьма актуальной и в настоящее время.
Спектроскопия комбинационного рассеяния (КР) в ближнем ИК-диапазоне является потенциально мощным методом идентификации и характеристики микроорганизмов [4–8]. К сожалению, интенсивность сигнала комбинационного рассеяния очень мала. Более того, микроорганизмы (а именно, молекулы на поверхности клеток микроорганизмов) имеют низкую активность в спектрах КР. По этой причине детектирование микроорганизмов по спектрам комбинационного рассеяния является сложной задачей, выполнимой только с помощью дорогостоящих КР-микроскопов. Такой подход неприменим для реального применения при серийных анализах в клинической диагностике. Однако недостаток такого детектирования может быть преодолен путем усиления комбинационного рассеяния. Наиболее подходящим методом является гигантское комбинационное рассеяние (ГКР), которое приводит к существенному (в 104–106 раз) увеличению сечения комбинационного рассеяния молекул [9].
Спектроскопия ГКР может эффективно применяться для безмаркерного обнаружения и идентификации бактерий. Спектры ГКР бактерий, служащие “отпечатками пальцев”, позволяют различать бактерии на уровне родов, видов и даже на внутривидовом уровне [10]. Метод ГКР основан на применении металлов с плазмонным резонансом в видимом диапазоне (золота или серебра) в виде дисперсий наночастиц или загрубленных наноструктурированных подложек [11–13]. Сферические серебряные и золотые наночастицы обладают поверхностным плазмонным резонансом около 405 и 520 нм соответственно, а при образовании ГКР-активных структур резонанс испытывает батохромный сдвиг. Длина волны возбуждения должна быть близка к плазмонному резонансу. По этим причинам необходимо использовать различные лазеры для возбуждения ГКР на серебряных и золотых наночастицах. Серебряные наночастицы могут быть токсичны для бактерий [14]. Золотые наночастицы более устойчивы к окислению, и поэтому их дисперсии более стабильны.
Сложности применения спектроскопии ГКР для идентификации бактерий связаны с низкой воспроизводимостью интенсивности сигнала и заметным влиянием загрязнений (например, стабилизирующих агентов или побочных продуктов синтеза наночастиц). Стоит отметить, что для экспрессного анализа бактерий с помощью портативного спектрометра необходимы высокоактивные ГКР-подложки. Подложки, получаемые наноструктурированием поверхности пленки золота [15–17], высокоэффективны и хорошо воспроизводимы, но малоприменимы для анализа бактерий. Крупные по сравнению с наночастицами клетки бактерий не могут быть эффективно расположены в активных центрах планарных структур. В связи с этим более эффективными оказываются ГКР-подложки, формируемые из наночастиц золота в присутствии бактериальных клеток.
Нанесение наночастиц на бактериальные клетки с последующим высушиванием образца позволяет повысить концентрацию клеток и ГКР-активных центров подложки в фокусном объеме лазерного луча. Этот подход позволяет использовать дешевые портативные КР-спектрометры для регистрации спектров бактерий.
Обработка смеси бактериальных клеток и наночастиц золота разбавленным раствором перекиси водорода позволяет повысить интенсивность сигнала. По всей видимости, такое усиление происходит за счет окисления цитрат–анионов и других органических веществ, адсорбированных на поверхности наночастиц, что позволяет освободить поверхность наночастиц для адсорбции молекул, находящихся на поверхности клеток бактерий.
Цель работы − применение для идентификации бактерий способа регистрации спектров ГКР бактерий, сочетающего преимущества использования твердых ГКР-подложек и подложек, изготавливаемых из дисперсий наночастиц.
МЕТОДИКА
Синтез зародышевых частиц. В пластиковую пробирку объемом 10 мл помещали 6 мл бидистилированной воды, 71 мкл 25 мМ раствора HAuCl4 (“Sigma-Aldrich”, США) и 88 мкл 60 мМ раствора цитрата натрия. Пробирку герметично закрывали, перемешивали раствор и термостатировали при 90°С 15 мин в жидкостном термостате. В результате образовывалась розовая суспензия зародышевых частиц. Полученную суспензию постепенно охлаждали до 15°С в водяной бане.
Синтез наночастиц золота. Синтез проводили по модифицированной методике Бастус с соавт. [18]. В предварительно охлажденную пробирку с раствором зародышевых частиц добавляли 40 мкл 25 мМ раствора HAuCl4 и 40 мкл 60 мМ раствора цитрата натрия. После смешивания реагентов пробирку герметично закрывали и выдерживали в жидкостном термостате при 90°С в течение 30 мин. Полученную дисперсию охлаждали до 15°С. Таким образом было получено первое поколение наночастиц золота.
Для получения целевого 18 поколения наночастиц золота (диаметром ~50 нм) вышеописанные процедуры повторялись требуемое число раз, при этом после 3, 6, 9, 12 и 15 стадий из пробирки отбирали 2000 мкл дисперсии и добавляли 1500 мкл бидистиллированной воды. После первого отбора дисперсии помимо основных прекурсоров (HAuCl4, цитрат натрия) на каждой стадии вводили 60 мкл 25 мМ раствора NaOH для корректировки pH.
Характеризация наночастиц золота. Для приготовления образцов для анализа методом просвечивающей электронной микроскопии (ПЭМ) 5 мкл суспензии наночастиц наносили на формваровую сетку для ПЭМ (“Ted Pella”, США) и высушивали при комнатной температуре. ПЭМ-микрофотографии были получены на электронном микроскопе JEM-2100 (“Jeol”, Япония) при ускоряющем напряжении 200 кВ. Микрофотографии были получены также на сканирующем электронном микроскопе (СЭМ) JIB-4501 (“Jeol”, Япония).
Приготовление образцов бактерий. В работе использовали штаммы бактерий Acinetobacter baumanii A01 (культура любезно предоставлена Никитиной А.А., ФИЦ Биотехнологии РАН, Россия), Micrococcus luteus DSM20030 (DSMZ, Braunschweig, Германия), Escherichia coli JF-238 (Институт молекулярной генетики РАН, Россия), Bacillus subtilis B-501 (ВКМ, Пущино, Россия). Для получения активной бактериальной культуры проводили посев петлей в 5 мл стерильной среды. Для выращивания E. coli использовали среду LB (г/л дистиллированной воды: NaCl – 10.0, триптон – 10.0, дрожжевой экстракт – 5.0), для остальных культур была использована жидкая среда с пептоном – 10.0 г/л водопроводной воды. Культуры были выращены аэробно при перемешивании на шейкере со скоростью 200 об./мин при 30°C (E. coli и A. baumanii – при 37°C) в течение 48 ч до достижения концентрации около 109 кл./мл. Каждый бактериальный образец помещали в стерильную микроцентрифужную пробирку для краткосрочного хранения при температуре 4°C. Для подготовки к экспериментам по спектроскопии комбинационного рассеяния культуры три раза отмывали свежеприготовленным NaCl в воде (0.9% мас.), отделяя клетки центрифугированием в течение 5 мин при 3000 g.
Спектроскопия гигантского комбинационного рассеяния. Спектры комбинационного рассеяния регистрировались с помощью спектрометра комбинационного рассеяния BWS415 (“BW-TEC AG”, Германия). Образец размещался на позиционирующем XYZ-столике Thorlabs (“Thorlabs”, США), регулировка положения фокуса лазера контролировалась с помощью USB-микроскопа Mikmed-2000R (ООО “Наблюдательные приборы”, Россия). Для регистрации спектров ГКР биологических объектов были получены различные субстраты на базе наноматериалов из золота. Образцы E. coli и B. subtilis дополнительно обрабатывали 3% раствором пероксида водорода, для чего смешивали равные объемы суспензии клеток, наночастиц золота и раствора пероксида водорода, после чего осуществляли регистрацию спектров ГКР.
Спектры ГКР обрабатывали автоматически с помощью программного обеспечения Octave. Спектры импортировали из программного обеспечения спектрометра в виде текстовых файлов, с помощью разработанного в среде GNU/Octave скрипта вычитали фон флуоресценции, отфильтровывали высокочастотный шум, распознавали наиболее интенсивные сигналы (при отношении сигнал/шум более 3) и экспортировали обработанные данные в файлы Excel для визуализации и интерпретации. Использовали фильтры Чебышева II типа, имеющие следующие характеристики: полоса пропускания на 0.10f, полоса подавления на 0.15f, допустимая пульсация не более 0.5 дБ, затухание 30 дБ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Спектры всех исследованных бактерий были успешно зарегистрированы, нормализованы и отфильтрованы от высокочастотных шумов. Для E. coli и B. subtilis регистрировали как исходные спектры ГКР, так и спектры ГКР после обработки разбавленным раствором пероксида водорода. Следует отметить, что пероксидная обработка приводит к увеличению интенсивности спектра ГКР, лишь незначительно изменяя соотношение интенсивности различных пиков [19]. Нормализованные спектры ГКР бактерий представлены на рис. 1.
Рис. 1.
Спектры ГКР бактерий при возбуждении лазером на длине волны 785 нм, нормализованные по наибольшему пику. 1 – Escherichia coli JF238, 2 – Bacillus subtilis B-501, 3 – Micrococcus luteus DSM20030, 4 – Acinetobacter baumanii A01.
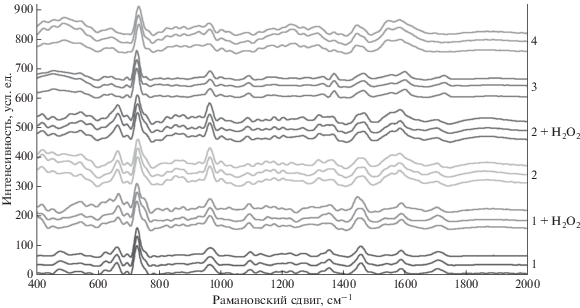
Спектры имели значительное количество пиков, для которых затруднено однозначное отнесение к типу колебаний групп атомов в молекулах аналита. Поскольку их непосредственное сравнение затруднено, было произведено преобразование спектров в матричную форму путем автоматического распознавания пиков с последующим уменьшением размерности данных по методу главных компонент. Благодаря схожести анализируемых спектров, различия между ними исчерпывающе описываются всего четырьмя главными компонентами. В табл. 1 приведены значения главных компонент для полученных спектров.
Таблица 1.
Координаты полученных ГКР-спектров бактерий в четырехмерном пространстве главных компонент (для каждого микроорганизма спектры приведены в трех повторностях)
| Микроорганизм | PC1 | PC2 | PC3 | PC4 |
|---|---|---|---|---|
| A. baumanii A01 | –0.4023 | –0.2559 | –0.3256 | –0.2817 |
| –0.2757 | 0.1626 | –0.2615 | –0.2307 | |
| –0.3369 | 0.0022 | –0.2580 | –0.1163 | |
| M. luteus DSM20030 | –0.6062 | –0.5653 | –0.3851 | 0.0458 |
| –0.6159 | –0.5446 | –0.4038 | 0.0361 | |
| –0.5982 | –0.3202 | –0.3666 | 0.0323 | |
| E. coli JF-238 | –0.5941 | –0.8206 | –0.0037 | 0.0485 |
| –0.5671 | –0.8348 | –0.0255 | 0.0317 | |
| –0.5417 | –0.8216 | –0.0622 | 0.0143 | |
| E. coli JF238 после обработки пероксидом водорода | –0.7366 | –0.4830 | –0.0623 | 0.1328 |
| –0.6649 | –0.2070 | –0.0349 | 0.1480 | |
| –0.8202 | –0.2295 | –0.0999 | 0.2213 | |
| B. subtilis B-501 | –0.5359 | 0.1729 | 0.0698 | –0.0582 |
| –0.5797 | 0.2652 | 0.0561 | –0.0040 | |
| –0.5378 | 0.1521 | 0.1091 | –0.0320 | |
| B. subtilis B-501 после обработки пероксидом водорода | –0.4954 | –0.1390 | 0.1565 | –0.0678 |
| –0.5165 | –0.2397 | 0.2000 | 0.0818 | |
| –0.4819 | –0.1316 | 0.2159 | 0.0269 |
Визуализация сходства и различия спектров после преобразования достигается путем отображения спектров в виде точек в трехмерном подпространстве трех первых главных компонент, так как они описывают различия между спектрами практически полностью (более, чем на 95%). На рис. 2 показаны спектры бактерий после преобразования. Оси соответствуют главным компонентам, точки – спектрам, эллипсоиды – границам выборок по тройному среднеквадратичному отклонению (СКО) в предположении нормального распределения по всем главным компонентам.
Рис. 2.
Отображение полученных ГКР-спектров бактерий в пространстве трех первых главных компонент. PC1, PC2, PC3 – первые три главные компоненты, 1, 2, 3, 4 как на рис. 1; эллипсоиды описывают тройное стандартное отклонение по выборке.
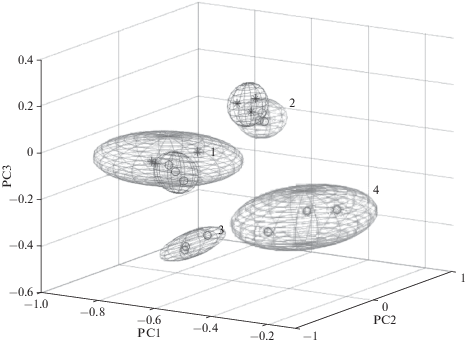
Для вычисления характеристик сходства и различия исследуемых спектров было рассчитано расстояние между выборками как евклидово расстояние между ближайшими спектрами двух выборок, поделенное на СКО расстояний от спектра первой выборки до всех спектров второй выборки. Полученные векторные расстояния приведены в табл. 2.
Таблица 2.
Векторы расстояний между спектрами бактерий в четырехмерном пространстве главных компонент (расстояния нормализованы по СКО выборки спектров микроорганизма 2)
| Пары (микроорганизм 1 → микроорганизм 2) | Расстоя-ние |
|---|---|
| A. baumanii → M. luteus | 3.91 |
| M. luteus → A. baumanii | 2.73 |
| E. coli → B. subtilis | 17.63 |
| E. coli → B. subtilis после обработки H2O2 | 7.49 |
| B. subtilis → E. coli | 135.97 |
| B. subtilis → E. coli после обработки H2O2 | 3.31 |
Как видно из рис. 2 и данных в табл. 2, после пероксидной обработки расстояние между спектрами E. coli и B. subtilis сократилось, однако все еще превышало более чем в 3 раза стандартное отклонение координат нахождения спектров группы сравнения в четырехмерном пространстве главных компонент.
В результате сопоставления и интерпретации спектров ГКР исследованных бактерий было установлено, что различия в спектрах ГКР, выявленные по методу главных компонент, позволяют надежно различать бактерии разных родов. Пероксидная обработка при регистрации спектров ГКР позволяет увеличить интенсивность спектрального сигнала, при этом не критически снижая разрешающую способность метода, оцениваемую как расстояния между кластерами данных в четырехмерном пространстве главных компонент.
Исследование выполнено при финансовой поддержке гранта Российского научного фонда (проект № 17-79-10489).
Список литературы
Tkachenko A.G. // Appl. Biochem. Microbiol. 2018. V. 54. № 2. P. 108–127.
Pelaz B. et al. // ACS Nano. 2017. V. 11. № 3. P. 2313–2381.
Ножевникова А.Н., Бочкова Е.А., Плакунов В.К. // Микробиология. 2015. Т. 84. № 6. С. 623–623.
Bodelón G. et al. // Nat. Mater. 2016. V. 15. № 11. P. 1203–1211.
Byrne H.J., Baranska M., Puppels G.J., Stone N., Wood B., Gough K.M., Lasch P., Heraud P., Sulé-Suso J., Sockalingum G.D. // Analyst. 2015. V. 140. № 7. P. 2066–2073.
Jarvis R.M., Brooker A., Goodacre R. // Faraday Discussions. 2006. V. 132. P. 281–292.
Sojinrin T., Conde J., Liu K., Curtin J., Byrne H.J., Cui D., Tian, F. // Anal. Bioanal. Chem. 2017. V. 409. № 19. P. 4647–4658.
Kairyte K., Luksiene Z., Pucetaite M., Sablinskas V. // Lith. J. Phys. 2012. V. 52. № 3. P. 276–283.
Kucheyev S.O., Hayes J.R., Biener J., Huser T., Talley C.E., Hamza A.V. // Appl. Phys. Lett. 2006. V. 89. № 5. P. 053102.
Premasiri W.R., Moir D.T., Klempner M.S., Krieger N., Jones G., Ziegler L.D. // J. Phys. Chem. B. 2005. V. 109. № 1. P. 312–320.
Lee S.J., Guan Z., Xu H., Moskovits M. // J. Phys. Chem. C. 2007. V. 111. № 49. P. 17985–17988.
Leopold N., Lendl B. // J. Phys. Chem. B. 2003. V. 107. № 24. P. 5723–5727.
Wei G., Zhou H., Liu Z., Li Z. // Appl. Surf. Sci. 2005. V. 240. № 1–4. P. 260–267.
Cui L., Chen S., Zhang K. // Spectrochim. Acta Part A Mol. Biomol. Spectrosc. 2015. V. 137. P. 1061–1066.
Hamon C., Liz-Marzan L.M. // J. Colloid Interface Sci. 2018. V. 512. P. 834–843.
Fan M., Andrade G.F.S., Brolo A.G. // Anal. Chim. Acta. 2011. V. 693. № 1–2. P. 7–25.
Vinokurov V.A., Kopitsyn D.S., Kotelev M.S., Ivanov E.V., Lvov Y.M., Novikov A.A. // JOM. 2015. V. 67. № 12. P. 2877–2880.
Bastus N.G., Comenge J., Puntes V. // Langmuir. 2011. V. 27. № 17. P. 11098–11105.
Gorbachevskiy M.V., Kopitsyn D.S., Kotelev M.S., Ivanov E.V., Vinokurov V.A., Novikov A.A. // RSC Advances. 2018. V. 8. P. 19051–19057.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


