Прикладная биохимия и микробиология, 2019, T. 55, № 1, стр. 3-16
Микроорганизмы и углеродные нанотрубки: взаимодействие и области применения (обзор)
1 Институт экологии и генетики микроорганизмов УрО РАН,
Пермский федеральный исследовательский центр УрО РАН
614081 Пермь, Россия
2 Пермский государственный национальный исследовательский университет
614990 Пермь, Россия
* E-mail: maks@iegm.ru
Поступила в редакцию 12.02.2018
После доработки 11.07.2018
Принята к публикации 25.07.2018
Аннотация
Обзор посвящен рассмотрению различных аспектов взаимодействия углеродных нанотрубок с микроорганизмами: антимикробному эффекту одностенных, многостенных, функционализированных и немодифицированных углеродных нанотрубок, механизму воздействия этих наноматериалов на отдельную клетку, а также влиянию нанотрубок на микроорганизмы почвенных и водных экосистем. Среди механизмов воздействия углеродных нанотрубок на микробную клетку отмечается прямой контакт, приводящий к нарушению клеточной стенки и цитоплазматической мембраны, изменение текучести мембраны, окислительный стресс, ингибирование ферментов, снижение уровня транскрипции ряда ключевых генов. Показано, что антимикробное воздействие углеродных нанотрубок сильно зависит от их диаметра, длины, степени агрегации, концентрации, функционализации поверхностными группами, степени очистки, времени и интенсивности контакта. Рассмотрены возможности биодеградации углеродных нанотрубок микроорганизмами. Показано изменение содержания в почве при внесении нанотрубок определенных таксономических групп бактерий, участвующих в биогеохимических циклах углерода и азота, что может неблагоприятно влиять на круговорот этих элементов в природе. Также в обзоре уделено внимание современным тенденциям в области создания микробных топливных элементов, биосенсорных технологий, биоремедиации и очистки сточных вод, где углеродные нанотрубки проявляют свои уникальные электронопроводящие и адсорбционные свойства, и являются связующим звеном для проявления полезных свойств микроорганизмов.
Открытие углеродных нанотрубок (УНТ) явилось одним из наиболее значительных достижений науки последних десятилетий [1]. Углеродные наноматериалы обладают комплексом исключительных структурных и функциональных свойств: высокими электро- и теплопроводностью, необычными магнитными свойствами, прочностью на растяжение, значительной удельной поверхностью и химической инертностью [2, 3]. Благодаря уникальным физико-химическим качествам УНТ находят применение в различных областях хозяйственной деятельности человека – электронике, механике, энергетике, а в последнее время и в биомедицине, биотехнологии и биосенсорных технологиях.
Появление и широкое распространение новых материалов неизбежно ставит вопрос об их воздействии на живые организмы. Первоочередной задачей является понимание степени риска распространения наноразмерных материалов, их влияния на здоровье человека. Бесспорно, что влияние нанообъектов на организм в целом начинается на клеточном уровне, и в этом случае оказываются незаменимыми знания о взаимодействии с одноклеточными организмами. Кроме того, среди живых существ микроорганизмы, и в первую очередь бактерии, наиболее близки по размерам к наноматериалам, что обусловливает возможность их непосредственного контакта.
Современное состояние биотехнологий предполагает использование наноматериалов, в том числе углеродных, для различных целей: получение энергии с помощью микроорганизмов, очистка окружающей среды, использование в биосенсорных технологиях. Во всех случаях возникает вопрос о совместимости одноклеточного живого организма и УНТ.
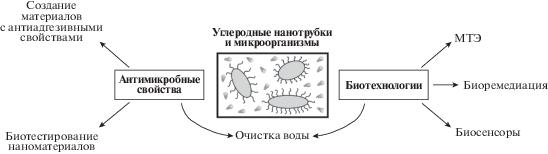
Таким образом, проблему взаимодействия микроорганизмов с УНТ можно рассматривать в нескольких аспектах: с одной стороны наноматериалы могут являться новыми антимикробными агентами, а бактерии, микроскопические грибы и водоросли – тест-объектами для изучения токсичности наноматериалов; в то же время нанотрубки могут служить адсорбентами для микроорганизмов в технологиях очистки воды, биодеградации загрязняющих веществ, в качестве электронопроводящего материала в микробных топливных элементах и биосенсорах (рис. 1). В настоящем обзоре обобщены сведения последних лет, касающиеся результатов исследований взаимодействия микроорганизмов и одностенных (ОУНТ), многостенных (МУНТ), функционализированных (ФУНТ) и немодифицированных УНТ, механизмов токсичности УНТ по отношению к микроорганизмам, применения углеродных наноматериалов в биотехнологиях, основанных на использовании полезных свойств микроорганизмов.
ВОЗДЕЙСТВИЕ УГЛЕРОДНЫХ НАНОТРУБОК НА МИКРООРГАНИЗМЫ
Еще в 1943 г., задолго до разработки технологии синтеза углеродных наноматериалов, Зобел [4] высказал предположение об отрицательном воздействии на бактерии объектов меньших размеров. Однако и сейчас, несмотря на большое количество научных работ, посвященных изучению взаимодействия микроорганизмов с УНТ, невозможно полностью подтвердить или опровергнуть эту гипотезу. Среди опубликованных работ подавляющее количество свидетельствует о цитотоксическом действии этих наноматериалов (табл. 1), однако встречаются и противоположные данные. Для лучшего понимания этого вопроса следует отдельно рассмотреть воздействие ОУНТ, МУНТ, ФУНТ и немодифицированных углеродных нанотрубок на клеточном и популяционном уровнях.
Таблица 1.
Антимикробное действие углеродных нанотрубок
| Тип нанотрубок | Микроорганизм | Эффект и механизм воздействия | Ссылка |
|---|---|---|---|
| ОУНТ | E. coli K12 | Нарушение клеточной мембраны, эффлюкс цитоплазмы | [5] |
| ОУНТ | E. coli K12 TG1 (plux) | Морфологические нарушения клеток, увеличение скорости потребления кислорода, падение интенсивности биолюминесценции клеток до 60% от контрольного уровня | [7] |
| ОУНТ | E. coli, B. subtilis | Разрушение клеточной стенки, вытекание внутриклеточного содержимого, уменьшение объема и высоты клетки, увеличение шероховатости поверхности бактерии | [8] |
| ОУНТ с металлическими свойствами | E. coli | Увеличение содержания окисленного глутатиона в цитоплазме; окислительный стресс | [14] |
| ОУНТ низкой степени очистки | E. coli | Повреждение поверхностных структур клеток | [29] |
| ОУНТ; карбоксилированные ОУНТ; МУНТ | E. coli, Ochrobactrum sp. | Возрастание текучести бактериальной цитоплазматической мембраны, увеличение уровня насыщенных с одновременным снижением ненасыщенных жирных кислот | [32] |
| ОУНТ-ОН | Paracoccus denitrificans | Ингибирование ключевых ферментов, ответственных за гликолиз, снижение образования НАДН, падение активности нитратредуктазы | [51] |
| ОУНТ-ОН; ОУНТ-СООН | P. denitrificans ATCC 19367 | Снижение транскрипции ключевых генов, связанных с транспортом веществ, переносом электронов, регуляцией транскрипции, модулирование экспрессии ключевых генов цикла глицеролипида/свободных жирных кислот | [52] |
| ОУНТ, короткие и длинные МУНТ, короткие МУНТ-OH и МУНТ- COOH | Lactobacillus
acidophilus, Bifidobacterium adolescentis, E. coli, Enterococcus faecalis, S. aureus |
“Пирсинг” короткими ОУНТ, “обертывание” длинными МУНТ, нарушение клеточных стенок и мембран, потеря мембранного потенциала, выделение ДНК и РНК | [39] |
| ОУНТ, ОУНТ-COOH, МУНТ | Dyella ginsengisoli LA-4 | “Пирсинг”, окислительный стресс | [67] |
| МУНТ/лизин, МУНТ/аргинин | E. coli, S. typhimurium, S. aureus |
Электростатическая адсорбция на клеточной стенке бактерий, нарушение жизнеспособности | [17] |
| Функционализация МУНТ сурфактантами | S. mutans | Агрегация бактерий, нарушение жизнеспособности | [16] |
| Ковалентная иммобилизация цефалексина через полиэтиленгликоль на МУНТ | E. coli, P. aeruginosa, S. aureus, B. subtilis |
Эффективная адсорбция клеток бактерий, нарушение жизнеспособности | [20] |
| ФМУНТ с карбоксильными, фенольными группами, 1-октодеканолом, импрегнированные наночастицами серебра, модифицированные додециламином | E. coli | Агрегация, нарушение жизнеспособности | [22, 23] |
Антимикробный эффект ОУНТ. Первые доказательства того, что очищенные ОУНТ проявляют сильную антимикробную активность, были приведены в работе [5]. Авторы показали, что бактерицидное действие ОУНТ связано с нарушением клеточной мембраны модельного организма Escherichia coli K12 в результате прямого контакта, приводящего к гибели бактериальной клетки. Доказательством явилось наблюдаемое в сканирующий электронный микроскоп изменение морфологии E. coli K12 после 60 мин контакта с ОУНТ, связанное с нарушением целостности клеток. Также эффлюкс содержимого цитоплазмы был подтвержден более чем пятикратным возрастанием количества плазмидной ДНК и двукратным увеличением содержания РНК в растворе после контакта клеток с ОУНТ. Окраска флюоресцирующими красителями DAPI и иодидом пропидия показала значительное снижение жизнеспособности агрегированных с нанотрубками клеток, тогда как суспендированные свободные клетки в присутствии ОУНТ не теряли жизнеспособности по сравнению с контролем.
Полученные результаты вызвали вопрос: что более токсично для бактерий – ОУНТ или МУНТ? Закономерно было предположить, что если механизм токсичности заключается в прямом нарушении целостности бактериальной клетки, то диаметр УНТ играет важную роль в инактивации бактерий, и ОУНТ будут проявлять больший антибактериальный эффект. Как окраска флюоресцентными красителями, так и сканирующая электронная микроскопия клеток, инкубированных с ОУНТ и МУНТ, подтвердили это предположение. Не только разрушение клеток, но и изменение экспрессии стрессзависимых генов указывало на наибольшую цитотоксичность ОУНТ, связанную с большой площадью контакта, более интенсивным проникновением в клеточную стенку за счет малых размеров, а также уникальными химическими и электронными свойствами нанотрубок [6].
Бактерицидный эффект ОУНТ в суспензиях генно-инженерного штамма E. coli K12 TG1 (plux) с клонированным в него lux-опероном из светящихся морских бактерий Photobacterium leiognathi был подтвержден морфологическими и физиологическими исследованиями и методом прямого высева. Морфологическим нарушениям клеток, выявленным с помощью атомно-силовой микроскопии, предшествовало двукратное увеличение скорости потребления кислорода после 2–3 ч взаимодействия клеток с ОУНТ с одновременным падением интенсивности биолюминесценции клеток до 60% от контрольного уровня и снижением количества КОЕ [7].
Методом атомно-силовой микроскопии был подтвержден антибактериальный эффект диспергированных ОУНТ как на грамотрицательные E. coli, так и на грамположительные Bacillus subtilis. ОУНТ образуют сеть на поверхности клетки, которая затем приводит к разрушению клеточной стенки и последующему вытеканию внутриклеточного содержимого, уменьшению объема и высоты клетки, а при возрастании времени инкубации с ОУНТ к увеличению шероховатости поверхности бактерий [8]. Эти данные согласовывались с предыдущими исследованиями тех же авторов, которые показали, что 58% клеток E. coli и 87% B. subtilis погибали после 2 ч инкубации с ОУНТ, а клетки имели существенные повреждения, наблюдаемые в сканирующий электронный микроскоп. Таким образом, антибактериальная активность ОУНТ является следствием аккумуляционного эффекта, который проявляется через взаимодействие большого количества нанотрубок в виде сети на поверхности микробных клеток.
Длинные ОУНТ проявляли более выраженную антибактериальную активность за счет более эффективной агрегации с микробными клетками, тогда как короткие имели тенденцию агрегировать между собой [9].
ОУНТ проявляют выраженный антибактериальный эффект в отношении как суспендированных, так и адгезированных бактерий и воздействуют на образование биопленок [10]. Однако исследования влияния ОУНТ на бактериальные споры, в частности, споры Bacillus anthracis, не дали положительного результата, что неудивительно, принимая во внимание плотную защитную оболочку спор и механизм инактивации бактериальных клеток этим типом УНТ. Вместе с тем, ОУНТ обладают свойствами, которые могут усилить их антибактериальную активность, а именно способностью поглощать свет в диапазоне от 700 до 1100 нм и переводить его в тепло, поэтому продолжительное облучение ближним инфракрасным светом обработанных ОУНТ спор может привести к их гибели из-за сильного локального нагрева [11]. Эти работы являются закономерным продолжением ранее выполненных исследований, показавших хорошую способность агрегатов ОУНТ адсорбироваться на спорах B. subtilis, которые служили непатогенной моделью B. anthracis [12].
Развитие антимикробной фотодинамической терапии – перспективный подход к инактивации микроорганизмов без использования антибиотиков. Функционализированный амином порфирин, конъюгированный с окисленными ОУНТ, приводил к разрушению клеточных мембран Staphylococcus aureus на свету. Этот подход может быть альтернативой традиционному лечению локализованных инфекций [13].
В работе [14] продемонстрировано, что ключевым фактором антибактериальной активности ОУНТ являются их электронопроводящие свойства, а именно, проявляют ли они свойства металла или полупроводника. Потеря жизнеспособности E. coli была более выражена при увеличении содержания фракции металлических ОУНТ. Увеличение содержания окисленного глутатиона в клетках при воздействии таких ОУНТ свидетельствовало об окислительном стрессе. Авторы постулировали трехшаговый антимикробный механизм воздействия ОУНТ: 1) контакт ОУНТ с поверхностью бактерий; 2) воздействие на клеточную мембрану; 3) окислительный стресс.
В качестве возможного молекулярного механизма токсичности ОУНТ для микроорганизмов авторами [15] предложена схема, основанная на взаимодействии нанотрубок с ферментами. ОУНТ вызывают значительные изменения конформации микробных ферментов, как глобальные, которые приводят к более или менее плотной упаковке молекулы, так и локальные, путем заполнения полостей, являющихся активными центрами. Кроме того, ОУНТ изменяют взаимодействия белков друг с другом, что влияет на метаболические процессы в клетке.
Антимикробный эффект МУНТ. МУНТ, по-видимому, менее токсичны для бактерий, чем ОУНТ [5, 10, 16–19]. Хотя МУНТ также эффективно покрывают поверхность бактериальных клеток, в отличие от ОУНТ они не оказывают бактерицидного действия из-за большего диаметра [16]. Снижение токсичности может быть вызвано менее плотным контактом между бактерией и нанотрубками, обусловленным более высокой жесткостью МУНТ и возможно меньшими силами Ван-дер-Ваальса на их поверхности. По этой причине МУНТ с меньшим диаметром проявляли более высокую цитотоксичность. Когда МУНТ имеют незамкнутые концы, небольшую длину и находятся в виде дисперсии в растворе, их токсичность по отношению к микроорганизмам увеличивается [10].
Одним из методов увеличения антибактериальной активности МУНТ является их функционализация. Модификация УНТ подразделяется на ковалентную и нековалентную, причем нековалентная более предпочтительна, так как в этом случае сохраняется структура и свойства нанотрубок. При нековалентной функционализации молекулы-модификаторы адсорбируются на внешней поверхности нанотрубок за счет гидрофобных сил, π-π-взаимодействий, а когда адсорбат имеет ионную природу, то за счет электростатических взаимодействий [16]. В качестве модифицирующих агентов могут быть использованы вещества различной природы. Так, функционализация аргинином и лизином приводила к значительному возрастанию цитотоксичности МУНТ по отношению к тестируемым бактериям. Отмечено, что антибактериальная активность возрастала в ряду: немодифицированные МУНТ – МУНТ/лизин – МУНТ/аргинин, причем ФМУНТ были особенно эффективны в отношении грамотрицательных бактерий – E. coli и Salmonella Typhimurium, хотя отмечалось и их воздействие на антибиотикоустойчивые штаммы Staphylococcus aureus. Возрастающую антибактериальную активность МУНТ, модифицированных таким образом, авторы связывают с положительным зарядом функциональных групп на их поверхности, приводящим к эффективной электростатической адсорбции на клеточной стенке бактерий [17].
Функционализация МУНТ сурфактантами также давала хорошие результаты. Связывание молекул сурфактанта с МУНТ увеличивало способность последних образовывать дисперсии в водной среде, что способствовало возрастанию их способности к связыванию бактерий. В этом случае антибактериальная активность ФМУНТ по отношению к Streptococcus mutans зависела от их концентрации и времени инкубации [16].
Ковалентная иммобилизация антибиотика цефалексина через связующий агент полиэтиленгликоль увеличивала антимикробные свойства МУНТ по отношению к грамотрицательным E. coli и Pseudomonas aeruginosa и грамположительным S. aureus и B. subtilis, а также снижала адгезивную способность этих бактерий. Это связано с тем, что МУНТ эффективно адсорбируют бактериальные клетки, образующие биопленки на доступной поверхности. Антибактериальные и антиадгезивные качества ФМУНТ могут быть полезны при изготовлении материалов и покрытий биомедицинского назначения [20]. Кроме того, авторы обзора [21] предполагают, что использование ФУНТ в качестве носителей антибиотиков обеспечит в перспективе их целевую доставку и увеличит биодоступность, а также снизит формирование резистентности у микроорганизмов.
В области, относящейся к дезинфекции воды, запатентован метод удаления E. coli из водной среды, основанный на смешивании суспензии бактерий с МУНТ, функционализированными карбоксильными, фенольными группами и 1-октодеканолом, импрегнированными наночастицами серебра [22] и модифицированными додециламином [23]. Метод основан на антибактериальных свойствах ФМУНТ и их способности образовывать агрегаты с бактериями.
Таким образом, действие углеродных наноматериалов в первую очередь основано на нарушении целостности клетки. На основании экспериментальных работ можно утверждать, что на первом этапе взаимодействия наноматериалы адсорбируются на бактериальной мембране, затем проходят через нее, экстрагируют липиды, индуцируют образование пор или активируют рецепторные белки мембран [24].
Насколько однозначно утверждение о цитотоксичности УНТ по отношению к микроорганизмам? Современные исследования, посвященные взаимодействию микроорганизмов с УНТ, не дают однозначного ответа на вопрос об антимикробном действии этих наноматериалов. Так, МУНТ в концентрации от 2 до 40 мкг/мл не влияли на жизнеспособность Saccharomyces cerevisiae [25]. Gluconacetobacter xylinum, продуцент бактериальной целлюлозы, культивировали при постоянном перемешивании с функционализированными полиэтиленгликолем МУНТ, которые были диспергированы в питательной среде. Конфокальная микроскопия подтвердила присутствие живых бактерий в среде, а сканирующая электронная микроскопия показала значительное количество хорошо диспергированных МУНТ, прикрепленных к поверхности целлюлозных волокон [26]. Также было показано, что на жизнеспособность Alcaligenes faecalis 2 и Rhodococcus ruber gt1 (оценку проводили по количеству КОЕ и окраске клеток флюоресцирующей меткой Live/DeadⓇ) не влияли ни очищенные, ни содержащие технологические примеси МУНТ, внесенные в среду культивирования [27]. Диффузионный метод, заключающийся во внесении 1 мг ОУНТ на поверхность агаризованной среды, инокулированной культурами S. aureus, B. cereus, S. epidermidis, Streptococcus pyogenes, E. coli, S. Typhimurium, Proteus spp., P. aeruginosa, показал наличие зоны ингибирования роста только у S. aureus и B. cereus [28].
Метод атомной силовой микроскопии, наиболее предпочтительный для изучения морфологии отдельной клетки, не дает однозначного ответа о токсичности УНТ. Так, в работе Дерябина с соавт. показано, что взаимодействие МУНТ и ряда ОУНТ с поверхностью E. coli не приводило к изменению морфологии и жизнеспособности бактериальных клеток, а повреждение поверхностных структур клеток авторы наблюдали лишь при воздействии ОУНТ низкой степени очистки [29].
Контакт клеток с МУНТ не приводил к образованию значительного количества колоний-ревертантов в бактериальной тест-системе, что позволило сделать вывод об отсутствии мутагенного эффекта этих углеродных наноматериалов по отношению к бактериям [28, 30].
Исследования последних лет, посвященные изучению взаимодействия микробных клеток с УНТ, показали, что на антибактериальную активность последних влияет множество факторов: диаметр, длина, степень агрегации, концентрация наноматериалов, функционализация поверхностными группами, степень очистки, а также используемый буферный раствор, время и интенсивность контакта [8, 16, 31–33]. Электростатические взаимодействия положительно заряженных УНТ с отрицательно заряженной поверхностью бактерий приводят к агрегации бактериальных клеток с нанотрубками. Как ОУНТ, так и МУНТ проявляют цитотоксичность по отношению к клеткам микроорганизмов. Механизм микробной токсичности ОУНТ заключается, по-видимому, в прямом нарушении клеточной стенки бактерий, тогда как МУНТ может вызывать развитие в клетке окислительного стресса [34]. Рассматриваются и другие возможные механизмы токсичности, такие как ингибирование транспорта электронов, увеличение проницаемости клеточной мембраны, образование активных форм кислорода, хотя большинство из этих механизмов еще не подтверждены экспериментально. Было показано, что текучесть бактериальной цитоплазматической мембраны возрастала при увеличении концентрации УНТ, среди которых были МУНТ, длинные и короткие ОУНТ, короткие карбоксилированные ОУНТ. Значительная отрицательная корреляция наблюдалась между жизнеспособностью и текучестью мембраны E. coli и Ochrobactrum sp., причем в присутствии УНТ наблюдали увеличение уровня насыщенных с одновременным снижением уровня ненасыщенных жирных кислот, что явилось адаптивным ответом на воздействие этих углеродных наноматериалов [32].
Влияние УНТ на биопленкообразование также неоднозначно. С одной стороны, антимикробные свойства нанотрубок предотвращают адгезию клеток и формирование биопленок [35, 36], с другой стороны, есть сведения, что биопленки могут нарастать на таких материалах. При этом мертвые клетки на поверхности экранируют токсический эффект УНТ, в результате чего происходит образование биопленки по принципу “живое на мертвом” [33, 37].
В большинстве работ подчеркиваются морфологические изменения клеток под воздействием УНТ, определяемые методом атомно-силовой и сканирующей электронной микроскопии, но для понимания физиологических изменений этого недостаточно. Для выяснения механизмов и причин гибели клетки необходимы исследования в области транскриптомики, протеомики и системный биологический подход [38].
На основании данных экспериментальных работ можно заключить, что антибактериальное воздействие УНТ тем больше, чем меньше диаметр, следовательно, ОУНТ более токсичны для микроорганизмов, чем МУНТ [5, 6, 16–19], длинные ОУНТ более токсичны, чем короткие [9], тогда как антимикробное действие коротких МУНТ сильнее, чем длинных [10]. Функционализированные, неочищенные и проявляющие металлические свойства УНТ оказывают большее антимикробное действие [14, 16, 17, 20, 21, 27, 29]. Наблюдаемая цитотоксичность обычно зависит от дозы этих углеродных наноматериалов [16, 38, 39]. Таким образом, противоречивые результаты, касающиеся цитотоксичности УНТ, требуют стандартизации используемых методик и унификации подходов к определению антимикробной активности этих наноматериалов.
ВЛИЯНИЕ УГЛЕРОДНЫХ НАНОТРУБОК НА ЭКОСИСТЕМЫ
Влияние УНТ на состав микробного сообщества почв и донных отложений. Использование УНТ в различных сферах народного хозяйства, электронике, медицине и биотехнологиях неминуемо приведет к повышению объемов их производства, и, как следствие, к попаданию в окружающую среду. Кроме того, есть сведения, что углеродные наноматериалы перспективны в качестве регуляторов роста растений [40–42]. Вопрос о влиянии новых материалов на природную среду включает в себя выяснение уровня их воздействия на микроорганизмы как основу круговорота биогенных элементов в биосфере.
Авторы работы [43] изучали влияние различных концентраций МУНТ от низких (10 мг/кг) до экстремально высоких (10000 мг/кг), на микрофлору супесчаных почв в 90-дневном эксперименте. При экстремально высоких концентрациях МУНТ исследователи наблюдали сдвиг в составе микробного сообщества: количество представителей родов Derxia, Holophaga, Opitutus и Waddlia снижалось, в то время как Rhodococcus, Cellulomonas, Nocardioides и Pseudomonas – увеличивалось. Интересно, что происходило увеличение содержания тех бактерий, которые являются типичными деструкторами сложных, трудно поддающихся разложению загрязнителей, таких как полициклические ароматические углеводороды.
Следует отметить, что в осадках пресных вод водоемов, загрязненных сырой нефтью, при внесении УНТ наблюдалось увеличение количества микроорганизмов, способных к деструкции нефтяных углеводородов. Изменялось биоразнообразие микрофлоры, особенно чувствительными оказались Flavobacteriales, Acholeplasmatales, Burkholderiales, Chlamydomonadales, Chlorellales, Chromatiales, Desulfovibrionales, Gemmatimonadales и Myxococcales. Содержание представителей порядка Actinomycetales возрастало при добавлении сырой нефти с УНТ. Авторы выдвинули гипотезу, что добавление МУНТ в среды, загрязненные сырой нефтью, увеличивает доступность углеводородов для микроорганизмов и обеспечивает прирост биомассы [44].
УНТ за счет своих адсорбционных свойств могут воздействовать на биодоступность и токсичность других органических загрязнителей. Так, МУНТ влияет на состав микробного сообщества почв, загрязненных полициклическими ароматическими углеводородами, причем степень этого влияния сильно варьирует в зависимости от типа почв и содержания в них органического вещества. Структура микробного сообщества при обработке МУНТ в концентрациях 50 и 100 мг/кг сильно изменялась в супесчаных почвах (1% органического вещества) по сравнению с контролем, и, наоборот, вообще не изменялась в суглинках (5.9% органического вещества). Тем не менее, биодеградация пирена в суглинках увеличивалась на 21 и 9.34% при обработке почвы МУНТ в концентрации 100 и 50 мг/кг соответственно [45].
Другой группой исследователей было проведено сравнение воздействия немодифицированных и ФМУНТ в концентрации 50, 500 и 5000 мкг/г на почвенную микрофлору. Отмечено, что на состав почвенного сообщества оказывали влияние только ФУНТ, возможно, из-за их большей способности смешиваться с водой, присутствующей в почве. Также более выраженный эффект ФМУНТ был связан с закислением почвенной среды при внесении больших концентраций этих наноматериалов [46].
Внесение МУНТ в концентрации 50–200 мг/л изменяло соотношение представителей бактериального сообщества почвы, на которой выращивали томаты, но разнообразие и основные филотипы оставались без изменений. При добавлении 200 мг/л МУНТ содержание Bacteroidetes и Firmicutes возрастало с 33.1% в контроле до 57.7% и с 1.9% в контроле до 3.1% соответственно, причем увеличение было пропорционально концентрации нанотрубок. Содержание Proteobacteria и Verrucomicrobia, наоборот, снижалось с 50.3 до 28.3% и с 3.5 до 2% соответственно. Значительно повышался уровень Sphingobacteria (фила Bacteroidetes) – с 8.2 до 24.7% при концентрации нанотрубок 200 мг/л, тогда как содержание Alphaproteobacteia снижалось с 39.3 до 22.7% [41]. Несколько иные результаты были получены при изучении воздействия МУНТ на состав бактериального сообщества ризосферы риса, выращенного в горшках с суглинистой почвой. Так, было отмечено снижение содержания доминантной группы – Proteobacteria с 3.96 до 3.25% при повышении концентрации МУНТ с 50 до 500 мг/кг. Содержание Gammaproteobacteria снижалось с увеличением концентрации МУНТ в почве, тогда как содержание Alphaproteobacteria оставалось без изменений при всех концентрациях МУНТ. Пропорционально повышению концентрации МУНТ снижалось содержание Nitrospira в почве, следовательно, УНТ опосредованно могут влиять на цикл азота [47].
Ферментативная активность почвенной микрофлоры также является отражением состояния экосистемы. Было изучено влияние МУНТ [48] и ОУНТ [49] на активность почвенных ферментов таких, как 1,4-β-глюкозидазы, целлобиогидролазы, ксилозидазы, 1,4-β-N-ацетилглюкозаминидазы и фосфатазы. Как МУНТ, так и ОУНТ снижали ферментативную активность, но ингибирующий эффект ОУНТ проявлялся при концентрациях в 5 раз более низких: если активность большинства ферментов имела тенденцию к снижению при добавлении к почве 500 мкг/г МУНТ, а 5000 мкг/г полностью подавляли активность всех изученных ферментов, то уже 300–1000 мкг/г ОУНТ ингибировали активность ферментов и снижали количество микробной биомассы [48, 49].
Как МУНТ, так и ОУНТ оказывали значительный эффект на разнообразие аммоний-окисляющих бактерий и архей в почве, причем однократное добавление УНТ приводило к резкому снижению количества архей, тогда как повторное добавление возвращало содержание этих микроорганизмов к исходным значениям [50].
ОУНТ, модифицированные гидроксильными группами, оказывали сильный ингибирующий эффект на денитрификацию. На модельном микроорганизме Paracoccus denitrificans было показано, что ФОУНТ ингибируют ключевые ферменты, ответственные за гликолиз, в результате чего резко снижается образование НАДН, донора электронов для денитрификации, а также падает активность нитрат-редуктазы [51]. В более поздней работе было показано влияние ФОУНТ на транскрипцию у денитрифицирующих бактерий. Гидроксилированные и карбоксилированные ОУНТ оказали сильное ингибирующее воздействие на денитрификацию, причем эффект первых был сильнее. ОУНТ-ОН гораздо сильнее влияли на транскрипцию ключевых генов, связанных с транспортом веществ, переносом электронов и регуляцией транскрипции, снижая ее. Было показано, что ФОУНТ модулируют экспрессию ключевых генов цикла глицеролипиды/свободные жирные кислоты, и таким образом нарушают процесс, ассоциированный с денитрификацией, в том числе энергетический и внутриклеточный окислительно-восстановительный баланс, а также транспорт [52]. Таким образом, попадание в среду большого количества ОУНТ-ОН может привести к серьезным нарушениям круговорота азота в биосфере.
В целом, сдвиг в содержании определенных таксономических групп бактерий в почве при воздействии УНТ необходимо учитывать, т.к. изменение в составе сообществ, участвующих в биогеохимических циклах углерода и азота, могут отрицательно воздействовать на круговорот этих элементов в природе.
Влияние УНТ на состав микробного сообщества водной среды. Воздействие УНТ на биологические объекты связано также с их сорбционной способностью по отношению к загрязнителям, что особенно важно в водной среде. Показано, что воздействие ОУНТ и МУНТ на микробное сообщество водной среды различается в присутствии ионов Cu2+ и ${\text{CrO}}_{4}^{{2 - }}$ от такового без добавления ионов металлов и их оксидов. Токсичность УНТ значительно увеличивалась в присутствии металлов, что можно объяснить двумя возможными механизмами: во-первых, нанотрубки могут изменять проницаемость покровов клетки, после чего в нее проникают металлы; во-вторых, в течение некоторого времени нанотрубки сорбируют металлы, и одновременно воздействуют на клетки в условиях агрегации. Доминирующими таксонами при таком воздействии оставались Bacillus sp. и Acidithiobacillus sp. УНТ, модифицированные карбоксильными и гидроксильными группами, оказались более токсичными для микроорганизмов [53].
Токсичность УНТ в водной среде также зависит от доступности питательных веществ, так как на способность микроорганизмов к восстановлению жизненных функций, нарушенных в присутствии наноматериалов, влияло снабжение клеток питанием [18].
Присутствие суспендированных твердых частиц в воде может изменять токсичность УНТ для микроорганизмов. Агрегация суспендированных твердых частиц и ОУНТ, по-видимому, ограничивала их доступность для бактериальных клеток. Поскольку количество таких твердых частиц в естественных водных средах значительно превосходит содержание ОУНТ, необходимо учитывать роль частиц для более точной оценки неблагоприятного воздействия ОУНТ на водные микроорганизмы [54].
Изучение влияния наноматериалов на микрофлору активного ила очень важно, так как снижение эффективности процессов очистки сточных вод приводит к попаданию необработанных стоков в окружающую среду. Показано, что структура микробного сообщества активного ила изменялась даже при кратковременном воздействии ОУНТ. Было отмечено негативное влияние ОУНТ на представителей семейства Sphingomonadaceae, играющих важную роль в деградации ксенобиотиков и формировании хлопьев. При этом прямой контакт нанотрубок с микробными клетками в данном случае был маловероятен, так как УНТ включаются во внеклеточный полимерный матрикс, предохраняющий клетки от их прямого воздействия [55].
Деградация УНТ почвенными микроорганизмами. Поведение УНТ в окружающей среде должно рассматриваться с позиции возможной биодеградации этих материалов. Методом меченых атомов было показано, что микробное сообщество в присутствии дополнительного источника углерода способно к биодеградации МУНТ. Среди бактерий, осуществляющих биодеградацию МУНТ, идентифицированы Burkholderia kururiensis, Delftia acidovorans и Stenotrophomonas maltophilia. Они осуществляли разложение МУНТ до углекислого газа через промежуточные продукты, такие как 2‑метоксинафталин, 2-нафтол, коричный альдегид и изофталевую кислоту [56].
Штамм Mycobacterium vanbaalenii PYR-1, деградирующий углеводороды, способен разлагать немодифицированные и функционализированные карбоксильными группами МУНТ, причем последние в большей степени. За 25 дней роста штамма на среде с глюкозой или с глюкозой и пиреном наблюдали морфологические изменения в УНТ обоих типов: МУНТ становились более короткими и тонкими с сильно разупорядоченной трубчатой структурой, изломами и изгибами, сломанными концами. Деградация происходила, вероятно, путем окисления кристаллических решеток и последующего отслоения графитовых стенок. По мнению авторов [57], каротиноиды у микобактерий могут защищать их от окислительного стресса, индуцированного МУНТ.
Возникает вопрос, каким образом УНТ подвергаются микробному разложению. Основная структура УНТ представлена ароматическими кольцами, которые соединены друг с другом через sp2-гибридизированный углерод. Эта структура аналогична полициклическим ароматическим углеводородам и представляется стабильной, однако пентагон-гептагонные пары, известные как дефект Стоуна–Уэйлса, sp3-гибридизированные атомы углерода, открытые концы делают УНТ более реакционноспособными [58] и доступными для атаки ферментов.
Устойчивые к наноматериалам почвенные бактерии, идентифицированные как Trabusiella guamensis, осуществляли биотрансформацию МУНТ через поверхностное окисление. Тем не менее, структурные трансформации МУНТ при воздействии микроорганизмов все еще не ясны [59].
Грибы также способны к биодеградации УНТ. Так, Sparassis latifolia секретируют лигнин-пероксидазу, которая участвует в биодеградации термически обработанных и неочищенных ОУНТ [60]. Марганец-зависимая пероксидаза из Phanerochaete chrysosporium, вызывающего белую гниль, способна разлагать немодифицированные ОУНТ [61].
Результаты, касающиеся деградации УНТ, позволяют сформулировать несколько заключений. Во-первых, поверхностные модификации или функционализация УНТ могут либо усилить, либо ингибировать биодеградацию, поэтому этот процесс зависит от используемых добавок. Во-вторых, микробные сообщества гораздо более перспективны для биодеградации наноматериалов, чем чистые культуры. Кроме того, среды, загрязненные УНТ, могут быть загрязнены графеном и его производными, поэтому важно понять возможность совместной биодеградации этих наноматериалов [61].
Данные, касающиеся биодеградации и биотрансформации УНТ микроорганизмами, пока немногочисленны, и нанотрубки вряд ли можно отнести к легко деградируемым материалам. Это связано не только с их стабильной структурой, но и относительно недавним их появлением, а микрофлоре природных сред необходимо время для адаптации к новым углеродным наноструктурам, созданным человеком.
БИОТЕХНОЛОГИЧЕСКОЕ ПРИМЕНЕНИЕ УГЛЕРОДНЫХ НАНОТРУБОК
Можно выделить основные направления использования УНТ в биотехнологиях, базирующихся на использовании микроорганизмов – это, главным образом, технологии очистки воды, основанные на сорбционных свойствах нанотрубок, которые могут концентрировать и удалять бактерии, и в то же время служить носителем для микроорганизмов, способных к биодеградации поллютантов; это создание микробных топливных элементов (МТЭ), где используется такое важное свойство УНТ, как повышенная электропроводность; это биосенсоры, в которых нанотрубки являются носителем для клеток микроорганизмов и электронопроводящей подложкой.
В области экологической биотехнологии можно выделить два, казалось бы, противоречащих друг другу направления использования УНТ: во-первых, это предотвращение биообрастания, которое осуществляется путем введения нанотрубок, проявляющих микробицидные свойства, в композиционные материалы, а также покрытия поверхности различных материалов, трубопроводов, фильтров и т.д., а во-вторых, формирование требуемой биопленки на подложке из УНТ со сниженной цитотоксичностью [35]. Изменение гидрофобно-гидрофильных свойств материала может осуществляться за счет различных веществ, модифицирующих УНТ, в результате чего поверхность будет либо защищена от микробной адгезии и формирования биопленок, либо наоборот, предпочтительна для их формирования [62].
УНТ в очистке воды и технологиях биоремедиации. Способность УНТ к агрегации может быть использована для удаления биозагрязнений – бактерий и вирусов из сточных вод. В отличие от активных углей, нанотрубки не только адсорбируют бактерии, но и способствуют обезвреживанию патогенов благодаря своей бактерицидной природе. Гладкая поверхность клеток грамположительных бактерий делает их более восприимчивыми к воздействию УНТ по сравнению с грамотрицательными. Эффект нарушения целостности клеточной оболочки может быть увеличен при диспергировании нанотрубок в растворе, увеличении их концентрации и скорости перемешивания при инкубации [38].
Мембранная фильтрация является эффективным методом удаления бактерий и вирусов из воды и сточных вод. Однако биологическое обрастание мембран является основным препятствием для более широкого применения мембранной технологии. Композитные мембраны, содержащие углеродные нанотрубки, более устойчивы к биообрастанию [63]. Разработаны мембраны для ультрафильтрации воды, содержащие вертикально ориентированные нанотрубки. Такие мембраны миллиметровой толщины обеспечивали пропускную способность 30.000 л · м–2 · ч–1 · бар–1 и были устойчивы к образованию биопленок на поверхности [64].
В ряде научных работ было показано, что УНТ воздействовали на биодеградацию поллютантов в различных средах [65–68]. Так, немодифицированные и окисленные МУНТ влияли на скорость деградации атразина – гербицида из класса хлортриазинов, актинобактериями Arthrobacter sp. При концентрации нанотрубок 25 мг/л скорость биодеградации увеличивалась на 20%, тогда как при концентрации 100 мг/л снижалась на 50%. Стимулирующий эффект малых концентраций МУНТ заключался в усилении роста бактерий и сверхэкспрессии генов деградации. УНТ стимулировали или угнетали процесс биодеградации за счет сочетания двух различных эффектов: токсического воздействия на микробную активность и изменения биодоступности разлагаемого вещества в результате процессов сорбции–десорбции [66].
Воздействие УНТ на рост и биодеградацию бифенила у Dyella ginsengisoli LA-4 было концентрационно-зависимым. При концентрации 1–1.5 мг/л МУНТ и карбоксилированные ОУНТ усиливали рост клеток и деградацию бифенила. УНТ агрегировали и адсорбировали клетки и бифенил, создавая подходящее микроокружение для размножения клеток, в котором бактерии могли легче утилизировать этот органический поллютант [67].
Агрегация УНТ с Ralstonia solanacearum в водной среде обеспечивала эффективное удаление микроцистина – токсина, продуцируемого некоторыми цианобактериями. R. solanacearum был способен к биодеградации микроцистина, а УНТ даже при большом разведении адсорбировали значительное количество этого вещества и способствовали агрегации бактерий-биодеструкторов, повышая эффективность процесса [65].
Устойчивость к урану у клеток Bacillus mojavensis, способных к его аккумуляции, при агрегации МУНТ повышалась почти в 7 раз, и составляла 25.8 мг/г. Колонка с иммобилизованным биосорбентом могла быть использована повторно в 30 циклах адсорбции–десорбции [69].
Кроме того было показано, что УНТ могут являться носителем для иммобилизации клеток в биокаталитических технологиях. Так, был получен гетерогенный биокатализатор для трансформации нитрилов в амиды и амидов в соответствующие карбоновые кислоты на основе клеток R. ruber gt1, R. erythropolis 11-2 и A. faecalis 2, агрегированных с МУНТ, и показано сохранение нитрилгидратазной и амидазной активности бактерий [27].
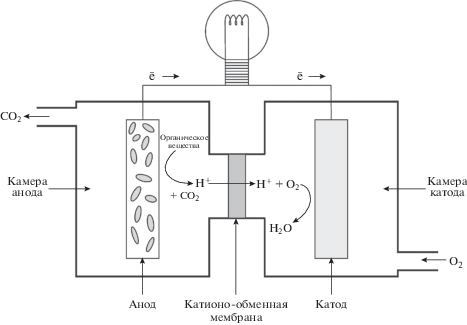
Микробные топливные элементы (МТЭ). МТЭ – это электрохимические устройства, в которых электрический ток генерируется биомассой клеток микроорганизмов. Основным отличием МТЭ от других топливных элементов является присутствие биокатализатора – электрогенных микроорганизмов (бактерий или водорослей) на поверхности анода. Типичный МТЭ состоит из анода, катода, мембраны и коллекторов тока (рис. 2). Конструирование и использование МТЭ представляет значительный интерес благодаря возможности получения энергии из органических отходов и биодеградабельного сырья. Тем не менее, широкое коммерческое использование этой технологии ограничено из-за низкой каталитической активности микроорганизмов и высокой стоимости материалов для создания МТЭ. В прошедшее десятилетие эффективность МТЭ удалось значительно повысить благодаря применению новых материалов, позволяющих получить более высокую плотность тока. Главным образом, это касается применения наноматерилов в конструкции анода [70].
Перспективность использования УНТ для увеличения электропроводности в МТЭ обосновывается в ряде научных работ [71–78]. В составе электродов могут быть как немодифицированные [75], так и ФУНТ или различные композиции наноматериалов [76–78]. Нанотрубки, функционализированные ионными жидкостями с терминальными группами NH2, усиливали межфазный перенос электронов от клеток Shewanella putrefaciens, иммобилизованных на аноде в составе МТЭ. Композиционный материал такого типа не только усиливает адгезию клеток S. putrefaciens, но и увеличивает как опосредованный флавином, так и прямой электронный трансфер между бактериальными клетками и анодом. Такой анод обеспечивал в 3 раза большую плотность тока, чем анод из немодифицированных УНТ, так как введение ионных жидкостей значительно увеличивало положительный заряд нанотрубок, не изменяя при этом их морфологию [76].
Композит из МУНТ и восстановленного оксида графена, в котором встроенные МУНТ не только предотвращают агрегацию слоев оксида графена, но и действуют как мостики, увеличивающие связи между слоями, обладает трехмерной пористой структурой с большой удельной поверхностью, отличной биосовместимостью и способностью к переносу электронов с высокой скоростью. Анод такого типа в МТЭ на основе штамма Shewanella putrefaciens CN32 обеспечивал максимальную удельную мощность, равную 789 мВт · м–2, что гораздо выше, чем анод на основе углеродных нанотрубок или восстановленного оксида графена по отдельности, и в 6 раз выше, чем на основе углеродной ткани [77].
Новая технология биологического получения водорода – микробные электролизные ячейки, была разработана на основе МТЭ. Ключевой момент этой технологии заключается в получении водорода из органических отходов через микробный электролиз. Микроорганизмы окисляют органическое вещество до углекислого газа, электронов и протонов, перенося электроны, полученные из окислительных реакций, на анод, и выделяя протоны в раствор. Водород образуется на катоде в реакции взаимодействия протонов и электронов при подаче дополнительного напряжения. При осуществлении этой технологии биокатод также может быть модифицирован углеродными наноматериалами, в частности в работе [79] использован композиционный материал полианилин/МУНТ в составе биокатода для получения биоводорода в однокамерной безмембранной электролизной ячейке.
Биосенсоры. Микробный биосенсор – это аналитическое устройство, состоящее из объединенных с передающим элементом микроорганизмов, предназначенное для определения широкого ряда химических загрязнителей, которое происходит через изменение дыхания и метаболизма живых организмов. Живые клетки способны аэробно или анаэробно конвертировать органический субстрат в различные продукты, такие как углекислый газ, аммиак, кислоты, что может быть легко определено с помощью различных трансдьюсеров. Преимущества микробных биосенсоров заключаются в адаптации к неблагоприятным факторам окружающей среды, в отсутствии дорогостоящей и трудоемкой процедуры выделения внутриклеточных ферментов, в пропорциональном количественном изменении респираторной и метаболической активности в ответ на присутствие токсичных веществ. Основным недостатком цельноклеточных сенсоров является ограничение диффузии аналита через клеточную стенку микроорганизма, что замедляет ответ в сравнении с биосенсорами на основе ферментов. Увеличение биодоступности контаминанта для клеток может быть достигнуто различными путями: физическими методами (замораживание-оттаивание), химическими методами (воздействие детергентов, растворителей), энзиматически (применение лизоцима), либо путем увеличения поверхности, доступной для иммобилизации клеток, в частности, путем использования наноматериалов, таких как углеродные нанотрубки [35].
Благодаря большой удельной поверхности и хорошей проводимости углеродные нанотрубки действуют как “электропроводка” между окислительно-восстановительным центром фермента и поверхностью электрода, что делает их отличным материалом для конструирования электрохимических биосенсоров [80]. В технологии создания микробных биосенсоров использование УНТ также обосновано такими их преимуществами перед другими материалами, как высокая электропроводность, лучшая операционная стабильность, устойчивость в высоком диапазоне температуры и рН [35]. Кроме того, УНТ проявляют такие уникальные оптические свойства, как фотолюминесценция в ближнем инфракрасном диапазоне и сильное резонансное Рамановское рассеяние, при этом они имеют низкий автофлюоресцентный фон и практически нечувствительны к фотообесцвечиванию в отличие от органических красителей, что делает их отличными кандидатами для биологической детекции [81, 82].
В работе [83] разработан биоэлектрод на основе перфторированной ионообменной смолы Nafion с МУНТ и бактериями E. coli BL21 (DE3), эксперссирующими ксилозодегидрогеназу на поверхности клеток. Такой биосенсор был высокочувствителен по отношению к D-ксилозе, не проявлял интерференции с другими сахарами, имел низкий пороговый уровень по отношению к аналиту (0.5 мкмоль), обладал хорошей долговременной стабильностью и воспроизводимостью ответа.
Бактерии могут являться не только частью биосенсора, но и аналитом. Был разработан селективный и чувствительный биосенсор для определения грамположительных и грамотрицательных бактерий, основанный на МУНТ, функционализированных карбоксильными группами c иммобилизованным на них антимикробном пептиде клаванине А. Этот биосенсор был использован для детекции Klebsiella pneumoniae, Enterococcus faecalis, E. coli и B. subtilis [84]. МУНТ были использованы для модификации дискового стеклоуглеродного электрода, что позволило быстро и количественно определять присутствие энтеротоксигенной E. coli F4 (K88) (ETEC F4) в природных образцах без предварительной обработки [85]. ОУНТ, функционализированные бактериофагом М13, были использованы как зонды для распознавания F+ и F– бактериальных штаммов. Также путем одношаговой модификации к таким ОУНТ были присоединены антитела к определенным бактериям и разработана процедура детекции внутримышечных инфекций S. aureus. Биологически функционализированные водно-дисперсные зонды на основе ОУНТ обладают возможностями для исследования бактериальных инфекций в организме, например, эндокардитов [81].
Аптамеры – короткие одноцепочечные олигонуклеотиды, способные с высокой аффинностью и эффективностью связываться с молекулами различной природы [86], могут быть использованы в качестве молекулярных рецепторов в биосенсорах различных видов. Были разработаны электрохимические биосенсоры для определения Salmonella Typhimurium, в частности, был получен линейный ответ биосенсора в диапазоне от 0.2 до 103 КОЕ · мл–1 при взаимодействии пилей IVB типа у сальмонелл с ОУНТ, функционализированными РНК-аптамером. Кроме электрохимических биосенсоров, для определения P. aeruginosa, S. Typhimurium и Lactobacillus acidophilus были использованы оптические биосенсоры, действие которых основано на поверхностном плазмонном резонансе [87]. Перспективны разработки потенциометрических аптасенсоров нового поколения, содержащих в своем составе УНТ. Аптамеры способны к самосборке с УНТ через π–π взаимодействия. Присутствие таргетных бактерий приводит к конформационным изменениям в аптамере, происходит отделение от ОУНТ фосфодиэфирных групп, ионизированных при рН 7.4, изменяется заряд ОУНТ, и регистрируется изменение потенциала. При помощи таких аптасенсоров возможно определение ультранизких концентраций аналита в режиме реального времени [88]. Сконструирован наносенсор путем нековалентной конъюгации полинуклеотидного аптамера с ОУНТ, обладающими флюоресценцией вблизи инфракрасного диапазона, и изучен эффлюкс немеченной ГТФазы RAP1 и интегразы HIV из E. coli и дрожжей Pichia pastoris, иммобилизованных в микрофлюидной камере [89].
Таким образом, применение углеродных нанотрубок в биотехнологиях имеет большие перспективы, особенно в биодетекции и альтернативной энергетике.
* * *
Сфера применения УНТ постоянно расширяется. Уникальные адсорбционные и электронопроводящие свойства этих наноматериалов могут послужить основой биоремедиации, технологий получения биотоплива, альтернативной электроэнергии, конструирования биосенсоров. Цитотоксичность по отношению к микроорганизмам сильно зависит от условий контакта нанотрубок и клеток, от типа наноматериалов, их функционализации, концентрации, морфологических характеристик. В зависимости от задач могут быть подобраны условия и/или разработана определенная модификация УНТ, в результате чего эти наноматериалы могут служить диаметрально противоположным целям – от антимикробного воздействия до использования полезных свойств микроорганизмов. Создание новых композиционных материалов на основе УНТ позволит решать различные задачи, среди которых борьба с биообрастанием, очистка сточных вод и создание биологически совместимых устройств с улучшенными производственными характеристиками.
Работа выполнена в рамках государственного задания, номер госрегистрации темы 01201353249.
Список литературы
Елецкий А.В. // Успехи физических наук. 1997. Т. 167. № 9. С. 945–972.
Aqel A., El-Nour K.M.M.A., Ammar R.A.A., Al-Warthan A. // Arabian J. Chem. 2012. V. 5. № 1. P. 1–23.
Chaturvedi S., Dave P.N., Shah N.K. // J. Saudi Chem. Soc. 2012. V. 16. № 3. P. 307–325.
Zobell C.E. // J. Bacteriol. 1943. V. 46. № 1. P. 39–56.
Kang S., Pinault M., Pfefferle L.D., Elimelech M. // Langmuir. 2007. V. 23. № 17. P. 8670–8673.
Kang S., Herzberg M., Rodrigues D.F., Elimelech M. // Langmuir. 2008. V. 24. № 13. P. 6409–6413.
Зарубина А.П., Лукашев Е.П., Деев Л.И., Пархоменко И.М., Рубин А.Б. // Российские нанотехнологии. 2009. Т. 4. № 11–12. С. 152–155.
Liu S., Ng A.K., Xu R., Wei J., Tan C.M., Yang Y., Chen Y. // Nanoscale. 2010. V. 2. № 12. P. 2744–2750.
Yang C., Mamouni J., Tang Y., Yang L. // Langmuir. 2010. V. 26. № 20. P. 16013–16019.
Jackson P., Jacobsen N.R., Baun A., Birkedal R., Kühnel D., Jensen K.A., Vogel U., Wallin H. // Chem. Cent. J. 2013. 7:154.
Dong X., Tang Y., Wu M., Vlahovic B., Yang L. // J. Biol. Eng. 2013. 7:19.
Upadhyayula V.K.K., Deng S., Smith G.B., Mitchell M.C. // Water Res. 2009. V. 43. № 1. P. 148–156.
Sah U., Sharma K., Chaudhri N., Sankar M., Gopinath P. // Colloids Surf., B. 2018. V. 162. P. 108–117.
Vecitis C.D., Zodrow K.R., Kang S., Elimelech M. // ACS Nano. 2010. V. 4. № 9. P. 5471–5479.
Chen M., Zeng G., Xu P., Yan M., Xiong W., Zhou S. // Environ. Sci.: Nano. 2017. V. 4. № 10. P. 1954–1960.
Bai Y., Park I.S., Lee S.J., Bae T.S., Watari F., Uo M., Lee M.H. // Carbon. 2011. V. 49. № 11. P. 3663–3671.
Zardini H.Z., Amiri A., Shanbedi M., Maghrebi M., B-aniadam M. // Colloids Surf., B. 2012. V. 92. P. 196–202.
Chi M.-F., Wu W.-L., Du Y., Chin C.-J. M., Lin C.-C. // J. Hazard. Mater. 2016. V. 318. P. 507–514.
Maas M. // Materials. 2016. V. 9. № 8. pii: E617.
Qi X., Gunawan P., Xu R., Chang M.W. // Chem. Eng. Sci. 2012. V. 84. P. 552–556.
Dizaj S.M., Mennati A., Jafari S., Khezri K., Adibkia K. // Adv. Pharm. Bull. 2015. V. 5. № 1. P. 19–23.
Патент США. 2012. № 20120213663.
Патент США. 2014. № 8754041.
Lin N. Berton P., Moraes C., Rogers R.D., Tufenkji N. // Adv. Colloid Interfac. 2018. V. 252. P. 55–68.
Phillips C.L., Yah C.S., Iyuke S.E., Rumbold K., Pillay V. // J. Saudi Chem. Soc. 2015. V. 19. № 2. P. 147–154.
Park W.-I., Kim H.-S., Kwon S.-M., Hong Y.-H., Jin H.-J. // Carbohydr. Polym. 2009. V. 77. № 3. P. 457–463.
Максимова Ю.Г., Никулин С.М., Осовецкий Б.М., Демаков В.А. // Прикл. биохимия и микробиология. 2017. Т. 53. № 5. С. 462–469.
Brandeburová P., Bírošová L., Vojs M., Kromka A., Gál M., Tichý J., Híveš J., Mackuľak T. // Monatsh. Chem. 2017. V. 148. № 3. P. 525–530.
Дерябин Д.Г., Васильченко А.С., Алешина Е.С., Тлягулова А.С., Никиян А.Н. // Российские нанотехнологии. 2010. Т. 5. № 11–12. С. 103–108.
Di Sotto A., Chiaretti M., Carru G.A., Bellucci S., Mazzanti G. // Toxicol. Lett. 2009. V. 184. № 3. P. 192–197.
Arias L.R., Yang L. // Langmuir. 2009. V. 25. № 5. P. 3003–3012.
Zhu B., Xia X., Xia N., Zhang S., Guo X. // Environ. Sci. Technol. 2014. V. 48. № 7. P. 4086–4095.
Goodwin Jr. D.G., Marsh K.M., Sosa I.B., Payne J.B., Gorham J.M., Bouwer E.J., Fairbrother D.H. // Environ. Sci. Technol. 2015. V. 49. № 9. P. 5484–5492.
Zhao X., Liu R. // Environ. Int. 2012. V. 40. P. 244–256.
Upadhyayula V.K.K., Gadhamshetty V. // Biotechnol. Adv. 2010. V. 28. № 6. P. 802–816.
Sun Y., Zhang Z. // Int. Biodeterior. Biodegrad. 2016. V. 110. P. 147–154.
Goodwin D.G., Jr., Xia Z., Gordon T.B., Gao C., Bouwerb E.J., Fairbrother D.H. // Environ. Sci.: Nano. 2016. V. 3. № 3. P. 545–558.
Das R., Hamid S.B.A., Ali M.E., Ismail A.F., Annu-ar M.S.M., Ramakrishna S. // Desalination. 2014. V. 354. P. 160–179.
Chen H., Wang B., Gao D., Guan M., Zheng L., Ouyang H., Chai Z., Zhao Y., Feng W. // Small. 2013. V. 9. № 16. P. 2735–2746.
Khodakovskaya M.V., de Silva K., Biris A.S., Dervishi E., Villagarcia H. // ACS Nano. 2012. V. 6. № 3. P. 2128–2135.
Khodakovskaya M.V., Kim B.-S., Kim J.N., Alimohammadi M., Dervishi E., Mustafa T., Cernigla C.E. // Small. 2013. V. 9. № 1. P. 115–123.
Zaytseva O., Neumann G. // Chem. Biol. Technol. Ag-ric. 2016. 3:17
Shrestha B., Acosta-Martinez V., Cox S.B., Green M.J., Li S., Cañas-Carrell J.E. // J. Hazard. Mater. 2013. V. 261. P. 188–197.
Abbasian F., Lockington R., Palanisami T., Megharaj M., Naidu R. // Sci. Total Environ. 2016. V. 539. P. 370–380.
Shrestha B., Anderson T.A., Acosta-Martinez V., Payton P., Cañas-Carrell J.E. // Ecotoxicol. Environ. Saf. 2015. V. 116. P. 143–149.
Kerfahi D., Tripathi B.M., Singh D., Kim H., Lee S., Lee J., Adams J.M. // PLoS ONE. 2015. V. 10(3): e0123042.
Hao Y., Ma C., Zhang Z., Song Y., Cao W., Guo J., Zhou G., Rui Y., Liu L., Xing B. // Environ. Pollut. 2018. V. 232. P. 123–136.
Chung H., Son Y., Yoon T.K., Kim S., Kim W. // Ecotoxicol. Environ. Saf. 2011. V. 74. № 4. P. 569–575.
Jin L, Son Y, Yoon T.K, Kang Y.J, Kim W., Chung H. // Ecotoxicol. Environ. Saf. 2013. V. 88. P. 9–15.
Chen Q., Wang H., Yang B., He F., Han X., Song Z. // Sci. Total Environ. 2015. V. 505. P. 649–657.
Su Y., Zheng X., Chen A., Chen Y., He G., Chen H. // Chem. Eng. J. 2015. V. 279. P. 47–55.
Zheng X., Su Y., Chen Y., Huang H., Shena Q. // Sci. Total Environ. 2018. V. 613–614. P. 1240–1249.
Wang F., Yao J., Liu H., Liu R., Chen H., Yi Z., Yu Q., Ma L., Xing B. // J. Hazard. Mater. 2015. V. 292. P. 137–145.
Zhu B., Xia X., Zhang S., Tang Y. // Environ. Pollut. 2018. V. 234. P. 581–589.
Goyal D., Zhang X.J., Rooney-Varga J.N. // Lett. Appl. Microbiol. 2010. V. 51. № 4. P. 428–435.
Zhang L., Petersen E.J., Habteselassie M.Y., Mao L., Huang Q. // Environ. Pollut. 2013. V. 181. P. 335–339.
You Y, Das K.K., Guo H., Chang C.W., Navas-Moreno M., Chan J.W., Verburg P., Poulson S.R., Wang X., Xing B., Yang Y. // Environ. Sci. Technol. 2017. V. 51. № 4. P. 2068–2076.
Моливер С.С., Зимагуллов Р.Р., Семенов А.Л. // Письма в ЖТФ. 2011. Т. 37. № 14. С. 68–75.
Chouhan R.S., Qureshi A., Yagci B., Gülgün M.A., Ozguz V., Niazi J.H. // Chem. Eng. J. 2016. V. 298. P. 1–9.
Chandrasekaran G., Choi S.-K., Lee Y.-C., Kim G.-J., Shin H.-J. // J. Ind. Eng. Chem. 2014. V. 20. № 5. P. 3367–3374.
Chen M., Qin X., Zeng G. // Trends Biotech. 2017. V. 35. № 9. P. 836–846.
Raie D.S., Mhatre E., El-Desouki D.S., Labena A., El-Ghannam G., Farahat L.A., Youssef T., Fritzsche W., Kovács Á.T. // Materials. 2018. V. 11. № 1. pii: E157.
Alvarez N.T., Noga R., Chae S.-R., Sorial G.A., Ryu H., Shanov V. // Biofouling. 2017. V. 33. № 10. P. 847–854.
Lee B., Baek Y., Lee M., Jeong D.H., Lee H.H., Yoon J., Kim Y.H. // Nat. Commun. 2015. 6:7109.
Yan H., Pan G., Zou H., Li X., Chen H. // Chin. Sci. Bull. 2004. V. 49. № 16. P. 1694–1698.
Zhang C., Li M., Xu X., Liu N. // J. Hazard. Mater. 2015. V. 287. P. 1–6.
Qu Y., Wang J., Zhou H., Ma Q., Zhang Z., Li D., Shen W., Zhou J. // Environ. Sci. Pollut. Res. 2016. V. 23. № 3. P. 2864–2872.
Yang F., Jiang Q., Zhu M., Zhao L., Zhang Y. // Sci. T-otal. Environ. 2017. V. 577. P. 54–60.
Özdemir S, Oduncu M.K., Kilinc E., Soylak M. // J. Environ. Manage. 2017. V. 187. P. 490–496.
Sonawane J.M., Yadav A., Ghosh P.C., Adeloju S.B. // Biosens. Bioelectron. 2017. V. 90. P. 558–576.
Sharma T., Reddy A.L.M., Chandra T.S., Ramaprabhu S. // Int. J. Hydrogen Energy. 2008. V. 33. № 22. P. 6749–6754.
Minteer S.D., Atanassov P., Luckarift H.R., John-son G.R. // Materials today. 2012. V. 15. № 4. P. 166–173.
Ghasemi M., Daud W.R.W., Hassan S.H.A., Ohc S.-E., Ismail M., Rahimnejad M., Jahim J.M. // J. Alloys Compd. 2013. V. 580. P. 245–255.
Zhang X., Epifanio M., Marsili E. // Electrochim. Acta. 2013. V. 102. P. 252–258.
He Y., Liu Z., Xing X.-h., Li B., Zhang Y., Shen R., Zhu Z., Duan N. // Biochem. Eng. J. 2015. V. 94. P. 39–44.
Wei H., Wu X.-S., Zou L., Wen G.-Y., Liu D.-Y., Qiao Y. // J. Power Sources. 2016. V. 315. P. 192–198.
Zou L., Qiao Y., Wu X.-S., Li C.M. // J. Power Sources. 2016. V. 328. P. 143–150.
Yazdi A.A., D’Angelo L., Omer N., Windiasti G., Lu X., Xu J. // Biosens. Bioelectron. 2016. V. 85. P. 536–552.
Chen Y., Xu Y., Chen L., Li P., Zhu S., Shen S. // Energy. 2015. V. 88. P. 377–384.
Lawal A.T. // Mater. Res. Bull. 2016. V. 73. P. 308–350.
Bardhan N.M., Ghosh D., Belcher A.M. // Nat. Commun. 2014. V. 5:4918.
Sireesha M., Babu V.J., Ramakrishna S. // J. Mater. Sci. Eng. B. 2017. V. 223. P. 43–63.
Li L., Liang B., Shi J., Li F., Mascini M., Liu A. // Biosens. Bioelectron. 2012. V. 33. № 1. P. 100–105.
Andrade C.A.S., Nascimento J.M., Oliveira I.S., de Olivei-ra C.V.J., de Melo C.P., Franco O.L., Oliveira M.D.L. // Colloids Surf. B. 2015. V. 135. P. 833–839.
Tarditto L.V., Arévalo F.J., Zon M.A., Ovando H.G., Vettorazzi N.R., Fernández H. // Microchem. J. 2016. V. 127. P. 220–225.
Лахин А.В., Тарантул В.З., Генинг Л.В. // Acta Naturae. 2013. Т. 5. № 4(19). С. 37–48.
Templier V., Roux A., Roupioz Y., Livache T. // Trends Anal. Chem. 2016. V. 79. P. 71–79.
Zelada-Guillén G.A., Blondeau P., Rius F.X., Riu J. // Methods. 2013. V. 63. № 3. P. 233–238.
Landry M.P., Ando H., Chen A.Y., Cao J., Kottadiel V.I., Chio L., Yang D., Dong J., Lu T.K., Strano M.S. // Nat. Nanotechnol. 2017. V. 12. № 4. P. 368–377.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология