Прикладная биохимия и микробиология, 2019, T. 55, № 1, стр. 25-33
Спонтанный протеолитический процессинг рекомбинантного антимюллерова гормона человека: структурные и функциональные различия молекулярных форм
А. Я. Рак 1, 2, *, А. В. Трофимов 1, Е. А. Протасов 1, С. В. Родин 1, А. В. Жахов 1, Я. А. Забродская 1, 3, А. М. Ищенко 1
1 Государственный научно-исследовательский институт особо чистых биопрепаратов ФМБА России
197110 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
3 Научно-исследовательский институт гриппа Минздрава России
197376 Санкт-Петербург, Россия
* E-mail: rak@hpb-spb.com
Поступила в редакцию 20.03.2018
После доработки 20.07.2018
Принята к публикации 25.07.2018
Аннотация
Описана технология получения высокоочищенных препаратов рекомбинантного антимюллерова гормона человека – потенциального противоопухолевого агента для терапии некоторых видов злокачественных новообразований. Установлено, что в процессе хранения этих препаратов в физиологических условиях возможен спонтанный протеолитический процессинг гормона, приводящий к образованию его С-концевого гомодимера (активированной формы), а затем, вследствие дальнейшего протеолиза, неактивного состояния. Определены сайты, по которым при длительном хранении происходил спонтанный процессинг молекулы гормона с образованием активных и неактивных фрагментов. Проанализированы структурные и функциональные различия молекулярных форм его С-концевого фрагмента, входящих в состав препаратов.
Антимюллеров гормон (АМГ – вещество, ингибирующее мюллеровы протоки, Mullerian inhibitory substance, MIS) – один из наименее изученных гликопротеинов суперсемейства TGF-β. Он является как эмбриональным, так и постнатальным регулятором развития и функционирования репродуктивной системы млекопитающих [1]. Рекомбинантный АМГ (рАМГ) также обладает противоопухолевой активностью по отношению к клеткам ряда опухолей человека [2, 3]. Молекула АМГ массой около 140 кДа представляет собой гомодимер, оба мономера которого содержат в своей последовательности сайт протеолитического расщепления, локализованный между аминокислотными остатками Arg427 и Ser428. Специфический протеолиз молекулы полноразмерного гормона по данному сайту приводит к ее расщеплению на N- и С-концевой гомодимеры, имеющие молекулярные массы около 115 и 25 кДа соответственно [1]. В физиологических условиях N- и С-концевой димеры АМГ после протеолиза образуют нековалентно ассоциированный комплекс. Известно, что, в отличие от N-концевого, С-концевой гомодимер АМГ является биологически активным [4]. Предполагают, что протеолиз АМГ in vivo происходит в процессе биосинтеза гормона или под действием фурина или плазмина при его поступлении в ткани и взаимодействии со специфическими рецепторами АМГ I и II типа – MISRI и MISRII соответственно [5–7].
Цель работы – получение и характеристика высокоочищенных препаратов рАМГ и его активной формы – C-концевого фрагмента.
МЕТОДИКА
Для получения препаратов рАМГ использовали культуральную жидкость клеток линии СНО (“American Type Tissue Collection”, США), трансфицированных геном АМГ человека (штамм продуцента CHO-MIS#26) [8]. Клетки культивировали в реакторе Wave Bioreactor 20/50 System (“GE Healthcare”, США) в бессывороточной среде CDM4CHO (“HyClone”, США). Культуральную жидкость отделяли центрифугированием, осветляли и использовали для выделения полноразмерного рАМГ, из которого далее получали производные гормона и его С-концевого фрагмента.
Для изучения свойств рАМГ и его производных были использованы различные типы моноклональных антител мыши (ФГУП “Гос. НИИ ОЧБ” ФМБА России) и разработанные на их основе варианты тест-систем. Антитела ACMIS-3 и конъюгированные с пероксидазой хрена антитела ACMIS-4 (ACMIS-4-Пх) распознавали различные эпитопы С-концевого фрагмента рАМГ, но не взаимодействовали с полноразмерным гормоном. В связи с этим созданная на основе этих антител иммуноферментная тест-система: (ACMIS-3) – рАМГ – (ACMIS-4-Пх) (I) использовалась для количественного определения в варианте гетерогенного сэндвич-иммуноферментного анализа (ИФА) молекул, содержащих С-концевой фрагмент рАМГ. Антитела М2, распознающие только полноразмерный рАМГ и его производные, содержащие N-концевой фрагмент, применялись для выделения и очистки полноразмерного рАМГ последовательно с антителами ACMIS-1. Они использовались также для детекции N-концевого фрагмента рАМГ в прямом твердофазном ИФА.
Биологическая активность препаратов рАМГ оценивалась по способности связываться с внеклеточной частью специфического рецептора АМГ – MISRII [8]. Для этого была разработана специальная иммуноферментная тест-система, ключевым компонентом которой являлся полученный ранее рекомбинантный химерный белок MISRII+Fc, состоящий из внеклеточной части MISRII и Fc-фрагмента иммуноглобулина IgG1 человека. В тест-системе использовались также антитела И4, специфичные к Fc-фрагменту иммуноглобулина IgG1 человека, и пероксидазный конъюгат ACMIS-4-Пх. На первом этапе анализа с применением этой тест-системы проводили сорбцию антител И4, которые (1.5 мкг/мл в 20 мМ боратном буфере, рН 8.0) вносили в лунки планшета. Они служили захватывающими антителами для химерной конструкции MISRII+Fc, обеспечивающими корректную ориентацию ее рецептор-специфической части в направлении лиганда вследствие специфичности к Fc-фрагменту IgG1. На следующем этапе в лунки планшета вносили раствор химерной MISRII-содержащей конструкции (100 нг/мл) в качестве специфического акцептора для тестируемых рАМГ. После внесения тестируемой пробы детекцию связанных с рецептором рАМГ осуществляли, используя конъюгат антител ACMIS-4-Пх (“Sigma”, США). Иммуноферментную реакцию регистрировали стандартным методом при 450 нм с использованием тетраметилбензидина и ридера для микроплат BioRad Reader Model 680 (“BioRad”, США). Схематически тест-систему для определения биологической активности рАМГ можно описать, как И4 – (MISRII+Fc) – рАМГ – (ACMIS-4-Пх) (II). Использование данной тест-системы давало возможность оценить количество биологически активного гормона и выразить его в единицах концентрации.
Калибровочные кривые для тест-систем I и II строили, используя в качестве стандарта очищенный C-концевой фрагмент рАМГ, полученный путем протеолиза плазмином полноразмерного гормона по ранее описанному методу [9] и его последующей очистки методом аффинной хроматографии на иммуносорбенте ACMIS-1-сефароза.
Полноразмерный рАМГ выделяли методом иммуноаффинной хроматографии из культуральной жидкости штамма продуцента. Иммуносорбенты были приготовлены путем иммобилизации моноклональных антител М2 и ACMIS-1 на CNBr-активированной сефарозе FF (“Pharmacia”, Швеция) по протоколу производителя. Фрагменты гормона получали из очищенного рАМГ после хранения в 20 мМ фосфатном буфере, рН 7.4, в течение длительного времени при 37°С.
Анализ препаратов рАМГ проводили методом электрофореза белков в полиакриламидном геле (ЭФ-ПААГ) в присутствии ДДС-Na и/или отсутствии восстанавливающего агента (β-меркаптоэтанола) по ранее описанной методике [10]. При этом использовался разделяющий гель с градиентной концентрацией акриламида 4–20% и концентрирующий гель с его концентрацией 5%. Для проведения ЭФ-ПААГ 1–2 мг/мл белка инкубировали в течение 5 мин при 95°С в присутствии β‑меркаптоэтанола (конечная концентрация – 2%) или без него, затем пробы объемом 15 мкл наносили на гель. ЭФ-ПААГ проводили в системе BioRad MiniProtean Tetra Cell (“BioRad”, США) при напряжении 40 V на один гель в течение 20 мин и далее – при силе тока 200 мА до конца электрофоретического разделения. Для визуализации результатов гель окрашивали Кумасси G-250 с последующей отмывкой 5%-ным раствором уксусной кислоты при комнатной температуре.
Фрагменты рАМГ фракционировали методом обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) на хроматографе Agilent 1260 (“Agilent Technologies”, Германия). Разделение проводили на колонке C18 “Jupiter” Phenomenex (4.6 × 250 мм, диаметр пор 300 Å) (“GE Healthcare”, Швеция). Элюцию осуществляли в течение 15 мин, при скорости потока 1.5 мл/мин в градиентной системе трифторуксусная кислота – ацетонитрил: 20–70%. Детекцию компонентов в ходе хроматографии проводили при 280 нм.
Для масс-спектрометрического изучения производные С-концевого фрагмента рАМГ обрабатывали дитиотрейтолом (ДТТ) (конечная концентрация 15 мМ), а затем – йодацетамидом (конечная концентрация 50 мМ). Образовавшиеся полипептиды вновь разделяли методом ОФ-ВЭЖХ. Полипептиды подвергали гидролизу трипсином (“Promega”, США) или протеазой GluC (“Sigma”, США) в 50 мM растворе бикарбоната аммония в течение 5 или 24 ч соответственно при 37°C согласно инструкции производителя. Полученные пептиды смешивали с матрицей HCCA (альфа-циано-4-гидроксикоричная кислота, “Bruker”, Германия), наносили на мишень “GroundSteel” (“Bruker”, Германия) и высушивали на воздухе. Масс-спектры получали на MALDI-TOF/TOF масс-спектрометре “UltrafleXtreme” (“Bruker”, Германия) в режиме регистрации положительных ионов. Для каждого спектра было просуммировано 3000 импульсов лазера. Идентификацию белков осуществляли с использованием поискового алгоритма Mascot (http://matrixscience.com) при обращении одновременно к базе данных SwissProt и локальной базе данных, в которую предварительно вносили последовательность рАМГ. Ошибка была ограничена 50 ppm, в качестве возможных модификаций пептидов также были указаны окисление метионинов и карбамидометилирование цистеинов. Для предсказания последовательностей пептидов по детектированным в масс-спектрах ионам дополнительно использовали программу “SequenceEditor”.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
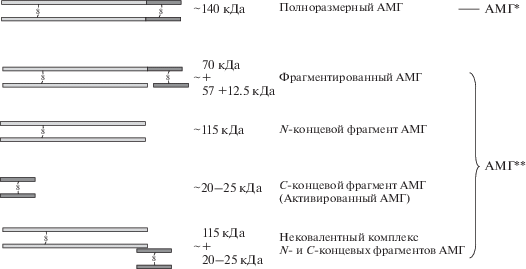
Предварительный анализ препаратов рАМГ, полученных после культивирования клеток штамма продуцента CHO-MIS#26, показал, что популяция молекул гормона, накапливающегося в культуральной среде, является гетерогенной. Она представлена не только полноразмерным рАМГ (рАМГ*), но и его производными (рАМГ**), среди которых нековалентный комплекс С- и N-концевых фрагментов, фрагментированный по одной цепи рАМГ и смесь изолированных С- и N-концевых фрагментов (рис. 1).
Рис. 1.
Схематическое изображение производных рАМГ, накапливающихся в культуральной жидкости клеток-продуцентов в процессе культивирования.
Для разделения производных рАМГ и выделения гомогенных фракций гормона был применен метод иммуноаффинной хроматографии с использованием антител различной специфичности. Для выделения полноразмерного рАМГ использовали метод двухступенчатой аффинной хроматографии на иммуносорбентах ACMIS-1-сефароза и М2-сефароза. Колонки, содержащие иммуносорбенты, уравновешивали 20 мМ фосфатным буфером, рН 7.4, содержавшим 0.15 М NaCl. На первом этапе очистки осветленную культуральную жидкость наносили на колонку с АСМIS-1-сефарозой для сорбции фрагментированного рАМГ. Затем неадсорбированные компоненты наносили на колонку с М2-сефарозой, на которой сорбировался рАМГ*. После промывки колонки уравновешивающим буфером и буфером, содержавшим 1 М NaCl, рАМГ* элюировали с иммуносорбента раствором 3 М MgCl2 в 20 мМ фосфатном буфере, pH 7.4.
Электрофоретический анализ нескольких элюатов показал, что содержащийся в них очищенный рАМГ* мигрировал в геле в области кажущихся молекулярных масс 150 кДа в виде широкой полосы, что характерно для гликозилированных белков, и не содержал примесных компонентов (рис. 2).
Рис. 2.
Электрофорез в ПААГ трех (1–3) препаратов рАМГ* (1 мкг белка/дорожку), очищенных методом двухступенчатой аффинной хроматографии на иммуносорбентах АСМIS-1- и М2-сефарозе; М – белки-маркеры молекулярных масс.

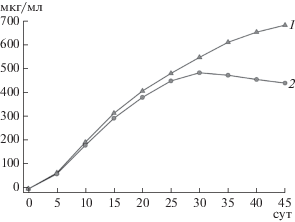
Для изучения стабильности очищенного рАМГ* его раствор (1 мг/мл) диализовали против 20 мМ фосфатного буфера, рН 7.4, стерилизовали путем микрофильтрации и хранили при 37°С. Через каждые 5 сут из него отбирали пробы для определения биологической активности, а также методом ИФА с помощью вышеописанных тест-систем I и II – общего количества образующегося рАМГ**. Результаты приведены на рис. 3. Очищенный рАМГ*, представляющий исходный препарат, не был способен к связыванию с рецептором и по результатам анализа в двух тест-системах характеризовался нулевым уровнем фрагментации. По мере его инкубации от 0 до 25 сут содержание рАМГ** в пробах возрастало, о чем свидетельствовали данные, полученные с помощью тест-системы I (рис. 3, кривая 1). Совпадение концентраций при тестировании обеими тест системами (I и II) указывало на то, что весь белок, содержащийся в этих пробах, был способен к взаимодействию с MISRII, то есть был биологически активен. При дальнейшей инкубации от 25 до 45 сут общее количество рАМГ** в пробах продолжало возрастать, в то время как доля биологически активного вещества достигала максимума к 30 сут, а затем начинала снижаться (рис. 3, кривая 2).
Рис. 3.
Содержание биологически активного рАМГ**, детектированное после длительной инкубации очищенного рАМГ* в 20 мМ фосфатном буфере, рН 7.4, при 37°С с помощью тест-системы I ACMIS-3 – рАМГ* – ACMIS-4-Пх (1) и тест-системы II И4 – MISRII+Fc – рАМГ – ACMIS-4-Пх (2).
Согласно дифференциальной специфичности тест-системы I, рост во времени концентрации распознаваемого материала в инкубационных пробах должен быть связан с фрагментацией рАМГ. Это отчетливо подтверждалось результатами ЭФ-ПААГ (рис. 4). Из представленной электрофореграммы следовало, что количество рАМГ* (дорожка 1) в процессе инкубации в течение 25 сут значительно уменьшалось вплоть до практически полного исчезновения, в то время как количество фрагментированных гетерогенных компонентов, диффузно распределяющихся в геле, возрастало. Одновременно в пробе накапливался белок с молекулярной массой около 20 кДа.
Рис. 4.
ЭФ-ПААГ исходного рАМГ* (1) и рАМГ после инкубации в 20 мМ фосфатном буфере, рН 7.4, в течение 15 (2) и 25 сут (3) при 37°С; М – белки-маркеры молекулярных масс.

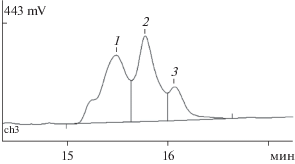
Для идентификации продуктов спонтанной фрагментации рАМГ*, образующихся в процессе инкубации к 25 сут (при максимальной рецептор-связывающей активности белка, см. рис. 3), был проведен анализ методом ОФ-ВЭЖХ (рис. 5а). Как видно из хроматограммы, продукт разделялся на два главных компонента и два минорных, обозначенных 2, 4 и 1, 3 соответственно.
Рис. 5.
ОФ-ВЭЖХ рАМГ* после инкубации в 20 мМ фосфатном буфере, рН 7.4, в течение 25 сут (а) и С‑концевого фрагмента рАМГ, полученного после обработки полноразмерного гормона плазмином (б).
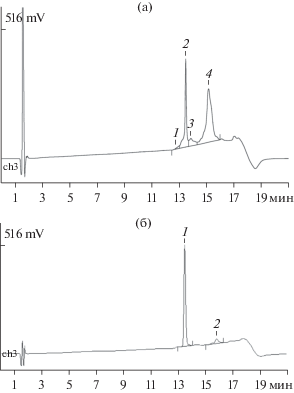
Полученные данные позволяли предположить, что пик, регистрируемый по времени удержания на колонке в области 13–14 мин, и детектируемый на электрофореграмме (рис. 4, дорожка 3) как белок с молекулярной массой около 20 кДа, соответствовал С-концевому фрагменту рАМГ, а пик 4 объединял гетерогенные фрагменты, не локализованные на электрофореграмме в виде четких полос.
В ходе дальнейшей работы более детально был изучен фрагмент, имеющий молекулярную массу около 20 кДа, с которым, согласно литературным данным, связывают проявление биологической активности АМГ [4]. Для того, чтобы проверить и подтвердить предположение о принадлежности этого спонтанно образовавшегося фрагмента С‑концевому гомодимеру рАМГ, стандартный о-бразец данного производного был получен независимо путем обработки рАМГ* плазмином (90 мин, 37°С при соотношении плазмина и белка 1 : 25) [10], очищен методом иммуноаффинной хроматографии на иммуносорбенте ACMIS-1-сефароза и подвергнут ОФ-ВЭЖХ (рис. 5б). Время удерживания на колонке С-концевого фрагмента рАМГ*, образующегося после его обработки плазмином, точно совпадало со временем удержания пика 2 – продукта спонтанной фрагментации рАМГ* при инкубации в течение 25 сут (рис. 5а, 5б), что подтверждало его принадлежность С-концевому фрагменту гормона. Можно также было заключить, что спонтанный протеолиз рАМГ протекал по связи Arg–Ser, поскольку показано, что плазмин так же, как и другие ферменты, ответственные за расщепление рАМГ на С- и N-концевые фрагменты, расщепляют полипептидную цепь in vivo именно по этой связи [8, 11]. Белок, содержащийся в пике 4 (рис. 5а), по результатам прямого твердофазного ИФА с использованием антител М2 и ACMIS-1, был идентифицирован как смесь фрагментированного по одной цепи рАМГ* и фрагментов гормона, содержащих N-концевой участок.
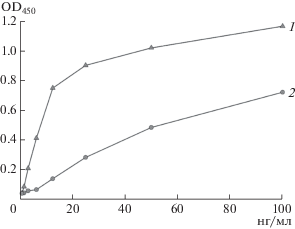
Далее были изучены причины инактивации рАМГ в процессе инкубации. Методом ОФ-ВЭЖХ С-концевые фрагменты были выделены из биологически активного рАМГ** (25 сут инкубации – препарат 1) и частично инактивированного рАМГ** (45 сут инкубации – препарат 2). Затем была изучена их способность связываться с рецептором MISRII в тест-системе II. Оказалось, что характер связывания С-концевых фрагментов, содержащихся в препаратах 1 и 2, с внеклеточной частью MISRII различен (рис. 6). Так, препарат 1 связывался с рецептором более интенсивно и это связывание характеризовалось тенденцией к насыщению. Эти результаты свидетельствовали о том, что причина потери биологической активности рАМГ** вызвана инактивацией именно С-концевого фрагмента, который, согласно литературным данным, вносит наибольший вклад в проявление биологической активности гормона [4].
Рис. 6.
Зависимость интенсивности связывания компонентов, входящих в состав рАМГ**, с внеклеточной частью рецептора MISRII, определяемая с помощью тест-системы II (И4 – MISRll+Fc – рАМГ – ACMIS-4-Пх), от инкубации в физиологических условиях полноразмерного рАМГ в течение 25 (1) и 45 сут (2).
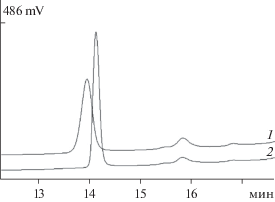
Для детального изучения молекулярной структуры частично инактивированного С-концевого фрагмента (препарат 2) его анализировали методом ОФ-ВЭЖХ. Этот фрагмент оказался неоднородным по составу (рис. 7). Компоненты 1 и 2 рехроматографировали в тех же условиях (рис. 8). В результате разделения были получены два гомогенных (по данным ОФ-ВЭЖХ) С-концевых фрагмента, обозначенные, как С1 и С2. Изучение их биологической активности с помощью тест-системы II показало, что С1 оказался неактивным, а как С2 проявлял высокую активность. Как показало дополнительное исследование, величина константы ассоциации С2 с MISRII, рассчитанная по методу Скэтчарда, составляла Kа = 4 ± ± 0.32 × 1010 М–1.
Рис. 8.
ОФ-ВЭЖХ пептидов С1 (1) и С2 (2), выделенных из частично инактивированного С-концевого фрагмента.
Полученные С1 и С2, а также исходный частично инактивированный препарат С-концевого фрагмента, представляющий собой их смесь, были проанализированы методом ЭФ-ПААГ (рис. 9). После разделения в невосстанавливающих условиях (рис. 9, дорожки 1–3) их электрофоретические профили оказались одинаковыми, при этом их молекулярные массы имели значения около 20 кДа, что соответствовало массе С-концевого гомодимера гормона.
Рис. 9.
ЭФ-ПААГ в не восстанавливающих (1–3) и восстанавливающих условиях (4–6) фрагмента С2 (биологически активной формы, 1 и 4), С1 (биологически неактивной формы, 3 и 6), очищенных фракционированием ОФ-ВЭЖХ, и исходного С-концевого гомодимера рАМГ*, образующегося после инкубации рАМГ в физиологических условиях в течение 45 сут при 37°С (2 и 5); M – белки-маркеры молекулярных масс.

Однако результаты их электрофоретического анализа в восстанавливающих условиях указывали на то, что изучаемые С1 и С2 существенно различались между собой. Препарат, полученный из рАМГ* после 45 сут инкубации (рис. 9, дорожка 5) и представляющий собой смесь С1 и С2, содержал два компонента, кажущиеся молекулярные массы которых составляли около 12.5 и 6 кДа. Следует отметить, что биологически активный С‑концевой фрагмент рАМГ – С2 (дорожка 4), мигрировал как один компонент с молекулярной массой около 12.5 кДа, соответствующей молекулярной массе полипептидной цепи С-концевого гомодимера. Компонент С1 (дорожка 6) также содержал индивидуальный полипептид, но характеризовался почти вдвое меньшей молекулярной массой около 6 кДа, что указывало на протеолитическое расщепление обеих полипептидных цепей С-концевого гомодимера рАМГ.
Полученные результаты свидетельствовали о том, что длительная инкубация рАМГ приводила к его фрагментации с образованием биологически активного С-концевого фрагмента, который подвергался дальнейшему протеолитическому процессингу и расщеплялся на фрагменты с молекулярными массами около 6 кДа. При этом все они были ассоциированы в единый комплекс с молекулярной массой около 20 кДа вследствие наличия в молекуле С-концевого фрагмента рАМГ многочисленных внутримолекулярных дисульфидных связей [12].
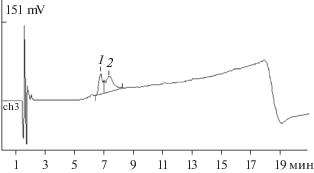
Для более детального анализа молекулярной структуры фрагментов полностью инактивированного белка С1 и определения сайта протеолиза, по которому инактивировался С-концевой димер рАМГ, его обрабатывали ДТТ в присутствии 4 М гидрохлорида гуанидина (раствор в 100 мМ трис-HCl буфере, рН 8.0), а затем – йодацетамидом для блокирования обратного замыкания дисульфидных связей. Анализ осуществляли методом ОФ-ВЭЖХ (рис. 10). Основные мажорные фракции (пики 1 и 2) затем были изучены методом MALDI масс-спектрометрии.
Рис. 10.
ОФ-ВЭЖХ фрагментов (1 и 2) пептида С1 после восстановления ДТТ и последующей модификации йодацетамидом.
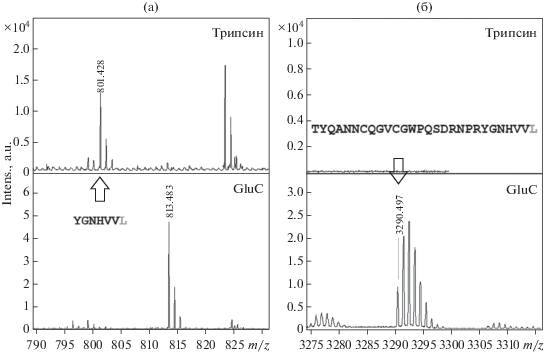
Анализ MALDI масс-спектров, полученных в результате исследования двух вышеописанных пептидов, позволил установить, что фрагментация С-концевого димера рАМГ протекала в его мономерах по лейциновому мотиву после первого лейцина (58-ой аминокислотный остаток) (рис. 11). В спектрах фрагмента с молекулярной массой около 6 кДа были идентифицированы пептиды, указывающие на разрыв полипептидной цепи по остаткам, не характерным для специфичности действия двух использованных протеаз. Так, после обработки трипсином обнаруживали ион с m/z = = 801.428, что соответствовало пептиду YGNHVVL, а – протеазой GluC – m/z = 3290.497, что соответствовало пептиду TYQANNCQGVCGWPQSDRNPRYGNHVVL (рис. 12). При этом ионы, соответствующие не фрагментированным пептидам (в частности, в случае трипсина – YGNHVVLLLK), в спектрах отсутствовали.
Рис. 11.
Сайт протеолиза в аминокислотной последовательности мономера С-концевого фрагмента рАМГ при специфической фрагментации гормона.

Рис. 12.
Область характеристического иона с m/z = 801.428 (а) и m/z = 3290.497 (б) MALDI масс-спектров одного из двух фрагментов С-концевого димера рАМГ, образующихся при специфической фрагментации полноценной цепи гормона; приведены аминокислотные последовательности пептидов, соответствующих этим ионам.
Таким образом, на основании приведенных результатов можно заключить, что длительная инкубация аффинно очищенного полноразмерного рАМГ при рН 7.4 приводила к спонтанной фрагментации белка по пептидной связи между аминокислотными остатками Arg и Ser и накоплению функционально активного С-концевого фрагмента рАМГ. В процессе дальнейшей инкубации С-концевой фрагмент расщеплялся по связи между двумя остатками лейцина (в положении 58 и 59), расположенными в центральной части мономера, и переходил в неактивную форму. Такое расщепление, предположительно, наблюдалось в высокоочищенном рАМГ без участия посторонних ферментов и могло быть следствием наличия у этого белка собственной протеолитической активности.
Таким образом, было показано, что in vitro в физиологических условиях протекал спонтанный процессинг полноразмерного рАМГ с образованием N- и С-концевых гомодимеров, установлена биологическая активность последнего. В контрольном эксперименте C-концевой фрагмент рАМГ был получен путем ограниченного протеолиза очищенного полноразмерного рАМГ плазмином. Установлено, что С-концевой фрагмент рАМГ, образующийся в результате спонтанного гидролиза, идентичен С-концевому гомодимеру, получаемому при расщеплении молекулы полноразмерного гормона плазмином. Показано, что длительная инкубация С-концевого гомодимера (активированного рАМГ) в физиологических условиях приводила к его дополнительному расщеплению по связи между 58-м и 59-м аминокислотными остатками лейцина (Leu-Leu) и потере способности связываться со специфическим рецептором АМГ II типа – MISRII.
Список литературы
Гукасова Н.В., Северин С.Е. // Вопросы биол., мед. и фарм. химии. 2005. № 4. С. 3–9.
Donahoe P.K., Clarke T., Teixeira J., Maheswaran S., MacLaughlin D.T. // Mol. Cell. Endocrinol. 2003. V. 211. № 1. P. 37–42.
Jung Y.S., Kim H.J., Seo S.K., Choi Y.S., Nam E.J., Kim S.W., Han H.D., Kim J.W., Kim Y.T. // Yonsei Med. J. 2016. V. 57. № 1. P. 33–40.
Pankhurst M.W., Leathart B.L., Batchelor N.J., McLennan I.S. // Endocrinol. 2016. V. 157. № 4. P. 1622–1629.
Di Clemente N., Jamin S.P., Lugovskoy A., Carmillo P., Ehrenfels C., Picard J. Y., Whitty A., Josso N., Pepin-sky R.B., Cate R. L. // Mol. Endocrinol. 2010. V. 24. № 11. P. 2193–2206.
Nachtigal M.W., Ingraham H.A. // Proc. Natl. Acad. Sci. U. S. A. 1996. V. 93. № 15. P. 7711–7716.
Ragin R.C., Donahoe P.K., Kenneally M.K., Ahmad M.F., MacLaughlin D.T. // Protein Expression Purif. 1992. V. 3. № 3. P. 236–245.
Рак А.Я., Трофимов А.В., Протасов Е.А., Симбирцев А.С., Ищенко А.М. // Росс. иммунол. журнал. 2017. Т. 11(20). № 4. С. 755–757.
Pepinsky R.B., Sinclair L.K., Chow E.P., Mattaliano R.J., Manganaro T.F., Donahoe P.K., Cate R.L. // J. Biol. Chem. 1988. V. 263. № 35. P. 18961–18964.
Walker J.M. // Methods Mol. Biol. 1984. V. 1. P. 57–61.
Lorenzo H.K., Teixeira J., Pahlavan N., Laurich V.M., Donahoe P.K., MacLaughlin D.T. // J. Chromatogr. B. 2002. V. 766. № 1. P. 89–98.
Massagué J. // Annu. Rev. Biochem. 1998. V. 67. № 1. P. 753–791.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология