Прикладная биохимия и микробиология, 2019, T. 55, № 2, стр. 199-208
Мeдиаторный БПК-биосенсор на основе клеток микроорганизмов, выделенных из активного ила
А. С. Харькова 1, В. А. Арляпов 1, А. Д. Туровская 1, А. Н. Автух 2, И. П. Стародумова 2, А. Н. Решетилов 1, 2, *
1 Тульский государственный университет
300012 Тула, Россия
2 Федеральный исследовательский центр “Пущинский научный центр биологических исследований
Российской академии наук”
142290 Московская обл., г. Пущино, Россия
* E-mail: anatol@ibpm.pushchino.ru
Поступила в редакцию 20.03.2018
После доработки 06.07.2018
Принята к публикации 25.09.2018
Аннотация
Три бактериальных штамма SPB1, SPB2 и SPB3, выделенные из активного ила очистных сооружений, наиболее эффективно по сравнению с остальными штаммами окисляли модельный раствор на основе глюкозы и глутаминовой кислоты в присутствии медиатора ферроцена. Изучена возможность использования выделенных штаммов в качестве основы медиаторного амперометрического БПК-биосенсора. Анализ генов 16S рРНК показал, что штаммы SPB1, SPB2 и SPB3 на 99.79–100% близки к штаммам Paracoccus yeei BAA-599T, Pseudomonas veronii DSM 11331T и Bacillus proteolyticus TD42T соответственно. Установлено, что лучшими характеристиками обладал биорецепторный элемент на основе штамма P. yeei SPB1. Его стабильность при хранении при 4°С составила 22 сут и нижняя граница определяемых концентраций 1.3 мгО2/дм3. С целью поиска наиболее эффективного медиатора переноса электронов для этого штамма был осуществлен скрининг девяти соединений, включающих ферроцен, тионин, метиленовый синий, гексацианоферрат(III) калия и 2,6-дихлорфенолиндофенол. Для каждого из них были получены сигналы медиаторного переноса электронов. Наиболее эффективным по чувствительности и по количеству субстратов, окисление которых можно зафиксировать в присутствии медиатора, оказался ферроцен. Анализ десяти проб сточной воды (до и после очистки) и рек Тульской области показал, что использование ферроцена и клеток штамма P. yeei SPB1 позволило получать данные, имеющие высокую корреляцию (R = 0.9934) с результатами стандартного метода.
Для характеристики загрязнения природных вод легкоокисляемыми органическими соединениями определяют биохимическое потребление кислорода (БПК) за определенный срок инкубации пробы воды, при этом наиболее часто используют индекс БПК5, то есть измерение в течение 5 сут. Принятый метод определения БПК регламентирован в международных стандартах ИСО 5815-1:2003 [1] и ИСО 5815-2:2003 [2]. Основным недостатком методики является длительность анализа, что стало причиной разработки экспресс-методов, которые включали создание биосенсорных анализаторов, основанных на применении микроорганизмов, метаболизирующих широкий спектр органических соединений [3].
Большинство коммерческих БПК-сенсоров, сокращающих время анализа до 5 сут и менее, относятся к биосенсорам амперометрического типа и основаны на измерении скорости потребления кислорода микроорганизмами [4–6]. Однако на измерение биохимического потребления кислорода электродом Кларка сильно влияют диффузионные обменные потоки кислорода между исследуемой пробой и атмосферой. Поэтому появлялись новые подходы для определения БПК [3]. Один из них предполагает использование в качестве медиаторов электронного транспорта низкомолекулярных соединений, переносящих электроны от микроорганизмов на электрод. Медиатор при этом облегчает перенос электронов, его использование выгодно термодинамически, но затруднено пространственно и/или кинетически. Являясь акцептором электронов, медиатор не расходуется в процессе биодеградации. Если к рабочему электроду приложить потенциал, равный окислительно-восстановительному потенциалу используемого медиатора, то можно оценить количество медиатора, необходимое для окисления биоразлагаемых органических веществ, и таким образом оценить БПК проб. Медиаторные биосенсоры не требуют блока аэрации или деаэрации в отличие от анализаторов “BOD 3300” и “QuickBOD α1000” (“Central Kagaku Co”, Япония), которые используются для оценки БПК кислородных аналогов (или биотопливных элементов [7].
Важным этапом разработки БПК-биосенсора является выбор биоматериала. В качестве биорецепторных элементов медиаторных БПК-биосенсоров используют как чистые культуры клеток прокариот и эукариот [8–10], так и различные консорциумы [11–13]. Ассоциация микроорганизмов дает возможность расширить спектр биодеградируемых соединений по сравнению с использованием индивидуальных культур и, следовательно, обеспечивает более точное определение БПК. Однако стандартизировать такие биосенсоры достаточно сложно вследствие изменения в биорецепторном элементе состава консорциума [6]. Используемый биоматериал должен быть устойчивым к токсикантам, находящимся в анализируемой пробе воды. Активный ил является идеальным биокатализатором для БПК анализа, поскольку он содержит разнообразное сообщество гетеротрофов, которые обеспечивают широкий спектр биодеградируемых органических веществ. Он используется в качестве бактериальной затравки в стандартном методе анализа БПК, поэтому применение активного ила в биораспознающем элементе биосенсора может максимально приблизить результаты экспресс-метода к данным, получаемым по стандартной методике. Однако его использование в биосенсорах сильно затруднено из-за постоянно меняющегося микробного состава [14].
Во многих работах используют индивидуальные штаммы микроорганизмов, выделенные из анализируемых сточных вод или из активного ила, применяемого в стандартном методе [11–13]. Такой подход наиболее целесообразен, так как данные микроорганизмы уже адаптированы к исследуемым пробам, что обеспечивает высокую сходимость с результатами стандартного метода. Так, в работе [15] из коммерческого инокулята BODSEED, выпускаемого компанией Bio-systems International (Венгрия) для стандартного БПК-анализа, была выделена бактерия Klebsiella pneumoniae. В качестве медиатора был использован гексацианоферрат (III) калия. При использовании в качестве стандартного раствора для калибровки биосенсора смеси на основе глюкозы и глутаминовой кислоты (ГГС) линейный диапазон измеряемых БПК составлял 30–500 мг О2/дм3. Из сточной воды были выделены бактерии Chromobacterium violaceum R1 и иммобилизованы на ультромикроэлектродах [10]. В качестве медиатора был использован гексацианоферрат(III) калия, а линейный диапазон измеряемых БПК составлял 20–225 мг О2/дм3.
Следует отметить, что в последнее время при разработке медиаторных биосенсоров активно используют природные штаммы микроорганизмов, выделенные из сточной воды или активного ила [10, 16, 17]. При этом к существенному недостатку таких работ относится то, что нижняя граница определяемых концентраций разработанными моделями биосенсоров не позволяет анализировать природные воды, в которых БПК5 обычно не превышает 2–4 мг О2/дм3. Так, биосенсор на основе бактерий Pseudomonas aeruginosa и медиатора гексацианноферрата (III) калия обладает нижней границей определяемых концентраций 5 мг О2/дм3 [5].
Цель работы – создание медиаторного биосенсора на основе микроорганизмов, выделенных из активного ила и проведение оценки эффективности его функционирования при использовании широкого спектра медиаторов электронного транспорта и в качестве амперометрического преобразователя угольно-пастового электрода.
МЕТОДИКА
Реактивы и материалы. Для выращивания и выделения микроорганизмов активного ила использовали триптон (“Panreac”, Испания), дрожжевой экстракт (“Helicon”, Россия), хлорид натрия (“Диаэм”, Россия) и агар-агар (“Panreac”, Испания). Для создания рабочего угольно-пастового электрода применяли графитовую пудру (“Fluka”, Германия), парафиновое масло (“Fluka”, Германия) и диализную мембрану с пределом пропускания 14 кДа (“Roth”, Германия).
В качестве медиаторов электронного транспорта использовали ферроцен (“Aldrich”, Германия), 1,1'-диметилферроцен (“Aldrich”, Германия), ферроценкарбоксальдегид (“Aldrich”, Германия), ферроценацетонитрил (“Aldrich”, Германия), нейтральный красный (“Диаэм”, Россия), 2,6-дихлорфенолиндофенол (“Диаэм”, Россия), тионин (“Диаэм”, Россия), метиленовый синий (“Диаэм”, Россия) и гексацианоферрат(III) калия (“Диаэм”, Россия).
Выделение клеток микроорганизмов активного ила. Активный ил был предоставлен очистными сооружениями ТулаГорВодоканал (Россия). Микроорганизмы выращивали на среде Луриа–Бертани (LB), содержащей (%): триптон – 1.0, дрожжевой экстракт – 0.5, NaCl – 1.0 и агар-агар – 2. Среду для выращивания клеток стерилизовали автоклавированием в течение 45 мин при давлении в 1 атм и 121°C, а затем разливали в чашки Петри. Дальнейшее выделение отдельных колоний проводили по методу Р. Коха.
Культивирование клеток микроорганизмов. Клетки выращивали аэробно на среде LB в течение 18–20 ч в качалочных колбах на 750 мл при 29°С. Полученную биомассу отделяли центрифугированием 10 мин при 6000 g при комнатной температуре. Осадок промывали 20 мМ фосфатным буфером, рН 6.8. Осевшие клетки переносили в свежие порции буфера, разделяли на порции и осаждали на центрифуге “Eppendorf” в течение 5 мин при 6000 g. Промытую биомассу взвешивали и хранили в микропробирках при − 25°С.
Идентификация выделенных клеток микроорганизмов Выделение и очистку ДНК проводили по методу Уилсона [17] с модификациями. Осажденную биомассу ресуспендировали в 280 мкл 10 мМ трис-HCl буфера, рH 8.0, содержащего 1 мМ ЭДТА (ТЕ буфер), и обрабатывали при 37○С последовательно в течение 1.5 ч 7 мкл 20%-ного раствора ДДС-Na, 1 ч – 1.5 мкл раствора РНКазы А (10 мг/мл), 1 ч – 6 мкл раствора протеиназы ПроК (“UniProt, США, 10 мг/мл), а затем в течение 15 мин при 55○С – 22 мкл 20%-ного раствора ДДС-Na, и 30 мин при 65○С 44 мкл 5 М хлорида натрия и 36 мкл гексадецилтриметиламмоний бромида. ДНК экстрагировали 400 мкл смеси фенол–хлороформ (1 : 1) и центрифугировали при 14 500 g в течение 10 мин. Водную фазу отбирали, экстрагировали равным объемом хлороформа и центрифугировали в тех же условиях. Водную фазу снова отбирали и добавляли 0.6 об. изопропилового спирта. Осадок промывали два раза 70%-ным этанолом в течение 1 ч, затем промывали один раз 96%-ным этанолом в течение 5–10 мин. Полученную ДНК высушивали на воздухе 20 мин. Затем ДНК перерастворяли в 20 мкл деионизированной воды и хранили при −20○С.
Для амплификации фрагментов генов 16S рРНК использовали универсальные бактериальные праймеры 27f (5'-AGAGTTTGATCCTGGCTCAG-3') и 1525r (5'-AAGGAGGTGATCCAGCC-3'). Нуклеотидные последовательности определяли на автоматическом секвенаторе 3730 DNA Analyzer (“Applied Biosystems”, США) в соответствии с протоколом фирмы-производителя. Уровни сходства нуклеотидных последовательностей генов 16S рРНК (в %) между изученными и типовыми штаммами близких видов определяли с помощью алгоритмов, представленных на сайте EzBioCloud [19]. Полученные нуклеотидные последовательности генов 16S рРНК депонированы в международные базы данных DDBJ/ENA/GenBank под номерами MG280783 (Paracoccus yeei SPB1), MG280784 (Pseudomonas veronii SPB2) и MG280785 (Bacillus proteolyticus SPB3).
Формирование рабочего электрода. Рабочий электрод формировали по методике, описанной в работе [8], наполняя приготовленной пастой (“графитовая пудра-минеральное масло”) пластиковую трубку площадью 6.3 мм2. Электроды на основе малорастворимых медиаторов (ферроцена, 1,1'-диметилферроцена, ферроценкарбоксальдегида и ферроценацетонитрила) формировали следующим образом. Графитовую пудру (100 мг) смешивали с 1%-ным раствором медиатора в ацетоне в количестве, необходимым для получения требуемой концентрации медиатора в графитовой пасте. После испарения ацетона добавляли 40 мкл парафинового масла и замешивали пасту. Такой модифицированной пастой заполняли пластиковую трубку измерительного электрода. Для формирования электродов на основе растворимых медиаторов (тионин, нейтральный красный, метиленовый синий, 2,6-дихлорфенолиндофенол и гексацианоферрат(III) калия) готовили немодифицированную пасту (100 мг графитовой пудры смешивали с 40 мкл парафинового масла) и также заполняли пластиковую трубку измерительного электрода.
Клетки микроорганизмов, выделенных из активного ила, иммобилизовали на поверхности электрода следующим образом. На рабочую поверхность электрода наносили 3 мкл суспензии с содержанием клеток 200 мг сырой биомассы/мл и подсушивали в течение 15 мин при комнатной температуре. Для удерживания клеток на поверхности электрода применяли закрепляющую диализную мембрану, которую фиксировали при помощи пластикового кольца.
Регистрация вольтамперных зависимостей. Циклические вольтамперограммы регистрировали при помощи вольтамперометрического анализатора “Экотест-ВА” (“Эконикс-Эксперт”, Россия) по трехэлектродной схеме. Рабочим электродом служил угольно-пастовый электрод с иммобилизованными клетками, вспомогательным – платиновый электрод. В качестве электрода сравнения использовали насыщенный хлоридсеребряный электрод (Ag/AgCl), относительно которого были представлены все значения потенциалов. Циклические вольтамперограммы регистрировали при скорости развертки потенциала 10 мВ/с в 0.15 М калий-натрий-фосфатном буфере, рН 6.8, при 22°С. Объем ячейки составлял 15 мл.
Биосенсорные измерения. Измерения выполняли с помощью гальванопотенциостата “IPC-micro” (НПО “Вольта”, Россия). Для регистрации ответов биосенсора (зависимости тока от времени) применяли двухэлектродную схему. Угольно-пастовый электрод с иммобилизованными клетками служил рабочим, который либо модифицировали нерастворимым медиатором, либо использовали немодифицированным, как описано в разделе “Формирование рабочего электрода”. Насыщенный хлоридсеребряный электрод применяли в качестве электрода сравнения.
Растворимые медиаторы (2,6-дихлорфенолиндофенол, тионин, нейтральный красный, гексацианоферрат(III) калия и метиленовый синий) добавляли в состав калий-натрий-фосфатного буферного раствора, в котором проводили измерения. Для измерений использовали потенциал, найденный из вольтамперограммы и соответствующий максимуму потенциала окисления. Температура измерения составляла 20°C, объем ячейки был равен 5 см3. После установления стабильного уровня тока в ячейку микропипеткой вносили необходимое для получения заданной концентрации количество раствора анализируемого вещества. После каждого измерения ячейку промывали калий-натрий-фосфатным буферным раствором.
Определение БПК5 стандартным методом разбавления. В качестве референтного метода для определения БПК5 был использован метод разбавления в соответствии с методикой [1, 2]. С помощью БПК-термооксиметра ЭКСПЕРТ-001-4.0.1 (“Эконикс-эксперт”, Россия) определяли концентрацию растворенного кислорода в первоначальной или разбавленной пробе до и после ее инкубации в течение 5 сут при нормированных условиях [1, 2]. По полученным результатам рассчитывали массу кислорода (мг), поглощенного из одного дм3 воды, требуемого для окисления находящихся в пробе органических веществ в результате биохимических процессов. В качестве инокулята для инкубации использовали активный ил.
Определение линейного диапазона определяемых концентраций медиаторных биосенсоров. Каждый рабочий электрод был откалиброван с помощью стандартного раствора, содержащего 150 мг/дм3 глюкозы и 150 мг/дм3 глутаминовой кислоты, значение БПК5 которого составляло 205 мгО2/дм3 [1, 2]. Полученные зависимости ответа биосенсора от концентрации стандартного раствора были аппроксимированы по уравнению 1, так как электрохимический ответ обеспечивался ферментативными реакциями микроорганизмов в рамках кинетики Михаэлиса-Ментен.
где R – ответ сенсора, мкА; [S] – значение БПК5 в измерительной кювете, мгО2/дм3. Параметры Rmax и KM получали в результате обработки полученных зависимостей по уравнению гиперболы. В соответствии с кинетикой Михаэлиса–Ментен Rmax – максимальная скорость ферментативной реакции, достигаемая при [S] → ∞, КM – эффективная константа Михаэлиса, то есть концентрация субстрата, при которой R = Rmax/2.Из уравнения 1 следовало, что при низких концентрациях субстрата аналитический сигнал пропорционален БПК5, что позволило выделить линейный участок градуировочной кривой, ограниченный сверху значением КM. Нижнюю границу линейного участка рассчитывали статистическим методом, исходя из критерия относительного стандартного отклонения результатов измерения (Sr(C)) < 0.33.
Долговременная стабильность рабочих электродов. Долговременную стабильность рабочих электродов (сут) оценивали путем ежедневного изучения ответов сенсора на введение модельного раствора ГГС. Между измерениями электрод хранили в буферном растворе при 4°С. За время работы сенсора принимали количество суток, в течение которых ответ сенсора составлял не менее 50% от ответа, полученного после формирования рабочего электрода.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выделение клеток микроорганизмов из активного ила и выбор биоматериала для медиаторного биосенсора. Из активного ила, отобранного в аэротенке очистных сооружений, были выделены чистые культуры микроорганизмов. Для создания биорецепторного элемента БПК-биосенсора использовали четыре бактериальных штамма SPB1, SPB2, SPB3 и SPB4, которые содержались в активном иле в наибольшем количестве. В качестве модельного медиатора электронного транспорта был использован ферроцен, так как электрохимическая реакция с его участием не зависит от рН среды, а его малая растворимость в воде позволяет модифицировать графитовую пасту, иммобилизуя медиатор на поверхности рабочего электрода [8]. Для каждого выделенного штамма микроорганизмов при окислительно-восстановительном потенциале ферроцена снимали градуировочную зависимость ответа сенсора от БПК5. В качестве этого потенциала был выбран равным 250 мВ, который наиболее часто использовался при работе с модифицированными угольнольно-пастовыми электродами [8, 20]. Три из четырех штаммов при использовании в качестве рецепторного элемента БПК-биосенсора давали ответы.
У штаммов, способных к осуществлению медиаторного переноса, были определены нуклеотидные последовательности гена 16S рРНК. Длина фрагментов этого гена для штаммов SPB1, SPB2 и SPB3 составляла 1353, 1422 и 1442 пар нуклеотидов соответственно. Уровни сходства выделенных штаммов с типовыми штаммами известных видов оказались 99.79% (для SPB2 – P. veronii DSM 11331T), 100% (для SPB3 – B. proteolyticus TD42T) и 100% (для SPB1 – P. yeei BAA-599T).
Для биосенсоров на основе каждого из трех штаммов были получены градуировочные зависимости ответа от уровня БПК в измерительной кювете. Они представлены на рис. 1. Основные характеристики сформированных биоэлектродов на основе штаммов, выделенных из активного ила, указаны в табл. 1.
Рис. 1.
Градуировочные зависимости ответа биосенсора (мкА) от БПК5 для биорецепторных элементов на основе выделенных штаммов B. proteolyticus SPB3 (1), P. veronii SPB2 (2) и P. yeei SPB1(3).
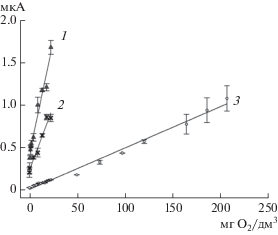
Таблица 1.
Характеристика биоэлектродов на основе штаммов, выделенных из активного ила
| Биоматериал, штамм | Диапазон определяемых концентраций БПК5, мгО2/дм3 | Время стабиль-ности, сут |
|---|---|---|
| P. yeei SPB1 | 1.3–200 | 22 |
| P. veronii SPB2 | 1.4–22 | 9 |
| B. proteolyticus SPB3 | 1.9–22 | 14 |
Таким образом, наиболее перспективным микроорганизмом для определения БПК5 оказался штамм P. yeei SPB1, который характеризовался максимальным временем стабильности и обладал наименьшей нижней границей определяемых концентраций. Данный штамм был использован в дальнейшей работе.
Выбор медиатора электронного транспорта. Для разработки БПК-биосенсора был проведен выбор медиаторов, способных к переносу заряда от клеток штамма P. yeei SPB1 на электрод. На рис. 2 представлены типичные вольтамперные зависимости для окислительно-восстановительного процесса на угольно-пастовом электроде в системе, содержащей медиатор гексацианоферрат(III) калия с иммобилизованными на поверхности электрода клетками штамма P. yeei SPB1.
Рис. 2.
Зависимость ответа биосенсора с угольно-пастовым электродом и медиатором гексацианоферратом(III) калия (1), полученном после иммобилизации на рабочем электроде клеток штамма P. yeei SPB1 в присутствии медиатора гексацианоферрата(III) калия (2) и после введения окисляемого субстрата – глюкозы (3) (концентрация в измерительной ячейке 12.5 мМ); скорость развертки 10 мВ/с.
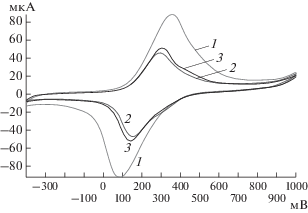
На циклической вольтамперограмме угольно-пастового электрода в присутствии гексацианоферрата(III) калия (рис. 2) возникали два пика. Анодный отражал окисление восстановленной формы медиатора, а катодный – восстановление его окисленной формы. При введении субстрата происходило уменьшение максимума катодного пика и увеличение максимума анодного. Такой характер изменения пиков связан с протеканием в присутствии клеток и субстрата электрокаталитического процесса, в ходе которого окисленная форма медиатора взаимодействовала с восстановленными сайтами бактериальных клеток, переходя при этом в восстановленную форму. Увеличение концентрации восстановленной формы и уменьшение концентрации окисленной формы вызывало наблюдаемый рост анодного пика и уменьшение катодного.
На основе полученных вольтамперограмм выбирали рабочие окислительно-восстановительные потенциалы для систем клетки штамма P. yeei SPB1 – медиатор – угольно-пастовый электрод. Были получены следующие значения рабочих потенциалов анодного пика вольтамперограмм для систем бактерии P. yeei SPB1 – медиатор – электрод: ферроцен – 250 мВ, 1,1’-диметилферроцен – 409 мВ, ферроценкарбоксальдегид – 601 мВ, ферроценацетонитрил – 338 мВ, нейтральный красный – 335 мВ, 2,6-дихлорфенолиндофенол – 416 мВ, тионин – 829 мВ, метиленовый синий – 401 мВ, гексацианоферрат(III) калия – 288 мВ. Значения потенциалов согласовывались с полученными ранее потенциалами анодных пиков вольтамперограмм для систем дрожжи Debaryomyces hansenii – медиатор – угольно-пастовый электрод [8].
Сформированные для БПК-биосенсоров системы на основе клеток штамма P. yeei SPB1, а также растворимых и малорастворимых медиаторов тестировали на наличие аналитического сигнала при найденных редокс-потенциалах. Отклики биосенсоров при окислении субстрата были получены только при использовании таких водорастворимых медиаторов, как гексацианоферрат(III) калия, метиленовый синий, тионин, 2,6-дихлорфенолиндофенол и малорастворимый ферроцен. Эти медиаторы были использованы в дальнейшей работе для формирования БПК-биосенсора. Остальные медиаторы, вероятно, не способны осуществлять биоэлектрокатализ с данными клетками.
Выбор рабочих параметров функционирования БПК-биосенсоров. При формировании биосенсора выбирали рабочие параметры, при которых может быть достигнута максимальная чувствительность определения индекса БПК5. Чем выше генерируемый аналитический сигнал, в данном случае амплитуда силы тока, тем выше чувствительность определения. На величину генерируемого тока могут влиять такие условия, как концентрация медиатора и количество биоматериала на электроде. Высокая концентрация медиатора может оказывать токсичное влияние на биоматериал, а значительная толщина слоя биоматериала на электроде – приводить к возникновению диффузионных ограничений как для используемого субстрата, так и для медиатора [20].
Для выбора рабочих параметров функционирования медиаторных биосенсоров на основе штамма P. yeei SPB1 определяли зависимость ответов биосенсоров от массы биоматериала на электроде и концентрации медиатора при введении раствора ГГС.
Значения ответов сенсора, как показано на рис. 3а, возрастали линейно при увеличении количества наносимого биоматериала вследствие того, что ток электрокаталитического окисления субстрата ферментными системами бактерий был пропорционален концентрации фермента на единицу площади поверхности электрода [21]. При увеличении количества биокатализатора на поверхности электрода (более 0.15 мг/мм2) ответы биосенсора снижались из-за того, что затруднялась диффузия субстрата к активным центрам ферментов бактерий, расположенных внутри биокаталитического слоя, что и приводило к снижению аналитического сигнала [22]. Таким образом, биосенсоры на основе всех исследованных медиаторов обладали максимальным аналитическим сигналом при массе биоматериала на электроде порядка ~0.15 мг/мм2. Типичный вид пикообразной зависимости генерируемого биосенсором тока от концентрации медиатора представлен на рис. 3б. Аналогичный характер зависимости был получен и для других медиаторов (данные не приведены). Можно предположить, что при высоких концентрациях медиатора происходило ингибирование ферментных систем биокатализатора. Это предположение было проверено для нерастворимого медиатора ферроцена. Его замешивали в графитовую пасту и снимали аналогичные зависимости ответа сенсора от массовой доли медиатора в пасте. При концентрации ферроцена более 15% наблюдалось снижение ответов сенсора на величину более 60% от максимального аналитического сигнала, достигаемого при концентрации медиатора 10%. По максимальному ответу биосенсора были выбраны следующие рабочие концентрации медиаторов: гексацианоферрат(III) калия–33 ммоль/дм3; метиленовый синий, 1.1 ммоль/дм3; 2,5-дихлорфенолиндофенол, 0.4 ммоль/дм3; тионин, 1.1 ммоль/дм3; ферроцен, 10% (массовая доля от его содержания в графитовой пасте).
Рис. 3.
Типичная зависимость ответа биосенсора (мкА) от массы клеток штамма P. yeei SPB1 (а, мг/мм2) и (б) концентрации медиатора тионина (б, моль/дм3).
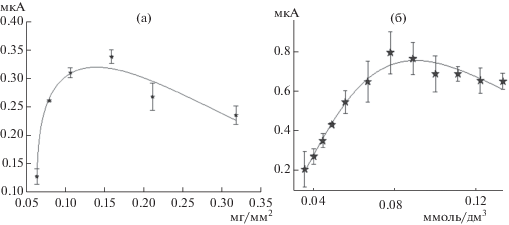
На основе полученных зависимостей были выбраны рабочие концентрации медиаторов, обеспечивающих максимальный сигнал, и биоматериала с удельной концентрации клеток на поверхности электрода, равной 0.15 мг/мм2, и получены для удельной концентрации клеток на поверхности электрода, равной 0.15 мг/мм2. Дальнейшие исследования проводили при указанных рабочих параметрах.
Аналитические и метрологические характеристики разработанных медиаторных БПК-сенсоров. Для биосенсоров на основе выбранного штамма и медиаторов были получены градуировочные зависимости аналитического сигнала от концентрации БПК5 (рис. 4).
Рис. 4.
Зависимость ответа биосенсоров (мкА) от индекса БПК5 (мг О2) в присутствии медиаторов: гексацианоферрата(III) калия (1), тионина (2), метиленового синего (3), ферроцена (4) и 2,6-дихлорфенолиндофенола (5).
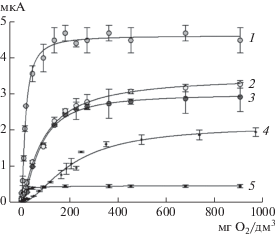
На основании анализа метрологических и аналитических характеристик, приведенных в табл. 2, можно сделать заключение о том, что разработанные медиаторные биосенсоры позволили получать стабильный аналитический сигнал, относительное стандартное отклонение которого не превышало 5.4%, исключение составил биосенсор на основе тионина. Биосенсор на его основе характеризовался самым малым временем стабильности (7 сут), что делало систему “штамм P. yeei SPB1–тионин” малопригодной для многократных анализов водных проб. По экспрессности наилучшие результаты были достигнуты в присутствии медиатора ферроцена, а биосенсоры на основе растворимых медиаторов значительно не различались по длительности единичного измерения.
Таблица 2.
Характеристика разработанных медиаторных биосенсоров на основе штамма P. yeei SPB1
| Медиатор | Ферроцен | Тионин | Метиленовый синий | Гексацианоферрат (III) калия | 2,6-Дихлорфенол-индофенол |
|---|---|---|---|---|---|
| Относительное стандартное отклонение 15 измерений, % | 2.9 | 17.8 | 2.4 | 3.1 | 5.4 |
| Время стабильности, сут | 22 | 7 | 14 | 17 | 17 |
| Длительность единичного измерения, мин | 4–6 | 7–12 | 7–12 | 8–15 | 7–12 |
| Линейный диапазон БПК5, мг/дм3 | 1.3–200 | 2.2–90 | 1.4–90 | 2.1–18 | 1.9–4 |
Для анализа природных вод, значение БПК5 которых может быть довольно низким и составлять ~2 мг/дм3 (чистые природные воды) [23], медиаторы тионин, гексацианоферрат(III) калия, а также 2,6-дихлорфенолиндофенол оказались мало пригодными, т.к. биосенсоры на их основе обладали высокой нижней границей определяемых концентраций, превышающей 2 мг/дм3. Для анализа таких проб целесообразно применять системы на основе медиаторов ферроцена и метиленового синего, поскольку нижняя граница этих биосенсоров позволяет производить оценку более низких значений БПК. Таким образом, на основании данных, приведенных в табл. 2, можно сделать заключение, что для определения БПК5 наиболее перспективными являются медиаторы ферроцен и метиленовый синий.
Для обеспечения высокой корреляции результатов биосенсорного и стандартного методов анализа необходимо, чтобы разработанный биосенсор мог регистрировать окисление максимального количества органических субстратов. Исходя из этого, была оценена субстратная специфичность изученных штаммов в присутствии медиаторов ферроцена и метиленового синего. Результаты приведены на рис. 5.
Рис. 5.
Ответ сенсора (%) на основе штамма P. yeei SPB1 и медиаторов ферроцена(I) и метиленового синего(II) в присутствии различных субстратов. 1 – глюкоза, 2 – фруктоза, 3 – ксилоза, 4 – манноза, 5 – галактоза, 6 – лактоза, 7 – сорбит, 8 – метанол, 9 – бутанол-1, 10 – 2-метилпропанол-1, 11 – изопропанол, 12 – 3-метилбутанол-1, 13 – метановая кислота, 14 – этановая кислота, 15 – пропандиовая кислота, 16 – этандиовая кислота, 17 – лимонная кислота, 18 – бензоат калия, 19 – 4-нитропарафенол, 20 – ЭДТА, 21 – тирозин, 22 – додецилсульфат натрия, 23 – додецилбензосульфат натрия, 24 – глутаминовая кислота, 25 – глицин, 26 – серин, 27 – аспаргиновая кислота, 28 – метаналь.
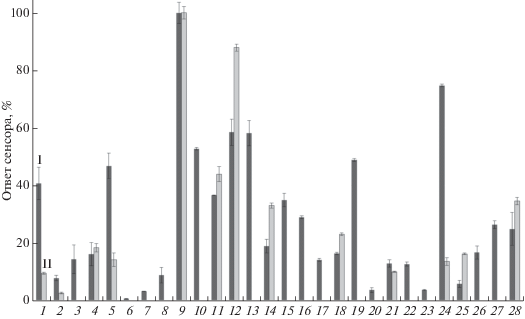
Анализ субстратной специфичности, приведенной на рис. 5, позволил сделать вывод о том, что характер электрокаталитического окисления субстратов зависел от используемого медиатора. При применении медиатора, метиленового синего, исчезал отклик биосенсора на такие карбоновые кислоты, как пропандиовая, этандиовая и лимонная кислоты, что, вероятно, связано с влиянием протонов на свойства этого медиатора.
В целом, следует отметить, что наиболее широкий круг субстратов можно зарегистрировать в присутствии медиатора ферроцена. Это позволило предположить, что при этом может быть получена высокая степень корреляции между показаниями биосенсора и результатами стандартного метода анализа.
Биорецепторный элемент на основе медиатора ферроцена и клеток штамма P. yeei SPB1 по таким параметрам как чувствительность, долговременная стабильность, экспрессность и селективность, оказался наиболее пригодным для создания БПК-биосенсора (табл. 2 и рис. 5). Для сравнения в табл. 3 приведены некоторые данные, полученные для ранее известных медиаторных БПК-биосенсоров.
Таблица 3.
Характеристика медиаторных биосенсоров
| Биоматериал/иммобилизация | Медиатор | Диапазон определяемых концентраций БПК, мгО2/дм3 | Ссылка |
|---|---|---|---|
| D. hansenii/адсорбция | Ферроцен + метиленовый синий | 2.7–7.2 | [8] |
| P. aeruginosa/включение клеток в полипиррольную матрицу | Гексацианоферрат(III) калия | 5–100 | [9] |
| C. violaceum/адсорбция | Гексацианоферрат(III) калия | 20–225 | [10] |
| Активный ил/суспензия | Гексацианоферрат(III) калия | 2–200 | [12] |
| Klebsiella pneumoniae/суспензия | Гексацианоферрат(III) калия | 30–500 | [15] |
| E. coli/включение в сополимер поливинилового спирта и 4-винилпиридина | Полинейтральный красный | 50–1000 | [24] |
| P. yeei SPB1/адсорбция | Ферроцен | 1.3–360 | Данная работа |
Из данных, представленных в табл. 3, видно, что разработанный в данной работе медиаторный БПК-биосенсор имеет высокую чувствительность и не только не уступает известным аналогам, но превосходит их по значению нижней границы определяемых концентраций. Таким образом, биосенсор на основе штамма P. yeei SPB1 и медиатора ферроцена был выбран для анализа образцов водных объектов.
Анализ образцов воды с использованием разработанного медиаторного биосенсора. Проведен анализ десяти образцов воды с использованием разработанного биосенсора и стандартным методом разбавления. Пробы представляли собой сточные воды городских очистных сооружений до и после очистки и пробы рек Тулицы, Холькельцы, Дубовки, Вашаны и Плавы (Тульская обл., Россия). Отбор проб и определение БПК5 стандартным методом проводили согласно действующим нормативным документам [1, 2]. На рис. 6 показана корреляция между значениями БПК5 образцов воды, определенными с помощью биосенсора, и стандартным методом разбавления.
Рис. 6.
Корреляция между значениями БПК5 (мг О2/дм3), определенными с помощью разработанного медиаторного биосенсора на основе ферроцена и штамма P. yeei SPB1, и БПК5, определенными стандартным методом. На врезке приведена корреляция для высоких значений БПК
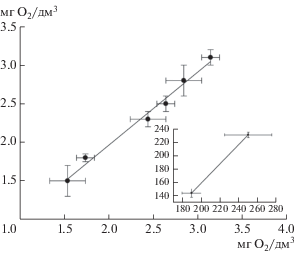
Статистическая обработка полученных данных (модифицированный тест Стьюдента) показала, что результаты анализа стандартным методом разбавления и биосенсорным методом незначительно различались между собой. Таким образом, разработанный биосенсор можно эффективно использовать для анализа различных образцов воды.
В результате выполненных измерений изучена возможность применения в качестве биорецепторного элемента амперометрического БПК-биосенсора бактериальных штаммов P. yeei SPB1, P. veronii SPB2 и B. proteolyticus SPB3, выделенных из активного ила. Показано, что для этого могут быть использованы клетки штамма P. yeei SPB1 совместно с медиатором ферроценом. С целью повышения эффективности переноса электрона был осуществлен скрининг девяти соединений, потенциально способных к переносу электронов на основе штамма P. yeei SPB1. Продемонстрирована возможность использования тионина, метиленового синего, гексацианоферрата (III) калия и 2,6-дихлорфенолиндофенола в качестве эффективных акцепторов переноса электронов от клеток штамма P. yeei SPB1 на угольно-пастовый электрод.
В результате анализа аналитических и метрологических характеристик разработанных медиаторных БПК-биосенсоров определены наиболее чувствительные рецепторные элементы, значение нижних границ определяемых концентраций которых не превышает 2 мг/дм3. Эти рецепторные элементы были сформированы на основе комбинации штамма P. yeei SPB1 и медиаторов ферроцена или метиленового синего.
Установлено, что наиболее перспективным медиатором для формирования БПК-биосенсора на основе штамма P. yeei SPB1 является ферроцен как по значению нижней границы определяемых концентраций, так и по количеству субстратов, окисление которых можно зафиксировать в его присутствии. Анализ проб воды различного происхождения показал, что применение медиатора ферроцена и штамма P. yeei SPB1 позволяло получать результаты, высоко коррелирующие с результатами стандартного метода (R = 0.9934). Предлагаемая комбинация бактериальных клеток и медиатора может использоваться в дальнейшем для создания прототипа БПК-биосенсора, чувствительность которого не будет уступать известным аналогам.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 17-74-10078).
Список литературы
ISO 5815-1:2003, 2003. Water Quality-Determination of Biochemical Oxygen Demand after NDays (BODn) – Part 1: Dilution and Seeding Method with Allylthiourea Addition. Geneva: International Organization for Standardization, 2003.
ISO 5815-2:2003, 2003. Water Quality – Determination of Biochemical Oxygen Demand after N Days (BODn) – Part 2: Method for Undiluted Samples. Geneva: International Organization for Standardization, 2003.
Jouanneau S., Recoules L., Durand M.J., Boukabache A., Picot V., Primault Y., Lakel A., Sengelin M., Barillon B., Thouand G. // Water Res. 2014. V. 49. № 1. P. 62–82.
Karube I. Whole Cell Sensing Systems I: Reporter Cells and Devices / Eds. Belkin S., Gu M.B. N.Y.: Springer Healthcare, 2010. 220 p.
Arlyapov V., Kamanin S., Ponamoreva O., Reshetilov A. // Enzyme Microb. Technol. 2012. V. 50. № 4. P. 215–220.
Arlyapov V. A., Yudina N.Yu., Asulyan L.D., Alferov S.V., Alferov V.A., Reshetilov A.N. // Enzyme Microb. Technol. 2013. V. 53. № 4. P. 257–262.
Modin O., Wilén B. M. // Water Res. 2012. V. 46. № 18. P. 6113–6120.
Zaitseva A.S., Arlyapov V.A., Yudina N.Yu., Alferov S.V., Reshetilov A.N. // Enzyme Microb. Technol. 2016. V. 98. P. 43–51.
Hu J., Gao G., Xia S. // Int. J. Electrochem. Sci. 2015. V. 10. № 11. P. 9695–9705.
Hooi K. B., Ismail A. K., Ahamad R., Shahir S. // Electrochim. Acta. 2015. V. 176. № 11. P. 777–783.
Jordan M.A., Welsh D.T., Teasdale P.R. // Talanta. 2014. V. 125. № 1. P. 293–300.
Liu L., Bai L., Yu D., Zhai J., Dong S. // Talanta. 2015. V. 138. № 1. P. 36–39.
Niyomdecha S., Limbut W., Numnuam A., Asawatreratanakul P., Kanatharana P., Thavarungkula P. // Sens Actuators B Chem. 2017. V. 241. № 31. P. 473–481.
Kindaichi T. // Biotechnol. Bioeng. 2006. V. 94. № 6. P. 1111–1121.
Bonetto M. C. // Talanta. 2011. T. 85. № 1. P. 455–462.
Chen C.Y., Tsai T.H., Wu P.S., Tsao S.E., Huang Y.S., Chung Y.C. // J. Env. Sci./Health. Part A. 2018. V. 53. № 2. P. 108–115.
Kolahchi N., Braiek M., Ebrahimipour G., Ranaei–Siadat O., Lagarde F., Jaffrezic–Renault N. // J. Environ. Chem. Eng. 2018. V. 6. № 1. P. 478–484.
Wilson K. Current Protocols in Molecular Biology / Ed. Ausubel F.M. N.Y.: John Wiley & Sons, 1997. 4648 p.
Yoon S.H., Ha S.M., Kwon S., Lim J., Kim Y., Seo H. // Int. J. Syst. Evol. Microbiol. 2017. V. 67. № 5. P. 1613–1617.
Babkina E., Chigrinova E., Ponamoreva O., Alferov V., Reshetilov A. // Electroanalysis. 2006. V. 18. № 19–20. P. 2023–2029.
Ikeda T., Kurosaki T., Takayama K., Kano K. // Anal. Chem. 1996. V. 68. № 1. P. 192–198.
Richardson N.J., Gardner S., Rawson D.M. // J. Appl. Bacteriol. 1991. V. 70. № 5. P. 422–426.
Arlyapov V.A., Nechaeva I.A., Skvortsova L.S., Volkova E.M. // Water: chem. and ecol. 2016. № 6. P. 9–21.
Liu L, Zhang S, Xing L, Zhao H, Dong S. // Talanta. 2012. V. 93. № 15. P. 314–319.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


