Прикладная биохимия и микробиология, 2019, T. 55, № 2, стр. 191-198
Ингибирование автоокисления каротиноидов паприки растительными антиоксидантами
Т. А. Мишарина 1, *, В. И. Киселёва 1
1 Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, Россия
* E-mail: tmish@rambler.ru
Поступила в редакцию 25.06.2018
После доработки 17.09.2018
Принята к публикации 25.09.2018
Аннотация
Проведена оценка антиоксидантных свойств эфирных масел, экстрактов пряно-ароматических растений, ионола, аскорбилпальмитата и их смесей по эффективности ингибирования автоокисления каротиноидов экстракта паприки. Степень окисления каротиноидов определяли спектрофотометрически. Активности эфирных масел кориандра, чеснока и экстракта красного перца были практически идентичными, более высокой ингибирующей активностью обладали эфирное масло орегано и экстракт розмарина, и максимальная активность обнаружена- у масла гвоздики, ионола и аскорбилпальмитата. Эффективность ингибирования автоокисления каротиноидов снижалась на 4–10% при уменьшении концентрации всех антиоксидантов с 4 до 1% к массе каротиноидов. Экстракт розмарина ингибировал автоокисление пропорционально концентрации, при этом при его содержании 4% степень ингибирования составляла 67%, а при 2–29%. Сложное влияние состава на эффективность ингибирования обнаружено для смесей антиоксидантов. Так, в смесях, содержащих эфирное масло гвоздики, суммарная активность оставалась близкой к активности этого эфирного масла. Экстракт розмарина снижал активность масла гвоздики в смеси 1 : 1 на 18%, но практически не влиял на активность эфирного масла орегано, аскорбилпальмитата и ионола. Во всех смесях антиоксидантов не обнаружено выраженных аддитивных или синергетических эффектов.
Для определения антиоксидантных (АО) свойств индивидуальных соединений или смесей веществ, в том числе растительных экстрактов, используют прямые или косвенные методы [1]. Прямые методы основаны на изучении влияния добавленных или содержащихся в исследуемом объекте АО на окисление субстрата, которым могут быть липиды, липидные смеси (масла), белки, ДНК, плазма крови, липопротеины низкой плотности или биологические мембраны [2, 3]. В основе этих методов лежат кинетические процессы перекисного окисления липидов (ПОЛ) или нецепные процессы (метод прямой конкуренции). В пищевых продуктах важнейшее значение имеет автоокисление липидов, при этом процесс протекает спонтанно с самоускорением, благодаря накоплению пероксидов [4, 5]. Для управления ПОЛ регулируют концентрацию свободных радикалов повышением парциального давления кислорода и температуры, добавлением катализаторов с металлами переходной валентности и изменением интенсивности освещения [5, 6].
К самым популярным методам исследования процесса ПОЛ относятся определение концентрации образующихся при окислении ненасыщенных кислот диеновых коньюгатов (поглощение при 234 нм) и содержания соединений, образующихся при взаимодействии тиобарбитуровой кислоты с продуктами окислительного расщепления жирных кислот. При нагревании пероксиды полиненасыщенных жирных кислот (ПНЖК) расщепляются с образованием низкомолекулярных альдегидов, кетонов и спиртов, а также малонового диальдегида, который при взаимодействии с тиобарбитуровой кислотой образует соединения розового цвета. Несмотря на их критику, эти методы популярны и позволяют получать хорошие результаты, особенно при сравнении с контрольными образцами [5, 6]. Так, наиболее достоверные данные при определении содержания не окисленных липидов или ПНЖК получают при изучении кинетики расхода субстрата., Способность различных эфирных масел (ЭМ) ингибировать автоокисление ПНЖК была определена методом капиллярной газовой хроматографии, которая позволила установить содержание не окисленных метиловых эфиров жирных кислот, полученных путем метанолиза липидов из гомогената мозга мышей, льняного масла и рыбьего жира [7–9]. Недостатком этого метода является его трудоемкость и длительность эксперимента, который продолжался в течение 4–6 мес.
Было показано, что величины окислительно-восстановительных или редокс потенциалов
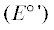 для каротиноидов и полиненасыщенных кислот близки [10, 11], т.е. эти соединения практически одинаково подвергаются автоокислению. Растительные
тетратерпиноиды, каротиноиды, интенсивно окрашены (от желтого цвета до темно-красного)
вследствие присутствия в их молекулах системы сопряженных двойных связей. При окислении
активными радикалами эта система разрушается, и каротиноиды быстро обесцвечиваются
[5, 12–15]. Наличие факторов защиты в виде АО приводит к ингибированию окисления и сохранению
окраски каротиноидов, которое можно фиксировать фотометрически. Был разработан спектрофотометрический
(СФ) метод оценки в системе на основе каротиноидов паприки АО свойств природных и синтетических
веществ, при этом каротиноиды выполняли роль субстрата для окисления и одновременно
являлись индикатором процесса окисления [16]. Поскольку каротиноиды были нанесены на пористый нейтральный сорбент, процесс автоокисления
проходил быстрее, чем в любом другом прямом методе определения ингибирующих свойств
антиоксидантов. По способности взаимодействовать с кислородными радикалами – окислителями
каротиноиды практически идентичны ПНЖК, поэтому полученные результаты хорошо отражают
поведение АО в реальных модельных системах и пищевых продуктах, содержащих липиды,
что можно рассматривать как важнейшее преимущество этого метода.
для каротиноидов и полиненасыщенных кислот близки [10, 11], т.е. эти соединения практически одинаково подвергаются автоокислению. Растительные
тетратерпиноиды, каротиноиды, интенсивно окрашены (от желтого цвета до темно-красного)
вследствие присутствия в их молекулах системы сопряженных двойных связей. При окислении
активными радикалами эта система разрушается, и каротиноиды быстро обесцвечиваются
[5, 12–15]. Наличие факторов защиты в виде АО приводит к ингибированию окисления и сохранению
окраски каротиноидов, которое можно фиксировать фотометрически. Был разработан спектрофотометрический
(СФ) метод оценки в системе на основе каротиноидов паприки АО свойств природных и синтетических
веществ, при этом каротиноиды выполняли роль субстрата для окисления и одновременно
являлись индикатором процесса окисления [16]. Поскольку каротиноиды были нанесены на пористый нейтральный сорбент, процесс автоокисления
проходил быстрее, чем в любом другом прямом методе определения ингибирующих свойств
антиоксидантов. По способности взаимодействовать с кислородными радикалами – окислителями
каротиноиды практически идентичны ПНЖК, поэтому полученные результаты хорошо отражают
поведение АО в реальных модельных системах и пищевых продуктах, содержащих липиды,
что можно рассматривать как важнейшее преимущество этого метода.
Цель работы – по скорости обесцвечивания каротиноидов паприки оценить способность различных индивидуальных АО и их смесей ингибировать автоокисление полиненасыщенных жирных кислот.
МЕТОДИКА
В работе использовали нативный крахмал восковидной кукурузы CLEARAM® (“ROQUETTE”, Франция), дезодорированный экстракт розмарина EWSL4DF, REL-126/17 (“AKAY Flavours & Aromatics Pvt. Ltd.,” Индия) и коммерческие препараты экстрактов красного перца и паприки, эфирные масла гвоздики, орегано, чеснока и семян кориандра (“Plant Lipids Ltd.”, Индия). Каждое ЭМ было проанализировано методом капиллярной газовой хроматографии, установлен состав его компонентов и определено их содержание, которое приведено в работе [16].
Автоокисление каротиноидов паприки в присутствии антиоксидантов. К 3 г нативного кукурузного крахмала добавляли по 3 мл ацетона, содержавшего по 100 мг экстракта паприки (ЭП) и по 1, 2 или 4 мг индивидуальных АО или 4 мг их смесей. Состав изученных смесей АО приведен в таблице. Смеси тщательно перемешивали, переносили в чашки Петри диаметром 10 см, путем встряхивания равномерно распределяли крахмал по дну чашки и помещали в вытяжной шкаф для испарения ацетона. После полного высыхания остатки перемешивали в чашке и для автоокисления каротиноидов инкубировали при комнатной температуре и естественном освещении. Периодически из каждой чашки после тщательного перемешивания отбирали по 3 навески (30 мг), из которых в пробирках экстрагировали каротиноиды 4 мл ацетона. Определяли спектры поглощения экстрактов в интервале 300–600 нм. Содержание каротиноидов рассчитывали как отношение оптической плотности хранившихся образцов к плотности свежеприготовленных и выражали в %. Математическую обработку результатов осуществляли с помощью программ Microsoft Excel 2007 и Sigma Plot 10.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Известно, что АО, выделяемые из природных источников, как правило, являются смесью нескольких веществ с различной антиоксидантной способностью. Эти соединения могут вступать в реакции по нескольким механизмам и с различающимися скоростями, а суммарное действие таких многокомпонентных АО в значительной степени зависит от состава смеси [17]. Натуральные или синтетические АО могут взаимодействовать между собой, оказывая синергетический, аддитивный или антагонистический эффект. Так, витамины С и Е (АО), растительные полифенолы, компоненты ЭМ и другие эндогенные АО часто проявляют синергетическое действие и успешно ингибируют окислительные процессы при хранении пищевых продуктов. Такие особенности природных АО в совокупности с разнообразием аналитических методов оценки их свойств приводят к тому, что получаются очень часто противоречивые результаты [18]. Поэтому для получения наиболее полного и адекватного представления об активности исследуемого АО и механизмах его действия рекомендуется создавать специальный протокол, содержащий характеристики нескольких его свойств, определенных в различных системах с различными субстратами [1, 3].
Предложенный ранее метод на основе автоокисления каротиноидов экстракта паприки [16] является модификацией хорошо известного и часто используемого метода оценки АО свойств веществ в модельной системе совместного автоокисления смеси линолевой кислоты и β-каротина [4, 5]. К преимуществу этого метода можно отнести возможность изучения кинетики автоокисления, позволяющей определить общую ингибирующую способность индивидуальных АО или их смесей, что обеспечивает точную оценку антиоксидантной защиты. Этот метод позволяет определять свойства веществ, имеющих различающиеся физико-химические характеристики и агрегатное состояние. Так, это могут быть смеси летучих органических соединений (например, эфирные масла), вязкие маслоподобные экстракты, содержащие нелетучие флавоноиды, фенольные кислоты, алкалоиды и другие природные соединения, а также твердые и жидкие синтетические АО [16]. К недостатку метода можно отнести окисление в неконтролируемых условиях, что затрудняет воспроизведение полученных ранее данных, но это не мешает проводить сравнение активности нескольких АО в одном эксперименте при одинаковых условиях автоокисления. Проведенные исследования показали, что метод имеет хорошую воспроизводимость, а стандартное относительное отклонение для 9 параллельных образцов составляло 5.7–8.3% [16].
Эффективность ингибирования автоокисления каротиноидов зависела сложным образом от концентрации АО. Она снижалась не пропорционально уменьшению их концентрации с 4 до 2 и 1% (рис. 1). Через 20 сут автоокисления степень окисления каротиноидов в системах с 2% масла гвоздики и орегано оказалась всего лишь на 4–6% ниже, чем в системах с 4%, а в системах с 1% ЭМ масел степень окисления каротиноидов была меньше на 8–10%, чем в системах с 4% этих масел. Для ЭМ кориандра и чеснока эти различия были еще меньше и составляли 2–4%. Аналогичное поведение было обнаружено для экстракта красного перца, аскорбилпальмитата и ионола. Только экстракт розмарина ингибировал автоокисление пропорционально его концентрации. Так, при содержании экстракта 4% степень ингибирования составляла 67%, а при 2 – 29%. Это свидетельствовало о том, что компоненты, отвечающие за АО свойства ЭМ, экстракта красного перца, ионола и аскорбилпальмитата присутствовали в достаточно больших количествах, и о том, что продукты их окисления могут также обладать АО активностью. В экстрактах розмарина компоненты с АО свойствами при взаимодействии с кислородными радикалами не могли регенерироваться и трансформировались в не активные продукты.
Рис. 1.
Относительное содержание каротиноидов паприки (%) через 20 дней автоокисления в системах, содержавших 4, 2 или 1% антиоксидантов к массе экстракта паприки. Антиоксиданты: 1 – ЭМ гвоздики, 2 – ЭМ орегано, 3 – ЭМ кориандра, 4 – ЭМ чеснока, 5 – экстракт красного перца, 6 – экстракт розмарина Р-126, 7 – ионол, 8 – аскорбилпальмитат.
Пряности и продукты их переработки (эфирные масла и экстракты) широко используются как в пищевой промышленности, так и в домашней кулинарии в виде специально составленных композиций для придания аромата продуктам. Одновременно с ароматизацией продуктов они способствуют снижению в них окислительных процессов и улучшению микробиологического статуса. Крайне важными и интересными продуктами переработки пряностей являются их экстракты. Они содержат соединения, придающие им вкус и участвующие в формировании общего аромата. Экстракты, называемые олеорезинами, так же, как и ЭМ, широко используются при производстве пищевых продуктов, биологически активных препаратов, в косметологии и др.
Были изучены экстракт сладкой паприки, который был субстратом для окисления, и два других экстракта – горького красного перца и розмарина, которые служили в качестве ингибиторов. В ряде работ было показано, что экстракты красного перца проявляли АО свойства в различных модельных системах, при этом АО активностью обладали не только каротиноиды, фенольные кислоты и флавоноиды, но и капсаициноиды [19–21]. Экстракты красного горького перца ингибировали окисление холестерина, линоленовой и докозагексаеновой кислот [20]. Обнаружено также, что содержание аскорбиновой кислоты, каротина, капсантина, кверцетина и лютеолина в красном перце выше, чем в зеленом [22]. Эти литературные данные хорошо согласуются с установленными в предыдущей работе [23] величинами антирадикальной эффективности экстрактов двух видов горького перца. Так, в одном из них (зеленый Халапеньо) содержание капсаицина составляло 1.0%, а во втором (красном кайенском перце) – 6.0. При этом оказалось, что величина антирадикальной эффективности (АЕ) экстракта красного перца была в 6 раз выше, а содержание веществ с высокой антирадикальной активностью было только в 4 раза больше по сравнению с экстрактом перца Халапеньо [23]. В последнее время некоторые компании активно предлагают для применения в различных сферах человеческой деятельности вместо синтетических АО дезодорированные экстракты розмарина. Было обнаружено, что экстракт розмарина замедлял процесс развития химически индуцированных опухолей, что связывали с присутствием в нем карнозола и урсоловой кислоты [24, 25]. Противораковая активность этих двух соединений детально изучена и показано, что они подавляли пролиферацию клеточных культур некоторых видов человеческого рака (мелкоклеточного рака легких, рака простаты, карциномы печени человека, аденокарцином молочной и предстательной желез человека и др.) [26]. Изученный экстракт розмарина содержал около 4% карнозиновой кислоты, являющейся основным АО, а также флавоноиды и фенольные кислоты [27, 28].
Важным и малоизученным вопросом остается взаимное влияние на их суммарную антиоксидантную активность летучих и нелетучих АО, содержащихся в ЭМ и экстрактах. В табл. 1. приведен состав нескольких смесей ЭМ, экстрактов и синтетических АО и степень ингибирования автоокисления каротиноидов индивидуальными АО и их смесями после 20 сут инкубирования. В состав 4-х смесей эфирных масел входило масло гвоздики, еще 4 смеси были приготовлены на основе экстракта розмарина. Видно, что степень ингибирования окисления каротиноидов при концентрации индивидуальных ЭМ 2 и 1% была максимальной для ЭМ гвоздики (70 и 60%), для ЭМ орегано она была меньше и составляла 51 и 42%, для ЭМ кориандра, чеснока и экстракта красного перца она была еще меньше и составляла 36–42%.
Таблица 1.
Степень ингибирования (%) автоокисления каротиноидов паприки после 20 сут индивидуальными антиоксидантами (2 и 1%) и их смесями
| Антиоксидант | Степень ингибирования, % | Смеси эфирных масел, экстрактов и антиоксидантов, содержание, % к каротиноидам | Степень ингибирования, % | ||
|---|---|---|---|---|---|
| содержании АО, % | |||||
| 4 | 2 | 1 | |||
| ЭМ гвоздики | 78 ± 5 | 70 ± 6 | 60 ± 5 | ЭМ гвоздики (2%) и орегано (2%) | 73 ± 6 |
| ЭМ орегано | 54 ± 4 | 51 ± 2 | 42 ± 2 | ЭМ гвоздики (2%) и кориандра (2%) | 66 ± 5 |
| ЭМ кориандра | 42 ± 3 | 40 ± 4 | 38 ± 4 | ЭМ гвоздики (1%), орегано (2%) и кориандра (1%) | 69 ± 4 |
| ЭМ чеснока | 43 ± 5 | 40 ± 5 | 36 ± 2 | ЭМ гвоздики (1%), кориандра (1%), чеснока (1%) и экстракта красного перца (1%) | 52 ± 4 |
| Экстракт красного перца | 46 ± 4 | 42 ± 3 | 39 ± 3 | Экстракт розмарина (2%) и ЭМ гвоздики (2%) | 52 ± 3 |
| Экстракт розмарина | 67 ± 5 | 30 ± 4 | – | Экстракт розмарина(2%) и ЭМ орегано (2%) | 50 ± 5 |
| Ионол | 74 ± 4 | 70 ± 4 | – | Экстракт розмарина (2%) и аскорбил пальмитат (2%) | 68 ± 6 |
| Аскорбилпальмитат | 74 ± 5 | 62 ± 3 | – | Экстракт розмарина (2%) и ионол (2%) | 71 ± 6 |
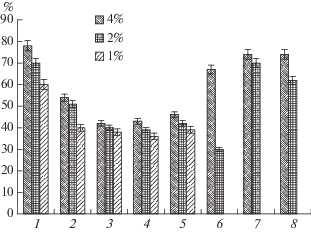
Для анализа поведения АО в течение всего периода автоокисления каротиноидов были построены кинетические кривые для действия индивидуальных ЭМ и их смесей (рис. 2а–2г). Как видно на рис. 2а и 2б, ЭМ орегано и кориандра обладали меньшей активностью, чем ЭМ гвоздики, но смесь ЭМ гвоздики и орегано ингибировала окисление каротиноидов так же, как и индивидуальное масло гвоздики. Ингибирование смесью ЭМ гвоздики и кориандра оказалось меньше, а активность смеси трех ЭМ, гвоздики, орегано и кориандра (рис. 2в), – выше, чем любого индивидуального масла, входящего в ее состав. Однако следует отметить, что разница в активности ЭМ гвоздики и смеси трех масел была незначительна. Аналогичные результаты были получены при изучении ингибирования смесями ЭМ гвоздики и орегано автоокисления ПНЖК, выделенных из рыбьего жира [9].
Рис. 2.
Относительное содержание каротиноидов паприки (%) в процессе автоокисления в контрольном образце и в системах, содержащих индивидуальные антиоксиданты или их смеси. а: К – контроль, 1 – ЭМ гвоздики (2%), 2 – ЭМ орегано (2%), 3 – смесь ЭМ гвоздики (2%) и орегано (2%); б: 1 – ЭМ гвоздики (2%), 2 – ЭМ кориандра (2%), 3 – смесь ЭМ гвоздики (2%) и кориандра (2%); в: 1 – ЭМ гвоздики (1%), 2 – ЭМ орегано (2%), 3 – ЭМ кориандра (1%), 4 – смесь ЭМ гвоздики (1%), орегано (2%) и кориандра (1%); г: 1 – ЭМ гвоздики (1%), 2 – ЭМ чеснока (1%), 3 – ЭМ кориандра (1%), 4 – экстракт красного перца (1%), 5 – смесь ЭМ гвоздики (1%), чеснока (1%), кориандра (1%) и экстракт красного перца (1%).
Смесь ЭМ гвоздики, чеснока и кориандра с экстрактом красного перца обладала более высокими антиоксидантными свойствами, чем ЭМ чеснока и кориандра, но почти такими же, как и индивидуальное масло гвоздики (рис. 2г). Обнаруженные различия были незначительны и можно уверено утверждать, что при снижении концентрации ЭМ гвоздики и добавлении масел орегано, кориандра, чеснока и экстракта красного перца суммарная активность практически не изменялась бы, и смеси сохраняли антиоксидантные свойства системы, близкие к свойствам самого активного компонента смеси – ЭМ гвоздики. При этом становилось возможным получение пищевых продуктов с большим разнообразием органолептических характеристик. Следует отметить, что такие смеси, как ЭМ гвоздики, орегано и кориандра или гвоздики, чеснока и кориандра с экстрактом красного перца, являются базовыми при разработке вкусо-ароматических добавок для некоторых видов соусов, маринадов и колбасно-сосисочных изделий.
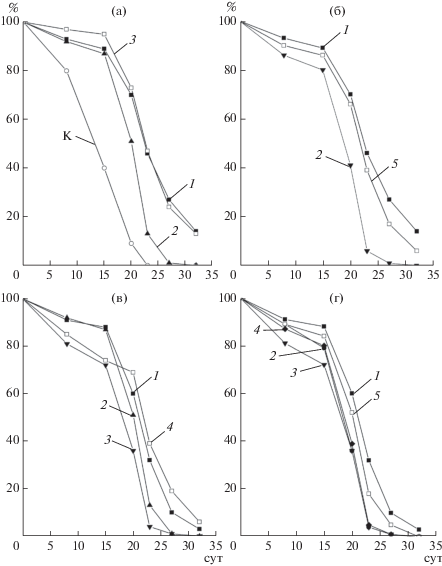
Изучение антиоксидантных свойств экстракта розмарина в системе на основе каротиноидов паприки показало, что его активность была ниже, чем у ЭМ гвоздики, ионола и аскорбилпальмитата и уменьшалась пропорционально изменению его содержания в системе (табл. 1, рис. 1 и 3). Смесь экстракта розмарина с ЭМ гвоздики имела активность меньше, чем индивидуальное масло гвоздики (рис. 3а), а смесь с аскорбилпальмитатом была активнее, чем индивидуальные АО, особенно в период 15–27 сут автоокисления (рис. 3в). Смесь экстракта розмарина и ионола характеризовалась таким же ингибирующим действием, как и индивидуальный ионол (рис. 3г). Так же, как и ЭМ, экстракт розмарина в смеси с другими АО не проявлял аддитивных или синергетических эффектов.
Рис. 3.
Относительное содержание каротиноидов паприки (%) в процессе автоокисления в контрольном образце и в системах, содержащих индивидуальные антиоксиданты или их смеси. а: 1 – экстракт розмарина (2%), 2 – ЭМ гвоздики (2%), 3 – смесь ЭМ гвоздики (2%) и экстракта розмарина (2%); б: 1 – экстракт розмарина (2%), 2 – ЭМ орегано (2%), 3 – смесь ЭМ орегано (2%) и экстракта розмарина (2%); в: 1 – экстракт розмарина (2%), 2 – аскорбилпальмитат (2%), 3 – смесь аскорбилпальмитата (2%) и экстракта розмарина (2%); г: 1 – экстракт розмарина (2%), 2 – ионол (2%), 3 – смесь ионола (2%) и экстракта розмарина (2%).
Сравнение антиоксидантной активности ЭМ гвоздики, орегано и кориандра, установленной методом с каротиноидами, с результатами прямого определения ингибирования этими маслами автоокисления ПНЖК [8, 9] свидетельствовало о близости получаемых результатов. На рис. 4 приведены данные по ингибированию окисления докозагексаеновой кислоты, являющейся самой ненасыщенной кислотой в натуральном рыбьем жире. Видно, 4% ЭМ гвоздики, орегано и кориандра через 3 мес. автоокисления сохранили 88, 74 и 49% этой кислоты. В системе с экстрактом паприки такие же ЭМ в концентрации 4% к массе экстракта ингибировали автоокисление каротиноидов на 78, 54 и 42% соответственно, при этом процесс тестирования занял 20 сут. Прямое определение окисления ПНЖК проводится дорогим и длительным методом, включающим выделение липидов, их гидролиз и получение метиловых эфиров кислот, затем периодически, с интервалом в 1 мес. в течение 6 мес. их анализируют газохроматографически. Каротиноиды окисляются намного быстрее и требуют простого спектрофотометрического анализа. Как видно из приведенных данных (рис. 4), получаемые результаты по ингибированию автоокисления каротиноидов ЭМ хорошо совпадали с автоокислительным действием этих масел на ПНЖК.
Рис. 4.
Относительное содержание каротиноидов паприки (%) после 20 сут автоокисления в контрольном образце (4) и в системах, содержащих индивидуальные эфирные масла гвоздики (1), орегано (2) и кориандра (3), полученное спектрофотометрическим методом и относительное содержание докозагексаеновой кислоты (%) через 3 мес. автоокисления рыбьего жира в контрольном образце (8) и в системах, содержавших те же эфирные масла (5, 6 и 7, соответственно), полученное газохроматографическим методом.

Таким образом, проведенное исследование показало, что предложенный ранее метод спектрофотометрической оценки антиоксидантных свойств различных препаратов в системе автоокисления каротиноидов экстракта паприки позволило успешно сравнивать эффективность ЭМ, экстрактов пряно-ароматических растений и синтетических антиоксидантов. Установлено, что активность ЭМ кориандра и чеснока, а также экстракта красного перца были близки, более высокой ингибирующей активностью обладали ЭМ орегано и экстракт розмарина и наиболее активными были ЭМ гвоздики, ионол и аскорбилпальмитат. Эффективность ингибирования автоокисления каротиноидов снижалась на 2–10% при уменьшении концентрации всех АО с 4 до 1%, кроме экстракта розмарина. Этот экстракт ингибировал автоокисление пропорционально его концентрации. Обнаружено сложное влияние состава смеси АО на эффективность ингибирования. В ди-, три- и тетра компонентных смесях ЭМ гвоздики, орегано, кориандра, чеснока или экстракта красного перца суммарная активность оставалась практически постоянной и близкой к свойствам наиболее активного компонента смеси – ЭМ гвоздики, при этом становилось возможным получение натуральных пищевых ароматизаторов с большим разнообразием органолептических характеристик. Экстракт розмарина снижал активность масла гвоздики в смеси 1 : 1, но практически не влиял на активность ЭМ орегано, аскорбилпальмитата и ионола. Во всех смесях АО не обнаружено аддитивных или синергетических эффектов.
Список литературы
Frankel E.N., Finley J.W. // J. Agric. Food Chem. 2008. V. 56. № 13. P. 4901–4908.
Huang D., Ou B., Prior R.L. // J. Agric. Food Chem. 2005. V. 53. № 6. P.1841–1856.
Prior R.L., Wu X., Schaich K. // J. Agric. Food Chem. 2005. V. 53. № 12. P. 4290–4302.
Miller H.E. // J. Amer. Oil Chem. Soc. 1971. V. 48. № 2. P. 91–98.
Roginsky V., Lissi E.A. // Food Chem. 2005. V. 92. P. 235–254.
Karadag A., Ozcelik B., Saner S. // Food Anal. Methods. 2009. V. 2. № 1. P. 41–60.
Бурлакова Е.Б., Мишарина Т.А., Фаткуллина Л.Д., Теренина М.Б., Крикунова Н.И., Ерохин В.Р., Воробьева А.К. // ДАН. 2011. Т. 437. № 3. С. 409–412.
Мишарина Т.А., Алинкина Е.С., Теренина М.Б., Крикунова Н.И., Киселева В.И., Семенова М.Г. // Прикл. биохимия и микробиология. 2015. Т. 51. № 4. С. 417–423.
Мишарина Т.А., Алинкина Е.С., Воробьева А.К., Теренина М.Б., Крикунова Н.И. // Прикл. биохимия и микробиология. 2016. Т. 52. № 3. С. 339–345.
Buettner G.R. // Archives of Biochem.Biophys. 1993. V. 300. № 4. P. 535–543.
Skibsted L.H. // J. Food Drug Analysis. 2012. V. 20. № 2. P. 355–358.
Miguel M.G. // Molecules. 2010. V. 15. P. 9252−9287.
Mortensen A., Skibsted L.H. // FEBS Letters. 1997. V. 417. № 2. P. 261–266.
El-Agamey A., Lowe G.M., Mcgarvey D.J., Mortensen A., Phillip D.M., Truscott T.G. // Arch. Biochem. Biophys. 2004. V. 430. № 1. P. 37–48.
Charles D.J. Antioxidant Properties of Spices, Herbs and Other Sources. N.Y.: Springer, 2013. 610 p.
Мишарина Т.А., Семенова М.Г., Киселева В.И. // Прикл. биохимия и микробиология, 2018. Т. 54. № 6. С. 655–661.
Antolovich M., Prenzler P.D., Patsalides E., McDonald S., Robards K. // Analyst. 2002. V. 127. № 1. P. 183–198.
Sacchetti G., Maietti S., Muzzoli M., Scaglianti M., Manfredini S., Radice M., Bruni R. // J. Agric. Food Chem. 2005. V. 91. № 3. P. 621–632.
Rosa A., Deiana M., Casu V., Paccagnini S., Appendino G., Ballero M., Dessi M.A. // J. Agric. Food Chem. 2002. V. 50. № 14. P. 7396–7401.
Ochi T., Takaishi Y., Kogure K., Yamauti I. // J. Nat. Prod. 2003. V. 66. № 6. P. 1094–1096.
Kim J.S., Ahn J., Lee S.J., Moon B., Ha T.Y., Kim S. // J. Food Sci. 2011. V. 76. № 1. P. C193–C198.
Materska M., Perucka I. // J. Agric. Food Chem. 2005. V. 53. № 6. P. 1750–1756.
Мишарина Т.А. // Прикл. биохимия и микробиология. 2016. Т. 52. № 1. С. 94–102.
Huang M.T., Ho C.T., Wang Z.Y. // Cancer Res. 1994. V. 54. № 3. P. 701–708.
Singletary K., MacDonald C., Wallig M. // Cancer Lett. 1996. V. 104. № 1. P. 43–48.
Yesil-Celiktas O., Sevimli C., Bedir E., Vardar-Sukan F. // Plant Food Hum. Nutr. 2010. V. 65. № 1. P. 158–163.
Chemistry of Spices / Eds. Parthasarathy V.A., Chempakam B., Zachariah T.J. Oxfordshire: CAB Int., 2008. P. 260–286.
Frankel E.N., Huang S.W., Aeschbach R., Prior E. // J. Agric. Food Chem. 1996. V. 44. № 1. P. 131–135.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


