Прикладная биохимия и микробиология, 2019, T. 55, № 2, стр. 133-137
Энантиоспецифичная сорбция L-лизина молекулярно импринтированными сорбентами на основе метакриловой кислоты и диметакрилата этиленгликоля
И. В. Полякова 1, *, О. А. Писарев 1, 2
1 Институт высокомолекулярных соединений РАН
199004 Санкт-Петербург, Россия
2 Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, Россия
* E-mail: pol_irina_val@list.ru
Поступила в редакцию 25.05.2018
После доработки 23.07.2018
Принята к публикации 25.09.2018
Аннотация
На основе метакриловой кислоты и диметакрилата этиленгликоля синтезированы полимерные сорбенты, импринтированные молекулами L-лизина. Проведено сравнительное изучение равновесия и кинетики сорбции этой аминокислоты синтезированными и контрольным сорбентами (неимпринтированным аналогом). Показано, что энантиоспецифичное разделение рацемической смеси D,L-лизина наиболее эффективно реализовывалось на полимерном сорбенте, синтезированном в присутствии 6 моль, % L-лизина, который сорбировал аминокислоту в поверхностном сорбционном слое на энергетически равноценных специфичных центрах связывания.
Одной из главных задач разработки препаративных сорбционных процессов выделения и очистки целевых биологически активных веществ (БАВ) из продуктов микробиологического синтеза относится поиск новых высокоселективных сорбентов, на которых их сорбция реализуется с высокими равновесными сорбционными емкостями, быстрой кинетикой гетерогенного массообмена при полной ее обратимости и сохранением нативной структуры [1, 2].
Молекулярный импринтинг является современной методикой создания высокоселективных сорбентов. При этомсополимеризацию функционального и сшивающего мономеров осуществляют в присутствии молекулы целевого БАВ, выполняющей роль шаблона или темплата. После удаления темплата из полимерной сетки в матрицах молекулярно импринтированных сорбентов (МИС) формируются импринт-сайты со специфичным сродством к целевому БАВ [3–5]. Таким образом, МИС представляют собой сорбенты, обладающие свойствами искусственных рецепторов к нему.
Энантиоспецифичное разделение рацемических смесей аминокислот, в частности D- и L-стереорегулярных форм лизинов, является актуальной задачей современной биотехнологии. К основному препятствию для широкого распространения прямого химического синтеза L-лизина относятся трудности, возникающие при разделении смеси аминокислот, состоящей из D- и L-изомеров. Широко известен способ получения L-лизина, основанный на использовании фермента лактомазы для ферментативной конверсии рацемата D,L–α-амино-ε-капролактама в L-лизин. После проведения ферментативной реакции в реакционной среде наряду с L-лизином находится и рацемическая смесь D- и L-стереоизомерных форм аминокислоты, которая должна быть подвергнута разделению [6].
Цель работы – разработка метода энантиоспецифичного разделения рацемической смеси D- и L-лизинов с использованием полимерных сорбентов на основе метакриловой кислоты (МАК) и диметакрилата этиленгликоля (ДМЭГ), молекулярно импринтированных L-лизином (лизМИС), и изучение влияния физико-химических свойств сорбционной среды на равновесие, кинетику и динамику сорбции ими аминокислоты.
МЕТОДИКА
В работе использованы МАК (“Вектон”, Россия), ДМЭГ (“Acros Organics”, Бельгия), изопропиловый спирт (ИПС) (“Вектон”, Россия), L-лизин (“Sigma”, США), аскорбиновая кислота (АсК) (“Вектон”, Россия) и персульфат аммония (ПСА) (“Вектон”, Россия).
Синтез полимерных сорбентов осуществляли методом радикальной сополимеризации МАК и ДМЭГ в среде 45%-ного ИПС при комнатной температуре. Концентрация сомономеров в реакционной смеси составляла 20% при соотношении МАК/ДМЭГ, равном 88 : 12 моль, %. Радикальную сополимеризацию инициировали окислительно-восстановительной системой ПСА-АсК в количестве 1 вес, % к массе сомономеров при соотношении ПСА/АсК, равном 1.5:1. Для синтеза лизМИСов в полимеризационную смесь вводили 3, 6, 9 и 12 моль, % L-лизина. Из синтезированных полимерных сеток темплаты аминокислоты вымывали 0.5 н. NaOH, водой, 0.5 н. HCl и далее снова водой до нейтрального рН.
Коэффициенты набухания (${{K}_{{\text{н }}}}$), насыпную плотность (d, г/см3), полную обменную емкость (ПОЕ, мг–экв/г) и кажущуюся константу диссоциации (pKα) сорбентов определяли по методикам, которые описаны в [7–9].
Величины pKα и параметр кооперативности ионизации (n) находили из линеаризованной формы модифицированного уравнения Гендерсона-Гассельбаха:
где n − характеризует изменение кажущейся константы диссоциации ионогенных групп с ростом их степени ионизации. Чем больше величина n отклоняется от 1, тем больше влияние ионизации каждой предыдущей карбоксильной группы на ионизацию последующей (кооперативный характер ионизации).Равновесие и кинетику сорбции L-лизина исследовали статическим методом. Равновесную емкость сорбции рассчитывали следующим образом:
где qр – равновесная емкость сорбции, мг/г; С и Ср – начальная и равновесная концентрация сорбтива (мг/мл), соответственно; V – объем раствора сорбтива (мл); m – масса сорбента (г).Кинетику сорбции аминокислоты изучали путем анализа кинетических кривых зависимости степени насыщения сорбента сорбатом (F) от времени (t). F рассчитывали по формуле:
где qt –сорбционная емкость в момент времени t.Среднее время сорбции, $\bar {t}$(мин), рассчитывали как площадь над кинетическими кривыми зависимости степени насыщения от времени сорбции:
При сорбции в полном объеме сферической частицы величина $\bar {D}$ рассчитывалась при помощи гомогенной модели Бойда [10]:
При сорбции в ограниченном сорбирующем слое кинетические характеристики сорбции могут быть рассчитаны при помощи модели “оболочка-ядро” [11]:
(6)
$\bar {D} = \frac{{(1 + 3\rho + 6{{\rho }^{2}} + 5{{\rho }^{3}})}}{{(1 + \rho + {{\rho }^{2}})}}\frac{{{{l}^{2}}}}{{15\bar {t}}},$Динамику сорбции изучали на колонках размером D × H = 10 × 50 мм. Динамические кривые сорбции анализировали в координатах Сi vs. (Vi – V0), где Сi – концентрация аминокислоты на выходе из колонки (мг/мл), Vi и V0 – объем элюента и свободный объем колонки (мл).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Структура и физико-химические свойства синтезированных полимерных сорбентов на основе МАК и ДМЭГ зависели от количества введенных темплатов L-лизина (табл. 1).
Таблица 1.
Влияние концентрации темплата на физико-химические свойства полимерных сорбентов на основе МАК и ДМЭГ
| Сорбент | Kн | ${{K_{{\text{н }}}^{{{\text{Na}}}}} \mathord{\left/ {\vphantom {{K_{{\text{н }}}^{{{\text{Na}}}}} {K_{{\text{н }}}^{{\text{H}}}}}} \right. \kern-0em} {K_{{\text{н }}}^{{\text{H}}}}}$ | d, г/см3 | Q, мг-экв/г | pKα | n | |
|---|---|---|---|---|---|---|---|
| Н-форма | Na-форма | ||||||
| КС | 4.0 | 10.0 | 2.5 | 0.71 | 8.6 | 6.3 | 1.7 |
| лизМИС-3 | 5.0 | 11.7 | 2.3 | 0.71 | 9.0 | 6.4 | 1.5 |
| лизМИС-6 | 5.4 | 14.4 | 2.7 | 0.70 | 8.8 | 6.3 | 1.4 |
| лизМИС-9 | 4.9 | 19.8 | 4.0 | 0.69 | 9.1 | 6.3 | 1.2 |
| лизМИС -12 | 4.4 | 24.5 | 5.6 | 0.69 | 9.2 | 6.2 | 1.2 |
Значения n в лизМИСах снижались по сравнению с неимпринтированным контрольным сорбентом (КС) и по мере роста концентрации темплатов в ряду лизМИСов. Следовательно, снижалось влияние ионизации карбоксильных групп на ионизацию последующих в матрицах сорбентов. В качестве характеристики структурной устойчивости КС и лизМИСов было выбрано отношение коэффициентов набухания сорбентов в натриевой форме к их коэффициентам набухания в водородной форме. Наименьшая структурная устойчивость наблюдалась для лизМИС-9 и лизМИС-12. Далее эти сорбенты не исследовались, так как большая разница в коэффициентах их набухания в натриевой и водородной формах исключала их применение в колоночных препаративных сорбционных процессах.
L-лизин является полиамфолитом и содержит в своей структуре две аминогруппы (pKα1 = = 9.12; pKα2 = 10.53) и одну карбоксильную группу (pKα = 2.18). Изоэлектрическая точка лизина pI = 9.82 [12].
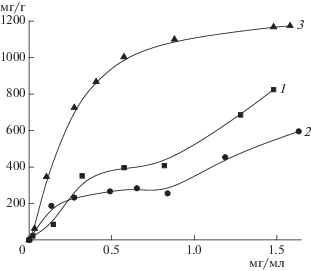
Сорбционные емкости КС по L-лизину значительно снижались с ростом ионной силы. Это, по-видимому, было обусловлено превалирующим вкладом ион-ионных взаимодействий в неспецифичную сорбцию аминокислоты (рис. 1а). Рост абсолютных величин сорбционных емкостей в области высоких значений рН был обусловлен сильными ион-ионными взаимодействия между полностью заряженными кислотными карбоксильными группами КС и сильноосновными ε-аминогруппами лизина.
Рис. 1.
Влияние pH и ионной силы на сорбционную емкость по L-лизину (0.2 мг/мл) КС (а), лизМИС-3 (б) и лизМИС-6 (в). 1 − 0.1, 2 − 0.2, 3 − 0.4 М ацетат натрия.
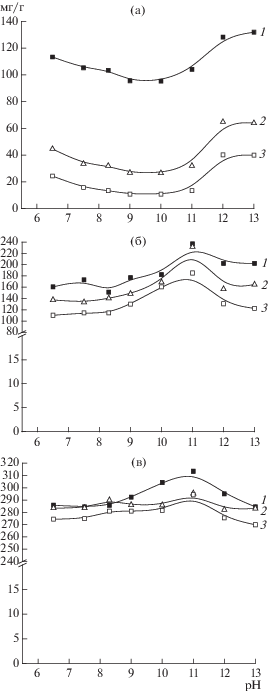
При сорбции на лизМИСах, особенно на лизМИС-6, величина сорбционной емкости практически не зависела от рН и ионной силы (рис. 1б, в). Это указывало на присутствие в молекулярно импринтированных матрицах совокупности сорбционных центров (импринт-сайтов), которые специфично связывали аминокислоту за счет неионных взаимодействий.
В ферментативном методе синтеза L-лизина продукты гидролиза D,L-α-амино-ε-капролактама в виде рацемической смеси D,L-аминокислот получают при рН 8.0–8.5 и ионной силе 0.2 М [6]. В связи с этим изотермы равновесной сорбции были изучены при рН 8.3 и I = 0.2 M.
Характер изотерм сорбции аминокислоты на КС и МИС различался. Неспецифичная сорбция L-лизина на КС осуществлялась на энергетически неоднородных сорбционных центрах (рис. 2, 1). Уже на лизМИС-3 наблюдалась тенденция к “гомогенизации” сорбционных центров, а на лизМИС-6 изотерма сорбции аминокислоты соответствовала выпуклой изотерме сорбции по независимым центрам (изотерме Ленгмюра, рис. 2, 2, 3). Это свидетельствовало о термодинамически выгодном распределении L-лизина на равноценных сорбционных центрах, которыми в матрице лизМИС-6 могут быть “полости”, комплементарные к аминокислоте.
Изучение кинетических характеристик сорбции также было проведено при рН 8.3 и 0.2 М ионной силе.
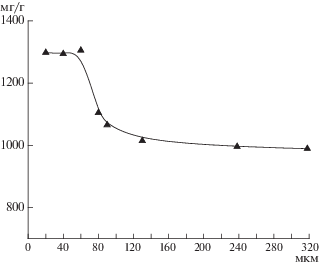
Радиус поверхностного сорбирующего слоя для расчета по модели “оболочка–ядро” был экспериментально установлен из зависимостей сорбционных емкостей от диаметра частиц и оказался равным 30 мкм (рис. 3).
Рис. 3.
Влияние диаметра частиц лизМИС-6 на сорбционную емкость по L-лизину при сорбции из 0.2 M ацетата натрия, pH 8.3.
По мере измельчения сорбентов их кинетические свойства улучшались (табл. 2). На фракции частиц с наиболее мелким размером (dч = 75 мкм) значения $\bar {D}$, рассчитанные по модели Бойда и “оболочка-ядро”, практически совпадали. Наиболее высокие значения $\bar {D}$ достигались на лизМИС-6. При этом они имели одинаковый порядок величин для всех размеров частиц сорбента. Это свидетельствовало о распределении аминокислоты преимущественно на легко “доступных” импринт-сайтах в поверхностно сорбирующем слое.
Таблица 2.
Кинетические характеристики сорбции L‑лизина КС и лизМИС (pH 8.3, I = 0.2 M)
| Сорбент | dч, мкм | $\bar {t},$ мин | $\bar {D} \times {{10}^{8}}$, см2/сек | |
|---|---|---|---|---|
| модель Бойда | модель “оболочка-ядро” | |||
| КС | 130 | 63.2 | 0.06 | 0.04 |
| 90 | 6.9 | 0.32 | 0.28 | |
| 75 | 1.1 | 1.42 | 1.38 | |
| лизМИС-3 | 130 | 8.6 | 0.43 | 0.97 |
| 90 | 4.3 | 0.52 | 0.45 | |
| 75 | 1.3 | 1.21 | 1.17 | |
| лизМИС -6 | 130 | 2.5 | 1.47 | 1.02 |
| 90 | 1.2 | 1.88 | 1.65 | |
| 75 | 0.7 | 3.23 | 3.17 | |
Данные по равновесию и кинетики сорбции были использованы для разработки динамического сорбционного метода разделения рацемической смеси D,L-лизина. На КС концентрационные профили были практически идентичны для L-лизина и D,L-лизина (рис. 4а). На лизМИС наблюдалось разделение концентрационного профиля при сорбции D,L-лизина (рис. 4б, в). При этом наиболее эффективное (практически до нулевой линии) разделение осуществлялось на лизМИС-6.
Рис. 4.
Специфичная сорбция L-лизина (1) и энантиоспецифичное разделение рацемической смеси D,L-лизина (2) (1 мг/мл в 0.2 M ацетате натрия, pH 8.3) на КС (а), лизМИС-3 (б) и лизМИС-6 (в) после десорбции 0.4 M ацетатом натрия, pH 11.7.
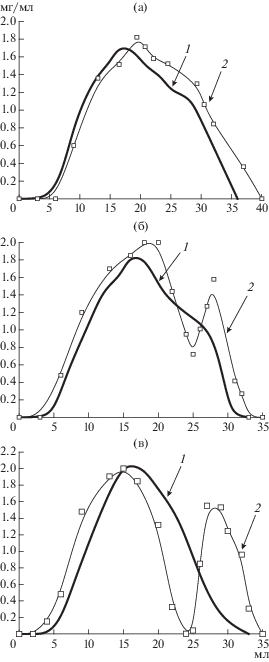
Таким образом, результаты исследования свидетельствовали о том, что импринтинг сополимеров МАК-ДМЭГ молекулами L-лизина приводил к получению полимерных сорбентов, которые обладали сорбционными центрами, способными осуществлять аффинноподобное связывание аминокислоты и еe энантиоселективное молекулярное узнавание.
Список литературы
Pisarev O.A., Polyakova I.V. Preparative Methods of Biologically Active Substances Fractionation. Saarbrucken: LAP Lambert Academic Publishing, 2013. 169 p.
Pisarev O.A., Polyakova I.V. // Trends in Chromatogr. 2013. V. 7. № 1. P. 85–106.
Spivak D.A., Shea K.I. // J. Mol. Recognit. 2012. V. 25. № 2. P. 320–382.
Cheong W.J., Yang S.H., Ali F. // J. Sep. Sci. 2013. V. 36. № 2. P. 609–628.
Chen L., Wang X., Lu W., Wu X., Li J. // Chem. Soc. Rev. 2016. V. 45. № 11. P. 2137–2211.
Mann J. Chemical Aspects of Biosynthesis. Oxford: University Press, 1998. 256 p.
Soldatov V.S., Sosinovich Z.I., Korshunova T.A., Mironova T.V. // React. Funct. Polym. 2004. V. 58. № 1. P. 3–12.
Полянский Н.Г., Горбунов Г.В., Полянская Н.Л. Методы исследования ионитов. М.: Химия, 1976. 206 с.
Ежова Н.М., Гаркушина И.С., Писарев О.А. // Прикл. биохимия и микробиология. 2011. Т. 47. № 6. С. 635–639.
Boyd G.E., Adamson A.W., Myers L.S. // J. Am. Chem. Soc. 1949. V. 67. № 9. P. 2836–2848.
Polyakova I.V., Pisarev O.A. // J. Chromatogr. A. 2005. V. 1092. № 1. P. 135–141.
Якубке Х.-Д., Ешкайт Х. Аминокислоты, пептиды, белки. М.: Мир, 1985. 455 с.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология