Прикладная биохимия и микробиология, 2019, T. 55, № 2, стр. 138-143
Получение и характеристика безметионинового варианта термостабильного шаперона GroEL из Thermus thermophilus
М. С. Юркова 1, 2, О. И. Саввин 2, В. А. Зенин 1, 2, А. Н. Фёдоров 1, 2, *
1 Российский университет дружбы народов
117198 Москва, Россия
2 Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
119071 Москва, Россия
* E-mail: a.fedorov@fbras.ru
Поступила в редакцию 03.09.2018
После доработки 17.09.2018
Принята к публикации 25.09.2018
Аннотация
Шаперон GroEL является объектом интенсивных исследований как с точки зрения его устройства и функционирования при сворачивании белков в клетке, так и возможностей использования в создаваемых системах экспрессии для получения рекомбинантных белков в растворимых формах. Создан вариант шаперона GroEL из Thermus thermophilus, в котором все остатки метионина заменены на остатки лейцина. Полученный вариант шаперона был очищен до гомогенного состояния. Измененный GroEL полностью сохранял четвертичную структуру, присущую исходному шаперону, в виде частицы из двойного гептамера, а также сохранял исходную термостабильность. Полученный вариант шаперона интересен не только с точки зрения структурной организации GroEL, но и может быть эффективно использован в качестве белка-носителя при получении целевых рекомбинантных белков. Замена остатков метионина в белке-носителе позволяет существенно упростить последующие процедуры очистки целевых полипептидов.
При экспрессии рекомбинантных белков и полипептидов в бактериальной системе исследователи часто сталкиваются с низким уровнем их экспрессии и/или агрегацией. Это может быть обусловлено различными причинами, как, например, лабильностью полипептидов, их гидрофобностью, неправильным сворачиванием белков в чужеродном организме или отсутствием гликозилирования. Одним из подходов к решению подобных проблем является создание слитых белков, где в качестве белка-лидера используется растворимый нетоксичный белок с высоким уровнем экспрессии, способный стабилизировать целевой белок. В качестве лидеров наиболее широко применяются тиоредоксин, мальтоза-связывающий белок и глутатионтрансфераза, которые в некоторых случаях помогали значительно повысить уровень экспрессии и/или растворимость целевого белка в составе конструкта [1–4]. Кроме перечисленных, разработаны и в некоторых случаях применяются и другие белки-лидеры, однако лидера, способного стабилизировать любые целевые белки, не существует, что объясняется, очевидно, разнообразием самих целевых белков. С точки зрения универсальности наибольшим потенциалом обладают, вероятно, шапероны, поскольку их нормальной функцией в клетке является ассистирование в сворачивании и стабилизация различных клеточных белков [5]. Кроме того, шаперон GroEL у большинства организмов имеет сложную четвертичную структуру, состоящую из двух колец по семь мономеров в каждом; субстратсвязывающая поверхность GroEL обращена внутрь образовавшейся полости, поэтому субстрат, связанный с GroEL, экранирован от цитоплазмы клетки [6]. Эти свойства GroEL представляются очень привлекательными при использовании его в качестве белка-лидера для экспрессии, например, лабильных полипептидов, или токсичных для бактериальной клетки. По окончании экспрессии слитого белка целевой полипептид бывает необходимо отделить от лидера, что удобно делать с помощью химической обработки, например, бромцианом, который расщепляет остатки метионина.
Цель работы – получение и изучение свойств шаперона GroEL из термостабильного организма, у которого все остатки метионина заменены на остатки лейцина для использования такой формы GroEL в качестве белка-носителя.
МЕТОДИКА
Создание гена GroEL Thermus thermophilus с заменой кодонов, кодирующих метионин, на кодоны, кодирующие лейцин. Получение экспрессирующей плазмиды. Аминокислотная последовательность GroEL из T. thermophilus содержит 6 остатков метионина, помимо инициаторного [6]. Кодирующие их триплеты были заменены на триплеты, кодирующие остатки лейцина, с помощью ПЦР с использованием следующих пар праймеров (праймеры синтезированы компанией “Евроген”, Россия):
TT-1 lo: 5'CCACCTTCTCCAGGGCGTCGGCAATCAGCTTG3',
TT-1 up: 5'GATTGCCGACGCCCTGGAGAAGGTGGGGAAGG3';
TT-2 lo: 5'AGGACCGCTTCCAGCGTCTCGGGGTTGGTGAC3',
TT-2 up: 5'CAACCCCGAGACGCTGGAAGCGGTCCTCGAGG3';
TT-3 lo: 5'TGTCCTTGAGCAGCTCCTTCCTGCGGTCACCGAAG3',
TT-3 up: 5'ACCGCAGGAAGGAGCTGCTCAAGGACATCGCGG3';
TT-4 lo: 5'CCGGCCCAGCAGGGAGAGGGTGGCGTTCTC3',
TT-4 up: 5'GCCACCCTCTCCCTGCTGGGCCGGGCCGAG3';
TT-5 lo: 5'CGCCTCCACCAGGTCCACGAACTCCCCGGTG3',
TT-5 up: 5'GGAGTTCGTGGACCTGGTGGAGGCGGGCATCG3'.
Далее, с помощью PCR со следующими праймерами (синтезированы в “Евроген”, Россия): прямой праймер TT-f-NdeI: 5'GGGAATTCCATATGGCGAAGATCCTGGTGTTTGACG3' и обратный праймер TT-r-BglII no Met 5'GGAAGATCTTTAGAAATCCAGGTCCCCGGCGC3' был получен ген безметионинового GroEL, заканчивающийся стоп-кодоном TAA (стоп-кодон выделен курсивом) и ограниченный рестрикционными сайтами для NdeI на 5'-конце и для BglII на 3'-конце (сайты выделены подчеркиванием). В качестве матрицы был использован геном T. thermophilus, полученный методом фенол-хлороформной депротеинизации из клеток микроорганизма. Полученный таким образом фрагмент был рестрицирован NdeI и BglII (“Fermentas”, Литва) согласно протоколу производителя и клонирован в экспрессионный вектор рЕТ11с (“Novagen”, Германия), в результате чего была получена экспрессионная плазмида pGroEL.
Клонирование GroES и создание бицистронной экспрессионной плазмиды. GroES из T. thermophilus был получен с помощью ПЦР с использованием прямого праймера (синтезированы в “Евроген”, Россия) f-NcoI 5'CATGCCATGGCCGCGGAGGTGAAGACG3' и обратного праймера (также “Евроген”, Россия) r-NotI 5'TTTTCCTTTTGCGGCCGCTTACTGCAGGACCGCAAGCAGGTCG3', содержащих, соответственно, рестрикционные сайты NcoI и NotI (сайты выделены подчеркиванием). В качестве матрицы был использован геном T. thermophilus, полученный методом фенол-хлороформной депротеинизации из клеток микроорганизма. Аминокислотная последовательность GroES из T. thermophilus не содержала остатков метионина [6].
Фрагмент GroEL, не содержащий кодирующих метионин кодонов, полученный на предыдущем этапе, был рестрицирован NdeI и BglII (“Fermentas”, Литва) согласно протоколу производителя и клонирован во второй полилинкер бицистронного экспрессионного вектора pET Duet (“Novagen”, Германия). Фрагмент GroES был рестрицирован NcoI и NotI и клонирован в первый полилинкер бицистронного экспрессионного вектора pET Duet. В результате была получена бицистронная экспрессионная плазмида pGroEL/ES.
Экспрессия белков. Экспрессию модифицированного варианта GroEL проводили в экспрессионном штамме E.coli BL21(DE3). Ca2+-компетентные клетки были трансформированы плазмидой pGroEL либо pGroEL/ES согласно общепринятой методике [7]. Клетки выращивали в жидкой среде LB с добавлением ампициллина (конечная концентрация 100 мкг/мл) при 37°С и интенсивной аэрации на качалке. По достижении клетками оптической плотности OD600 0.4 индукцию начинали добавлением изопропил-β-D-1-тиогалактопиранозида ( ИПТГ ) в конечной концентрации 0.4 мМ. Экспрессию проводили при 37°С в течение 3 ч при интенсивной аэрации, после чего клетки собирали с помощью центрифугирования при 4°С и 4000 g в течение 15 мин.
Выделение и очистка. Полученную биомассу лизировали под действием ультразвука в фосфатно-солевом буфере (10 мМ KH2PO4, рН 7.4, 140 мМ NaCl) в присутствии 1 мМ AEBSF (4-(2-aminoethyl)benzenesulfonyl fluoride hydrochloride). Растворимые белки отделяли от клеточного дебриса с помощью центрифугирования при 14 000 g в течение 15 мин при 4°С. Затем фракцию растворимых белков инкубировали при 62°С в течение 5 мин на водяной бане при постоянном перемешивании и снова центрифугировали в том же режиме, чтобы отделить агрегировавшие клеточные белки. Термостабильный комплекс GroEL/ES при этом оставался во фракции растворимых белков. Дальнейшую очистку проводили на колонке 10 × 300 мм (Tricorn, “GE Healthcare”, США) на носителе сефакрил S-400 в фосфатно-солевом буфере (10 мМ KH2PO4 рН 7.4, 140 мМ NaCl). Полученные фракции исследовали с помощью электрофореза в полиакриламидном геле в денатурирующих условиях. Фракции, содержащие гомогенный комплекс GroEL/ES, объединяли и использовали для экспериментов по проверке функциональности.
Гель-фильтрация. Аналитическая гель-фильтрация для оценки олигомерного состояния полученного белка или комплекса проводилась на колонке 10 × 300 мм (Tricorn, “GE Healthcare”, США) на носителе сефакрил S-400, предварительно откалиброванной с помощью стандартного набора белков Gel Filtration Calibration Kit HMW (голубой декстран, ферритин, бычий сывороточный альбумин, лизоцим, “GE Healthcare”, США). Хроматографию проводили в фосфатно-солевом буфере (10 мМ KH2PO4 рН 7.4, 140 мМ NaCl). Полученные фракции исследовали с помощью электрофореза в полиакриламидном геле в денатурирующих условиях.
Проверка термостабильности. Для проверки термостабильности комплекса GroEL/ES фракцию растворимых клеточных белков инкубировали при 62°С в течение 5 мин в твердотельном термостате “Гном” (“ДНК-технология”, Россия), после чего охлаждали на льду. Агрегировавшие белки отделяли от растворимой фракции центрифугированием при 13000 g в течение 15 мин при 4°С (центрифуга Eppendorf 5415R “DJB Labcare Ltd”, Великобритания), после чего супернатант и осадок анализировали с помощью электрофореза в полиакриламидном геле в денатурирующих условиях.
Проверка функциональности. Функциональность безметионинового GroEL, так же как и исходного варианта, проверяли по способности обратимо связывать денатурированный зеленый флюоресцирующий белок, GFP [8]. GFP денатурировали 10 мМ HCl. Спонтанную ренатурацию проводили в буфере, содержащим 50 мМ трис-HCl, 10 мМ КСl, 10 мМ MgСl2, 1 мM ДТТ, рН 7.8, с конечной концентрацией GFP 0.1 мкМ. Для изучения действия GroEL на ренатурацию в буфер добавляли 0.4 мкм GroEL либо 0.4 мкм GroEL с 0.8 мкм GroES, а через 5 мин также добавляли 2 мМ АТФ. Наличие функционального GFP определяли по его флюоресценции на 498 нм при длине волны возбуждения флюоресценции 395 нм на спектрофотометре Shimadzu RF-5301 (“Shimadzu”, Япония) и рассчитывали как долю или процент флюоресценции от флюоресценции при спонтанном сворачивании GFP.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
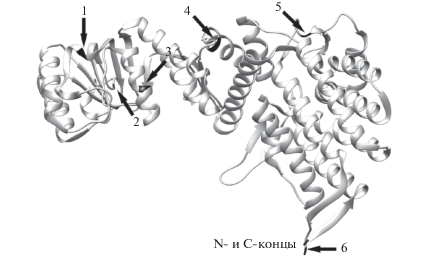
Безметиониновый вариант шаперона GroEL из термофильного организма был предназначен для последующего его использования в качестве белка-носителя при экспрессии целевых рекомбинантных полипептидов в системе слитых белков. Шаперон GroEL является наиболее полно исследованным шапероном с точки зрения его структурной организации и функционирования в ассистировании сворачивания белков в клетке [9–13]. Функции шаперонов, в том числе GroEL, по стабилизации различных белков в стрессовых для них условиях, могут быть также адаптированы для использования при экспрессии в бактериальной системе лабильных, гидрофобных, склонных к агрегации или токсичных пептидов [14, 15]. Шаперон GroEL применяется для повышения экспрессии, сворачивания и растворимости целевых рекомбинантных белков как при его ко-экспрессии, так и в качестве белка-носителя [5]. Для использования GroEL в качестве белка-носителя в подобной системе экспрессии необходимо предусмотреть возможность последующего отделения целевого полипептида, например, с помощью химического отщепления под действием бромциана по остаткам метионина. Если белок-носитель не содержит в своей аминокислотной последовательности остатков метионина, то очистка относительно небольшого полипептида от крупного белка может быть полноценно осуществлена в одну стадию, тогда как расщепление белка-носителя на несколько фрагментов существенно усложняет эту задачу. Природный GroEL содержит в своей аминокислотной последовательности шесть остатков метионина (рис. 1) [6].
Рис. 1.
Схема трехмерной структуры мономера GroEL из T. thermophilus [рисунок адаптирован из https://www.ncbi. nlm.nih.gov/Structure/pdb/1WE3 с помощью программы Chimera visualization [19]]. Стрелки с номерами указывают остатки метионина в структуре белка. N- и C-концы выделены черным цветом.
Кодирующие их триплеты были заменены на триплеты, кодирующие остатки лейцина, с помощью ПЦР (рис. 2). В качестве матрицы использовали ген GroEL из термофильного организма T. thermophilus. Природный термофильный GroEL из T. thermophilus сохраняет свою структуру и функциональность до температуры 90°С [16]. Предполагалось, что если GroEL сохранит термофильные свойства после внесенных в аминокислотную последовательность изменений, это станет еще одним преимуществом при последующем его использовании в качестве белка-носителя для экспрессии в бактериальной системе, поскольку позволит отделять мезофильные белки клетки-хозяина с помощью нагревания. Полученный ген был клонирован в экспрессионный вектор рЕТ11с и продемонстрировал высокий уровень экспрессии в бактериальной системе E. coli (данные не представлены). Однако проведенная с помощью гель-фильтрации оценка агрегатного состояния показала, что рекомбинантный термофильный GroEL существует в форме мономера, не образуя присущей исходной форме сложной четвертичной структуры (рис. 4а). Из литературных данных [17, 18] известно, что присутствие ко-фактора GroES стабилизирует такую структуру, поэтому безметиониновый термофильный GroEL был переклонирован в бицистронный экспрессионный вектор pET-Duet вместе с GroES из T. thermophilus для ко-экспрессии (см. раздел “Методика”). Полученный в данных условиях безметиониновый GroEL продемонстрировал высокий уровень экспрессии (рис. 3а) и практически полностью присутствовал во фракции растворимых клеточных белков (рис. 3б).
Рис. 2.
Схема ПЦР для конструирования последовательности GroEL T. thermophilus, не содержащей остатков метионина. Последовательности праймеров приведены в разделе “Методика”. Стрелками указано направление амплификации, под стрелками − названия соответствующих праймеров.
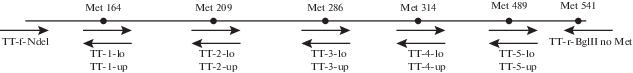
Рис. 3.
Электрофорез экспрессируемого белка GroEL T. thermophilus, не содержащего остатков метионина. а: 1 – до индукции, 2 – по окончании экспрессии; б: 1 – растворимые клеточные белки, 2 – нерастворимые белки. 3 – cтандарты молекулярной массы.
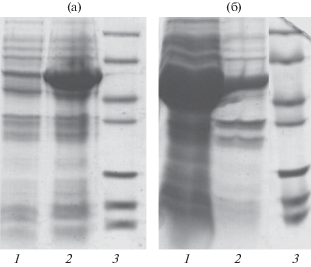
Рис. 4.
Гель-фильтрация на колонке с сефакрил S-400 GroEL из T. thermophilus, не содержащего остатков метионина, экспрессированного без GroES (а), ко-экспрессированного с GroES в составе бицистронной плазмиды (б). 14–21 – время выхода фракций, мин.; M – стандарты молекулярной массы; в – калибровочная кривая для колонки с сефакрил S-400 (кДа): голубой декстран – 1000, ферритин – 400, бычий сывороточный альбумин – 67, лизоцим – 14. Стрелками указано время выхода мономера GroEL и комплекса GroEL/ES.
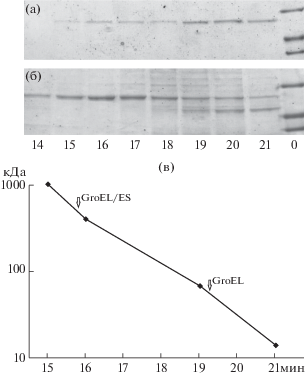
Агрегатное состояние комплекса GroEL/ES было проверено с помощью гель-фильтрации на колонке с сефакрилом S-400 (рис. 4б, 4в). Как показывает электрофоретический анализ фракций, комплекс GroEL/ES выходит в исключенном объеме, пик достигает максимума на 16 мин (рис. 4б) между калибровочными белками голубой декстран (более 1000 кДа) и ферритин (400 кДа), что указывает на сохранение четвертичной структуры комплекса GroEL/ES. Термостабильность комплекса была проверена с помощью нагревания фракции растворимых клеточных белков до 62°С в течение 5 мин (рис. 5).
Рис. 5.
Проверка термостабильности GroEL, не содержащего остатков метионина. 1 – до нагревания; 2 – супернатант, 3 – осадок после нагревания. M – cтандарты молекулярной массы.
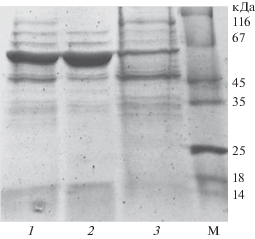
Комплекс GroEL/ES преимущественно оставался в растворе, тогда как большая часть белков мезофильной клетки-хозяина агрегировала. Сохранение термостабильности косвенно подтверждает сохранение четвертичной структуры комплексом GroEL/ES. Кроме того, термостабильность комплекса GroEL/ES предоставляет практическое преимущество, поскольку позволяет очистить его от белков клетки-хозяина с помощью нагревания, что и было использовано при последующей очистке белка на первой стадии. Дальнейшую очистку до гомогенного состояния проводили с помощью гель-проникающей хроматографии на колонке с сефакрилом S-400 (см. “Методика”), поскольку размеры комплекса GroEL/ES значительно превосходят размеры клеточных белков. Полученный гомогенный комплекс GroEL/ES использовали в экспериментах по проверке его функциональности. Одним из белков для изучения сворачивания с участием шаперона GroEL является зеленый флуоресцентный белок GFP, который в силу простоты и чувствительности теста является общепринятой моделью. Показано, что GroEL способен связывать и инкапсулировать GFP внутри частицы шаперона, а в присутствии также GroES и АТФ рефолдинг возобновляется с параметрами, неотличимыми от спонтанной ренатурации [8]. В проведенных экспериментах по ренатурации GFP было показано, что в присутствии как исходного GroEL, так и его безметионинового варианта, восстановления флюоресценции, т.е. ренатурации GFP, не происходило. Ренатурация возобновлялась в обоих случаях после добавления GroES и АТФ, и конечная достигнутая флюоресценция соответствовала флюоресценции GFP при спонтанной ренатурации в аналогичных условиях.
Замена сразу нескольких метионинов не сказывалась на основных параметрах шаперона GroEL – он оставался растворимым, сохранялся как термостабильная частица в комплексе GroEL/ES, а также сохранял функциональность. Это делает созданный вариант шаперона привлекательным для использования в качестве белка-носителя при получении целевых рекомбинантных пептидов в составе слитых белков.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации, уникальный идентификатор работы (проекта) RFMEFI57517X0151.
Список литературы
Kapust R.B., Waugh D.S. // Protein Sci. Publ. Protein Soc. 1999. V. 8. № 8. P. 1668–1674.
Riggs P., La Vallie E.R., McCoy J.M. // Curr. Protoc. Mol. Biol. Ed. Frederick M Ausubel Al. 2001. V. Chapter 16. C. Unit16.4A. doi 10.1002/0471142727.mb1604as28.10.1002/0471142727.mb1604as28
Terpe K. // Appl. Microbiol. Biotechnol. 2003. V. 60. № 5. P. 523–533.
Bell M.R., Engleka M.J., Malik A., Strickler J.E. // Protein Sci. Publ. Protein Soc. 2013. V. 22. № 11. P. 1466–1477.
Fedorov A.N., Yurkova M.S. // NanoWorld J. 2018. V. 4. № 1. P. 8–15.
Horwich A.L., Farr G.W., Fenton W.A. // Chem. Rev. 2006. V. 106. № 5. P. 1917–1930.
Inoue H., Nojima H., Okayama H. // Gene. 1990. V. 96. №1. P. 23–28.
Ishino S., Kawata Y., Taguchi H., Kajimura N., Matsuzaki K., Hoshino M. // J. Biol. Chem. 2015. V. 290. № 24. P. 15042–15051.
Thirumalai D., Lorimer G.H. // Annu. Rev. Biophys. Biomol. Struct. 2001. V. 30. P. 245–269.
Saibil H. // Nat. Rev. Mol. Cell Biol. 2013. V. 14. № 10. P. 630–642.
Fedorov A.N., Baldwin T.O. // J. Biol. Chem. 1997. V. 272. № 52. P. 32715–32718.
Kim Y.E., Hipp M.S., Bracher A., Hayer-Hartl M., Hartl F.U. // Annu. Rev. Biochem. 2013. V. 82. P. 323–355.
Tokatlidis K., Friguet B., Deville-Bonne D., Baleux F., Fedorov A.N., Navon A., Djavadi-Ohaniance L, Goldberg M.E. // Philos. Trans. R. Soc. Lond. B. Biol. Sci. 1995. V. 348. № 1323. P. 89–95.
Kim S.G., Kweon D.H., Lee D.H., Park Y.C., Seo J.H. // Protein Expr. Purif. 2005. V. 41. № 2. P. 426–432.
Tong Y., Feng S., Xin Y., Yang H., Zhang L., Wang W., Chen W. // J. Biotechnol. 2016. V. 218. P. 75–84.
Taguchi H., Konishi J., Ishii N., Yoshida M. // JBC 1991. V. 266. № 33. P. 22411–22418.
Weiss C., Jebara F., Nisemblat S., Azem A. // Front. Mol. Biosci. 2016. https://doi.org/. doi 10.3389/fmolb.2016.00080
Ryabova N.A., Marchenkov V.V., Marchenkova S.Y., Kotova N.V., Semisotnov G.V. // Biochemistry. (Moscow). 2013. V. 78. № 13. P. 1405–1414.
Pettersen E.F., Goddard T.D., Huang C.C., Couch G.S., Greenblatt D.M., Meng E.C., Ferrin T.E. // J. Comput. Chem. 2004. V. 25. № 13. P. 1605–1612.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


