Прикладная биохимия и микробиология, 2019, T. 55, № 4, стр. 410-416
Разработка иммуноферментного анализа Х-вируса картофеля с тираминовой амплификацией
Н. А. Панфёрова 1, В. Г. Панфёров 1, И. В. Сафенкова 1, Ю. А. Варицев 2, А. В. Жердев 1, Б. Б. Дзантиев 1, *
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Всероссийский научно-исследовательский институт картофельного хозяйства им. А.Г. Лорха
140051 п. Красково, Московская обл., Россия
* E-mail: dzantiev@inbi.ras.ru
Поступила в редакцию 01.11.2018
После доработки 12.12.2018
Принята к публикации 20.02.2019
Аннотация
Предложен способ снижения предела обнаружения иммуноферментного анализа Х-вируса картофеля, основанный на множественном введении тирамина в иммунные комплексы и последующей детекции ферментной метки. При проведении иммуноферментного анализа постадийно формировался “сэндвич” комплекс, содержащий иммобилизованные антитела – Х-вирус картофеля–конъюгат пероксидазы хрена с антителами к вирусу. Пероксидаза катализировала множественное введение тирамин-биотиновой метки в белковые молекулы, обеспечивая амплификацию сигнала при добавлении конъюгата стрептавидин–полипероксидаза. Установлены условия анализа, обеспечивающие высокую степень амплификации и минимальный фоновый сигнал. Использование тираминовой амплификации позволяло снизить предел обнаружения более чем в 30 раз (с 100 до 3 нг/мл) при анализе в буфере и экстрактах листьев картофеля, незначительно увеличивая его продолжительность. Тираминовая амплификация основана на использовании универсальных реагентов и может быть применена для снижения предела обнаружения иммуноферментного анализа других антигенов.
В настоящее время иммуноферментный анализ (ИФА) широко используется для детекции целевых аналитов в медицинской диагностике [1], пищевой промышленности [2], ветеринарии [3] и мониторинге окружающей среды [4, 5]. Наибольшее распространение получил ИФА в гетерогенном микропланшетном формате. Использование твердого носителя позволяет проводить разделение свободных и связавшихся иммунореагентов путем промывки его лунок. Комплексы антигенов и специфических антител, образующиеся при ИФА, выявляются с помощью конъюгатов иммунореагентов с ферментами, которые детектируются по каталитической активности. В ИФА в качестве метки наиболее распространена пероксидаза хрена (ПХ) [6].
Однако, несмотря на высокую каталитическую активность ПХ, в ряде случаев предел обнаружения ИФА, который для поливалентных антигенов (белков, вирусов и клеток) лимитируется чувствительностью детекции метки, оказывается недостаточным. Для высокочувствительного ИФА может быть использован подход, основанный на детекции оптических свойств наночастиц (длина волны максимума поглощения и значение максимального поглощения), изменяющихся при их взаимодействиях и модификациях [7]. Другой подход для снижения предела обнаружения ИФА основан на амплификации количества детектируемых молекул методом полимеразной цепной реакции (иммуно-ПЦР) [8].
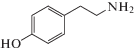
В данной работе представлена схема ИФА, основанная на множественном ковалентном введении тираминовых производных (биотин-тирамин). В работе [9] было показано, что ПХ способна активировать тирамин с образованием высокоактивного свободного радикала, который связывается с тирозиновыми остатками белков, приводя к ковалентному связыванию тирамина с белковыми молекулами. Структурная формула тирамина представлена на рис. 1. Формирование активных радикалов обеспечивает свободная гидроксильная группа в его молекуле, а синтез конъюгатов с биотином (или иными метками) – аминогруппа [10].
Амплификация основана на введении в белковые молекулы множества молекул тирамина, благодаря чему обеспечивается включение в состав иммунных комплексов большего количества метки – флуорофора [11], фермента [12] и др. Тираминовая амплификация была использована для снижения предела обнаружения различных форматов иммуноанализа [13–17].
Цель работы – разработка ИФА с тираминовой амплификацией для высокочувствительной детекции Х-вируса картофеля (ХВК), одного из основных его патогенов [18], и подбор условий его проведения для растительных проб с высоким уровнем эндогенных пероксидаз, обеспечивающих минимальный неспецифический сигнал.
МЕТОДИКА
ХВК выделяли из зараженных растений картофеля методом экстракции/осаждения и последующего градиентного центрифугирования, как описано в [19]. Получение и характеристика моноклональных антител клона 3G4, специфичных к ХВК, приведены в [20], а поликлональных антител к ХВК − в [18]. В работе использовали диметилформамид (ДМФ), 3,3',5,5'-тетраметилбензидин (ТМБ), конъюгат стрептавидин-полипероксидаза, периодат натрия, триэтиламин, тирамин гидрохлорид, цианоборогидрид натрия и пероксидазу хрена (“Sigma”, США), диметилсульфоксид (ДМСО), бычий сывороточный альбумин (БСА) и биотин-N-гидроксисукцинимид (“MP Biomedicals”, Великобритания), яичный альбумин (ЯА) (“Bioreba”, Швейцария), этаноламин (“ICN Pharmaceuticals”, США) и пероксид водорода (“Химмед”, Россия). Все соли, кислоты и растворители были химической чистоты.
Для проведения ИФА использовали 96-луночные прозрачные полистироловые микропланшеты Costar 9018 (“Corning Costar”, США). Отмывку лунок микропланшетов от не связавшихся реагентов проводили с помощью автоматического моющего устройства Biochrom Anthos Fluido 2 (“Biochrom”, Великобритания), а измерения интенсивности окраски в лунках по окончании ИФА – микропланшетного спектрофотометра PerkinElm (“PerkinElmer”, США). Для получения спектров поглощения использовали спектрофотометр Biochrom Libra S80 (“VBW”, Великобритания).
Синтез конъюгатов поликлональных антител с пероксидазой хрена. ПХ конъюгировали с антителами, используя метод периодатного окисления [21]. К раствору ПХ (10 мг/мл в 50 мМ калий-фосфатном буфере, pH 7.4, содержащем 0.1 М NaCl, ФБС) добавляли периодат натрия до конечной концентрации 8 мМ и инкубировали в течение 20 мин. Окисленную ПХ отделяли с помощью центриконов (“Merck Millipore”, США) с порогом отсечения 15 кДа, и добавляли к ней поликлональные антитела к ХВК в 200 мМ натрий-карбонатном буфере, pH 9.5. Мольное соотношение ПХ:антитела составляло 5 : 1. Полученную смесь инкубировали в течение 3 ч, затем добавляли цианоборогидрид натрия до конечной концентрации 50 мкМ и инкубировали в течение 1 ч. Для блокирования не прореагировавших окисленных групп ПХ добавляли этаноламин до конечной концентрации 50 мМ и инкубировали также 1 ч. Полученный конъюгат диализовали три раза против ФБС, добавляли глицерин до конечной концентрации 50% и хранили при – 24°C.
Синтез конъюгата тирамин-биотин. Для конъюгирования тирамин (55 мМ) и биотин-N-гидроксисукцинимид (66 мМ) растворяли в безводном ДМСО и смешивали их равные объемы. В реакционную смесь добавляли 30 мМ триэтиламина и выдерживали при постоянном перемешивании и комнатной температуре в течение 3 ч. Для блокирования избытка активированных групп добавляли этаноламин до конечной концентрации 20 мМ и инкубировали 1 ч. Полученный раствор конъюгата смешивали с равным объемом этанола и хранили при 4°C [22].
Приготовление экстрактов листьев картофеля. Свежесрезанные листья здоровых и инфицированных ХВК растений картофеля помещали в ФБС с добавлением 0.05% детергента Тритон X‑100 (ФБС-Т). Соотношение лист:буфер по массе составляло 1 : 15. Листья тщательно измельчали в ступке в течение 30 с и использовали для анализа без дальнейшей пробоподготовки. Для приготовления искусственно контаминированных экстрактов в экстракты листьев здоровых растений вносили ХВК в известных концентрациях.
Проведение ИФА. На поверхность лунок микропланшета сорбировали моноклональные антитела клона 3G4 (2 мкг/мл в ФБС) в течение 2 ч при 37°C. Микропланшет пятикратно промывали ФБС-Т. Для блокирования поверхности в лунки микропланшета вносили раствор БСА или ЯА (3 мг/мл) и выдерживали в течение 1 ч при 37°С. Далее микропланшет пятикратно промывали ФБС-Т. Затем в лунки микропланшета добавляли по 100 мкл проб, содержащих ХВК в концентрациях от 500 до 0.008 нг/мл (или экстракт с неизвестным содержанием ХВК), инкубировали в течение 1 ч при 37°С и после этого пятикратно промывали ФБС-Т. Далее в лунки микропланшета добавляли 100 мкл конъюгата ПХ с антителами к ХВК в ФБС-Т в различных разбавлениях (1 : 7000, 1 : 5000, 1 : 2000 и 1 : 1000), инкубировали в течение 1 ч при 37°С и промывали ФБС-Т. В лунки микропланшета добавляли раствор субстрата, содержавший ТМБ (0.4 мМ) и Н2О2 (3 мМ) в 40 мМ Na-цитратном буфере, рН 4.0. Смесь инкубировали в течение 10 мин при комнатной температуре. Ферментативную реакцию останавливали добавлением 50 мкл 1 М серной кислоты, и измеряли оптическую плотность при 450 нм (А450). Зависимость оптической плотности от концентрации ХВК строили с помощью программы OriginPro 9.0 (“Origin Lab”, США). Предел обнаружения (ПО) ИФА определяли как количество ХВК, для которого значение А450 превосходило сумму оптической плотности для отрицательного контроля (Blank450) и трех стандартных отклонений (СО): ПО ИФА = Blank450 + 3СО.
Проведение ИФА с тираминовой амплификацией. Сорбцию антител, блокирование поверхности и добавление пробы с ХВК и конъюгата антитела–ПХ выполняли, как описано выше. После пятикратной промывки ФБС-Т вносили раствор, содержавший конъюгат тирамин–биотин в концентрации 20 мкМ (на стадии оптимизации варьировали концентрацию от 100 до 0.1 мкМ) и пероксид водорода (0.08%), и инкубировали в течение 10 мин при комнатной температуре. Микропланшет пятикратно промывали ФБС-Т, добавляли конъюгат стрептавидин–полипероксидаза (1 : 7000 в ФБС-Т) и инкубировали 40 мин при 37°C. После пятикратной промывки микропланшета ФБС-Т добавляли раствор субстрата и регистрировали результаты анализа, как описано в предыдущем разделе.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Оптимизация условий ИФА. Система с прямым введением пероксидазной метки имела меньше этапов, что позволяло снизить неспецифический фон. Анализ основан на формировании “сэндвич” комплекса, содержавшего адсорбированные антитела – ХВК – конъюгат ПХ-поликлональные антитела к ХВК. Для системы без тираминового усиления на стадии 3 (рис. 2) добавляли ТМБ и регистрировали А450.
Рис. 2.
Использованные в работе схемы ИФА: без тираминовой амплификации (1–3 – последовательные стадии анализа) и с тираминовой амплификацией (4, 5 – последовательные стадии анализа). В нижнем ряду приведены графические обозначения компонентов формирующихся в ходе ИФА иммунных комплексов. Буквенные обозначения приведены в тексте статьи.
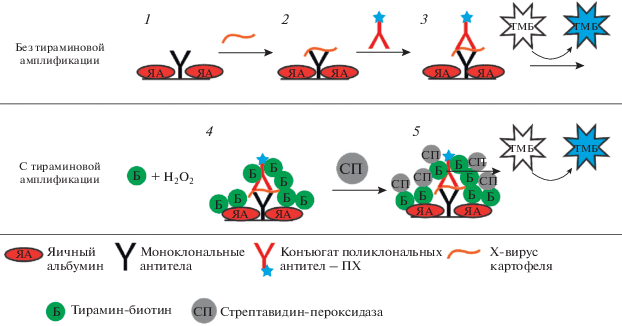
Для снижения ПО и уменьшения неспецифического связывания была проведена оптимизация условий ИФА без/с тираминовой амплификацией. На каждой из стадий ИФА последовательно варьировали концентрации реагентов, время инкубации и условия промывки. Оптимальными считали параметры, обеспечивающие наименьший ПО анализа и наименьший неспецифический фон. Полученные результаты суммированы в табл. 1.
Таблица 1.
Результаты оптимизации ИФА без/с тираминовой амплификацией
| Стадия ИФА либо условия ее проведения | Варьируемые пределы | Оптимальное значение для ИФА | |
|---|---|---|---|
| без амплификации | с амплификацией | ||
| Блокировка поверхности микропланшета | Концентрация белков (БСА, ЯА) 2–3 мг/мл или отсутствие блокировки | Не влияет на характеристики ИФА | Блокировка ЯА (3 мг/мл) снижает фоновый сигнал и увеличивает специфический сигнал |
| Состав буфера для промывки микропланшета | ФБС-Т ФБС-Т + 200 мМ NaCl ФБС-Т + 0.1% Тритон X-100 |
Не влияет на характеристики ИФА | Не влияет на характеристики ИФА |
| Количество промывок микропланшета | От 3 до 5 | Не влияет на характеристики ИФА | Использование 5 отмывок незначительно снижает фоновый сигнал |
| Разведение конъюгата ПХ-антитела | От 1 : 103 до 1 : 105 | Использование конъюгата в разведении 1 : 103 приводит к неспецифическому фону | Специфический сигнал определяется разведением конъюгата. При малых разведениях (1 : 103) наблюдается неспецифический фон |
| Концентрация конъюгата тирамин-биотин | 0.1–100 мкМ | Не используется | 15 мкМ |
| Время инкубации с конъюгатом тирамин-биотин | 1–30 мин | Не используется | 10 мин. Инкубация свыше 20 мин приводит к высокому фоновому сигналу |
| Разведение конъюгата стрептавидин-полипероксидаза | От 1 : 4 × 103 до 1 : 7 × 103 | Не используется | 1 : 7 × 103. Использование разведения 1 : 5 × 103 и менее приводит к высокому фоновому сигналу |
Проведенные эксперименты показали, что для достижения максимального специфического и минимального неспецифического сигналов необходимо блокировать поверхность микропланшета ЯА (3 мг/мл). В выбранных условиях неспецифическое связывание иммунореагентов на последующих стадиях анализа не наблюдали. Блокировка позволяла повысить А450 за счет большего связывания тираминовой метки, активированной ПХ, с тирозиновыми остатками блокирующего ЯА [23]. Все последующие эксперименты проводили в оптимизированных условиях, включающих 5-кратную промывку микропланшета ФБС-Т, концентрацию конъюгата тирамин–биотин – 15 мкМ, время инкубации с конъюгатом тирамин–биотин – 10 мин и разведение конъюгата стрептавидин–полипероксидаза – 1 : : 7 × 103 (табл. 1).
ИФА ХВК в буфере с тираминовой амплификацией. Для определения аналитических характеристик ИФА анализировали ХВК в буфере при разных разведениях конъюгата ПХ–антитела – от 1 : 104 до 1 : 105. Зависимость А450 от концентрации ХВК для ИФА без и с тираминовым усилением представлена на рис. 3.
Рис. 3.
Зависимость А450 от концентрации ХВК при проведении ИФА в буфере без тираминового усиления, конъюгат ПХ-антитела с разведением 1 : 104 (1), и с тираминовым усилением, конъюгат ПХ-антитела с разведениями 1 : 104, 1 : 5 × 104, 1 : 105 (2–4). а − калибровочные кривые; б − участки кривых при низких концентрациях ХВК. Уровни А450, соответствующие пределам обнаружения ИФА для калибровочных кривых 2–4, показаны пунктирными линиями.
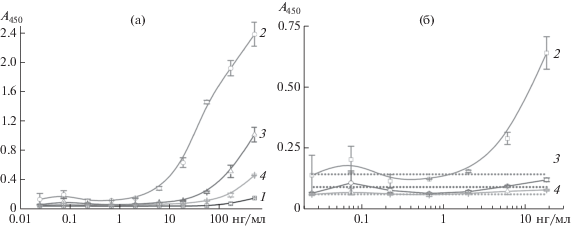
Из полученных результатов видно, что для ИФА без тираминовой амплификации детектируемый сигнал наблюдался только при разведении конъюгата ПХ–антитела 1 : 104 (рис. 3а, кривая 1). ПО ХВК в ИФА без тираминовой амплификации составлял 100 нг/мл. При использовании больших разведений конъюгата (1 : 5 × 104 и 1 : 105) не наблюдалось окрашивания раствора субстрата даже при высоких концентрациях вируса (более 200 нг/мл).
Для ИФА с тираминовой амплификацией, чем большее количество ПХ вводили на стадии формирования сэндвич-комплекса (рис. 2, стадия 3), тем больше активировалась тираминовая метка и больше конъюгата стрептавидин-полипероксидаза вводилось в состав иммунного комплекса (рис. 2, стадии 4 и 5). В связи с этим ПО ИФА с тираминовым усилением зависела от разведения конъюгата ПХ. Так, при разведении конъюгата ПХ 1 : 104, 1 : 5 × 104 и 1 : 105 ПО ХВК в буфере оказался равен 3, 10 и 20 нг/мл соответственно (рис. 3б). Использование меньших разведений конъюгата ПХ было ограничено неспецифическим окрашиванием даже в схеме без тираминовой амплификации.
Детекция ХВК в экстрактах листьев картофеля. Листья картофеля характеризуются высокой эндогенной пероксидазной активностью, которая в используемом ИФА может привести к высокому фоновому сигналу из-за неспецифического введения тираминовой метки. Выбранные условия ИФА (блокировка поверхности и оптимизированные концентрации реагентов, см. табл. 1) нивелировали эндогенную пероксидазную активность, что позволяло проводить ИФА в растительных экстрактах. Зависимости А450 от содержания вируса в растительном экстракте представлены на рис. 4.
Рис. 4.
Зависимость А450 от концентрации ХВК при проведении ИФА в экстракте листьев картофеля без тираминового усиления, конъюгат ПХ-антитела с разведением 1 : 104 (1), и с тираминовым усилением, конъюгат ПХ-антитела с разведением 1 : 104 (2). а − калибровочные кривые; б − участки кривых, при низких концентрациях ХВК. Уровни А450, соответствующие пределам обнаружения ИФА для калибровочных кривых 1 и 2, показаны пунктирными линиями.
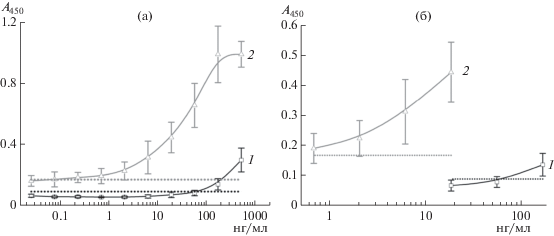
Из полученных результатов (рис. 4б) видно, что тираминовая амплификация снижала ПО ХВК в экстрактах листьев картофеля более чем в 30 раз – с 100 до 3 нг/мл.
ИФА с тираминовой амплификацией и без нее были применены для детекции ХВК в экстракте листьев картофеля. Были протестированы 9 экстрактов до и после их разбавления (в 10, 50, 100, 200 раз) здоровым экстрактом. Полученные результаты представлены в табл. 2.
Таблица 2.
Результаты ИФА экстрактов листьев картофеля без/с тираминовой амплификацией
| Экстракт | Вариант ИФА | Разбавление | |||
|---|---|---|---|---|---|
| 10 | 50 | 100 | 200 | ||
| № 1 | Без амплификации | + | + | – | – |
| С амплификацией | + | + | + | + | |
| № 2 | Без амплификации | + | + | + | + |
| С амплификацией | + | + | + | + | |
| № 3 | Без амплификации | + | – | – | – |
| С амплификацией | + | + | – | – | |
| № 4 | Без амплификации | + | – | – | – |
| С амплификацией | + | + | + | – | |
| № 5 | Без амплификации | + | + | + | – |
| С амплификацией | + | + | + | + | |
| № 6 | Без амплификации | + | + | – | – |
| С амплификацией | + | + | + | + | |
| № 7 | Без амплификации | + | + | + | – |
| С амплификацией | + | + | + | + | |
| № 8 | Без амплификации | + | – | – | – |
| С амплификацией | + | + | – | – | |
| № 9 | Без амплификации | – | – | – | – |
| С амплификацией | – | – | + | – | |
Использование тираминовой амплификации в ИФА позволяло детектировать ХВК в сильно разбавленных экстрактах по сравнению с не амплифицированным форматом ИФА. Экстракт листьев здорового растения (№ 9) показал отрицательный результат в ИФА как с тираминовой амплификацией, так и без нее.
Сравнение пределов обнаружения анализа без/с тираминовой амплификации. Показано, тираминовая амплификация обладает различной эффективностью (табл. 3). Разработанный в данной работе ИФА с тираминовой амплификацией позволил снизить ПО в 30 раз, что оказалось сопоставимо с ранее описанными реализациями этого подхода. Следует отметить, что тираминовая амплификация до настоящего времени не использовалась при анализе проб с высокой эндогенной пероксидазной активностью.
Таблица 3.
Эффективность использования тираминовой амплификации для разных иммуноаналитических систем
| Аналит | Снижение предела обнаружения, раз | Матрикс | Ссылка |
|---|---|---|---|
| Респираторно-синцитиальный вирус человека | 50 | Разбавленная сыворотка | [10] |
| Salmonella typhimurium | 50 | Пробы мяса | [24] |
| Последовательность нуклеиновой кислоты | 10–50 | Разбавленная сыворотка | [25] |
| Альфа-фетопротеин | 17 | Разбавленная сыворотка | [16] |
| IgG | 10 | Буфер | [26] |
| IgG | 10 | Буфер | [27] |
| Х-вирус картофеля | 30 | Растительный экстракт | Данная работа |
Предложенный формат ИФА был применен для определения ХВК в экстрактах листьев картофеля. Высокая чувствительность детекции фитопатогенов позволяла выявлять инфицирование на начальных стадиях и диагностировать латентные инфекции, сопровождающиеся отсутствием внешних симптомов и накоплением малых количеств патогена.
Таким образом, разработан способ снижения ПО ХВК методом ИФА, основанный на множественном введении тираминовой метки. При анализе экстракта листьев картофеля тираминовая амплификация с применением ПХ позволила снизить ПО ХВК с 100 до 3 нг/мл. Тираминовая амплификация, которая относится к универсальному методу снижения ПО иммуноанализа, может быть использована для высокочувствительной детекции других антигенов.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 14-14-01131).
Список литературы
Tighe P.J., Ryder R.R., Todd I., Fairclough L.C. // Proteomics Clin. Appl. 2015. V. 9. № 3–4. P. 406–422.
Asensio L., González I., García T., Martín R. // Food Control. 2008. V. 19. № 1. P. 1–8.
Wild D. The Immunoassay Handbook. Waltham: Elsevier, 2013. 987 p.
Zhang Z., Zeng K., Liu J. // Trends Anal. Chem. 2017. V. 87. P. 49–57.
Watanabe E., Miyake S., Yogo Y. // J. Agric. Food Chem. 2013. V. 61. № 51. P. 12459–12472.
Vashist S.K., Luong J.H.T. Handbook of Immunoassay Technologies Approaches, Performances and Applications. N. Y.: Academic Press, 2018. 478 p.
Satija J., Punjabi N., Mishra D., Mukherji S. // RSC Adv. 2016. V. 6. № 88. P. 85440–85456.
Chang L., Li J., Wang L. // Anal. Chim. Acta. 2016. V. 910. P. 12–24.
Bobrow M.N., Harris T.D., Shaughnessy K.J., Litt G.J. // J. Immunol. Methods. 1989. V. 125. № 1–2. P. 279–285.
Zhan L., Yang T., Li C.M., Wu W.B., Huang C.Z. // Sens. Actuators B Chem. 2018. V. 255. P. 1291–1297.
Speel E.J.M., Ramaekers F.C.S., Hopman A.H.N. // J. Histochem. Cytochem. 1997. V. 45. № 10. P. 1439–1446.
Liu P., Li C., Zhang R., Tang Q., Wei J., Lu Y., Shen P. // Biosens. Bioelectron. 2018. V. 126. P. 543–550.
Kubota K. // Microbes Environ. 2013. V. 28. № 1. P. 3–12.
Meany D.L., Hackler L., Zhang H., Chan D.W. // J. Proteome Res. 2011. V. 10. № 3. P. 1425–1431.
Akama K., Shirai K., Suzuki S. // Anal. Chem. 2016. V. 88. № 14. P. 7123–7129.
Li X., Chen B., He M., Xiao G., Hu B. // Talanta. 2018. V. 176. P. 40–46.
Lucas-Garrote B., Morais S., Maquieira A. // Sens. A-ctuators B Chem. 2017. V. 246. P. 1108–1115.
Бызова Н.А., Сафенкова И.В., Чирков С.Н., Жердев А.В., Блинцов А.Н., Дзантиев Б.Б., Атабеков И.Г. // Прикл. биохимия и микробиология. 2009. Т. 45. № 2. С. 225–231.
Nikitin N., Ksenofontov A., Trifonova E., Arkhipenko M., Petrova E., Kondakova O., Kirpichnikov M., Atabekov J., Dobrov E., Karpova O. // FEBS Lett. 2016. V. 590. № 10. P. 1543–1551.
Safenkova I., Zherdev A., Dzantiev B. // Anal. Bioanal. Chem. 2012. V. 403. № 6. P. 1595–1605.
Hermanson G.T. Bioconjugate Techniques. San Diego: Acad. Press, 2013. 1146 p.
Hopman A.H.N., Ramaekers F.C.S., Speel E.J.M. // J. Histochem. Cytochem. 1998. V. 46. № 6. P. 771–777.
Bhattacharya R., Bhattacharya D., Dhar T.K. // J. Immunol. Methods. 1999. V. 227. № 1–2. P. 31–39.
Herzig G.P.D., Aydin M., Dunigan S., Shah P., Jeong K.C., Park S.H., Ricke S.C., Ahn S. // J. Food Saf. 2016. V. 36. № 3. P. 383–391.
Zerbini M., Cricca M., Gentilomi G., Venturoli S., Gallinella G., Musiani M. // Clin. Chim. Acta. 2000. V. 302. № 1–2. P. 79–87.
Yuan L., Xu L., Liu S. // Anal. Chem. 2012. V. 84. № 24. P. 10737–10744.
Fu C., Jin S., Shi W., Oh J., Cao H., Jung Y.M. // Anal. Chem. 2018. V. 90. № 22. P. 13159–13162.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология