Прикладная биохимия и микробиология, 2019, T. 55, № 4, стр. 403-409
Роль оксида азота в фотоморфогенезе Neurospora сrassa
С. Ю. Филиппович 1, *, М. В. Онуфриев 2, Г. П. Бачурина 1, М. С. Крицкий 1
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Институт высшей нервной деятельности и нейрофизиологии РАН
117485 Москва, Россия
* E-mail: syf@inbi.ras.ru
Поступила в редакцию 16.09.2018
После доработки 26.11.2018
Принята к публикации 20.02.2019
Аннотация
Роль оксида азота в фотоморфогенезе штаммов Neurospora сrassa дикого типа wt-987, nit-2 (лишенный нитрит- и нитратредуктаз) и nit-6 (лишенный нитритредуктазы) оценивали по присутствию конечных продуктов распада NO, нитрата и нитрита, в мицелии и среде культивирования. Анализ динамики выхода нитрита из мицелия в ходе фотостимулируемого конидиогенеза штамма N. crassa nit-6 свидетельствовал о возможном участии NO-генерирующего механизма в трансдукции фотосигнала гриба. Введение в среду культивирования донора оксида азота, S-нитрозоглутатиона, ингибировало, а ингибитора NO-синтазы, L-нитроаргинина, стимулировало фотоконидиогенез N. crassa, что является свидетельством участия NO в данном процессе. Вместе с тем, отсутствие выхода ${\text{NO}}_{2}^{ - }$ в ходе светорегулируемого развития предшественников женских половых структур, протоперитециев, указывало на малую вероятность участия NO в половом процессе гриба.
Фазы развития аскомицета Neurospora сrassa четко различимы морфологически, а их смена регулируется определенными факторами среды (например, действием воды, света и голода). Поэтому этот гриб является ценнейшей моделью для изучения явлений клеточной дифференцировки, причем процессы, регулируемые светом, занимают среди них особое место. Дифференцировка N. crassa может идти по двум путям – бесполому и половому циклам. Бесполое развитие приводит к образованию вегетативных спор, конидий. Их оранжевый цвет обусловлен наличием каротиноидов, главным образом нейроспораксантина. В условиях голодания по углероду образование конидий стимулируется синим светом [1]. Растущий в темноте белый мицелий гриба со временем также становится оранжевым. Если облучить мицелий синим светом, то процесс идет быстрее, так как происходит фотоиндукция биосинтеза каротиноидов. При половом развитии на мицелии образуются предшественники женских плодовых тел – протоперитеции, в которых после слияния с конидиями или мицелием противоположного типа спаривания образуются аскоспоры. В поверхностной культуре в условиях голодания по азоту кратковременное воздействие синего света стимулирует формирование протоперитециев [2] и ингибирует конидиогенез [3].
Широко распространенная молекула оксида азота (монооксида азота, NO), которая имеет короткое время полужизни, быстро диффундирует и отличается высокой реакционной способностью. Установлено, что NO может участвовать в передаче клеточного сигнала во множестве физиологических ответов у высших растений, в том числе светозависимых.
В литературе имеются данные об участии оксида азота в физиологических и биохимических процессах у грибов [4–9]. Разнообразие сигнальных путей, регулируемых оксидом азота, свидетельствует о сложности их механизмов. Оксид азота может быть вовлечен в механизм взаимодействия различных видов грибов [10]. Кроме того, NO способен влиять на выживание и прорастание спор, а также на рост Aspergillus fumigatus [11], Colletotrichum coccodes [12], A. niger, Monilinia fructicola, Penicillium italicum [13], Botrytis cinerea [14] и P. expansum [15]. Известно также, что оксид действует в качестве сигнальной молекулы при дифференцировке грибов, принадлежащих к различным таксономическим группам, – Phycomyces blakesleeanus [16], Flammulina velutipes [17], Coniothyrium minitans [18, 19] и A. nidulans [20].
На основании опытов с использованием в качестве донора оксида азота нитропруссида натрия, а также специфических ингибиторов NO-синтазы, ответственной за реакцию взаимодействия кислорода и L-аргинина с образованием оксида азота и L-цитруллина, было сделано заключение, что NO ингибирует светостимулируемое образование конидий у N. crassa [21].
Уровень содержания NO в клетке определяется балансом систем его синтеза и распада. Известно, что основная масса молекул оксида азота претерпевает в клетке неферментативные превращения. Окисление NO кислородом воздуха приводит к образованию двух стабильных анионов – нитрита (${\text{NO}}_{2}^{ - }$) и нитрата (${\text{NO}}_{3}^{ - }$), которые могут выбрасываться из клетки в среду. Интенсивность данного выхода может служить косвенной оценкой активности NO-синтезирующего механизма непосредственно в клетке [22].
В отличие от животных и некоторых низших грибов в клетках штаммов дикого типа N. crassa и других высших грибов присутствуют нитритредуктаза (НиР) и нитратредуктаза (НР). Для измерения концентрации нитрата и нитрита внутри клетки и в среде культивирования использовали штамм nit-2, лишенный НиР и НР, и штамм nit-6, дефектный по НиР. Ген nit-2 является глобальным регуляторным геном, кодирующим ядерный белок, он положительно влияет на экспрессию более 100 генов азотного метаболизма и участвует у N. crassa в азотной катаболитной дерепрессии в условиях недостатка таких первичных источников азота, как аммоний, глутамин и глутамат [23]. Ген nit-6 кодирует НиР гриба. Оценку полученных результатов проводили с учетом фотоморфогенетических ответов для nit-штаммов и штамма дикого типа N. crassa, культивированных на средах с различными источниками азота.
Цель работы – изучение роли оксида азота в регуляции стимуляции конидиогенеза и формирования протоперитециев у аскомицета N. crassa светом и динамики изменения содержания конечных продуктов метаболизма NO – нитрата и нитрита.
МЕТОДИКА
Штаммы N. crassa и культивирование. Штамм N. crassa дикого типа wt 987 (74-0R23-1A) и мутанты nit-2 (33 A) и nit-6 (3463 A) были предоставлены Центром по хранению генетического материала грибов (Fungal Genetic Stock Center – FGSC, США). Оба мутанта дефектны по НиР, а штамм nit-2 – по НиР и НР.
В качестве инокулята использовали суспензию конидий с концентрацией спор 30 мг/мл (соответствует 106 конидий), которую получали по разработанному ранее методу [3] и хранили при – 70°C.
Инокулюм гриба равномерно распределяли по поверхности бислоя целлофан-фильтровальная бумага (диаметр чашки Петри 9 см), помещенного на агаризованную среду для роста (0.25 мг спор), или (при исследовании выхода нитрита из мицелия) на слой стеклянных шариков диаметром 7 мм, погруженных в жидкую питательную среду (1 мг спор). Мицелий выращивали на среде Фогеля с 2%-ной сахарозой в качестве источника углерода, модифицированной по источнику азота [24]. В различных опытах по конидогенезу вместо 25 мM NH4NO3 использовали 50 мM NH4Cl или 50 мМ NH4NO3, или 50 мМ NaNO3. При культивировании на агаризованной среде фильтровальный диск пропитывали 3 мл среды роста, чтобы предотвратить формирование конидий на мицелии при выращивании в темноте. Для образования протоперитециев в агаризованную среду Фогеля, покрытую целлофановым диском, включали 4 мM NH4Cl в качестве источника азота, а также 1% сорбозы и 0.1% глюкозы как источник углерода. Смесь 20% сорбозы и 2% глюкозы стерилизовали отдельно и добавляли в стерильную расплавленную среду роста.
Фотоморфогенез. В опытах по фотостимуляции конидиогенеза мицелий N. crassa культивировали на агаризованой среде в темноте (в светонепроницаемых хлопчатобумажных мешках) в течение 24 ч при 28°C (переход от логарифмической к стационарной фазе роста) и затем в течение 2 ч экспонировали под флуоресцентными лампами ЛДЦ-36 (“ВНИИС_Лисма”, Россия) при интенсивности 15 Вт м–2. Темновые контроли выдерживали при комнатной температуре. После 24 ч темновой инкубации всех чашек при 28°C собирали споры для изучения влияния различных реагентов на конидиогенез или же мицелий для определения внутриклеточного содержания нитрита и нитрата.
Для сбора конидий в каждую чашку Петри добавляли по 5 мл стерильной дистиллированной воды и полученную суспензию спор последовательно разводили (1 : 100, 1 : 1000 и 1 : 10 000) и анализировали. Для этого споры высевали на агаризованную среду Фогеля, модифицированную для получения колониального роста N. crassa [25]. Через 2 сут инкубации в тех же условиях подсчитывали число жизнеспособных конидий.
Для проверки действия различных реагентов на фотоморфогенез гриба 1 мл тестируемого соединения вносили в темноте под бислой “целлофан-фильтровальная бумага” и затем перед освещением инкубировали 30 мин при 28°C.
Мицелий собирали шпателем при красном свете, промывали дистиллированной водой, фильтровали через 3 слоя марли, высушивали при помощи фильтровальной бумаги и разрушали при растирании с жидким азотом в течение 15 мин. Для получения гомогената экстракцию проводили при слабом перемешивании в течение 30 мин тремя объемами 50 мM трис-HCl буфера, pH 8.0, содержащего 0.5 мM ЭДTA, 1 мM дитиотреитола, 5 мкг/мл леупептина, 5 мкг/мл апротинина, 5 мкг/мл пепстатина и 1 мМ фенилметилсульфонилфторида. Пробы центрифугировали при 20 000 g в течение 30 мин при 4°С, и полученные супернатанты после депротеинизации исследовали на содержание нитритов и нитратов.
Для индукции образования протоперитециев целлофановый диск с мицелием N. crassa после 3 сут темнового роста на агаризованной среде при 23°C переносили при красном свете на новую чашку Петри со средой того же состава, но без источника азота. После 24 ч темновой инкубации при 23°C чашки с мицелием освещали синим светом (370–500 нм, 1 Вт м–2) в течение 2 мин. Контроли хранили в темноте. После 2 сут темновой инкубации при 23°C подсчитывали под бинокулярным микроскопом число образовавшихся протоперитециев.
Число конидий и протоперитециев нормализовали на 1 см2 поверхности чашки Петри.
Определение нитрита и нитрата. Нитрит определяли в среде культивирования после различных периодов освещения мицелия N. crassa, выращенного в поверхностной культуре на бислое “целлофан-фильтровальная бумага”, положенном на слой стеклянных шариков, погруженных в жидкую питательную среду. Для этого к среде, профильтрованной через стеклянный фильтр № 4 (“Duran”, Германия), добавляли реактив Грисса (1%-ная сульфаниловая кислота в 20%-ной HCl, содержащей 0.1%-ный нафтилэтилендиаминдигидрохлорид) и после 15 мин инкубации измеряли поглощение раствора при 545 нм. Для построения калибровочной кривой использовали нитрит натрия.
Внутриклеточную концентрацию нитрита и нитрата (NOx) определяли в супернатантах гомогенатов N. crassa (30 мин, 20 000 g при 4°С) после действия 2,3-диаминонафталина (ДАН), образующего флуоресцирующий продукт, 1-(H)-нафтотриазол, флуорометрическим методом с небольшими модификациями [26]. Депротеинизированные при 100°C супернатанты мицелия добавляли к смеси, содержащей 0.125 ед/мл НР, 25 мкM НАДФН и 25 мкM ФАД в 20 мM трис-HCl буфере, pH 7.6, и инкубировали 30 мин при 37°C. Для окисления непрореагировавшего НАДФН использовали систему лактатдегидрогеназа–пируват в концентрациях 150 Ед/мл и 10 мМ соответственно. Затем добавляли 316.0 мкM ДАН в 0.62 M HCl, и смесь инкубировали 10 мин при 37°C в темноте. Чтобы стабилизировать флуоресценцию образованного продукта, вносили 280 мкM NaOH. Интенсивность флуоресценции измеряли при помощи флуоресцентного ридера Wallac 1420 (“Perkin Elmer”, США) при λвозбуждения 365 нм и λэмиссии 405 нм. Концентрацию NOx выражали в нмоль/мг белка.
Концентрацию общего белка определяли по методу Бредфорд, используя БСА в качестве стандарта.
Статистика. Число биологических параллелей варьировало от 3 до 15, число биохимических параллелей было не ниже 3.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Особенности фотоморфогенеза в различных штаммах N. crassa.Ранее было установлено, что в зависимости от природы источника азота в среде роста и его концентрации может происходить ингибирование или активирование фоторегулируемых процессов полового и бесполого развития у N. crassa [27, 28], а также регуляция фотозависимых генов al, bli и con [29]. В 2015 г. было показано [24], что конидиогенез в клетках дикого типа гриба, выращенных на среде с хлористым аммонием в качестве единственного источника азота, нечувствителен к действию света, в то время как в культуре, выращенной на среде с нитратом аммония или натрия, освещение стимулировало образование жизнеспособных бесполых спор. При этом фотоответы nit-2 и nit-6 мутантов на среде с NH4Cl были сходны, но сильно отличались от ответов на среде с NH4NO3.
Был проведен сравнительный анализ стимуляции светом образования предшественников женских половых структур, протоперитециев, у штамма дикого типа и nit-6 мутанта. Полученные данные свидетельствовали о том, что после освещения количество образовавшихся протоперитециев у данных штаммов изменялось сходным образом (табл. 1).
Таблица 1.
Образование протоперитециев после освещения мицелия синим светом в nit-6 мутанте, диком типе wt 987 N. crassa и темновых контролях
| Штамм N. crassa | Протоперитеции/см2 | |
|---|---|---|
| темнота | свет | |
| nit-6 | 145 ± 29 | 505 ± 49 |
| wt 987 | 168 ± 25 | 528 ± 72 |
Таким образом, стимуляция светом образования бесполых и половых структур у дикого типа и мутантов по азотному метаболизму N. crassa различалась.
Выход нитрита из мицелия nit-6 мутанта N. crassa при фотостимулируемых каротиногенезе, конидиогенезе и образовании протоперитециев. В предыдущей работе [30] показано, что выброс ${\text{NO}}_{2}^{ - }$клетками суточной культуры мутанта nit-6, в которых отсутствует НиР, но присутствует НР, более чем в 10 раз превышает таковой из клеток nit-2 штамма гриба, лишенного обоих ферментов. Поэтому использование nit-6 штамма N. сrassa, в котором осуществляется каталитическое превращение нитрата в нитрит, и выход ${\text{NO}}_{2}^{ - }$ можно рассматривать как показатель суммарного содержания ${\text{NO}}_{3}^{ - }$ и NO2 вне клетки, что облегчает выполнение исследования. Ранее было изучено [30], как изменяется содержание нитрита в среде культивирования при фотоиндукции каротиногенеза в мицелии nit-6 мутанта N. crassa. После 30 мин инкубации мицелия на свету (лаг-фаза фотоиндукции каротиноидов) концентрация нитрита в среде превышала его концентрацию в темновом контроле в полтора раза и далее снижалась до уровня темнового контроля.
Уровень содержания ионов нитрита в среде культивирования nit-6 штамма N. crassa также изменялся при фотостимулируемом конидиогенезе (рис. 1). Светозависимое образование конидий nit-6 мутантом гриба изучали в поверхностной культуре, выращенной на жидкой среде в присутствии 50 мМ NH4NO3 (в этих условиях наблюдается 8-кратная фотостимуляция конидиогенеза). После 24 ч темнового роста мицелий освещали в течение 30 мин, 1 или 2 ч, затем снова переносили чашки Петри в темноту на 1 сут (за это время происходит формирование конидий). Отбор проб культуральной среды для измерения содержания нитрит-ионов проводили в течение 2 ч фотоэкспозиции и каждый ч после ее окончания (в 6 ч диапазоне), а также через 1 сут. Выявлено достоверное возрастание по сравнению с темновыми контролями выхода этих ионов из мицелия nit-6 штамма N. crassa, подвергнутого освещению, которое оказалось наиболее интенсивным через 4 ч после окончания действия света.
Рис. 1.
Влияние освещения на выход нитрита в культуральную среду мутанта N. crassa nit-6 при фотостимуляции конидиогенеза.
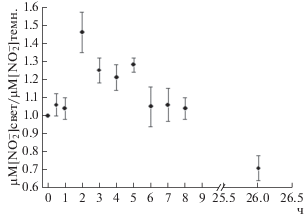
В противоположность фотокаротиногенезу и фотоконидиогенезу на разных стадиях фотоморфегенеза полового цикла (3 сут мицелий, голод по азоту, облучение синим светом и стадия сформировавшихся протоперитециев в освещенной и темновой культурах штамма гриба nit-6) не был обнаружен выход ионов нитрита в среду культивирования.
Анализ динамики выхода нитрита в ходе фотоиндуцированного каротиногенеза [30] и фотостимулируемого образования вегетативных спор (данная работа) штамма N. crassa nit-6 свидетельствовал о возможном участии NO в передаче фотосигнала. Вместе с тем отсутствие выброса ${\text{NO}}_{2}^{ - }$в ходе светорегулируемого формирования предшественников половых структур N. сrassa указывало на то, что эндогенный оксид азота не участвовал в этом процессе. Таким образом, в зависимости от природы трех светорегулируемых процессов (индукция каротиногенеза, стимуляция бесполого или полового циклов) роль NO-генерирующего механизма в трансдукции фотосигнала гриба может отличаться.
Внутриклеточное содержание нитрита и нитрата при светозависимом конидиогенезе N. crassa в разных условиях формирования конидий. Оценить, что происходит с метаболитами оксида азота внутри клетки при фотостимуляции конидиогенеза можно по данным рис. 2. На нем представлено содержание нитрита и нитрата в расчете на мг белка в супернатантах гомогенатов 3 штаммов N. crassa, определенное с использованием флуоресцентного индикатора ДАН. Для сравнения выбраны различные варианты образования конидий после действия света в гидратированной культуре (штамм + источник азота в среде роста) без заметного влияния света (wt-987 или nit-2 + + 50 мМ NH4Cl) и фотостимуляция (остальные) [24]. Для всех вариантов после фотоэкспозиции наблюдалось резкое снижение содержания [${\text{NO}}_{3}^{ - }$ + ${\text{NO}}_{2}^{ - }$]. Исключение составил вариант (wt‑987 + 50 мМ NaNO3), для которого этот параметр не изменялся. После освещения мицелия внутриклеточное содержание нитрит-ионов снижалось во всех случаях, кроме варианта (nit-2 + + 50 мМ NH4Cl), в котором оно чрезвычайно мало и практически не изменялось. В фотоэкспонированных клетках nit-мутантов гриба содержание нитрат-ионов падало по сравнению с темновыми контролями в отличие от штамма дикого типа, в котором оно возрастало. Несмотря на наличие светозависимого изменения содержания ионов нитрита и нитрата в изучаемых штаммах N. crassa, прямой корреляции изменения этого параметра с явлением фотостимуляции конидиогенеза не удалось обнаружить.
Рис. 2.
Внутриклеточное содержание нитрита и нитрата, определенное флуоресцентным методом, в темновом и освещенном мицелии при конидиогенезе у штаммов N. crassa (штамм + среда культивирования) на среде с 50 мМ NH4Cl (а), 50 мМ NH4NO3 (мутант nit-6, б) и 50 мМ NaNO3 (штамм wt-987, в) 1 – NOx/мг белка; 2 – NO2/мг белка; 3 – NO3/мг белка.
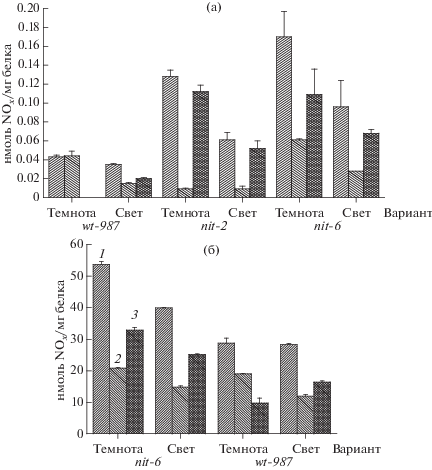
В работе [31] для идентификации и функциональной оценки эндогенного NO у N. crassa также был использован флуоресцентный метод с другим флуоресцентным индикатором – 4-амино-5-метиламино-2',7'-дифлуоресцеин диацетатом. Было обнаружено увеличение содержания внутриклеточного оксида азота в гифах мицелия при росте в погруженной культуре, а также в конидиофорах при конидиогенезе в поверхностной культуре. Было также показано, что обработка мицелия NO-скавенджером, 2-(4-карбоксифенил)-4,5-дигидро-4,4,5,5-тетраметил-1-H-имидазолил-1-окси-3-оксидом, приводила к резкому уменьшению уровня транскрипции генов con-10 и con-13, экспрессия которых возрастает при конидиогенезе. Было предположено, что оксид азота образуется внутри молодых растущих гиф и участвует в формировании конидий. Вместе с тем, в данных экспериментах по конидиогенезу влияние света (сравнение освещенных и темновых культур) не было изучено, а также не учитывалось влияние изменения природы азотного компонента среды роста на фотоконидиогенез.
Увеличение содержания производных продуктов NO наблюдали при споруляции водного гриба Blastocladiella emersonii, применяя флуоресцентное определение с 4,5-диаминофлуоресцеин диацетатом [32]. Еще один флуоресцентный краситель, диаминорходамин-4М, использовали для доказательства образования NO при прорастании и раннем развитии мицелия Magnaporthe oryzae [33].
Действие L-нитроаргинина, S-нитрозоглутатиона (GSNO) и нитрита натрия на фотостимуляцию конидиогенеза. Результаты, приведенные в табл. 2 показали, как инкубация с различными реагентами, влияющими на азотный метаболизм, сказывалась на фотоконидиогенезе N. crassa при культивировании мицелия разных штаммов на среде с 50 мМ хлоридом аммония.
Таблица 2.
Действие различных реагентов на число жизнеспособных конидий поверхностной культуры штаммов N. crassa nit-2, nit-6 и wt-987 при фотостимуляции конидиогенеза при культивировании на среде с 50 мМ NH4Cl в качестве источника азота
| Штамм | Конидии, (×105)/1 см2 поверхностной культуры | |||
|---|---|---|---|---|
| реагент | темнота | свет | свет/темнота, % | |
| wt-987 | Вода | 2.4 ± 0.5 | 2.2 ± 0.4 | 92 |
| 10 мМ NaNO2 | 2.7 ± 1.1 | 5.1 ± 0.6 | 189 | |
| 5 мМ L-НA | 4.0 ± 1.5 | 9.6 ± 2.6 | 240 | |
| 2 мМ GSNO | 3.6 ± 0.3 | 2.9 ± 0.6 | 81 | |
| nit-2 | Вода | 7.8 ± 1.2 | 8.4 ± 0.2 | 108 |
| 10 мМ NaNO2 | 2.2 ± 0.9 | 3.5 ± 0.9 | 159 | |
| 5 мМ L-НA | 3.5 ± 0.6 | 9.9 ± 1.4 | 283 | |
| nit-6 | Вода | 3.1 ± 1.6 | 5.5 ± 2.7 | 177 |
| 10 мМ NaNO2 | 2.7 ± 0.6 | 2.7 ± 0.6 | 100 | |
| 5 мМ L-НA | 3.3 ± 1.1 | 7.9 ± 3.8 | 239 | |
Эффект от добавления доноров оксида азота и ингибиторов NO-синтазы млекопитающих является индикатором образования оксида азота в клетках грибов [12, 16–20, 32]. Количественный анализ образования жизнеспособных конидий при действии ингибитора NO-синтазы, L-нитроаргинина (L-НА), выявил светозависимую стимуляцию процесса у всех изученных штаммов N. crassa. Это согласовывалось с данными работы [21] по действию специфических ингибиторов NO-синтазы на светозависимый конидиогенез al-2 bd штамма гриба, вычисленными по плотности полос конидиирования на единицу их площади.
Как правило в литературе для выяснения сигнальной функции эндогенного NO при дифференцировке грибов используют донор экзогенного оксида азота – нитропруссид натрия. При его добавлении наблюдали увеличение под действием света образования спорообразующих структур у грибов Phycomyces blakesleeanus [16] и плодовых тел у Flamulina velutipes [17], а также возобновление формирования конидий у L-аргининового ауксотрофа Coniothyrium minitans [18, 19]. Вместе с тем введение данного донора NO приводило к ингибированию образования вегетативных спор у A. nidulans [20] и фотоконидиогенеза у N. crassa [21]. Несмотря на то, что в данной работе использовали донор NO другой природы, GSNO, он также оказывал ингибирующее действие на фотостимуляцию образования конидий у N. crassa.
Следует отметить, что добавление нитрита натрия, который можно рассматривать как метаболит оксида азота, вызывало после освещения более чем двукратное увеличение по сравнению с водными контролями числа образовавшихся конидий у дикого штамма и значительное их уменьшение у nit-мутантов N. crassa как в темноте, так и после фотоэкспозиции (табл. 2). При этом у штамма дикого типа и nit-2 мутанта был отмечен эффект фотостимуляции конидиогенеза, что противоречило предположению об отрицательной регуляторной роли NO в фотоконидиогенезе, выдвинутому в работе [21].
Таким образом, результаты по введению в среду культивирования донора оксида азота GSNO, ингибитора NO-синтазы, L-НA, и нитрита натрия можно было отнести к косвенным свидетельствам участия NO в фотоконидиогенезе N. crassa.
Вопрос о природе генерации NO у грибов остается открытым. Одним из возможных ферментов, ответственных за этот процесс, является НР. Так, в работе [34] сообщалось, что при развитии Aspergillus nidulans синтез NO регулируется НР, причем ген нитратредуктазы niaD активируется при индукции конидиогенеза даже в условиях репрессии азотом в присутствии аммония. Ранее возможность участия НР и НиР в регуляции фотоконидиогенеза была показана для дикого штамма N. crassa [24], однако установлено, что это не являлось необходимым элементом процесса, так как и в отсутствие этих ферментов (nit-2 и nit-6 мутанты) наблюдалась светозависимая стимуляция образования спор.
Другими возможными кандидатами, ответственными за образование оксида азота у грибов, могут быть NO-синтаза, катализирующая синтез NO из аргинина и кислорода, ксантиноксидаза или неэнзиматический синтез [35].
Список литературы
Ricci M., Krappmann D., Russo V.E.A. // Fungal Genet. Newslett. 1991. V. 38. P. 87–88.
Degli Innocenti F., Pohl U., Russo V.E.A. // Photochem. Photobiol. 1983. V. 37. № 1. P. 49–51.
Kritsky M.S., Russo V.E.A., Filippovich S.Yu., Afanasieva T.P., Bachurina G.P. // Photochem. Photobiol. 2002. V. 75. № 1. P. 79–83.
Canovas D., Marcos J.F., Marcos A.T., Strauss J. // Curr. Genet. 2016. V. 62. № 3. P. 513–518.
Biotechnology of Fungal Genes. V.K. Gupta, M. Ayyachamy, Eds., Boca Raton, USA: CRC Press Inc. 2012. P. 400.
Domitrovic T., Palhano F.L., Barja-Fidalgo C., DeFreitas M., Orlando M.T., Fernandes P.M. // FEMS Yeast Res. 2003. V. 3. № 4. P. 341–346.
Wilken M., Huchzermeyer B. // Eur. J. Cell Biol. 1999. V. 78. № 3. P. 209–213.
Prats E., Carver T.L., Mur L.A. // Res. Microbiol. 2008. V. 159. № 6. P. 476–480.
Kong W., Huang C., Chen Q., Zou Y., Zhang J. // Fungal Genet. Biol. 2012. V. 49. № 1. P. 15–20.
Zheng W., Miao K., Zhang Y., Pan S., Zhang M., Jiang H. // 2009. Microbiology. V. 155. № 10. P. 3440–3448.
Kunert J. // Folia Microbiol. 1995. V. 40. № 3. P. 238–44.
Wang J., Higgins V.J. // Fungal Genet. Biol. 2005. V. 42. № 4. P. 284–292.
Lazar E.E., Wills R.B., Ho B.T., Harris A.M., Spohr L.J. // Lett. Appl. Microbiol. 2008. V. 46. № 6. P. 688–692.
Turrion-Gomez J.L., Eslava A.P., Benito E.P. // Fungal Genet. Biol. 2010. V. 47. № 5. P. 484–496.
Lai T., Li B., Qin G., Tian S. // Curr. Microbiol. 2011. V. 62. № 1. P. 229-234.
Maier J., Hecker R., Rockel P., Ninnemann H. // Plant Physiol. 2001. V. 126. № 3. P. 1323–1330.
Song N.K., Jeong C.S., Choi I.S. // Mycologia. 2000. V. 92. № 6. P. 1027–1032.
Gong X., Fu Y., Jiang D., Li G., Yi X., Peng Y. // Fungal Genet. Biol. 2007. V. 44. № 12. P. 1368–1379.
Li B., Fu Y., Jiang D., Xie J., Cheng J., Li G. et al. // Appl. Environ. Microbiol. 2010. V. 76. № 9. P. 2830–2836.
Chiuchetta S.J.R., Castro-Prado M.A.A. // Gen. Mol. Biol. 2005. V. 28. № 4. P. 798–803.
Ninnemann H., Maier J. // Photochem. Photobiol. 1996. V.64. № 2. P. 393–398.
Miranda K.M., Espay M.G., Wink D.A. // Nitric Oxide: Biol. Chem. 2001. V. 5. № 1. P. 62–71.
Marzluf G.A. // Microbiol. Mol. Biol. Rev. 1997. V. 61. № 1. P. 17–32.
Филиппович С.Ю., Бачурина Г.П., Щербаков Д.Л. // Прикл. биохим. и микробиол. 2015. Т. 51. № 3. С. 326–334.
Филиппович С.Ю., Бачурина Г.П., Гесслер Н.Н., Голованов А.Б., Макарова А.М., Гроза Н.В., Белозерская Т.А. // Прикл. биохим. и микробиол. 2015. Т. 51. № 6. С. 578–583.
Misko T.P., Schilling R.J., Salvemini D., Moore W.M., Currie M.G. // Anal. Biochem. 1993. V. 214. № 1. P. 11–16.
Sommer T., Degli-Innocenti F., Russo V.E.A. // Planta. 1987. V. 170. № 2. P. 205–208.
Ninnemann H. // J. Photochem. Photobiol. B. 1991. V. 9. № 2. P. 189–199.
Sokolovsky V.Y., Lauter F.-R., Müller-Röber B., Ricci M., Schmidhauser T.J., Russo V.E.A. // J. Gen. Microbiol. 1992. V. 138. № 10. P. 2045–2049.
Филиппович С.Ю., Бачурина Г.П., Крицкий М.С. // Прикл. биохим. и микробиология. 2007. Т. 43. № 3. С. 331-337.
Pengkit A., Jeon S.S., Son S.J., Shin J.H., Baik K.Y., Choi E.H., Park G. // Sci. Reports. 2016. V. 6. Article № 30 037. https://doi.org/10.1038/srep30037
Vieira A.L.G., Linares E., Augusto O., Gomes S.L. // Fungal Genet. Biol. 2009. V. 46. № 8. P. 575–584.
Samalova M., Johnson J., Illes M., Kelly S., Fricker M., Gurr S. // New Phytologist. 2013. V. 197. № 1. P. 207–222.
Marcos A.T., Ramos M.S., Marcos J.F., Carmona L., Strauss J., Cánovas D. // Mol. Microbiol. 2016. V. 99. № 1. P. 15–33.
Zweier J.L., Samouilov A., Kuppusamy P. // Biochim. Biophys. Acta. 1999. V. 1411. № 2–3. P. 250–262.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


