Прикладная биохимия и микробиология, 2020, T. 56, № 1, стр. 3-18
Роль фосфат-аккумулирующих бактерий в биологической очистке сточных вод от фосфора (обзор)
А. Г. Дорофеев 1, 2, *, Ю. А. Николаев 1, А. В. Марданов 3, Н. В. Пименов 1
1 Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 АО “Мосводоканал”
105005 Москва, Россия
3 Институт биоинженерии, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: DorofeevAG@mail.ru
Поступила в редакцию 22.06.2019
После доработки 24.07.2019
Принята к публикации 30.08.2019
Аннотация
Обзор посвящен микробиологическим аспектам биологического удаления фосфора из сточных вод. Кратко изложена история становления биотехнологии и открытия физиологической группы фосфат-аккумулирующих бактерий (ФАО), осуществляющих биологическое удаление фосфора путем поглощения фосфатов и запасания их в виде внутриклеточных полифосфатов. Для ФАО характерен циклический тип метаболизма, реализующийся при циклической смене анаэробных/аэробных условий. В анаэробных условиях ФАО поглощают и запасают органические соединения за счет энергии деградации внутриклеточных полифосфатов. При смене анаэробных условий на аэробные или появлении альтернативного акцептора электронов, ФАО поглощают фосфаты и синтезируют внутриклеточные полифосфаты, используя для этих процессов накопленные в анаэробных условиях внутриклеточные полимерные источники углерода и энергии. Описаны основные представители ФАО, их метаболические модели и физиологические особенности. Рассмотрены основные принципы реализации биотехнологии, использующиеся в практике очистки сточных вод от фосфора и других биогенных элементов.
Фосфор – биогенный элемент, играющий ключевую роль во многих природных и искусственных экосистемах. Интенсификация его добычи и использования для обеспечения растущего населения сельскохозяйственной продукцией привела к возникновению двух масштабных проблем:
– массовой эвтрофикации водоемов, вызванной увеличением в них концентрации фосфора из-за увеличения его сброса со сточными водами [1];
– опасности возникновения в ближайшие десятилетия глобального дефицита фосфора в связи с ограниченностью и невозобновляемостью его минеральных запасов [2].
Возможные пути решения этих проблем – разработка и внедрение реализуемых на практике и экономически обоснованных технологий реутилизации фосфора, обеспечивающих: (1) его извлечение из сточных вод до экологически безопасного уровня и (2) перевод извлеченного фосфора в товарный продукт для повторного использования [1, 3].
Существует множество путей очистки сточных вод от фосфора, наиболее распространенные из них – физико-химический, биологический и комбинированный [4, 5]. Считается, что наиболее эффективный и экономически привлекательный путь извлечения фосфора с последующей реутилизацией (по крайней мере, на крупных сооружениях очистки муниципальных сточных вод) – внедрение технологий, основанных на биологическом удалении фосфора и комбинаций биологического удаления с химическим осаждением [3, 6, 7]. В настоящей работе используется устоявшийся в отечественной литературе термин “биологическое удаление фосфора”, соответствующий англоязычному термину “Enhanced biological phosphorus removal”, в котором подчеркивается тот факт, что удаление фосфора улучшено (Enhanced) в результате протекания особых биологических процессов.
История изучения процесса биологического удаления фосфора и выделение группы фосфат-аккумулирующих микроорганизмов. Впервые биологическое удаление фосфора активным илом было отмечено группой исследователей из Индии в 1959 г. [8], обнаружившей, что при определенных условиях активный ил очистных сооружений способен накапливать фосфор в количестве, существенно превышающем потребности в фосфоре обычной микробной биомассы. Было также продемонстрировано, что это явление имеет биологическую природу (подавляется тепловой обработкой, ингибируется токсичными веществами, требует аэрации).
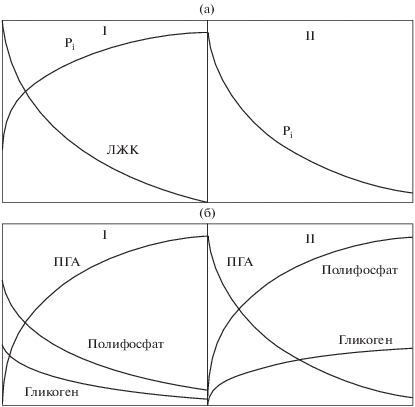
В дальнейшем систематические исследования активного ила на сооружениях биологической очистки и в лабораторных условиях позволили установить основные условия биологического удаления фосфора, разработать и внедрить первые технологии биологической очистки сточных вод от фосфора, часть из которых не потеряла актуальность до сих пор [9–13]. Несмотря на отсутствие на этом этапе детальной биохимической картины процесса, был определен основной принцип биологического удаления фосфора: создание для активного ила чередования анаэробиоза с наличием легкодоступного органического вещества (главным образом, летучих жирных кислот) и аэробных или аноксидных условий без легкодоступного органического вещества. В соответствии с общепринятой в области очистки сточных вод терминологией, под аноксидными условиями мы понимаем отсутствие в среде кислорода, но присутствие конечных акцепторов электронов в форме нитратов и (или) нитритов. Такая смена обеспечивала потребление органического вещества и выброс фосфатов из активного ила в анаэробной фазе, а затем, при поступлении кислорода или других акцепторов электронов потребление фосфатов. При этом в аэробный период поглощается фосфатов больше, чем выбрасывается в анаэробный, что приводит к снижению их концентрации в сточной воде в конце аэробного периода (рис. 1) [14]. В аэробной фазе происходит обогащение активного ила фосфором: если в обычном активном иле количество фосфора составляет около 0.015 мг Р/мг взвешенных веществ (ВВ), то в обогащенном – до 0.05–0.1 мг Р/мг ВВ [15]. В большинстве технологий удаление фосфора заключается в его выведении из системы в конце аэробного периода вместе с активным илом (т. н. “избыточным активным илом”), обогащенным фосфором.
Рис. 1.
Цикл биологического удаления фосфора. Концентрация в сточной воде внеклеточных ортофосфатов (Pi) и летучих жирных кислот (ЛЖК) (а) и внутриклеточного содержания ПГА, полифосфатов и гликогена (б) в анаэробный период с наличием легкодоступного органического вещества (I) и аэробный период (или при наличии в среде нитратов или нитритов) без легкодоступного органического вещества (II).
Уже ранние исследования активных илов, осуществляющих удаление фосфора, привели к заключению о микробиологическом характере этого процесса и к выделению особой физиологической группы организмов, его осуществляющих – “фосфат-аккумулирующих организмов” (ФАО) [16, 17].
Основные признаки ФАО. В клетках многих прокариот и эукариотных организмов обнаруживаются полифосфаты, существующие как в свободном состоянии, так и в связанном, в виде комплексов с катионами, белками и нуклеиновыми кислотами. Первоначально предполагалось, что функции этих полимеров ограничивается созданием биохимического резерва фосфатов и внутриклеточного запаса энергии, однако впоследствии было установлено, что полифосфаты играют важную роль и в других процессах – регуляции активности ферментов, контроле экспрессии генов, отвечающих за устойчивость к стрессовым условиям и голоданию, участвуют в мембранном транспорте, образовании клеточных оболочек [18, 19].
Среди полифосфат-содержащих микроорганизмов была выделена группа ФАО, представители которой осуществляют удаление фосфора из сточных вод за счет способности к внутриклеточному накоплению фосфора в количествах, существенно выше необходимого для обеспечения жизнедеятельности обычных гетеротрофных бактерий (до 0.38 мг Р/мг сухого беззольного вещества [20–22]). Особенности этой группы микроорганизмов проявляются при циклической смене условий среды, задающейся в биореакторах для осуществления биологического удаления фосфора. К ФАО изначально были отнесены аэробные микроорганизмы, характеризующиеся следующими свойствами [23–25] (рис. 1).
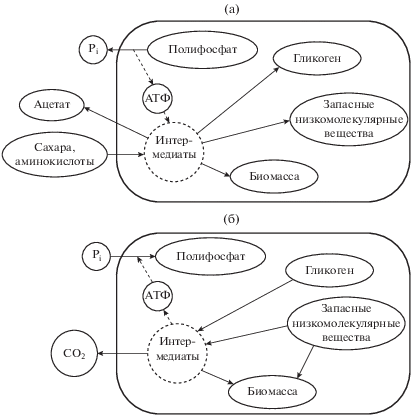
1. Способностью в анаэробных условиях, поглощать легкоусвояемые органические соединения и запасать их в форме внутриклеточных полимеров (главным образом, полигидроксиалканоатов, ПГА), одновременно с деградацией внутриклеточных полифосфатов и выбросом фосфатов в среду. Основные органические субстраты для ФАО – летучие жирные кислоты (ацетат и пропионат), трансформируемые в ПГА.
2. Способностью в аэробных условиях и (или) наличии альтернативного акцептора электронов (нитратов или нитритов) поглощать ортофосфаты и синтезировать внутриклеточные полифосфаты, используя для этих процессов накопленные в анаэробных условиях внутриклеточные полимерные источники углерода и энергии. В этих условиях происходит рост биомассы клеток.
Отметим, что открытие группы ФАО высветило необычную особенность микробной физиологии: оказалось, что в анаэробных условиях могут активно функционировать строго аэробные микроорганизмы [23]. Цикличность явлений, протекающих в метаболических процессах, связанных с удалением фосфора послужило основой для выделения нового способа микробного существования – циклического типа метаболизма [26].
Основная биохимическая модель и соответствующие ей представители ФАО. Осуществляющие ФАО биохимические процессы до конца не детализированы, что связано с отсутствием чистых культур основных представителей ФАО и разнообразием путей метаболизма бактерий этой группы. На основании ранних исследований активного ила промышленных сооружений, а также лабораторных работ с обогащенными ФАО культурами были разработаны две основные биохимические модели метаболизма ФАО: модель Мино [27, 28] и модель Комо и Вентцеля [29, 30]. В настоящее время модель Мино считается доминирующей, хотя результаты ряда исследований показывают возможность существования обоих механизмов, величина вклада которых в суммарный процесс может зависеть от внешних условий и физиологического состояния клеток ФАО [31, 32]. Согласно модели Мино (рис. 2), ФАО относятся к аэробным гетеротрофным организмам, способным в анаэробных условиях поглощать летучие жирные кислоты (ацетат и пропионат) и запасать их в виде поли-β-гидроксиалканоатов. Основной источник энергии в анаэробных условиях – гидролиз внутриклеточных полифосфатов. Образующиеся ортофосфаты выбрасываются из клеток параллельно с выходом контр-ионов (Mg2+ и К+) в соотношении P : Mg2+ : K+ = 1 : 0.33 : 0.33. НАДН, необходимый для синтеза ПГА в анаэробных условиях, образуется при распаде гликогена, регенерирующегося в аэробных условиях. Источниками энергии в анаэробной стадии служит как гидролиз полифосфатов, так и катаболизм гликогена.
Рис. 2.
Основная модель метаболизма ФАО в анаэробный (а) и аэробный (предполагающий наличие акцептора электронов) период (б).
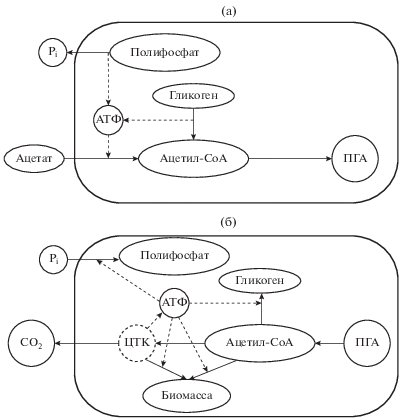
В аэробной фазе происходит катаболизм внутриклеточных ПГА, синтез на продуктах их распада “обычной” биомассы ФАО и регенерация гликогена. В аэробной фазе происходит поглощение ортофосфатов, сопряженное с переносом ионов Mg2+ и К+, и создание внутриклеточного пула полифосфатов.
Общепризнанным представителем ФАО считается “Candidatus Accumulibacter phosphatis”, входящий в cемейство Rhodocyclacea класса Betaproteobacteria [33]. “Ca. Accumulibacter phosphatis” относят к некультивируемым микроорганизмам, и в чистой культуре его до сих пор выделить не удалось.
Результаты исследований микробных сообществ активного ила и обогащенных ФАО лабораторных культур указывают на то, что во многих случаях именно “Ca. Accumulibacter phosphatis” играет доминирующую роль в процессе биологического удаления фосфора на промышленных очистных сооружениях, и метаболизм этих бактерий полностью соответствует основной биохимической модели ФАО [34–40]. Известное местообитание “Ca. Accumulibacter phosphatis” – активные илы сооружений биологической очистки сточных вод, хотя имеются данные о присутствии этих прокариот не только в активном иле, но и в осадках пресноводных водоемов и эстуарий [41].
Установлено, что существует две основные филогенетические группы “Ca. Accumulibacter phosphatis” (тип I и тип II), каждая из которых в свою очередь подразделяется на клады: тип I – на клады от IА до IЕ и тип II на клады от IIA до II I) [25, 26, 41–44]. Причем показана связь состава ФАО (кладов) с типом очистных сооружений, условиями питания (ацетат или пропионат), но не с географическим положением [45].
В связи с отсутствием изолятов, исследования “Ca. Accumulibacter phosphatis” в значительной степени связаны с молекулярно-биологическим анализом высокообогащенных ФАО смешанных культур [46–48]. Результаты таких исследований зачастую противоречивы, что может быть объяснено неоднородностью метаболизма этих микроорганизмов, варьированием свойств бактерий с изменением внешних условий, недостаточной степенью обогащения в накопительных культурах. Например, Мартин с совт. [46], анализируя метагеном обогащенной “Ca. Accumulibacter phosphatis” биомассы, обнаружили полный набор генов фиксации азота и фиксации CO2. Однако позднее эти гены были выявлены только у штамма, принадлежащего к типу II, но не типу I [49]. Исследования экспрессии генов цикла трикарбоновых кислот выявили значительные расхождения в анаэробном и аэробном метаболизме различных популяций Accumulibacter [50]. Было показано, что представители “Ca. Accumulibacter phosphatis” имеют как общие пути центрального метаболизма углерода и фосфора, так и специфические, связанные со спектром используемых органических субстратов и акцепторов электронов [51]. На основании протеомного анализа было установлено, что анаэробная деградация гликогена у всех изученных Accumulibacter осуществляется по пути Эмбдена–Мейергофа–Парнаса [52]. Результаты исследований изменения метатранскриптома в ходе анаэробно/аэробного цикла показали первостепенное значение для Accumulibacter регуляции на уровне транскрипции и возможность использовать более широкий спектр источников углерода, чем предполагалось ранее [53].
Следует отметить, что даже при высокой численности “Ca. Accumulibacter phosphatis”, участие этих микроорганизмов в удалении фосфора не всегда находит подтверждение. Например, иногда большинство клеток “Ca. Accumulibacter phosphatis” в удаляющем фосфор активном иле не содержат полифосфатов [54, 55], что косвенно указывает на наличие других микроорганизмов, принадлежащих к группе ФАО и осуществляющих удаление фосфора. Исследования представителей ФАО типа IIA показали, что со снижением внутриклеточного содержания полифосфатов эта группа прокариот способна переключаться на метаболизм, не связанный с аккумулированием полифосфатов [22], т.е. выпасть из рамок определения ФАО.
С высокой вероятностью к “классическим” ФАО относятся некультивируемые бактерии “Candidatus Halomonas phosphatis” (в настоящее время “Candidatus Accumulimonas spp.”), обнаруживаемые в активных илах сооружений, работающих по технологиям биологической очистки воды от фосфора [56]. “Ca. Halomonas phosphatis” относится к гаммапротеобактериям, способен к запасанию органического вещества в виде ПГА в отсутствие акцепторов электронов, а в аэробных условиях – поглощать ортофосфат с синтезом полифосфатов.
Представители ФАО с типом метаболизма, отличным от основной метаболической модели. Модель Мино считается “классической” и удовлетворительно описывает процессы биологического удаления фосфора на многих полномасштабных сооружениях и в лабораторных условиях при работе с культурами, обогащенными “Ca. Accumulibacter phosphatis” – доказанным представителем группы ФАО, осуществляющим процесс очистки сточной воды от фосфора. Однако в результате исследования микрофлоры активных илов современными методами [57] выявляются новые микроорганизмы, метаболически не соответствующие модели Мино, но способные к накоплению полифосфатов и претендующие на участие в очистке сточной воды от фосфора [58, 59]. Поэтому в последние годы наблюдается тенденция к расширению рамок, ограничивающих принадлежность микроорганизмов к ФАО. В частности, увеличился спектр субстратов, используемых микроорганизмами, способными к циклическому потреблению/выбросу фосфатов; у многих кандидатов в группу ФАО обнаружена способность к сбраживанию и т.д. [40, 58, 59].
Ряд исследователей относят к ФАО грамположительные аэробные актинобактерии Tetrasphaera, повсеместно обнаруживаемые в удаляющих фосфор активных илах, но не полностью соответствующие основной модели ФАО [60–63]. Как и “Ca. Accumulibacter phosphatis”, эти бактерии в аэробных условиях способны потреблять ортофосфаты и накапливать их в виде внутриклеточного полифосфата при условии, что в предыдущей анаэробной фазе в среде содержался легко усваиваемый органический субстрат. Однако, в отличие от “классической” биохимической модели ФАО, бактерии Tetrasphaera в анаэробных условиях ассимилируют целый спектр органических соединений, включая глюкозу и аминокислоты без образования ПГА [64–66]. Группой Кристиансен с соавт. было проведено исследование генома нескольких изолятов Tetrasphaera,и создана метаболическая модель этой группы, существенно отличающаяся от “классической” модели ФАО [66]. Согласно этой модели, в анаэробных условиях часть потребляемой глюкозы ферментируется с образованием сукцината и других метаболитов. В качестве запасного вещества Tetrasphaera синтезируют гликоген, используя энергию гидролиза полифосфатов и ферментации субстрата. В течение аэробного периода запасенный гликоген катаболизируется, обеспечивая энергией процессы роста и восстановления запасов полифосфата, необходимые для следующего анаэробного цикла развития. Относящиеся к ФАО Tetrasphaera способны к денитрификации. Показано, что бактерии группы Tetrasphaera в анаэробных условиях способны к поглощению и внутриклеточному накоплению глицина и продуктов его ферментации, которые в аэробных условиях служит источником энергии для биосинтеза, поглощения ортофосфатов и синтеза полифосфатов [67]. В настоящее время из активного ила выделено несколько видов рода Tetrasphaera: T. australiensis, T. japonica [61], T. elongata [68, 69], T. jenkinsii, T. vanveenii и T veronensis [70].
Кандидатом в группу ФАО считаются актинобактерии Microlunatus phosphovorus – грамположительные кокковидные неподвижные и не образующих спор прокариоты, характеризующиеся строго аэробным хемоорганотрофным типом обмена. Новый вид использует в анаэробных условиях не ацетат, а сахара, отличаясь от основной модели метаболизма ФАО [71, 72]. В аэробный период цикла Microlunatus phosphovorus аккумулирует полифосфаты до 166 мг фосфора/г сухих клеток без внешнего органического источника углерода и энергии [73].
Обобщенная схема метаболических путей Tetrasphaera и других ФАО, не соответствующих основной биохимической модели, приведена на рис. 3.
Новый кандидат в группу ФАО – сульфидокисляющие бактерии Thiothrix caldifontis, обладающие миксотрофным типом метаболизма, использующие внутриклеточный пул серы в качестве источника энергии [75, 76]. В циклических аэробно/анаэробных условиях T. caldifontis способен в анаэробной фазе запасать углерод в форме ПГА и генерировать требуемую для этого энергию за счет гидролиза полифосфата. В аэробный период происходит утилизация ПГА для роста, поглощения фосфатов с образованием полифосфатов, а также образование гликогена. Культура, обогащенная T. caldifontis, способна аккумулировать 100 мг фосфора/г сухого беззольного вещества. Дополнительным источником энергии в этой фазе может быть окисление внутриклеточной серы до сульфата.
С использованием молекулярно-биологических и эко-физиологических методов показана возможность участия в биологическом удалении фосфора и других микроорганизмов, принадлежащим к родам Dechloromonas [77, 78], Gemmatimonas [79], Malikia [80], Thauera [81], а также некультивируемых цианобактерий “Candidatus Obscuribacter phosphatis” [82]. Однако принадлежность перечисленных бактерий к группе ФАО требует более весомой доказательной базы.
Стехиометрия биологического удаления фосфора. Для выяснения путей метаболизма ФАО и оптимизации технологий биологического удаления фосфора большое значение имеет знание стехиометрии и кинетики основных биохимических процессов. Центральный обобщенный стехиометрический показатель метаболизма ФАО – отношение количества выделенного клетками фосфора фосфатов к количеству поглощенного ими в анаэробной стадии органического вещества (Р/С), тогда как наиболее технологически-значимым для очистки воды от фосфора представляется отношение удаляемого фосфора к количеству потребляемого органического субстрата.
В большинстве случаев расчет стехиометрических показателей проводится по технологическим показателям работы промышленных сооружений, осуществляющих биологическое удаление фосфора. Детальные исследования стехиометрических характеристик метаболизма ФАО, их связи с внешними условиями и внутриклеточным составом клеток были проведены главным образом с использованием лабораторных культур, обогащенных “Ca. Accumulibacter phosphatis” [22, 83].
Выполненный в соответствии с основной моделью ФАО расчет показывает, что в анаэробной фазе при потреблении ацетата отношение P/C зависит от кислотности среды, увеличиваясь от 0.2 до 0.75 моль P/моль C при возрастании рН от 5.5 до 8.5. При нейтральной реакции среды Р/С составляет около 0.5 [84]. Многочисленные экспериментальные данные, полученные с использованием обогащенных “Ca. Accumulibacter phosphatis” лабораторных культур и удаляющих фосфор активных илов полномасштабных очистных сооружений, как правило, подтверждают расчет: величины Р/С в большинстве случаев находятся в пределах 0.25–0.75 моль P/моль C [21, 83, 84]. Вместе с тем, соотношение Р/С во многом определяется физиологическим состоянием культуры, в частности, количеством запасенных в аэробный период полифосфатов [22]. Для Teterasphaera при использовании глицина Р/С составило 0.48 моль P/моль C [67], а для Microlunutus phosphovorus при росте на смешанном органическом субстрате – 0.39 моль P/моль C [85].
Отношение (суммарный удаленный из раствора фосфор)/(поглощенное органическое вещество) – показатель чрезвычайно вариабельный. В соответствии с основной моделью ФАО, для включения 1 мг фосфора в полифосфат необходимо потребление около 24 мг ацетата [86]. Экспериментальные данные показывают, что этот показатель изменяется в широких пределах от 8 до 25 мг в зависимости от условий проведения эксперимента или используемой технологии биологического удаления фосфора [20, 21]. В технологической практике принимают, что при удалении 1 мг фосфора расходуется 7–10 мг легкодоступного органического вещества (ацетата) [87], а для надежного удаления фосфора органического вещества требуется около 20 мг [14].
Влияние внешних факторов на ФАО. Существование ФАО в консорциуме микроорганизмов активного ила и успешность биологического удаления фосфора на очистных сооружениях определяется многими факторами: наличием и природой легкодоступных источников углерода и энергии, природой акцепторов электронов, режимом циклов, температурой, кислотностью среды, наличием необходимых микроэлементов и т.д.
Одной из основных причин падения эффективности биологического удаления фосфора считается неблагоприятный для ФАО исход конкуренции за органическое вещество с гликоген-аккумулирующими организмами (ГАО). ГАО – физиологическая группа аэробных микроорганизмов, способных к существованию в циклических условиях, сходных с ФАО. ГАО поглощают и накапливают внутри клеток органический субстрат в анаэробных условиях, а затем используют его для синтеза биомассы и получения энергии в аэробных условиях [88, 89]. В первом приближении биохимические модели ФАО и ГАО близки, однако у ГАО отсутствует цикл “фосфаты–полифосфаты”, т.е. при развитии ГАО наблюдается снижение в активном иле доли ФАО и падение эффективности удаления фосфора. Считается, что исход конкуренции ФАО – ГАО определяется температурой, соотношением в среде органического вещества к фосфатам (доступностью фосфора), типом органического субстрата и кислотностью среды [89].
Зависимость от температуры. Для ФАО оптимальной, как правило, оказывается температура около 20°С, однако достаточно высокая активность наблюдается даже при 5°С [90, 91]. Со снижением температуры с 20 до 5°С эффективность биологического удаления фосфора после кратковременного падения может даже возрастать, превышая в несколько раз величины, характерные для условий при 20°С [92]. По этой причине некоторые авторы относят ФАО к психрофильным микроорганизмам или к мезофилам, пограничным с психрофилами [93, 94]. Повышение температуры куьтивирования до 30–35°С ведет к снижению тотальной активности ФАО [93].
Считается, что от температуры зависит итог может исход конкуренции в активном иле между ФАО и ГАО, а при температуре 20°С и ниже конкурентное преимущество получают ФАО. Например, при понижении температуры культивирования с 20 до 10°С в циклической культуре, обогащенной ГАО, наблюдалось постепенное вытеснение ГАО представителями ФАО [96]. Наоборот, при повышении температуры ФАО вытесняются из системы мезофильными ГАО. Основанием для такого вывода служат факты увеличения доли ГAO при температурах выше 20°С, а также зависимость от температуры скоростей выделения фосфатов и потребления ацетата в анаэробных условиях [96, 97].
Вместе с тем, имеются сообщения о стабильном и эффективном процессе удаления фосфора (в результате метаболизма ФАО) и при температурах 28–30°С, характерных для очистных сооружений в тропическом климате [98–102]. В работе Онга с соавт. [103] показано устойчивое удаление фосфора при повышении температры с 24 до 32°С. Авторы предполагают, что “Ca. Accumulibacter phosphatis” тип IIF обладает высокой устойчивостью к воздействию тепла, что и позволяет вести процесс удаления фосфора даже при 32°С. В другой работе этого коллектива [98] показано, что достаточно высокая эффективность удаления фосфора и повышенное соотношение ФАО/ГАО сохраняется при температуре 28°С: бактерии группы ФАО “Ca. Accumulibacter phosphatis” и ГАО составили соответственно 36 и 7%. Стабильное удаление фосфора при высоких температурах удалось получить и при использовании “стратегии мультицикла” – многократном чередовании условий аэробиоза/анаэробиоза в ходе одного цикла удаления фосфора [104].
Способность к денитрификации и влияние нитритов. Оценка способности к использованию нитратов или нитритов в качестве акцепторов электронов денитрифицирующими ФАО (ДФАО) – важнейшее научно-практическое направление исследований, связанное с экономическими преимуществами использования денитрификации в технологиях очистки сточных вод от биогенных элементов. По сравнению с процессами удаления фосфора и азота, осуществляемыми разными группами организмов (ФАО плюс “обычные” денитрифицирующие микроорганизмы), использование ДФАО приводит к тем же результатам, но с меньшим потреблением кислорода и с меньшим приростом биомассы [105]. Соответственно, в промышленных биореакторах могут быть снижены энергозатраты на принудительную аэрацию и расходы, связанные с обработкой образующегося осадка. Кроме того, ДФАО на удаление Р и азота используют меньше легкодоступного органического вещества, находящегося в муниципальной сточной воде в дефиците, и зачастую ограничивающего глубину удаления этих элементов [106]. Кроме того, способность к денитрификации – один из возможных факторов, определяющих исход конкуренции между ФАО и ГАО.
Существование способных к денитрификации, по крайней мере некоторых представителей ФАО, не вызывает сомнений, так как одновременное удаление P и денитрификация в близких к бескислородным условиях наблюдалось как в лабораторных установках, так и на полномасштабных сооружениях [107, 108]. Однако организмы, участвующие в этих процессах, до сих пор детально не изучены. Ланхем с соавт. [107] отмечают, что в отношении “Ca. Accumulibacter phosphatis” доминируют две гипотезы: 1) существуют несколько фенотипов: неспособные к денитрификации ФАО, нитрит-восстанавливающие ДФАО (в основном связанные с “Ca. Accumulibacter phosphatis” тип II) и нитрат-восстанавливающие ДФАО (связанные с “Ca. Accumulibacter phosphatis” тип I) [109, 110]; 2) существует только один фенотип – нитрит-восстанавливающие ДФАО, а превращение нитрата в нитрит в микробном консорциуме активного ила осуществляется сопутствующими популяциями [111, 112]. Что касается относящихся к ФАО представителей Tetrasphaera, то их поглощение Р при денитрификации оказалось очень низким [113].
Несмотря на способность использовать нитриты в качестве акцептора электронов, при высоких концентрациях нитрита наблюдается ингибирование метаболических процессов ФАО [114–116]. В настоящее время установлено, что ингибирующее воздействие оказывает не столько нитрит, сколько свободная азотистая кислота, подавляющая метаболическую активность ФАО как в аэробный (или аноксидный), так и в анаэробный период. Показано [117], что в аэробной фазе уже в диапазоне концентраций 0.36–0.52 мкг N-HNO2/л происходит 50%-ное снижение скорости поглощения ФАО ортофосфатов, образования гликогена и скорости роста, причем ингибирующий эффект проявляется сильнее в процессах анаболизма, чем в катаболических реакциях (окислении полигидроксиалканоатов). При концентрациях 2–10 мкг N-HNO2/л происходило полное ингибирование этих процессов [117, 118].
В условиях денитрификации поглощение фосфатов ингибировалось азотистой кислотой при концентрациях менее 2 мкг N-HNO2/л, а при концентрации 20 мкг N-HNO2/л – полностью подавлялось [119]. При содержании 44 мкг N-HNO2/л наблюдалось “переключение” денитрифицирующих ФАО на анаэробный метаболизм (выброс фосфатов и распад гликогена), несмотря на присутствие нитратов как акцептора электронов [120]. Показано, что в анаэробном периоде скорость поглощения органического вещества падала вдвое при концентрациях азотистой кислоты 1–2 мкг N-HNO2/л [121].
Влияние фосфатов. В работах Уэллса с соавт. [122] установлено, что концентрация фосфатов оказывала существенное влияние на структуру и обилие микробного сообщества ФАО, а при лимите по фосфору доминирует “Ca. Accumulibacter phosphatis” тип II. Эти результаты подтверждены японскими исследователями [123], установившими, что избыточная концентрация фосфатов ингибирует активность ФАО, причем ингибирующий эффект более выражен у представителей “Ca. Accumulibacter phosphatis” типа II, чем у типа I. В условиях лимита по фосфору, при концентрациях менее 5 мг Р/л, среди представителей “Ca. Accumulibacter phosphatis” доминирует тип II, тогда как при концентрациях 50–500 мг Р/л преимущество получают представители типа I. Для описания зависимости скорости роста ФАО от концентрации фосфора фосфатов авторы используют модифицированную кинетическую модель Михаэлиса–Ментен с учетом ингибирования:
Таблица 1.
Ориентировочные кинетические константы “Ca. Accumulibacter phosphatis”
| “Ca. Accumulibacter phosphatis” | Km, мг Р/л | Ki, мг Р/л |
|---|---|---|
| Тип I | 0.48 | 2000 |
| Тип II | 0.5 | 300 |
Следует отметить, что концентрация фосфора фосфатов в сточных водах, как правило, находится в пределах 1–10 мг P-PO4/л, когда ингибирующий эффект не проявляется, при этом выражен положительный эффект фосфатов на активность и скорость роста ФАО.
Биотехнологические аспекты биологического удаления фосфора. Создание циклических условий, необходимых для успешного развития ФАО и проведения биологического удаления фосфора, в полной мере осуществляется при циклическом культивировании микроорганизмов [124]. Этот тип культивирования основан на последовательной смене нескольких фаз выращивания с отличающимися друг от друга условиями роста и продолжительностью цикла, сопоставимым (меньшим) с продолжительностью цикла клеточного деления (удвоения биомассы). Прохождение фаз роста в определенной последовательности обеспечивает конкурентоспособность ФАО и осуществление биологического удаления фосфора. Циклически меняющимися факторами могут быть любые физико-химические параметры – температура, концентрация кислорода, содержание и состав органического вещества и т.п. В случае ФАО, такими параметрами служит концентрация акцепторов электронов (кислорода, нитратов, нитритов) и легкодоступных органических веществ, а продолжительность цикла устанавливается меньше, чем время удвоения биомассы [26]. Циклическое культивирование может включать элементы и непрерывного, и периодического культивирования, чередующиеся на протяжении одного цикла выращивания в определенном порядке.
Создание циклических условий для развития обогащенного ФАО активного ила и осуществления процесса удаления фосфора связано, главным образом, с использованием циклических реакторов типа SBR (Sequencing Batch Reactor – последовательный периодический реактор; синонимы: последовательно-циклический реактор, реактор последовательно периодического действия, реактор последовательно-переменного действия, реактор циклического действия), а также с организацией внутренних рециклов в проточных биореакторах [125].
На небольших и среднего масштаба сооружениях биологическая очистка сточных вод от фосфора, а также лабораторные исследования проводятся, как правило, в реакторах типа SBR [126, 127], позволяющих в одной емкости за один цикл культивирования провести культуру ФАО или активный ил через серию фаз, составляющих единый цикл очистки сточной воды. Как и в случае с обычным периодическим культивированием, цикл очистки воды в SBR начинается заполнением реактора исходной средой (сточной водой), и заканчивается удалением отработанной среды (рис. 4).
Рис. 4.
Вариант биологического удаления фосфора из сточных вод в биореакторе типа SBR. 1 – подача в биореактор с активным илом сточной воды; 2 – анаэробная фаза; 3 – аэробная фаза; 4 – отстаивание; 5 – удаление очищенной сточной воды; 6 – удаление приросшего (избыточного) активного ила, обогащенного полифосфатами.
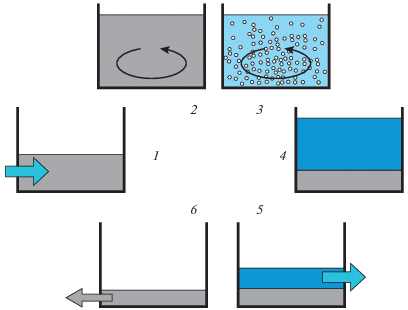
После подачи сточной воды в биореактор, частично заполненный уплотненным активным илом (1), иловая смесь инкубируется в анаэробных условиях (2), где происходит гидролиз полифосфатов с выходом фосфатов из клеток ФАО и потребление содержащегося в поступающей сточной воде легкодоступного органического вещества. В следующей фазе (3) иловую смесь аэрируют, ФАО окисляют запасенное органическое вещество и поглощают фосфаты с образованием полифосфатов. Затем следует период отстаивания (5) и удаления из биореактора очищенной сточной воды. Часть обогащенного полифосфатами активного ила выводится из системы (т.н. избыточного активного ила). После этого цикл очистки повторяется. При жестком соблюдении условий существования ФАО, степень обогащения активного ила этими микроорганизмами в таких установках может достигать 90–99% (например, в работе [128]).
Следует отметить, что рабочие циклы в SBR могут отличаться от представленного варианта. Например, при использовании для отделения ила мембранных систем отсутствует период отстаивания. Добавление поступающей сточной воды может не выделяться в отдельную фазу, а происходить параллельно с протеканием других фаз, вплоть до варианта непрерывной подачи сточной воды в течение всего цикла SBR. В некоторых технологиях аэробная фаза может быть заменена на аноксидную (с наличием нитратов или нитритов), или аноксидная и аэробная фазы могут следовать друг за другом [129, 130].
При биологическом удалении фосфора в промышленных масштабах широко используются биореакторы проточного типа, конфигурация и организация потоков в которых позволяет последовательно проводить активный ил через анаэробные и аэробные (или аноксидные) зоны соответственно богатые и обедненные легкодоступным органическим веществом [131]. В таких системах происходит развитие консорциума микроорганизмов, обогащенных ФАО, и их активность поддерживается на уровне, достаточном для удаления фосфатов из муниципальных сточных вод. В исходной сточной воде содержится, как правило, 5–10 мг/л фосфора, тогда как после биологической очистки его концентрация снижается до 0.1–1.0 мг/л [132].
Для создания циклической смены необходимых для удаления фосфора условий в проточных биореакторах организуют зоны, обедненные или обогащенные кислородом и органическим веществом путем регулирования интенсивности аэрации и перемешивания, а также созданием рециклов – возврата части потока сточной воды и (или) иловой смеси из одной зоны биореактора в другую.
Первый простейший непрерывный процесс для биологического удаления фосфора из сточной воды Phoredox (PHOsphorus REDuction OXidation) был разработан еще в 70 гг. (рис. 5) [133]. Цикличность условий для развития ФАО реализуется в результате прохождения иловой смеси через две последовательно расположенные зоны. В первой, анаэробной (без аэрации) происходит смешивание возвратного активного ила и сточной воды. Вместе со сточной водой поступают легкодоступные органические вещества, а отсутствие или крайне низкие концентрации О2 создают условия для их ферментации с образованием летучих жирных кислот. В этой зоне ФАО потребляют органическое вещество и выбрасывают в среду фосфаты.
Рис. 5.
Схема процесса Phoredox. СВ – сточная вода; АНАЭР – анаэробная зона биореактора; АЭРОБ – аэробная зона биореактора; ИО – отделитель ила; ОчСВ – очищенная сточная вода; ВАИ – возвратный активный ил; ИАИ – избыточный активный ил.

Затем иловая смесь поступает в аэробную зону, обогащающуюся кислородом принудительной аэрацией. В этой зоне ФАО поглощают фосфаты, а затем ил поступает в илоотделитель. После отделения ила часть обогащенного фосфором активного ила (избыточный активный ил или прирост активного ила) выводится из процесса, а остальная часть возвращается в анаэробную зону, и цикл удаления фосфора повторяется. Длительность пребывания в зонах и концентрация активного ила подбираются таким образом, чтобы концентрация фосфора на выходе из аэробной зоны была ниже, чем в поступающей воде и соответствовала проектному значению.
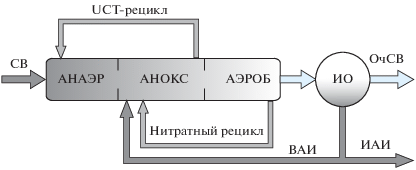
Процесс Phoredox предназначен для очистки сточных вод от органического вещества и фосфора, однако в настоящее время к очистным сооружениям предъявляются требования очистки не только от этих загрязнителей, но и от азота. Поэтому широко используются более сложные технологические схемы. Одна из наиболее распространенных технологий была разработана в Кейптаунском университете и носит название “UCT – процесс” (University of Cape Тown) [134].
В UCT-процессе (рис. 6) органическое вещество удаляется окислением сначала в аноксидной зоне (в ходе денитрификации), а затем в аэробной зоне. Азот удаляется в молекулярном виде путем последовательной нитрификации (в аэробной зоне) – денитрификации (в аноксидной зоне). Для этой цели организован нитратный рецикл, возвращающий часть образующихся в аэробной зоне нитратов в аноксидную зону. Путем организации UCT- рецикла исключается попадание большей части нитратов из аноксидной зоны в анаэробную, в которой начинается первый этап цикла удаления фосфора. Поглощение фосфатов происходит последовательно в аноксидной зоне денитрифицирующими ФАО, а затем – в аэробной зоне.
Рис. 6.
Схема UCT-процесса. АНОКС – аноксидная зона биореактора. Остальные обозначения, как на рис. 5.
Ближайшие перспективы. Полученные в последние годы результаты исследований физиологии и экологии ФАО привели к появлению новых биотехнологических решений, существенно отличающихся от перечисленных нами “классических” вариантов циклических процессов удаления фосфора.
Так, в работах Ванга с соавт. было показано, что циклы потребления-выделения фосфатов могут быть вызваны не только циклическими изменениями наличия/отсутсвия акцепторов электронов [135–137]. Фосфатный цикл возможен в перманентно аэробных условиях, но при чередовании (1) периодов высокого содержания легкодоступного органического источника углерода и энергии вещества с периодами (2) длительного голодания. В период (1) происходит потребление субстрата и синтез полифосфатов, в период (2) – выброс фосфатов. Авторы предложили свою модель обнаруженного явления [138]. При наличии в среде в аэробный период глюкозы или ацетата (период 1) происходит их быстрое потребление и синтез ПГА и гликогена, а затем – окисление накопленных внутриклеточных биополимеров и потребление фосфатов с синтезом полифосфатов. В период длительного голодания (период 2) источником энергии для поддержания жизнеспособности служат полифосфаты, гидролиз которых приводит к выбросу фосфатов.
Разработан и исследован новый процесс, сочетающий циклы удаления фосфора, окисления/восстановления серы и денитрификацию и получивший название “Глубокое биологическое удаление фосфора, связанное с денитрификационным превращением серы” (Denitrifying Sulfur conversion-associated Enhanced Biological Phosphorus Removal, DS-EBPR) [139]. Процесс основан на взаимодействии сульфат-редуцирующих микроорганизмов и ФАО, способных к окислению сульфидов нитратом, проводится чередованием анаэробных/аноксидных условий, не нуждается в кислороде и заметно снижает выход биомассы по субстрату.
Ведутся работы и в направлении оптимизации традиционной схемы удаления фосфора за счет повышения разнообразия симбиотических отношений внутри консорциума активного ила. Например, появились обнадеживающие результаты использования в качестве источника кислорода фотосинтетических микроорганизмов, заменяющих принудительную аэрацию и, тем самым, существенно повышающих экономическую привлекательность такой технологии [140].
Одно из перспективных направлений разработки новых подходов по биологическому удалению фосфора из сточных вод связано с достижениями в области синтетической биологии и метаболической инженерии микроорганизмов. Учитывая, что выделить ФАО в чистые культуры до настоящего времени не удается, одним из способов повышения эффективности удаления фосфора является использование генно-инженерных штаммов бактерий других видов, способных эффективно поглощать фосфаты из среды. Например, был получен штамм Pseudomonas aeruginosa с инактивируемым геном phoU [141]. В другой работе получили рекомбинантный штамм магнитотактической бактерии Magnetospirillum gryphiswaldense, в которой был дополнительно экспрессирован ген полифосфат-киназы (ppk) [142]. В результате этих модификаций полученные генно-инженерным способом бактерии стали более эффективно акумулировать полифсофаты из окружающей среды. Использование таких микроорганизмов является перспективным направлением разработки новых эффективных биотехнологических подходов для удаления фосфатов из сточных вод.
Работа выполнена при частичной финансовой поддержке Российского Фонда фундаментальных исследований (проект № 18-29-25016 мк) и министерства образования и науки РФ.
Список литературы
Farley M. Eutrophication in Fresh Waters: an International Review // Encyclopedia of Lakes and Reservoirs / Eds. Bengtsson L., Herschy R.W., N.Y.: Fairbridge Springer-Verlag Inc., 2012. P. 258–270.
Cordell D., White S. // Agronomy. 2013. V. 3. P. 86–116. https://doi.org/10.3390/agronomy3010086
Cornel P., Schaum C. // Water SciюTechnolю. 2009. V. 59. № 6. P. 1069–1076.
Phosphorus and Nitrogen Removal From Municipal Wastewater Principles and Practices. 2nd Ed. / Ed. R.I. Sedlak. CRC Press. Taylor & Frances Group, 1991. 256 p.
Bunce J.T., Ndam E., Ofiteru I.D., Moore A., Graham D.W. // Front. Environ. Sci. 2018. V. 6. Article 8. https://doi.org/10.3389/fenvs.2018.00008
Hirota R., Kuroda A., Kato J., Ohtake H. // J. Biosci. Bioeng. 2010. V. 109. № 5 P. 423–432.
Wilfert P., Kumar P.S., Korving L., Witkamp G.-J., van Loosdrecht M.C.M. // Environ. Sci. Technol. 2015. V. 49. № 16. P. 9400–9414.
Srinath E.G., Sastry C.A. and Pillai S.C. // Experientia. 1959. V. 15. № 9. P. 339–340.
Shapiro J., Levin G.V., Zea H.G. // J. Water Pollut. Control Fed. 1967. V. 39. № 11. P. 1811–1818.
Shapiro J. // Science. 1967. V. 155. P. 1269–1271.
Barnard J.L. // Water Wastes Eng. 1974. V. 11. № 7. P. 33–36.
Barnard J.L. // Water Res. 1975. V. 9. № 5–6. P. 485–490.
Nicholls H.A. // Water SA. 1975. V. 1. № 3. P. 121–132.
Janssen P.M.J., Meinema K., van der Roes H.F. Biological phosphorus removal: manual for design and operation. London: Stowa. 2002. 224 p.
Wentzel M.C., Comeau Y., Ekama G.A., van Loosdrecht M.C.M., Brdjanovic D. Enhanced Biological Nutrient Removal // Biological Wastewater Treatment Principles, Modelling and Design / Eds. Henze M., van Loosdrecht M.C.M., Ekama G.A., Brdjanovic D. London: IWA Pub., 2008. P. 155–220.
Levin G.V., Shapiro J. // J. Water Pollut. Control Fed. 1965. V. 37. № 6. P. 800–821.
Fuhs G.W., Chen M. // Microbiol. Ecol. 1975. V. 2. № 2. P. 119–138.
Kulaev I.S., Vagabov V.M., Kulakovskaya T.V. The Biochemistry of Inorganic Polyphosphates. 2nd ed. John Wiley & Sons, Ltd. 2004. 273 p.
Rehm B.H.A. // Nat. Rev. Microbiol. 2010. V. 8. № 8. P. 578–592.
Wentzel M.C., Loewenthal R.E., Ekama G.A., Marais G.V.R. // Water S.A. 1988. V. 14. № 2. P. 81–92.
Schuler A.J., Jenkins D. // Water Environ. Res. 2003. V. 75. № 6. P. 485–498.
Welles L., Abbas B., Sorokin D.Y., Lopez-Vazquez C.M., Hooijmans C.M., van Loosdrecht M.C.M., Brdjanovic D. // Front. Microbiol. 2016. V. 7. 2121. https://doi.org/10.3389/fmicb.2016.02121
Van Loosdrecht M.C.M., Hooijmans C.M., Brdjanovic D., Heijnen J.J. // Appl. Microbiol. Biotechnol. 1997. V. 48. № 2. P. 289–296.
Mino T., Van Loosdrecht M.C.M., Heijnen J.J. // Wat. Res. 1998. V. 32. № 11. P. 3193–3207.
Seviour R.J., Mino T., Onuki M. // FEMS Microbiol. Rev. 2003. V. 27. № 1. P. 99–127.
Дорофеев А.Г., Николаев Ю.А., Марданов А.В., Пименов Н.В. // Микробиология. 2019. Т. 88. № 4. С. 401–416.
Mino T., Arun V., Tsuzuki Y., Matsuo T. Effect of phosphorus accumulation on acetate metabolism in the biological phosphorus removal // Biological phosphate removal from wastewaters / Ed. Ramadori R. Oxford: Pergamon Press. 1987. P. 27–38.
Arun V., Mino T., Matsuo T. // Water Res. 1988. V. 22. № 5. P. 565–570.
Comeau Y., Hall K.J., Hancock R.E.W., Oldham W.K. // Water Res. 1986. V. 20, № 12. P. 1511–1521.
Wentzel M.C., Lotter L.H., Loewenthal R.E., Marais G.v.R. // Water S.A. 1986. V. 12. № 4. P. 209–224.
Hesselmann R.P.X., Von Rummell R., Resnick S.M., Hany R., Zehnder J.B. // Water Res. 2000. V. 34. № 14. P. 3487–3494.
Pijuan M., Oehmen A., Baeza J.A., Casas C., Yuan Z. // Biotechnol. Bioeng. 2008. V. 99. № 1. P. 170–179.
Hesselmann R.P.X., Werlen C., Hahn D., van der Meer J.R., Zehnder A.J.B. // Syst. Appl. Microbiol. 1999. V. 22. P. 454–465.
Bond P.L., Hugenholtz P., Keller J., Blackall L.L. // Appl. Environ. Microbiol. 1995. V. 61. № 5. P. 1910–1916.
Crocetti G.R., Hugenholtz P., Bond P.L., Schuler A., Keller J., Jenkins D., Blackall L.L. // Appl. Environ. Microbiol. 2000. V. 66. № 3. P. 1175–1182.
Zilles J.L., Peccia J., Kim M., Hung C., Noguera D.R. // Appl. Environ. Microbiol. 2002. V. 68. № 6. P. 2763–2769.
Zilles J.L., Hung C.H., Noguera D.R. // Water Sci. Technol. 2002. V. 46. № 1–2. P. 123–128.
Kong Y.H., Nielsen J.L., Nielsen P.H. // Appl. Environ. Microbiol. 2004. V. 70. № 9. P. 5383–5390.
He S., Gu A.Z., McMahon K.D. // Microb. Ecol. 2008. V. 55. № 2. P. 229–236.
Lu H., Oehmen A., Virdis B., Keller J., Yuan Z. // Water Res. 2006. V. 40. № 20. P. 3838–3848.
Peterson S.B., Warnecke F., Madejska J., McMahon K.D., Hugenholtz P. // Environ. Microbiol. 2008. V. 10. № 10. P. 2692–2703.
McMahon K.D., Dojka M.A., Pace N.R., Jenkins D., Keasling J.D. // Appl. Environ. Microbiol. 2002. V. 68. № 10. P. 4971–4978.
He S., Gall D.L., McMahon K.D. // Appl. Environ. Microbiol. 2007. V. 73. № 18. P. 5865–5874.
Kim J.M., Lee H.J., Kim S.Y., Song J.J., Park W., Jeon C.O. // Appl. Environ. Microbiol. 2010. V. 76. № 12. P. 3825–3835.
Mao Y., Graham D.W., Tamaki H., Zhang T. // Sci. Rep. 2015. V. 5. P. 11857. https://www.nature.com/ articles/srep11857
Martín G.H., Ivanova N., Kunin V., Warnecke F., Barry K.W., McHardy A.C., Yeates C., He S., Salamov A.A., Szeto E., Dalin E., Putnam N.H., Shapiro H.J., Pangilinan J.L., Rigoutsos I., Kyrpides N.C., Blackall L.L., McMahon K.D., Hugenholtz P. // Nat. Biotechnol. 2006. V. 24. № 10. P. 1263–1269.
Mino T., Satoh H. // Nature Biotechnology. 2006. V. 24. № 10. P. 1229–1230.
He S., McMahon K.D. // Microb. Biotechnol. 2011. V. 4. № 5. P. 603–619.
Flowers J.J., He S., Malfatti S., del Rio T.G., Tringe S.G., Hugenholtz P., McMahon K.D. // The ISME Journal. 2013. V. 7. № 12. P. 2301–2314.
Wexler M., Richardson D.J., Bond P.L. // Environ. Microb-iol. 2009. V. 11. № 12. P. 3029–3044.
Skennerton C.T., Barr J.J., Slater F.R., Bond P.L., Tyson G.W. // Environ. Microbiol. 2015. V. 17. № 5. P. 1574–1585.
Wilmes P., Andersson A.F., Lefsrud M.G., Wexler M., Shah M., Zhang B., Hettich R.L., Bond P.L., VerBerkmoes N.C., Banfield J.F. // ISME J. 2008. V. 2. P. 853–864.
Oyserman B.O., Noguera D.R., del Rio T.G., Tringe S.G., McMahon K.D. // ISME J. 2016. V. 10. № 4. P. 810–822.
Wong M.T., Mino T., Seviour R.J., Onuki M., Liu W.-T. // Water Res. 2005. V. 39. № 13. P. 2901–2914.
Beer M., Stratton H.M., Griffiths P.C., Seviour R.J. // J. Appl. Microbiol. 2006. V. 100. № 1. P. 223–243.
Nguyen H.T., Nielsen J.L., Nielsen P.H. // Environ. Microbiol. 2012. V. 14. № 10. P. 2826–2837.
Tarayre C., Nguyen H.-T., Brognaux A., Delepierre A., De Clercq L., Charlier R., Michels E., Meers E., Delvigne F. // Sensors. 2016. V. 16. P. 1–14.
Stokholm–Bjerregaard M., McIlroy S.J., Nierychlo M., Karst S.M., Albertsen M., Nielsen P.H. A // Front Microbiol. 2017. V. 8:718. https://doi.org/10.3389/fmicb.2017.00718
Tarayre C., Charlier R., Delepierre A., Brognaux A., Bauwens J., Francis F., Dermience M., Lognay G., Taminiau B., Daube G., Compère P., Meers E., Michels E., Delvigne F. // Environmental Science and Pollution Research. 2017. V. 24. № 9. P. 8017–8032.
Maszenan A.M., Seviour R.J., Patel B.K.C., Schumann P., Burghardt J., Tokiwa Y., Stratton H.M. // Int. J. Syst. Evol. Microbiol. 2000. V. 50. № 2. P. 593–603.
Kong Y., Nielsen J.L., Nielsen P.H. // Appl. Environ. Microbiol. 2005. V. 71. № 7. P. 4076–4085.
Nguyen H.T., Le V.Q., Hansen A.A., Nielsen J.L., Nielsen P.H. // FEMS Microbiol. Ecol. 2011. V. 76. № 2. P. 256–267.
Muszynski A., Zaleska–Radziwill M. // Architecture Civil Engineering Environment. 2015. V. 8. № 4. P. 99–105.
Kong Y., Xia Y., Nielsen P.H. // Environ. Microbiol. 2008. V. 10. № 8. P. 2008–2019.
Nielsen J.L., Nguyen H., Meyer R.L., Nielsen P.H. // Microbiology. 2012. V. 158. P. 1818–1825.
Kristiansen R., Nguyen H.T.T., Saunders A.M., Nielsen J.L., Wimmer R., Le V.Q., McIlroy S.J., Petrovski S. Seviour R.J., Calteau A., Nielsen K.L., Nielsen P.H. // ISME J. 2013. V. 7. P. 543–554.
Nguyen H.T., Kristiansen R., Vestergaard M., Wimmer R., Nielsen P.H. // Appl. Envir. Microbiol. 2015. V. 81. № 14. P. 4809–4818.
Hanada S., Liu W.T., Shintani T., Kamagata Y., Nakamura K. // Int. J. Syst. Evol. Microbiol. 2002. V. 52. P. 883–887.
Onda S., Takii S. // J. Gen. Appl. Microbiol. 2002. V. 48. P. 125–133.
McKenzie C.M., Seviour E.M., Schumann P., Masze-nan A.M., Liu J.-R., Webb R.I., Monis P., Saint C.P., Steiner U., Seviour R.J. // Int. J. Syst. Evol. Microbiol. 2006. V. 56. P. 2279–2290.
Nakamura K., Hiraishi A., Yoshimi Y., Kawaharasaki M., Masuda K., Kamagata Y. // Int. J. Syst. Bacteriol. 1995. V. 45. P. 17–22.
Kawakoshi A., Nakazawa H., Fukada J., Sasagawa M., Katano Y., Nakamura S., Hosoyama A., Sasaki H., Ichikawa N., Hanada S., Kamagata Y., Nakamura K., Yamazaki S., Fujita N. // DNA Res. 2012. V. 19. № 5. P. 383–394.
Nakamura K., Masuda K., Mikami E. // J. Ferment. Bioeng. 1991. V. 4. P. 258–263.
Marques R., Santos J., Nguyen H., Carvalho G., Noronha J.P., Nielsen P.H., Reis M.A.M., Oehmen A. // Water Res. 2017. V. 122. P. 159–171.
Chernousova E., Gridneva E., Grabovich M., Dubinina G., Akimov V., Rossetti S., Kuever J. // Int. J. Syst. Evol. Microbiol. 2009. V. 59. № 12. P. 3128–3135.
Rubio–Rincón F.J., Welles L., Lopez-Vazquez C.M., Nierychlo M., Abbas B., Geleijnse M., Nielsen P.H., van Loosdrecht M.C.M., Brdjanovic D. // Water Res. 2017. V. 116. P. 53–64.
Kong Y., Xia Y., Nielsen J.L., Nielsen P.H. // Microbiology. 2007. V. 153. № 12. P. 4061–4073.
Terashima M., Yama A., Sato M., Yumoto I., Kamagata Y., Kato S. // Microbes Environ. 2016. V. 31. №. 4. P. 449–455.
Zhang H., Sekiguchi Y., Hanada S., Hugenholtz P., Kim H., Kamagata Y., Nakamura K. // Int. J. Syst. Evol. Microbiol. 2003. V. 53. 1155–1163.
Spring S., Wagner M., Schumann P., Kämpfer P. // Int. J. Syst. Evol. Microbiol. 2005. V. 55. 621–629.
Sun L., Zhao X., Zhang H., Zhang Y. // Ecological Engi-neering. 2015. V. 81. P. 82–88.
Soo R.M., Skennerton C.T., Sekiguchi Y., Imelfort M., Paech S.J., Dennis P.G., Steen J.A., Parks D.H., Tyson G.W., Hugenholtz P. // Genome Biol. Evol. 2014. V. 6. P. 1031–1045.
Welles L., Tian W.D., Saad S., Abbas B., Lopez-Vazquez C.M., Hooijmans C.M., van Loosdrecht M.C.M., Brdjanovic D. // Water Res. 2015. V. 83. P. 354–366.
Smolders G.J.F., Van der Meij J., Van Loosdrecht M.C.M., Heijnen J. J. // Biotechnol. Bioeng. 1994. V. 43. № 6. P. 461–470.
Nakamura K., Ishikawa S., Kawaharasaki M. // J. Ferment. Bioeng. 1995. V. 80. P. 377–382.
Smolders G.J.F., van Loosdrccht M.C.M., Heijnen J.J. // Biotechrrol. Bioeng. 1994. V. 44. № 7. P. 837–848.
Henze M., Harremoes P., Jansen J.C., Arvin E. Wastewater Treatment: Biological and Chemical Processes. Springer-Verlag. Berlin Heidelberg 1997. 383 p.
Mino T., Liu W.-T., Kurisu F., and Matsuo T. // Water Sci. Technol. 1995. V. 31. № 2. P. 25–34.
McMahon K.D., He S., Oehmen A. The microbiology of phosphorus removal. Microbial Ecology of Activated Sludge / Eds. Seviour R., Nielsen P.H. London: IWA, 2010. Chapter 10. P. 281–319.
Brdjanovic D., Logemann S., Van Loosdrecht M.C.M., Hooijmans C.M., Alaerts G.J., Heijnen J.J. // Water Res. 1998. V. 32. № 4. P. 1035–1048.
Helmer C., Kunst S. // Water Sci. Technol. 1998. V. 37. № 4–5. P. 531–539.
Erdal U.G., Erdal Z.K., Randall C.W. // Water Sci. Technol. 2003. V. 47. № 11. P. 1–8.
Panswad T., Doungchai A., Anotai J. // Water Res. 2003. V. 37. P. 409–415.
Zheng X., Sun P., Han J., Song Y., Hu Z., Fan H., Lv S. // Process Biochemistry. 2014. V. 49. № 12. P. 2207–2213.
Tian W., Lopez-Vazquez C.M., Li W., Brdjanovic D., van Loosdrecht M.C.M. // Chemosphere. 2013. V. 92. № 10. P. 1314–1320.
Brdjanovic D., van Loosdrecht M.C.M., Hooijmans C.M., Alaerts G.J., Heijnen J.J. // ASCE J Environ Eng 1997. V. 123. № 2. P. 144–154.
Lopez-Vazquez C.M., Song Y.I., Hooijmans C.M., Brdjanovic D., Moussa M.S., Gijzen H.J., van Loosdrecht M.M. // Biotechnol Bioeng. 2007. V. 97. № 3. P. 483–495.
Ong Y. H., Chua A.S.M, Huang Y.N., Ngoh G.C., You S.J. // Sustainable Environment Research. 2016. V. 26. P. 14–19.
Ong Y.H., Chua A.S.M., Lee B.P., Ngoh G.C. // Water Sci. Technol. 2013. V. 67. № 2. P. 340–346.
Cao Y., Kwok B.H., van Loosdrecht M.C., Daigger G.T., Png H.Y., Long W.Y., Chye C.S., Ghani Y.A. // Water Sci. Technol. 2017. V. 75. № 3–4. P. 741–751.
Law Y., Kirkegaard R.H., Cokro A.A., Liu X., Arumugam K., Xie, C., Stokholm-Bjerregaard M., Drautz-Moses D.I., Nielsen P.H., Wuertz S., Williams R.B.H. // Sci. Rep. 2016. V. 6 Article 25719. https://doi.org/10.1038/srep25719
Qiu G., Zuniga-Montanez R., Law Y., Thi S.S., Nguyen T.Q.N., Eganathan K., Liu X., Nielsen P.H., Williams R.B.H., Wuertz S. // Water Res. 2019. V. 149. P. 496–510.
Ong Y.H., Chua A.S.M., Fukushima T., Ngoh G.C., Shoji T., Michinaka A. // Water Res. 2014. V. 64. P. 102–112.
Shen N., Chen Y., Zhou Y. // Water Res. 2017. V. 114. P. 308–315.
Kuba T., Murnleitner E., vanLoosdrecht M.C.M., Heijnen J.J. // Biotechnol. Bioeng. 1996. V. 52. № 6. P. 685–695.
Kuba T., Van Loosdrecht M. C. M., Heijnen J. // Water Research. 1996. V. 30. № 7. P. 1702–1710.
Lanham A. B., Oehmen A., Carvalho G., Saunders A.M., Nielsen P.H., Reis M.A.M. // Water Science & Technology. 2018. V.78. № 12. P. 2449–2458.
Zou H., Wang Y. // Environment Protection Engineering. 2017. V. 43. № 3. P. 225–237.
Flowers J.J., He S., Yilmaz S., Noguera D.R., McMahon K.D. // Environ. Microbiol. Rep. 2009. V. 1. № 6. P. 583–588.
Lanham A.B., Moita R., Lemos P.C., Reis M.A.M. // Water Sci. Technol. 2011. V. 63. № 2. P. 352–359.
Rubio–Rincón F.J., Lopez–Vazquez C.M., Welles L., van Loosdrecht M.C.M., Brdjanovic D. // Water Res. 2017. V. 120. P. 156–164.
Saad S., Welles L., Abbas B., Lopez–Vazquez C., van Loosdrecht M. Brdjanovic D. // Water Res. 2016. V. 105. P. 97–109.
Marques R., Ribera–Guardia A., Santos J., Carvalho G., Reis M.A.M., Pijuan M., Oehmen A. // Water Res. 2017. V. 137. P. 262–272.
Zeng W., Li B., Wang X., Bai X., Peng Y. // Chemosphere. 2016. V. 144. P. 1018–1025.
Meinhold J., Arnold E., Isaacs S. // Water Res. 1999. V. 33. P. 1871–1883.
Saito T., Brdjanovic D., Van Loosdrecht M.C.M. // Water Res. 2004. V. 38. P. 3760–3768.
Pijuan M., Ye L., Yuan Z. // Water Res. 2010. V. 44. P. 6063–6072.
Zhoy Y., Ganda L., Lim M., Yuan Z., Ng W.J. // Bioresour. Technol. 2012. V. 116. P. 340–347.
Zhou Y., Pijuan M., Yuan Z. // Biotechnol. Bioeng. 2007. V. 98. P. 903–912.
Zhou Y., Ganda L., Lim M., Yuan Z., Kjelleberg S., Ng W. // Appl. Micobiol. Biotechnol. 2010. V. 88. P. 359–369.
Ye L., Pijuan M., Yuan Z. // Bioresour. Technol. 2013. V. 130. P. 382–389.
Welles L., Lopez-Vazquez C.M. Hooijmans C.M., van Loosdrecht M.C.M. and Brdjanovic D. // AMB Express. 2016. 6:44. https://doi.org/10.1186/s13568-016-0214-z
Nurmiyanto A., Kodera H., Kindaichi T., Ozaki N., Aoi Y., Ohashi A. // Microbes Environ. 2017. V. 32. №. 3. P. 260–267.
Dorofeev A.G., Grigor’eva N.V., Kozlov M.N., Kevbrina M.V., Aseeva V.G. Nikolaev Yu. A. // Microbiology (Moscow). 2014. V. 83. № 5. P. 450–461.
Tchobanoglous G., Burton F.L., Stensel H.D. Wastewater Engineering: Treatment and Reuse. Metcalf and Eddy, McGraw Hill, New York, USA. 2014. 2044 p.
Sequencing Batch Reactor Technology. Scientific & Technical Reports № 10 / Eds. Wilderer P.A., Irvine R.L., Goronszy M.C. IWA Publishing. 2001. 76 p.
Artan N., Orhon D. Mechanism and design of sequencing batch reactors for nutrient removal. Scientific and Technical Report Series, № 19. IWA Publishing, London. 2005. P. 116.
Saad A.S., Welles L., Lopez C.M, van Loosdrecht M.C.M., Brdjanovic D. // Chemical Engineering J. 2017. V. 326. P. 68–77.
Von Sperling M. Activated Sludge and Aerobic Biofilm Reactors. Biological Wastewater Treatment. Volume 5. London: IWA Publishing. 2007. P. 322.
Wang L.K., Li Y. Sequencing Batch Reactors Handbook of Environmental Engineering Series. Volume 8. Biological Treatment Processes / Eds. Wang L.K., Pereira N.C., Hung Y.T., and Shammas N.K. Humana Press. 2009. P. 459–511.
Barnard J., Comeau Y. Phosphorus removal in activated sludge. Activated Sludge – 100 Years and Counting / Eds. Jenkins D., Wanner J. IWA Publishing. 2014. P. 93–115.
Neethling J. B., Bakke B., Benisch M., Gu A., Stephens H., Stensel H.D., Moore R. Factors Influencing the Reliability of Enhanced Biological Phosphorus Removal. WERF Report 01-CTS-3. London: IWA. 2005.
Barnard J.L. // Water SA. 1976. V. 2. № 3. P. 136–144.
Marais G.v.R., Loewenthal R.E., Siebritz I.P. // Water Sci. Technol. 1983. V. 15. № 3, 4. P. 15–41.
Wang D.B., Li X.M., Yang Q., Zeng G.M., Liao D.X., Zhang J. // Bioresour. Technol. 2008. V. 99. P. 5466–5473.
Chen H.B., Wang D.B., Li X.M., Yang Q., Luo K., Zeng G. Tang M., Xiong W., Yang G. // Biochem. Eng. J. 2014. V. 90. P. 27–35.
Wang D., Xu Q., Yang W., Chen Y., Li X., Liao D., Yang G., Yang Q., Zeng G. // Biochemical Engineering Journal. 2014. V. 87. P. 15–24.
Wang D., Li X., Yang Q., Zheng W., Liu Z., Liu Y., Cao J., Yue X., Shen T., Zeng G., Deng J. // Bioresour Technol. 2009. V. 100. P. 4005–4011.
Guo G., Wu D., Ekama G.A., Hao T., Mackey H.A., Chen G. // Water Res. 2018. V. 141. P. 9–18.
Oyserman B.O., Martirano J.M., Wipperfurth S., Owen B.R., Noguera D.R., McMahon. K.D. // Environ. Sci. Technol. 2017. V. 51. № 6. P. 3165–3175.
De Almeida L.G., Ortiz J.H., Schneider R.P., Spira B. // Appl. Environ. Microbiol. 2015. V. 81. № 9. P. 3006–3015.
Zhou Y., Lisowski W., Zhou Y., Jern N.W., Huang K., Fong E. // Biotechnol Lett. 2017. V. 39. № 10. P. 1509–1514. https://doi.org/10.1007/s10529-017-2383-5
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология