Прикладная биохимия и микробиология, 2020, T. 56, № 3, стр. 305-312
Зависимость содержания липидов и ненасыщенных жирных кислот в скелетных мышцах радужной форели от условий выращивания и физиологического состояния рыб
Н. Н. Фокина 1, *, Л. А. Лысенко 1, Т. Р. Руоколайнен 1, И. В. Суховская 1, Н. П. Канцерова 1, Н. Н. Немова 1
1 Институт биологии ФИЦ “Карельский научный центр РАН”
185910 Петрозаводск, Россия
* E-mail: fokinann@gmail.com
Поступила в редакцию 04.09.2019
После доработки 03.12.2019
Принята к публикации 23.12.2019
Аннотация
Продукт товарного рыбоводства, скелетные мышцы рыб, является источником животного белка, фосфолипидов и ненасыщенных жирных кислот, незаменимых в питании человека. Изучено влияние условий обитания рыб (сезонной динамики температуры воды и кислородного режима) и их физиологического состояния (инфекционного статуса) на липидный состав мышечной ткани у двухлетней радужной форели Oncorhynchus mykiss, выращиваемых в садках на естественном водоеме. Установлено, что скорость ростовых процессов молоди снижалась в условиях повышенной температуры воды, наличия бактериальной инфекции и последующей антибиотикотерапии. При этом в мышцах накапливался избыток энергетических липидов (триацилглицеринов) и повышалась степень насыщенности мембранных липидов. Влияние внешних факторов и бактериальной инфекции пытались нивелировать введением в рацион рыб антиоксидантной пищевой добавки, включающей дигидрокверцетин и арабиногалактан. Показано, что у потреблявшей кормовую добавку форели состав структурных тканевых липидов и содержание ненасыщенных жирных кислот были стабильными, что указывало на более высокие потребительские свойства и сбалансированный нутриентный состав получаемого из нее продукта.
Радужная форель, Oncorhynchus mykiss, широко распространенный вид семейства лососевых, относится к традиционным объектам аквакультуры на Северо-Западе России. Метаболизм форели и темпы ее роста так же, как у всех пойкилотермных животных, в значительной степени определяются температурой среды обитания. Выростной период (июнь-сентябрь) у форели сопровождается интенсивным приростом массы и линейного размера. Осенью с понижением температуры окружающей среды интенсивность ростовых процессов снижается [1]. Сезонные метаболические перестройки у форели обусловлены как ростовыми процессами, так и воздействием абиотических факторов среды обитания (температурного, кислородного режимов и др.) [2–4]. Интенсивное культивирование форели служит причиной развития у рыб патологических процессов, вызванных, в том числе, бактериальными инфекциями, которые, в свою очередь, могут значительно отразиться на биохимических и физиологических параметрах рыб [5, 6]. Липиды и их жирнокислотные компоненты относятся к важнейшим метаболическим (энергетическим) и структурным системам организма, обеспечивающим его оптимальное функционирование в норме, в том числе, при изменении факторов среды [2, 7–9]. Состав липидов определяет качество рыбы как пищевой продукции для человека, при этом высокую пищевую ценность имеет рыбная продукция с высоким содержанием полиненасыщенных жирных кислот (ПНЖК) n-3 семейства, которое должно превалировать над ПНЖК n-6 семейства, оцениваемого по соотношению n-3/n-6 [7, 9–12]. Изменения в липидном составе мышц рыб могут провоцироваться внешними факторами. Так, например, воздействие пониженной температуры способствует повышению уровня ненасыщенности фосфолипидов мембран, в то время как влияние повышенной температуры приводит к увеличению насыщенности липидов [8, 13]. Загрязнение среды, бактериальные, грибковые и вирусные инфекции и паразитарные инвазии также изменяют метаболизм в тканях рыб, в частности, повышают уровень свободных радикалов и инициируют тем самым окислительную модификацию макромолекул и оксидативный стресс [14]. ПНЖК в составе мембранных липидов являются одной из мишеней оксидативных процессов [14], их дефицит, в конечном счете, может отразиться на физиологическом состоянии рыб и качественном составе получаемой из нее продукции.
Биологически активные пищевые добавки широко применяются в мировой технологии аквакультуры с целью ускорения роста культивируемых рыб и повышения их устойчивости к различным стрессовым воздействиям, в том числе к бактериальным инфекциям [15]. Ранее было показано, что использование в аквакультуре антиоксидантных пищевых добавок и пребиотиков, включая аскорбиновую кислоту, витамин Е, бета-гликан и бетаин, приводит к снижению уровня стрессовых гормонов у рыб и укреплению их иммунитета [16–20].
Цель работы – изучение сезонных и индуцированных бактериальной инфекцией модификаций липидного состава мышц молоди (1+) форели, а также их сохранение при введении в рацион форели смеси дигидрокверцетина (биофлавоноида) и арабиногалактана (полисахарида), получаемых из древесины лиственницы и обладающих антиоксидантными, противовоспалительными и пребиотическими свойствами [21, 22].
МЕТОДИКА
Схема эксперимента и отбор проб. С июня по ноябрь 2017 г. на форелевом хозяйстве, расположенном на одном из озер северо-западного региона России, 36000 особей молоди форели Oncorhynchus mykiss (1+) сходной массы 100 ± 2.3 г были помещены в садки с плотностью посадки 2.1 кг/м3. Форель получала стандартный коммерческий корм (“BioMar”, Дания) без добавок (контрольные садки) или с добавлением смеси 25 мг дигидрокверцетина и 50 мг арабиногалактана на кг корма (экспериментальные садки) в соответствии с рекомендацией производителя добавок (“Аметист”, сертификат № 396-08.17, Россия). Через 1 мес. после начала эксперимента у рыб, содержавшихся в контрольных и экспериментальных садках, методами визуальной оценки и по повышенному отходу было обнаружено бактериальное заболевание, возбудителем которого по данным микробиологического анализа (заключение № 939/22 от 23.08.2017, ФГБНУ ВИЭВ, Россия) оказалась ассоциация бактерий Pseudomonas putida и Cytophaga psychrophila. В связи с этим заболевание было диагностировано как бактериальная геморрагическая септицемия. Рыбы обеих групп были подвергнуты антибактериальной терапии энрофлоксацином (25 мг/кг рыбы) в течение 6 сут. Ежедневно фиксировали температуру воды и содержание кислорода.
Образцы тканей рыб (8 особей из каждого садка) отбирали два раза в 1 мес., фиксировали в 97%-ном этаноле и хранили при 4°C до проведения биохимического анализа. Одновременно с забором проб проводили измерение размерно-в-есовых характеристик рыб, с помощью которых рассчитывали индекс упитанности рыбы (коэффициент Фультона, K):
Анализ состава липидов. Биохимический анализ липидов и их жирных кислот в мышцах форели осуществляли с использованием оборудования Центра коллективного пользования Карельского научного центра РАН (Петрозаводск, Россия). Липиды из тканей форели экстрагировали смесью хлороформ : метанол (2 : 1) по методу Фолча [23]. Для разделения на основные классы, экстрагированные липиды хроматографировали на ТСХ пластине Silica gel 60 F254 (“Merck”, Германия) в системе растворителей петролейный эфир : серный эфир : уксусная кислота (90 : 10 : 1). Для идентификации полученных компонентов использовали стандартные растворы смеси фосфолипидов (“Supelco”, США) и триацилглицеринов (“Sigma-Aldrich”, США), а также растворы холестерина и пальмитата холестерина (“Sigma-Aldrich”, США). Количественное содержание основных классов липидов определяли спектрофотометрическими методами, описанными в работах [24, 25] и рассчитывали как % средних значений сухого веса ± ошибка среднего.
Содержание отдельных фракций фосфолипидов, включающих фосфатидилинозитол (ФИ), фосфатидилсерин (ФС), фосфатидилэтаноламин (ФЭА), фосфатидилхолин (ФХ), лизофосфатидилхолин (ЛФХ) и сфингомиелин, оценивали с помощью высокоэффективной жидкостной хроматографии на хроматографе “Stayer” (“Aquilon”, Россия), используя колонку Nucleosil 100-7 (“Elsiko”, Россия) [26]. Компоненты идентифицировали по времени удерживания, сравнивая со стандартными растворами фосфолипидов: смеси фосфолипидов (P3817 “Supelco”, США), фосфатидилсерина (P7769, “Sigma-Aldrich”, США) и сфингомиелина (S7004 4, “Sigma-Aldrich”, США), и их содержание рассчитывали как % средних значений сухого веса ± ошибка среднего.
Метиловые эфиры жирных кислот общих липидов были получены с использованием метанола и хлористого ацетила, затем их разделяли ВЭГХ на газовом хроматографе “Agilent 7890A” (“Agilent Technologies”, США) с пламенно-ионизационным детектором на колонке “DB-23” (60 м – 0.25 мм) (“Agilent Technologies”, США). Компоненты идентифицировали, сравнивая время удерживания их и стандартного раствора смеси метиловых эфиров жирных кислот (“Supelco”, США). Содержание рассчитывали как % суммы средних значений жирных кислот± ошибка среднего.
Статистическая обработка. Достоверность различий оценивали с помощью непараметрического критерия Манна–Уитни. Различия считались достоверными при р ≤ 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Естественную сезонную динамику параметров окружающей среды в течение периода наблюдений с июня по ноябрь 2017 г. и поражение рыб спорадической бактериальной инфекцией в июле можно было считать двумя факторами, которые в равной степени воздействовали на рыб обеих выборок, при этом вызываемые ими эффекты не могли быть достоверно разделены. Вместе с тем обнаруженные различия по выживаемости, скорости ростовых процессов и модификациям липидного состава мышц у форели, выращенной на стандартных и обогащенных биоактивной добавкой кормах, позволили судить не только о преимуществах использования этой добавки, но и в определенной мере о механизмах ее действия.
Физиологический статус форели. На протяжении исследуемого сезона (июнь-ноябрь 2017 г.) температура воды в садках изменялась в диапазоне 5.0–15.8°С с максимумом в августе, при этом содержание кислорода сохранялось на стабильно высоком уровне и составляло 7–10 мг/л. Естественное изменение температур в 2017 г. не превышало пороговых значений толерантности форели к температурному фактору и не провоцировало явлений гипоксии у изучаемого поголовья рыб. Вместе с тем на физиологическом статусе форели существенно сказалось перенесенное бактериальное заболевание. Его признаки, включая повышенную смертность, поведенческие отклонения (плавание на боку и отказ от корма) и изменения в состоянии внутренних органов (цвета, формы и тургора печени и наличие кровоизлияний в ее капсуле), наблюдались с середины июля. При максимуме бактериальной геморрагической септицемии величина отхода составила 4.0% среди рыб, выращиваемых на стандартной диете, и 1.7% – на экспериментальной. Различие в уровне смертности сохранилось между контрольной и опытной группами до конца сезона, составив 4.19 и 1.97% соответственно, что указывало на иммуномодулирующее действие добавки, благодаря которому получавшая ее рыба оказалась устойчивее к действию инфекции.
Показатели живой массы и длины форели стабильно возрастали в обеих группах на протяжении выростного сезона с максимальной скоростью роста в июле и закономерным ее снижением при сезонном понижении температуры воды (табл. 1). Индекс упитанности отражал пропорциональный линейный и весовой прирост форели обеих исследуемых групп. Тенденция к более высокой скорости роста у рыб, получавших кормовую добавку, достигла статистической значимости в августе в период излечения бактериального заболевания. Вероятно, это свидетельствовало о сокращении срока восстановительного периода у экспериментальной выборки.
Таблица 1.
Линейно-массовые характеристики форели (Oncorhynchus mykiss) контрольной и экспериментальной групп, определяющие длину (см), массу (г) и коэффициент упитанности рыбы
| Дата сбора | 25.06 (1) | 14.07 (2) | 26.07 (3) | 12.08(4) | 28.08(5) | 12.09(6) | 16.11(7) |
|---|---|---|---|---|---|---|---|
| Масса, г | |||||||
| Контроль | 100.0 ± 2.3 | 143.3 ± 8.7 | 187.3 ± 12.9 | 235.3 ± 29.3 | 324.8 ± 36.1 | 478.3 ± 46.5 | 702.3 ± 41.2 |
| Эксперимент | 100.0 ± 2.3 | 134.8 ± 5.4 | 185.1 ± 10.8 | 283.3 ± 14.9 | 378.9 ± 22.8 | 527.1 ± 16.5 | 743.1 ± 53.5 |
| Длина, см | |||||||
| Контроль | 20.7 ± 0.4 | 21.1 ± 0.9 | 22.9 ± 1.3 | 22.6 ± 3.3 | 25.6 ± 3.1 | 28.4 ± 2.7 | 32.9 ± 1.7 |
| Эксперимент | 20.6 ± 0.4 | 20.9 ± 1.2 | 22.4 ± 1.2 | 25.6 ± 1.1* | 26.8 ± 1.1 | 30.7 ± 1.4 | 33.6 ± 2.7 |
| Коэффициент упитанности | |||||||
| Контроль | 1.0 ± 0.1 | 1.5 ± 0.1 | 1.5 ± 0.1 | 1.9 ± 0.4 | 1.9 ± 0.3 | 2.1 ± 0.3 | 1.9 ± 0.2 |
| Эксперимент | 1.0 ± 0.1 | 1.5 ± 0.1 | 1.7 ± 0.1 | 1.6 ± 0.2 | 2.0 ± 0.2 | 1.8 ± 0.1 | 2.0 ± 0.1 |
Модификации липидного состава. Известно, что в мышцах лососевых рыб накапливаются липиды [11, 27, 28]. В мышцах форели обеих исследуемых групп отмечалось сезонное (с июля по август) накопление общих липидов (рис. 1), главным образом за счет высокоэнергетических липидов – триацилглицеринов (ТАГ). Значительное снижение уровня мембранных липидов – общих фосфолипидов (ФЛ) и их основных фракций (ФХ, ФЭА, ФС и ЛФХ), более выраженное у контрольной группы рыб, отмечалось к середине августа (рис. 1, 12 августа). Можно предположить, что снижение связано с активацией перекисных процессов, вызванных бактериальной инфекцией и, возможно, введением антибиотика. Показано, что на ранней стадии бактериального заболевания липидный состав мышц молоди форели существенно не изменялся, за исключением повышенного содержания минорных специфических (бактериального происхождения) насыщенных жирных кислот с нечетным числом атомов углерода (15:0 и 17:0), отмеченного в органах рыб уже в июне-июле (рис. 2). Содержание данных кислот значительно снизилось к середине августа после курса антибиотикотерапии, а у экспериментальной группы рыб - и в более короткий промежуток времени.
Рис. 1.
Содержание (% от сухой массы) общих липидов (а), триацилглицеринов (б), фосфолипидов (в), стеринов (г), фосфатидилхолина (д), фосфатидилэтаноламина (е), фосфатидилсерина (ж) и лизофосфатидилхолина (з) в мышцах радужной форели O. mykiss контрольной (1) и экспериментальной (2) групп: по оси абсцисс − 1–7 даты сбора, как в табл. 1 (^ − отличия достоверны при сравнении контрольной и экспериментальной группы рыб внутри одной временной точки сбора, * − внутри одной группы рыб при сравнении с предыдущей временной точкой сбора).
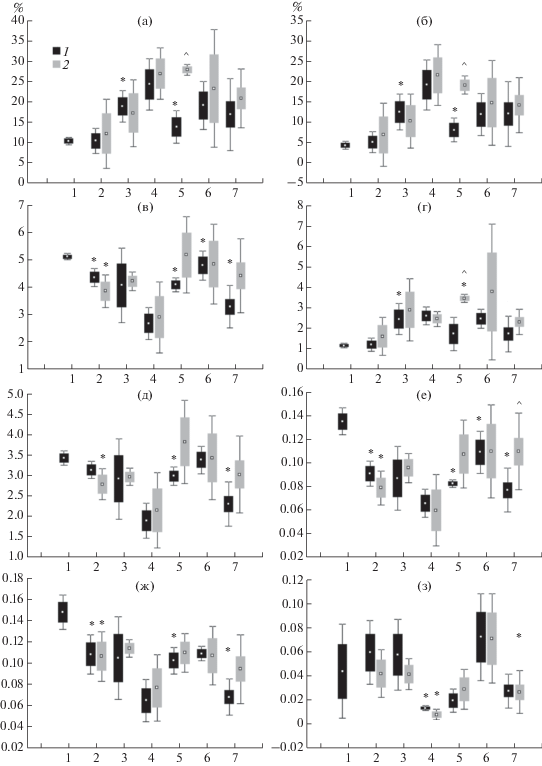
Рис. 2.
Содержание жирных кислот (% от суммы) общих липидов 15:0 (а), 17:0 (б), 18:2n-6 (в), 18:3n-3 (г), 20:4n-6 (АК, д), 20:5n-3 (ЭПК, е), 18:1n-9 (ж) и 22:6n-3 (ДГК, з) в мышцах радужной форели O. mykiss контрольной (1) и экспериментальной (2): по оси абсцисс − 1−7 даты сбора, как в табл. 1; (^ − отличия достоверны при сравнении контрольной и экспериментальной группы рыб внутри одной временной точки сбора, * − внутри одной группы рыб при сравнении с предыдущей временной точкой сбора).
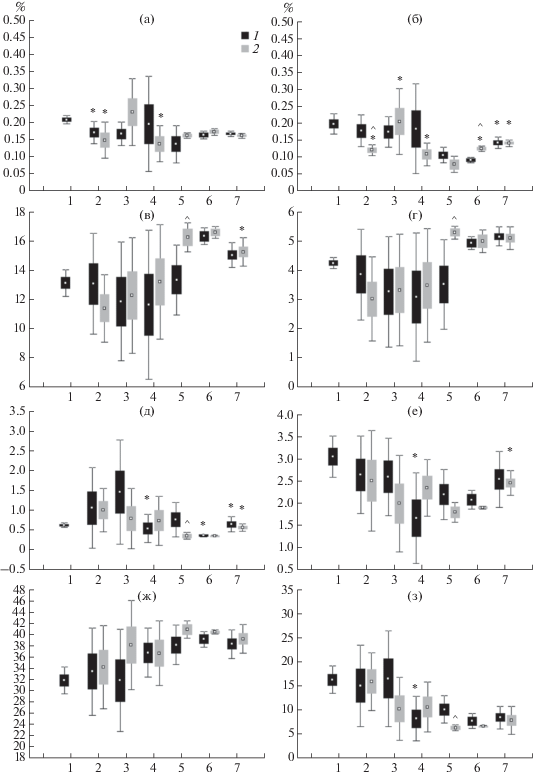
Одновременно со снижением уровня ФЛ, отмеченного после перенесенной инфекции, в мышцах форели обнаружено снижение уровня ненасыщенности общих липидов (индекс ненасыщенности, ИН), преимущественно за счет арахидоновой (АК), эйкозапентаеновой (ЭПК) и докозагексаеновой (ДГК) кислот (рис. 2 и 3, точка 12 августа). Отмечалось также снижение соотношения n-3/n-6 ПНЖК, которое рассчитывали как средние значения ± ошибка среднего (рис. 3, 12 августа). Можно предположить, что такие модификации в составе липидов являлись результатом оксидативных процессов, вызванных кумулятивным действием инфекционных агентов и антибиотика. Ранее было показано, что антибиотик энрофлоксацин активирует (главным образом, на 3 сут введения) процессы оксидативного стресса, которые сопровождаются изменением активности антиоксидантных ферментов и повышением уровня продуктов перекисного окисления липидов [5, 6]. Необходимо отметить, что модификация жирнокислотного состава липидов в сторону снижения уровня их ненасыщенности была характерна исключительно для контрольной группы рыб. Молодь форели, которая получала с кормом экспериментальную добавку, характеризовалась относительно стабильным составом липидов при действии бактериальной инфекции и последующей терапии антибиотиком. В этом случае компонент добавки дигидрокверцетин, вероятно, проявлял свои антиоксидантные свойства, предотвращая окисление липидов и жирных кислот, инициируемое действием бактерий и антибиотика.
Рис. 3.
Соотношение n-3/n-6 полиненасыщенных жирных кислот (а) и индекс ненасыщенности (ИНЖК) жирных кислот (б) общих липидов мышц радужной форели O. mykiss контрольной (1) и экспериментальной (2): по оси абсцисс − 1−7 даты сбора, как в табл. 1 (^ − отличия достоверны при сравнении контрольной и экспериментальной группы рыб внутри одной временной точки сбора, * − внутри одной группы рыб с предыдущей временной точкой сбора).

У контрольной группы рыб к концу августа отмечалось восстановление уровня ФЛ за счет расходования мышечных резервов ТАГ, содержание которых снизилось (рис. 1, 28 августа). На этом сроке в мышцах форели контрольной группы отмечался пониженный по сравнению с экспериментальной группой уровень ТАГ и стеринов. Можно предположить, что активация пластического обмена вследствие подавления активности бактерий с помощью антибиотика способствовала активному росту рыб, и в дальнейшем (сентябрь) наблюдалось повышение уровня структурных липидов – ФЛ. Необходимо отметить, что у экспериментальной группы рыб уже к концу августа было обнаружено повышение уровня эссенциальных жирных кислот, линолевой 18:2n-6 и альфа-линоленовой 18:3n-3, которое вызывалось более легким перенесением инфекционного процесса и более коротким периодом восстановления после него. Указанные жирные кислоты служат предшественниками для синтеза ПНЖК – АК и ЭПК соответственно [7, 9], которые участвуют в синтезе биологически активных молекул – эйкозаноидов, ответственных за протекание воспалительных процессов [29, 30]. Блокирование синтеза АК и ЭПК у экспериментальной группы рыб свидетельствовало о меньшей интенсивности оксидативных процессов в их органах, провоцируемых антибактериальной терапией.
К концу выростного сезона у молоди форели обеих групп отмечалось снижение уровня ФЛ (ФХ, ФЭА, ФС и ЛФХ), что, по-видимому, связано со снижением у них интенсивности ростовых процессов в ответ на понижение температуры окружающей среды (рис. 1, точка 16 ноября). При этом важной особенностью липидного состава мышц молоди форели оказалось повышение соотношения фосфатидилэтаноламин/фосфатидилхолин в составе фосфолипидов мембран, а также уровня ненасыщенности липидов за счет накопления полиненасыщенных жирных кислот (АК, ЭПК и ДГК). Выявленные модификации в составе мембранных липидов мышц форели отражали температурные перестройки в составе липидов мембран [8, 13]. При этом у рыб экспериментальной группы наблюдалось в большей степени повышение соотношения n-3/n-6 ПНЖК за счет накопления физиологически активной ЭПК.
Таким образом, наблюдаемые изменения ростовых показателей и состава липидов молоди форели отражали не только воздействие абиотических факторов (главным образом, температуры), но и влияние бактериальной инфекции и последующей антибиотикотерапии. Наиболее подверженными влиянию неблагоприятных факторов оказались рыбы контрольной группы, у которых изменения состава структурных липидов и ненасыщенных жирных кислот были более выраженными. Экспериментальная группа форели отличалась относительно стабильным составом липидов мышц, как в период заболевания, так и в период химиотерапии, что свидетельствовало об их повышенной устойчивости к действию бактериальной инфекции и антибиотиков. У рыб, получавших экспериментальную диету, более быстрое восстановление процессов накопления липидов в мышцах и роста в целом, в том числе за счет синтеза биологически активных жирных кислот, указывало также на возможную физиологическую роль биоактивной добавки.
С точки зрения пищевой ценности продукции рыбоводства, полученные результаты свидетельствовали об ухудшении потребительских качеств рыбного сырья в сезон высоких температур и при распространении в поголовье инфекционных заболеваний, которые не только служили причиной повышенного отхода рыб и снижения скорости индивидуального прироста, и, как следствие, убытков рыбного производства, но и изменяли качественный состав скелетных мышц рыб. В тоже время липидный состав продукции, полученной из форели, выращенной с использованием биодобавки, оказался более сбалансированным. Он характеризовался меньшей общей жирностью (оцениваемой по содержанию общих липидов и ТАГ) и, как следствие, калорийностью, и, вместе с тем, более высоким содержанием фосфолипидов, обогащенных эссенциальными полиненасыщенными жирными кислотами, получаемыми человеком преимущественно из рыбной продукции.
Авторы выражают благодарность О.Н. Кремневу за организацию работы на форелевом хозяйстве, Е.А. Завьяловой и А.Е. Дрошневу (ФГБНУ ВИЭВ, Москва) за вирусологический и бактериологический анализ материала.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 17-74-20098).
Список литературы
Титарев Е.Ф. Холодноводное форелевое хозяйство. Рыбное: “Астраханский гос. технический ун-т”, Дмитровский филиал, 2007. 279 с.
Сидоров В.С. Экологическая биохимия рыб. Липиды. Л.: Наука, 1983. 240 с.
Cordiner S., Egginton S. // Fish Physiol. Biochem. 1997. V. 16. № 4. P. 333–343.
Thibault M., Blier P.U., Guderley H. // Fish Physiol. Biochem. 1997. V. 16. № 2. P. 139–155.
Tu H.T., Silvestre F., Bernard A., Douny C., Phuong N.T., Tao C.T., Kestemont P. // Aquac. 2008. V. 285. № 1–4. P. 244–248.
Sehonova P., Tokanova N., Hodkovicova N., Kroupo-va H.K., Tumova J., Blahova J., Chloupek P. // Environ. Toxicol. Pharmacol. 2019. V. 67. P. 87–93.
Bell M.V., Henderson R.J., Sargent J.R. // Comp. Biochem. Physiol. B Biochem. Mol. Biol. 1986. V. 83. № 4. P. 711–719.
Hochachka P.W., Somero G.N. Biochemical Adaptation: Mechanism and Process in Physiological Evolution. Oxford: Oxford University Press, 2002. 480 p.
Tocher D.R. // Aquac. Res. 2010. V. 41. № 5. P. 717–732.
Sushchik N.N., Gladyshev M.I., Kalachova G.S. // Food Chem. 2007. V. 104. № 4. P. 1353–1358.
Vegusdal A., Østbye T.K., Tran T.N., Gjøen T., Ruyter B. // Lipids. 2004. V. 39. № 7. P. 649–658.
Гладышев М.И. // Журн. СФУ. 2012. № 5. С. 352–386.
Hazel J.R., Williams E.E. // Prog. Lipid Res. 1990. V. 29. № 3. P. 167–227.
Lesser M.P. // Annu. Rev. Physiol. 2006. V. 68. P. 253–278.
Blazer V.S. // Annu. Rev. Fish Dis. 1992. V. 2. P. 309–323.
Dabrowski K., Lee K. J., Guz L., Verlhac V., Gabaudan J. // Aquac. 2004. V. 233. № 1–4. P. 383–392.
Ji L., Sun G., Li J., Wang Y., Du Y., Li X., Liu Y. // Fish Shellfish Immunol. 2017. V. 64. P. 56–67.
Kiron V., Puangkaew J., Ishizaka K., Satoh S., Watanabe T. // Aquac. 2004. V. 234. № 1–4. P. 361–379.
Kumar N., Jadhao S.B., Chandan N.K., Kumar K., Jha A.K., Bhushan S., Rana R.S. // Fish Physiol. Biochem. 2012. V. 38. № 4. P. 989–1000.
Pinedo-Gil J., Martín-Diana A.B., Bertotto D., Sanz-Calvo M.Á., Jover-Cerdá M., Tomás-Vidal A. // Fish Physiol. Biochem. 2018. V. 44. № 3. P. 939–948.
Awad E., Austin D., Lyndon A.R. // Aquac. 2013. V. 388. № 15. P. 193–197.
Awad E., Awaad A.S., Esteban M.A. // Fish Shellfish Immunol. 2015. V. 43. № 1. P. 43–50.
Folch J., Lees M., Stanley G.H.S. // J. Biol. Chem. 1957. V. 226. № 1. P. 497–509.
Engelbrecht F.M., Mari F., Anderson J.T. // S. A. Med. J. 1974. V. 48. № 7. P. 250–256.
Сидоров В.С., Лизенко Е.И., Болгова О.М., Нефедова З.А. // Лососевые (Salmonidae) Карелии. Вып. 1. Петрозаводск: КФАН СССР, 1972. С. 150–163.
Arduini A., Peschechera A., Dottori S., Sciarroni A.F., Serafini F., Calvani M. // J. Lipid Res. 1996. V. 37. № 3. P. 684–689.
Bilinski E. // Can. J. Biochem. Physiol. 1963. V. 41. № 1. P. 107–112.
Castell J.D., Lee D.J., Sinnhuber R.O. // J. Nutr. 1972. V. 102. № 1. P. 93–99.
Das U.N. // J. Adv. Res. 2018. V. 11. № 1. P. 57–66.
Martinez-Rubio L., Morais S., Evensen Ø., Wadsworth S., Vecino J.G., Ruohonen K., Tocher D.R. // Fish Shellfish Immunol. 2013. V. 34. № 6. P. 1533–1545.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


