Прикладная биохимия и микробиология, 2020, T. 56, № 4, стр. 358-365
NO-синтазная активность в фотоморфогенезе Neurospora сrassa
С. Ю. Филиппович 1, *, М. В. Онуфриев 2, Д. И. Перегуд 3, Г. П. Бачурина 1, М. С. Крицкий 1
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Институт высшей нервной деятельности и нейрофизиологии РАН
117485 Москва, Россия
3 Национальный медицинский исследовательский центр психиатрии и наркологии им. В.П. Сербского Минздрава России
119034 Москва, Россия
* E-mail: syf@inbi.ras.ru
Поступила в редакцию 14.01.2020
После доработки 03.02.2020
Принята к публикации 25.02.2020
Аннотация
Изучение превращения 3H-L-аргинина в 3H-L-цитруллин в клетках Neurospora crassa позволило выявить активность NO-синтазы. По чувствительности к ионам кальция, действию специфических ингибиторов фермента, вестерн-блот анализу NO-синтаза сходна с индуцибельной формой фермента млекопитающих. По данным Вестерн-блоттинга молекулярная масса фермента составляла около 130 кДа. Светозависимые изменения удельной активности NO-синтазы в фотокаротиногенезе и фотоконидиогенезе N. сrassa не обнаружены.
Оксид азота – короткоживущая молекула, обладающая высокой реакционной способностью. Функции NO разнообразны, от высокотоксичного агента до сигнальной молекулы, участвующей в регуляции разнообразных метаболических путей.
Важно, что онтогенез и биосинтетическая продуктивность мицелиальных грибов зависят от химической природы источников азота и метаболических путей их ассимиляции. В литературе представлены данные об участии оксида азота в физиологических и биохимических процессах у грибов. Целый ряд работ посвящен влиянию NO на процессы роста и дифференцировки грибов, принадлежащих к различным таксономическим группам, – Colletotrichum coccodes [1], Aspergillus niger, Monilinia fructicola, Penicillium italicum [2], Botrytis cinerea [3], Penicillium expansum [4], Phycomyces blakesleeanus [5], Flammulina velutipes [6], Coniothyrium minitans [7, 8] и Aspergillus nidulans [9].
Известно, что синтез NO осуществляется NO-синтазой (КФ 1.14.13.39), катализирующей превращение L-аргинина и кислорода в L-цитруллин и NO. Процесс описан для различных представителей высших и низших организмов. Наиболее хорошо изучен фермент млекопитающих, представленный 3 формами: нейрональной (nNOS), индуцибельной (iNOS) и эндотелиальной (eNOS), кодируемыми разными генами [10]. Он представляет собой гомодимер, содержащий N-концевой каталитический или оксигеназный домен (NOSox), С-концевой редуктазный домен (NOSred) и регуляторный кальмодулинсвязывающий участок, соединяющий NOSox и NOSred в единый комплекс. У млекопитающих NO-синтаза регулирует кровяное давление, сокращение мышц, а также работу иммунной и нервной систем. NO-синтазы бактерий отличаются от одноименного фермента млекопитающих отсутствием редуктазного домена [11]. Единственное исключение из этого правила – NO-синтаза миксобактерии Sorangium cellulosum. Помимо отличия в структуре, NO-синтазы бактерий различаются и функциями – участвуют в нитровании индольного кольца триптофана и восстановлении повреждений, вызванных УФ-радиацией, в адаптации бактерий к окислительному стрессу, синтезе cGMP и устойчивости бактерий к антибиотикам. У высших растений образование NO происходит 2 путями: нитратредуктазным и L-аргинин-зависимым, причем данные о существовании второго пути являются противоречивыми [12, 13]. Вместе с тем, в 2016 г. Чанг с соавт. [14] разработали метод с применением нового флуоресцентного аналога аргинина, позволяющий напрямую идентифицировать NO-синтазу у высших растений, и успешно применили его для листьев табака. Этот метод можно сочетать с тестированием ингибиторов энзима млекопитающих и иммуноцитохимическим анализом.
Пути синтеза и распада оксида азота, позволяющие поддерживать определенный баланс NO в клетках грибов, изучены мало [15]. Одним из основных препятствий является отсутствие в геноме большинства грибных организмов типичных полноценных генов, кодирующих NO-синтазы млекопитающих. Несмотря на это, активность фермента, определяемая изотопным методом, по превращению 3H- или 14C-L-аргинина в 3H- или 14C-L-цитруллин, обнаружена в таких грибах как Neurospora crassa [16], F. velutipes [6], Saccharomyces cerevisiae [17], Blastocladiella emersonii [18] и C. minitans [8]. Кроме того, у ряда грибов выявлены стадии развития, чувствительные к действию соединений, влияющих на активность NO-синтазы. Для зигомицета P. blakesleeanus это светостимулируемое образование макроспорангиофоров [5], для базидиомицета F. velutipes – образование плодовых тел [6], для хитридиомицета B. emersonii – образование зооспор [18], для митоспорового гриба C. minitans – пикнидий [8].
При исследовании роли оксида азота в метаболизме аскомицета N. crassa сложилась противоречивая ситуация. Применив донор NO, нитропруссид натрия, а также специфические ингибиторы NO-синтазы, Ниннеманн и Майер [16] предположили, что NO ингибирует у N. crassa светостимулируемое образование вегетативных спор, конидий. Наряду с этим, в мицелии гриба изотопным методом они обнаружили NO-синтазную активность. Вместе с тем, как и у большинства грибов, в геноме N. crassa не удалось найти полноценный ген NО-синтазы животного типа. Ранее был проанализирован выход нитрат- и нитрит-ионов и их внутриклеточное содержание в качестве методического подхода к исследованию метаболизма и функций NO у N. crassa [19, 20]. Для этого гриба детально охарактеризован ряд генов, связанных с метаболизмом азота [21]. Структурный ген nit-6 кодирует нитритредуктазу (НиР). Глобальный регуляторный ген nit-2 кодирует ядерный белок, влияющий на экспрессию более 100 генов азотного метаболизма, при его повреждении в клетках гриба полностью отсутствует активность НиР и нитратредутазы (НР). Использование nit-мутантов позволило измерить выход ионов нитрата и нитрита из клетки, избежав их вторичной ассимиляции. Изучение N. crassa вызывает также особый интерес в связи со светозависимой регуляцией процессов развития и дифференцировки этого гриба [22]. Установлено, что динамика выхода нитрита в ходе фотоиндуцированного каротиногенеза [19] и фотостимулируемого конидиогенеза [20] nit-6 мутанта N. crassa свидетельствует о возможном участии NO-генерирующего механизма в трансдукции фотосигнала гриба.
Цель работы – определение NO-синтазной активности в клетках дикого типа wt-987 и мутантов nit-2 и nit-6 N. crassa и ее динамики при светозависимой стимуляции каротиногенеза и конидиогенеза.
МЕТОДИКА
Штаммы N. crassa, среды, культивирование. Штамм дикого типа wt 987(74-0R23-1A) и мутанты nit-2 (33 A) и nit-6 (3463 A) аскомицета N. crassa были получены из Центра по хранению генетического материала грибов (Fungal Genetic Stock Center – FGSC, США). Оба мутанта дефектны по НиР, а nit-2 штамм лишен также и НР.
Состав сред, получение инокулята и условия культивирования дикого типа и nit-мутантов были описаны ранее [20, 22]. Мицелий выращивали на агаризованной среде Фогеля с 2%-ной сахарозой в качестве источника углерода, но с другим источником азота [22]. В опытах по конидиогенезу вместо 25 мM NH4NO3 использовали 50 мM NH4Cl или 50 мМ NH4NO3, или 50 мМ NaNO3.
Регуляция светом каротиногенеза и конидиогенеза. Фотоиндукцию каротиногенеза и фотостимуляцию конидиогенеза проводили согласно предыдущим работам [19, 20].
Получение экстрактов мицелия. После 24 ч выращивания в темноте при 28°C мицелий собирали с поверхности целлофана при красном свете, промывали дистиллированной водой, фильтровали через 3 слоя марли, высушивали с помощью фильтровальной бумаги и растирали с жидким азотом в течение 15 мин. Экстракцию осуществляли при слабом перемешивании в течение 30 мин тремя объемами 50 мM Трис-HCl буфера, pH 8.0, содержащего 0.5 мM ЭДTA, 1 мM дитиотреитола, 5 мкг/мл леупептина, 5 мкг/мл апротинина, 5 мкг/мл пепстатина и 1 мМ фенилметилсульфонилфторида (PMSF). После центрифугирования при 20 000 g в течение 30 мин при 4°С полученные супернатанты диализовали в течение ночи против того же буфера, содержащего в качестве ингибитора протеаз только 1 мМ PMSF. Аликвоты диализатов хранили при –70°C.
Определение активности NO-синтазы. Активность NO-синтазы оценивали по превращению 3H-L-аргинина в 3H-L-цитруллин. В серии предварительных экспериментов были определены оптимальные условия для ферментативной реакции. Реакционная смесь общим объемом 50 мкл содержала (мкМ): НАДФН – 1.0, ФАД – 5.0, ФМН – 5.0, тетрагидробиоптерин − 50, валин − 50 мМ, цитруллин – 1.0 мМ, аргинин − 10 мкМ и 3H-аргинин − 0.5 мкл (“Amersham Biosciences”, США) с активностью 1 мккюри/мл, растворенного в 50 мМ Трис-HCl буфере, рН 8.0. Ферментативную реакцию начинали добавлением 20 мкл диализата белков N. crassa и проводили в течение 20 мин при 37°C. Реакцию останавливали добавлением 300 мкл суспензии ионообменника Dowex 50 Wx8 (400 меш, Na+ форма; “Sigma-Aldrich”, США) в 50 мМ HEPES буфере, pH 7.5. Положительно заряженный L-аргинин связывался с колонкой Dowex, а незаряженный продукт, 3H-цитруллин, оставался в растворе. Радиоактивность полученных проб определяли на жидкостном сцинтилляционном счетчике Wallac 1420 (“Perkin Elmer”, США). Для исключения неспецифичеcкого действия на ферментативную активность различных соединений, содержащихся в мицелиальном диализате, добавляли ингибитор индуцибельной NO-синтазы животных L-N6-(1-иминоэтил)-лизин (L-NIL). Для снижения влияния фоновой радиоактивности данные для реакционной смеси, содержащей воду, вычитали из данных для той же смеси с 0.1 мМ L-NIL вместо воды. Концентрацию белка измеряли по методу Бредфорд, используя БСА в качестве стандарта.
Удельную активность NO-синтазы выражали в пмоль цитруллина образовавшегося в мин на мг белка.
Вестерн-блоттинг. Диализаты N. crassa смешивали с равным объемом 125 мМ Трис-HCl буфера, pH 6.8, содержащего 4% ДДС, 10% глицерина, 0.006% бромфенолового синего, 1.8% ß-меркаптоэтанола, прогревали при 100°C в течение 10 мин, пробы центрифугировали при 10000 g в течение 5 мин. После измерения концентрации белка в супернатанте его равные количества фракционировали методом электрофореза в 8%-ном ПААГ с Na-ДДС при 100 В в течение 90 мин. Затем белки переносили на мембрану из поливинилиденфторида с размером пор 0.2 мкМ (“Bio-Rad Laboratories”, США) при 150 мА в течение 180 мин. Предварительно окрашенные высокомолекулярные белковые стандарты (“Bio-Rad Laboratories”, США) использовали в качестве маркеров для контроля переноса белков. Блокировку сайтов неспецифического связывания 20 мМ Трис-HCl буфером, рН 7.5, содержащим 150 мM NaCl, 0.1% Tвин-20 (TBST) и 5% сухое молоко проводили в течение ночи. Затем мембраны промывали в TBST и инкубировали в течение ночи при 4°C с первичными антителами к мышиной нейрональной NO-синтазе (разведение 1 : 2000, “Chemicon”, США) или мышиной эндотелиальной NO-синтазе (разведение 1 : 5000, “BD Biosciences”, США) или кроличьей индуцибельной NO-синтазе (разведение 1 : 5000, “Chemicon”, США). После трехкратной промывки мембраны инкубировали со вторичными антителами, конъюгированными с пероксидазой хрена, которые визуализировали используя хемилюминесцентный субстрат SuperSignal West Pico (“Thermo Scientific Pierce”, США).
Статистический анализ. Число биологических параллелей варьировало от 3 до 15, число биохимических параллелей было не ниже 3. Результаты представлены в виде средних значений ± ошибка среднего.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
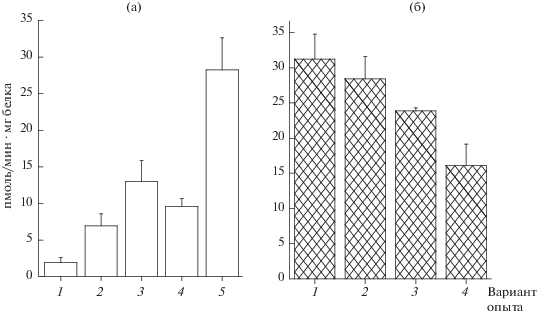
Сравнение свойств NO-синтазы N. crassa с индуцибельным ферментом млекопитающих. Для определения активности фермента в диализатах мицелиальных клеток гриба был оптимизирован метод измерения скорости ферментативного окисления 3H-L-аргинина, использовавшийся ранее при исследовании клеток млекопитающих. Оказалось, что фермент N. crassa чувствителен к специфическим ингибиторам ферментов животного происхождения. Исследование проводили на диализатах супернатантов экстрактов мицелия и для исключения неспецифического действия различных примесей, а также эндогенного L-аргинина результаты измерения NO-синтазной активности представляли в виде разности активностей в пробах, содержащих и не содержащих ингибитор фермента. Ферментативная активность N. crassa была на порядок более чувствительна к L-NIL, чем к метиловому эфиру N-нитро-L-аргинина (NAME) (рис. 1а). Кроме того, аналогично ферменту из P. blakesleeanus [5], она не активировалась в присутствии ионов кальция (рис. 1б). Известно, что iNOS млекопитающих является Са-независимой, так как она тесно связывается с кальмодулином вне зависимости от концентрации внутриклеточного кальция [23]. На основании результатов по действию специфических ингибиторов и ионов кальция на активность фермента было сделано предположение о сходстве NO-синтазы N. crassa с индуцибельной формой фермента животных.
Рис. 1.
Действие различных ингибиторов (а) и ионов кальция (б) на активность (пмоль цитруллина/мин · мг белка) NO синтазы N. crassa). а − 1 – 0.01 мМ L-NAME; 2 – 0.1 мМ L-NAME; 3 – 1 мМ L-NAME; 4 – 0.01 мМ L-NIL; 5 – 0.1 мМ L-NIL; б − 1 – 200 мМ ЭДTA; 2 – 1 мМ ЭГТА; 3 – 0.01 мМ Са2+; 4 – 0.1 мМ Са2+. Способ подсчета удельной активности фермента описан в тексте статьи.
Действительно, с помощью Вестерн-блоттинга (рис. 2) выявлено наличие у всех изучаемых штаммов N. crassa белка, с которым специфически связываются поликлональные антитела против iNOS изоформы фермента млекопитающих, но не взаимодействуют антитела против eNOS и nNOS изоформ фермента. Для прореагировавших антител иммуногеном служил С-концевой пептид, содержащий 14 аминокислот iNOS, полученный из макрофагов мыши. При сравнении с положением белковых метчиков было выявлено, что молекулярная масса обнаруженной формы фермента N. crassa близка к таковой для iNOS животных [24] и равна 130 кДа.
Рис. 2.
Результаты Вестерн-блоттинга различных штаммов N. crassa с использованием антител к нейрональной (1), эндотелиальной (2) и индуцибельной (3) изоформам NO-синтазы млекопитающих; 1 – nit-1 мутант; 2 – nit-6 мутант и 3 – wt-987 штамм N. crassa. Цифры обозначают молекулярные массы белков-метчиков (кДа).

Данные о существовании различных форм NO-синтазы грибов, аналогичных формам, обнаруженным для фермента животных, немногочисленны. Канадиа с соавт. [25], используя моноклональные антитела против nNOS, выявили конститутивную форму NO-синтазы у дрожжей S. cerevisiae. В более поздней работе у этого же микроорганизма в экспоненциальной фазе роста выявлена экспрессия эндотелиальной, нейрональной и индуцибельной изоформ фермента [26]. Показано, что индукция различных изоформ NO-синтазы у этого гриба зависит от метаболического состояния клеток и ответа на стресс.
Таким образом, на основании комплекса полученных данных о чувствительности фермента к специфическому ингибитору iNOS и ионам кальция и его взаимодействии с поликлональными антителами против iNOS можно предположить существование в поверхностном мицелии N. crassa формы фермента, сходной с индуцибельной изоформой млекопитающих.
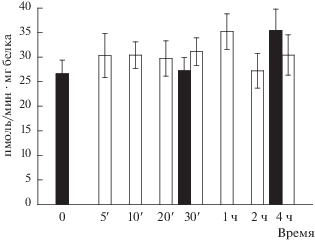
NO-синтаза в фотоморфогенезе N. crassa. На рис. 3 представлены результаты изменения удельной активности NO-синтазы в каротиногенезе у штамма дикого типа N. crassa в зависимости от времени освещения. Достоверных изменений этого параметра не наблюдалось как в освещенных культурах, так и в темновых контролях. Рост гриба осуществляли на стандартной среде Фогеля, содержащей 4 мМ хлорид аммония в качестве источника азота. Необходимо отметить, что, в противоположность дикому штамму, в этих условиях культивирования N. crassa NO-синтазная активность в диализатах nit-мутантов не обнаруживалась.
Рис. 3.
Активность NO-синтазы в каротиногенезе wt-987 штамма N. crassa (культивирование на среде с 4 мМ NH4Cl в качестве источника азота). Темные столбики – темновые контроли, светлые – освещенные культуры. Способ подсчета удельной активности фермента описан в тексте статьи.
С результатами опыта, представленными на рис. 3 согласовывались результаты на рис. 4, согласно которым освещение мицелия гриба в присутствии ингибитора NO-синтазной реакции L-NIL при концентрации от 0.1 до 1.0 мМ, практически не сказывалось на фоторегуляции каротиногенеза в клетках трех штаммов N. crassa.
Рис. 4.
Синтез каротиноидов в присутствии и отсутствии L-NIL у мутантов nit-2 (1, 4), nit-6 (2, 5) и штамма wt-987 (3, 6) N. crassa. 1, 2, 3 – освещенный мицелий, 4, 5, 6 – темновые контроли.

В табл. 1 приведены результаты определения удельной активности NO-синтазы в фоторегулируемом конидиогенезе N. crassa, осуществляемом в сухой поверхностной культуре на средах с разными источниками азота. Ранее было показано [22], что в этих условиях совместное действие света и дегидратации в большинстве вариантов азотного статуса вызывало синергическое увеличение выхода конидий, поэтому для исследования были взяты варианты (штамм + источник азота в среде), в которых наблюдался эффект фотостимуляции конидиогенеза или же он отсутствовал. Было установлено, что при культивировании на среде с 50 мМ NH4Сl активность фермента не была обнаружена как в вариантах, для которых отмечена фотостимуляция конидиогенеза, так и без нее. При выращивании дикого типа на среде с 50 мМ NaNO3 фермент был активен, но величина удельной активности NO-синтазы оказалась одинаковой и в темновом контроле, и в мицелии, подвергнутом освещению. Сравнимая удельная активность фермента обнаружена у гриба-паразита C. minitans [8]. Примечательно, что она достигает максимального уровня 20 пмоль/мин · мг белка именно при конидиогенезе.
Таблица 1.
NO-синтазная активность в конидиогенезе N. crassa
| Источник азота в среде | Штамм | Эффект фотостимуляции конидиогенеза (дегидратированная культура) |
Вариант опыта | Активность
NO-синтазы, пмоль/мин · мг белка |
|---|---|---|---|---|
| 50 мМ NH4Сl | wt-987 | Нет | Темновой контроль | 0 |
| 2 ч света | 0 | |||
| nit-2 | × 8.1 | Темновой контроль | 0 | |
| 2 ч света | 0 | |||
| nit-6 | ×12.3 | Темновой контроль | 0 | |
| 2 ч света | 0 | |||
| 50 мМ NaNO3 | wt-987 | ×8.1 | Темновой контроль | 28.5 ± 2.7 |
| 2 ч света | 28.0 ± 4.3 |
При увеличении концентрации хлорида аммония в среде культивирования дикого штамма N. crassa от 4 до 50 мМ активность NO-синтазы исчезала. Вместе с тем активность фермента выявлялась при выращивании гриба на среде с 50 мМ NaNO3. Это позволило предположить наличие ингибирующего действия ионов ${\text{NH}}_{{\text{4}}}^{{\text{ + }}}$ и активирующего ${\text{NO}}_{3}^{ - }$ на NO-синтазу N. crassa, подобного обнаруженному для НР [27].
Вестерн-блоттинг диализатов различных штаммов N. crassa, полученных для разных вариантов конидиогенеза аскомицета, с антителами к iNOS представлен на рис. 5а. Использовали разные варианты (штамм + источник азота в среде), в которых эффект фотостимуляции конидиогенеза или был, или отсутствовал. Несмотря на отсутствие активности фермента в ряде случаев (табл. 1) иммунологически NO-синтаза выявлялась во всех вариантах. Средние показатели денситометрии экспрессии фермента в различных вариантах конидиогенеза из 3 Вестерн-блот опытов суммированы на диаграмме рис. 5б. Они свидетельствовали скорее о зависимости экспрессии фермента от состава среды культивирования, чем от влияния освещения мицелия в разных вариантах конидиогенеза N. crassa.
Рис. 5.
Вестерн-блоттинг и денситометрический анализ диализатов различных штаммов N. crassa, полученных для разных вариантов конидиогенеза аскомицета, с поликлональными антителами к iNOS кролика (а) и денситометрия экспрессии NOS (б). a − 1, 2 – wt-987 + 50 мМ NH4Сl; 3, 4 – nit-2 + 50 мМ NH4Сl; 5, 6 – nit-6 +50 мМ NH4Сl; 7, 8 – nit-6 + 50 мМ NH4NO3; 9, 10 – wt-987 + 50 мМ NaNO3. 1, 3, 5, 7 – темновые контроли, 2, 4, 6, 8 – после 2-часовой стимуляции светом. Цифры обозначают молекулярные массы белков-метчиков(кДа).

Изменение удельной активности NO-синтазы под действием света ранее было выявлено у зигомицета P. blakesleeanus [5]. Предполагали, что данный фермент является частью световой сигнальной цепи, так как образование цитруллина из аргинина увеличивалось под действием света в наиболее важных фазах развития зигомицета – в логарифмической фазе роста мицелия и при созревании макроспорангиофоров. Увеличение активности NO-синтазы в 72 раза перед образованием плодовых тел происходило в освещенном мицелии базидиомицета F. velutipes [6], однако оценить вклад действия света в этот процесс сложно, так как темновые контроли не были поставлены. Основываясь на действии донора NO и ингибиторов NO-синтазы на фотоконидиогенез N. сrassa, Ниннеманн и Майер [16] предположили, что свет может быть отрицательным регулятором функционирования NO за счет ингибирующего действия на фермент. Однако, в настоящей работе выявить какие-либо светозависимые изменения удельной активности NO-синтазы в светорегулируемых процессах каротиногенеза и конидиогенеза N. сrassa не удалось. Вместе с тем, учитывая данные о динамике выхода нитрита из мицелия nit-6 и изменения внутриклеточного содержания ${\text{NO}}_{3}^{ - }$ и ${\text{NO}}_{2}^{ - }$ у разных штаммов при фотоиндукции каротиногенеза и фотоактивации конидиогенеза [19, 20], можно также предположить возможность L-аргинин-независимого синтеза NO у N. сrassa. Он может осуществляться белком (или комплексом белков), обычно выполняющим другие ферментативные функции.
У высших растений в определенных условиях продукцию оксида азота катализируют НР [28, 29]. Недавно на примере Aspergillus установлено, что грибы также способны синтезировать NO при помощи НР [30]. Возможность участия НР и НиР в регуляции фотоконидиогенеза N. сrassa (wt-987 штамм на среде с вторичным азотом) рассматривалась в предыдущей работе [22], однако наличие данных ферментов не являлось необходимым элементом процесса, так как и у nit-2, и nit-6 мутантов наблюдалась светозависимая стимуляция образования спор. С использованием мутантов, дефицитных по НР и НиР было показано, что эти ферменты также не участвуют в синтезе NO у Magnaporthe oryzae, аскомицета, вызывающего гниль риса [31]. Другими вероятными кандидатами, ответственными за образование оксида азота, могут быть ксантиноксидоредуктаза [29], p450:НАДФН-P450 редуктаза [31] или некоторые мембраносвязанные ферменты [29, 32]. Гипотеза, предложенная для высших растений, по которой NO-синтазоподобная активность, зависимая от L-Arg, может быть результатом кооперативного действия нескольких дискретных белков, собранных в сложный комплекс, в результате чего генерируется NO [12], может быть справедлива и для грибов.
Недавно Пенгкит с соавт. [33] выявили в геноме N. crassa ряд генов, имеющих высокую степень гомологии с генами NO-синтазы других грибов и человека. Анализируя их свойства, авторы предположили возможность существования различных путей синтеза NO (зависимого и независимого от NO-синтазы) у N. crassa.
Список литературы
Wang J., Higgins V.J. // Fungal Genet. Biol. 2005. V. 42. № 4. P. 284–292.
Lazar E.E., Wills R.B., Ho B.T., Harris A.M., Spohr L.J. // Lett. Appl. Microbiol. 2008. V. 46. № 6. P. 688–692.
Turrion-Gomez J.L., Eslava A.P., Benito E.P. // Fungal Genet. Biol. 2010. V. 47. № 5. P. 484–496.
Lai T., Li B., Qin G., Tian S. // Curr. Microbiol. 2011. V. 62. № 1. P. 229–234.
Maier J., Hecker R., Rockel P., Ninnemann H. // Plant Physiol. 2001. V. 126. № 3. P. 1323–1330.
Song N.K., Jeong C.S., Choi I.S. // Mycologia. 2000. V. 92. № 6. P. 1027–1032.
Gong X., Fu Y., Jiang D., Li G., Yi X., Peng Y. // Fungal Genet. Biol. 2007. V. 44. № 12. P. 1368–1379.
Li B., Fu Y., Jiang D., Xie J., Cheng J., Li G. et al. // App-l. Environ. Microbiol. 2010. V. 76. № 9. P. 2830–2836.
Chiuchetta S.J.R., Castro-Prado M.A.A. // Genet. Mol. Biol. 2005. V. 28. № 4. P. 798–803.
Alderton W.K., Cooper C.E., Knowles R.G. // Biochem. J. 2001. V. 357. Pt. 3. P. 593–615.
Филиппович С.Ю. // Биохимия. 2010. Т. 75. № 10. С. 1367–1376.
Corpas F.G., Barroso J.B. // Nitric Oxide. 2017. V. 68. P. 5–6.
Santolini J., Andre F., Jeandroz S., Wendehenne D. // Nitric Oxide. 2017. V. 63. P. 30–38.
Chang K., Guo T., Li P., Liu Y., Xu Y., Fang Y., Qian X. // Sci. Reports. 2016. V. 6. P. 32630.
Cánovas D., Marcos J.F., Marcos A.T., Strauss J. // Curr. Genet. 2016. V. 62. P. 513–518.
Ninnemann H., Maier J. // Photochem. Photobiol. 1996. V. 64. № 2. P. 393–398.
Almeida B., Buttner S., Ohlmeier S., Silva A., Mesquita A., Sampaio-Marques B. et al. // J. Cell Sci. 2007. V. 120. № 18. P. 3279–3288.
Vieira A.L., Linares E., Augusto, O., Gomes S.L. // Fungal Genet. Biol. 2009. V. 46. № 8. P. 575–584.
Филиппович С.Ю., Бачурина Г.П., Крицкий М.С. // Прикл. биохимия и микробиология. 2007. Т. 43. № 3. С. 331–337.
Филиппович С.Ю., Онуфриев М.В., Бачурина Г.П., Крицкий М.С. // Прикл. биохимия и микробиология. 2019. Т. 55. № 4. С. 403–409.
Marzluf G.A. // Microbiol. Mol. Biol. Rev. 1997. V. 61. № 1. P. 17–32.
Филиппович С.Ю., Бачурина Г.П., Щербаков Д.Л. // Прикл. биохимия и микробиол. 2015. Т. 51. № 3. С. 326–334.
Ruan J., Xie Q., Hutchinson N., Cho H., Wolfe G.C., Nathan C. // J. Biol. Chem. 1996. V. 271. № 37. P. 22679–22686.
Hevel J.M., White K.A., Marletta M.A. // J. Biol. Chem. 1991. V. 266. № 34. P. 22789–22791.
Kanadia R.N., Kuo W.N., Mcnabb M., Botchway A. // Biochem. Mol. Biol. Int. 1998. V. 45. № 6. P. 1081–1087.
Domitrovic T., Palhano F.L., Barja-Fidalgo C., DeFreitas M., Orlando M.T., Fernandes P.M. // FEMS Yeast Res. 2003. V. 3. № 4. 341–346.
Bahns M., Garret R.H. // J. Biol. Chem. 1980. V. 255. № 2. P. 690–693.
Moreau M., Lindermayr C., Durner J., Klessig D.F. // Physiol. Plant. 2010. V. 138. № 4. P. 372–383.
Gupta K.J., Fernie A.R., Kaiser W.M., van Dongen J.T. // Trends Plant Sci. 2011. V. 16. № 3. P. 160–168.
Marcos A.T., Ramos M.S., Marcos J.F., Carmona L., Strauss J., Canovas D. // Mol. Microbiol. 2016. V. 99. № 1. P. 15–33.
Samalova M., Johnson J., Illes M., Kelly S., Fricker M., Gurr S. // New Phytol. 2013. V. 197. P. 207–222.
Baudouin E. // Plant Biol. 2011. V. 13. № 2. P. 233–242.
Pengkit A., Jeon S.S., Son S.J., Shin J.H., Baik K.Y., Choi E.H., Park G. // Sci. Reports. 2016. V. 6. Article № 30037. https://doi.org/10.1038/srep30037
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


