Прикладная биохимия и микробиология, 2020, T. 56, № 4, стр. 383-389
Участие сероводорода в индуцировании салициловой кислотой антиоксидантной системы корней проростков пшеницы и их теплоустойчивости
Ю. В. Карпец 1, М. А. Шкляревский 1, Е. И. Горелова 1, Ю. Е. Колупаев 1, *
1 Харьковский национальный аграрный университет им. В.В. Докучаева
62483 Харьков, Украина
* E-mail: plant.biology.knau@gmail.com
Поступила в редакцию 14.01.2020
После доработки 12.02.2020
Принята к публикации 25.02.2020
Аннотация
Исследовали возможную роль сероводорода как сигнального посредника при индуцировании теплоустойчивости проростков пшеницы (Triticum aestivum L.) салициловой кислотой (СК). Обработка проростков 1 и 10 мкМ СК или 0.1 и 0.25 мМ донором сероводорода (NaHS) вызывала повышение их устойчивости к повреждающему прогреву (10 мин при 45°С). При этом под влиянием СК происходило транзиторное увеличение содержания сероводорода в корнях с максимальным эффектом через 2–3 ч после начала обработки. Обработка корней СК вызывала повышение в них активности супероксиддисмутазы (СОД), каталазы и гваяколпероксидазы. Под влиянием донора сероводорода NaHS существенно повышалась активность СОД и каталазы. Также обработка корней проростков СК и NaHS уменьшала вызываемое прогревом накопление продуктов пероксидного окисления липидов. Ингибиторы синтеза сероводорода гидроксиламин и пируват калия частично устраняли вызываемые СК эффекты повышения активности антиоксидантных ферментов и развития теплоустойчивости проростков. В то же время комбинированная обработка 10 мкМ СК и 0.1 мМ NaHS способствовала дополнительному увеличению активности антиоксидантных ферментов и повышению выживаемости проростков после прогрева. Сделано заключение об участии сероводорода как одного из посредников в реализации протекторного влияния СК на проростки пшеницы при тепловом стрессе.
Сероводород (H2S) является одним из газотрансмиттеров, участвующих в регуляции многих функций растительного организма, в первую очередь, адаптации к действию стресс-факторов [1, 2]. Показаны эффекты увеличения его содержания в клетках растений в ответ на действие гипо- и гипертермии, засухи и других стрессоров [3–5]. Имеются также сведения о повышении устойчивости растений к неблагоприятным абиотическим факторам различной природы под влиянием обработки донорами H2S [6–8].
В реализации стресс-протекторного действия H2S принимают участие другие компоненты сигнальной сети, в частности, ионы кальция, активные формы кислорода (АФК) и оксид азота (NO) [1, 4, 9]. В свою очередь получены экспериментальные данные, свидетельствующие о том, что H2S может выступать в роли посредника при передаче сигналов других мессенджеров [4, 10–12] в клетках растений.
В последние годы появляются сведения об участии H2S в трансдукции сигналов фитогормонов. Так, показано, что стресс-протекторное влияние абсцизовой кислоты на растения арабидопсиса при засухе реализуется с участием сероводорода [13]. Индуцирование метилжасмонатом устойчивости растений проса к токсическому действию кадмия зависело от синтеза H2S и угнеталось ингибиторами L-цистеиндесульфгидразы [14].
Одним из фитогормонов, задействованных в формировании устойчивости растений к стрессорам различной природы, является салициловая кислота (СК) [15]. В многочисленных работах показана возможность индуцирования устойчивости растений к стрессовым температурам [16, 17], обезвоживанию [18] и засолению [19] под действием экзогенной СК. Установлена роль как сигнальных посредников (в частности, АФК и NO) [16, 20], так и гормонального комплекса в целом [21] в реализации ее стресс-протекторных эффектов. Однако на участие H2S как посредника физиологического действия СК указывают лишь единичные экспериментальные данные, полученные на проростках кукурузы. В работе [22] установлено, что индуцирование их теплоустойчивости экзогенной СК сопровождалось повышением содержания сероводорода в побегах. С использованием проростков кукурузы также показан синергический эффект активации антиоксидантной системы при совместном действии СК и донора сероводорода гидросульфида натрия (NaHS) [23]. В то же время связь между состоянием антиоксидантной системы и изменением эндогенного содержания H2S при действии на растения СК специально не исследовалась. Не изученной оставалась и возможная роль сероводорода в стресс-протекторном действии СК на корни растений, которые отличаются от других органов большей ''реактивностью'' редокс-гомеостаза при внешних воздействиях [24] и повышенной чувствительностью к тепловому стрессу по сравнению с надземной частью растений [25]. Получение таких сведений представляет интерес для практического использования доноров сигнальных молекул для усиления физиологических эффектов фитогормонов.
Цель работы – изучение возможного участия эндогенного H2S в индуцировании СК антиоксидантной системы корней проростков пшеницы и развитии их теплоустойчивости.
МЕТОДИКА
Объектом исследования служили 4-суточные (на момент начала эксперимента) проростки озимой пшеницы (Triticum aestivum L.) сорта Досконала. Семена после обеззараживания 6%-ным пероксидом водорода в течение 30 мин проращивали при 20°С на очищенной водопроводной воде. Затем проростки соответствующих вариантов переносили на растворы с СК в концентрации от 0.1 до 50 мкМ, NaHS (0.025–1.000 мМ), либо смесь 10 мкМ СК и 0.1 мМ NaHS и инкубировали 24 ч (поступление через корни). Корневую систему проростков отдельных вариантов инкубировали в течение 26 ч на растворах антагонистов H2S (ингибиторов L-цистеиндесульфгидразы [22]) 0.3 мМ гидроксиламина или 0.3 мМ пирувата калия. В вариантах с комбинированным действием на корни СК и этих соединений последние вносили в среду инкубации за 2 ч до добавления в нее СК. Концентрации гидроксиламина и пирувата калия, в наибольшей степени модифицирующие изучаемые эффекты СК, но не оказывающие на проростки видимого токсического влияния, были выбраны на основании предварительных опытов (результаты не приведены).
По окончании инкубации проростки подвергали повреждающему прогреву в водяном ультратермостате при 45°С в течение 10 мин. После прогрева проростки всех вариантов переносили на очищенную водопроводную воду. Часть из них инкубировали на свету (6000 лк, фотопериод 12 ч света/12 ч темноты) в течение 3 сут и определяли их выживаемость.
Содержание H2S в корнях проростков определяли в динамике в течение 24 ч инкубации в растворе СК. Активность антиоксидантных ферментов в корнях анализировали по окончании 24–26-часовой инкубации в растворах исследуемых соединений и через 2 ч после повреждающего прогрева, содержание продукта пероксидного окисления липидов (ПОЛ) малонового диальдегида (МДА) – через 24 ч после прогрева. Как было установлено в предварительных опытах, именно через такие временные интервалы проявлялись наибольшие различия изучаемых показателей между вариантами.
Содержание H2S в корнях определяли по реакции с 5,5'-дитиобис-2-нитробензойной кислотой (ДТНБК) [26]. Для этого корни гомогенизировали при температуре ≈0°С и полном погружении в реакционную смесь, содержащую 0.4 мМ ДТНБК, 0.15 М К, Na-фосфатный буфер, pH 7.0, и 10 мМ ЭДТА. Гомогенат центрифугировали на холоде при 10000 g в течение 15 мин на центрифуге MPW 350R (“MedInstruments”, Польша). Оптическую плотность супернатанта определяли при 412 нм на спектрофотометре СФ-46 (“ЛОМО”, Россия). В качестве стандарта использовали растворы NaHS.
Активность антиоксидантных ферментов супероксиддисмутазы (СОД, КФ 1.15.1.1), каталазы (КФ 1.11.1.6) и гваяколпероксидазы (КФ 1.11.1.7) определяли по методикам, описанным ранее [8, 16]. Корни гомогенизировали в 0.15 М K, Na-фосфатном буфере, pH 7.6, содержавшем 0.1 мМ ЭДТА и 1 мМ дитиотреитол на холоде. Для анализа использовали супернатант, полученный после центрифугирования гомогената при 8000 g в течение 10 мин при температуре не выше 4°С. Активность СОД определяли методом, основанным на способности фермента конкурировать с нитросиним тетразолием за супероксидные анион-радикалы, образующиеся вследствие аэробного взаимодействия НАДH и феназинметосульфата. Активность каталазы оценивали по количеству пероксида водорода, разложившегося за единицу времени. Активность гваяколпероксидазы определяли, используя в качестве донора водорода гваякол, а в качестве субстрата – пероксид водорода. Активность СОД и гваяколпероксидазы выражали в усл. ед./(г сырой массы × мин), активность каталазы – в ммоль H2O2/(г сырой массы × мин).
Для определения продуктов ПОЛ, реагирующих с 2-тиобарбитуровой кислотой (преимущественно МДА), растительный материал гомогенизировали в реакционной среде, содержащей 0.25%-ную 2-тиобарбитуровую кислоту в 10%‑ной ТХУ, гомогенат помещали на кипящую водяную баню на 30 мин. Затем пробы резко охлаждали и центрифугировали 15 мин при 10000 g. В супернатанте определяли продукты ПОЛ, реагирующие с 2-тиобарбитуровой кислотой (в основном МДА), измеряя оптическую плотность при длинах волн 532 нм (максимум светопоглощения МДА) и 600 нм (для поправки на неспецифическое светопоглощение) [27]. Содержание МДА выражали в нмоль/г сырой массы.
Опыты проводили в 3–4 кратной биологической повторности и каждый опыт воспроизводили независимо 3 раза. На рисунках приведены средние величины и их стандартные ошибки. Кроме отдельно оговоренных случаев обсуждались различия, достоверные при P ≤ 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Инкубация проростков в течение 1 сут на среде с добавлением СК вызывала повышение их устойчивости к повреждающему прогреву (рис. 1а). Наиболее заметный эффект проявлялся при использовании 1 и 10 мкМ СК.
Рис. 1.
Влияние СК (а) и NaHS (б) на теплоустойчивость проростков пшеницы (% выживших после 10 мин прогрева при 46°C).
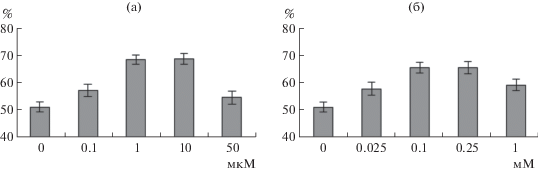
Обработка проростков растворами донора сероводорода, NaHS, также способствовала повышению их теплоустойчивости (рис. 1б). Набольшее защитное действие отмечали при использовании растворов 0.1 и 0.25 мМ NaHS.
При инкубации корней проростков пшеницы в растворе с добавлением 10 мкМ СК в них происходило транзиторное увеличение содержания H2S (рис. 2). Тенденция к такому эффекту проявлялась уже через 1 ч инкубации, а через 2–3 ч отмечалось максимальное (приблизительно на 45%) повышение содержания H2S в корнях, которое затем уменьшалось. К 24 ч наблюдений содержание H2S в корнях проростков, обработанных СК, снижалось до уровня контроля (рис. 2).
Рис. 2.
Динамика содержания сероводорода в корнях проростков пшеницы при обработке СК. 1 – контроль; 2 – СК (10 мкМ).
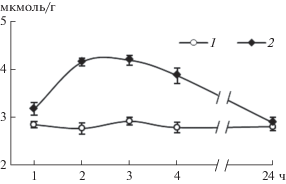
Таким образом, временное повышение содержания H2S в корнях проростков пшеницы указывало на его возможное участие в реализации действия СК.
Обработка проростков 0.3 мМ гидроксиламином, который является ингибитором ключевого фермента синтеза сероводорода L-цистеиндесульфгидразы, снижала их выживание после повреждающего прогрева (рис. 3). При этом другой ингибитор этого фермента пируват калия в такой же концентрации почти не оказывал влияние на выживание проростков после теплового стресса. В то же время оба ингибитора практически полностью устраняли положительное действие СК на теплоустойчивость проростков. При комбинированном действии 100 мкМ NaHS и 10 мкМ СК выживание проростков после стресса оказалось заметно выше, чем при обработке проростков этими соединениями по отдельности.
Рис. 3.
Теплоустойчивость проростков пшеницы (% выживших после 10 мин прогрева при 46°C) при воздействии СК, NaHS, антагонистов сероводорода и комбинаций указанных соединений. 1 – контроль; 2 – СК (10 мкМ); 3 – NaHS (0.1 мМ); 4 – гидроксиламин (0.3 мМ); 5 – пируват калия (0.3 мМ); 6 – СК (10 мкМ) + гидроксиламин (0.3 мМ); 7 – СК (10 мкМ) + + пируват калия (0.3 мМ); 8 – СК (10 мкМ) + NaHS (0.1 мМ).

Одной из протекторных систем, задействованных в салицилат-индуцированном повышении теплоустойчивости проростков, может быть антиоксидантная система. Под влиянием СК в корнях проростков в отсутствие стрессового воздействия повышалась активность одного из важнейших антиоксидантных ферментов СОД (рис. 4а). Под действием обоих ингибиторов синтеза сероводорода отмечалось небольшое снижение активности фермента. При комбинированной обработке этими ингибиторами совместно с СК влияние последней на активность СОД почти не проявлялось. В то же время при сочетании обработки СК с действием донора H2S активность СОД была несколько выше, чем в вариантах только с СК или NaHS.
Рис. 4.
Активность СОД (а), каталазы (б) и гваяколпероксидазы (в) в корнях проростков пшеницы при воздействии СК, NaHS, антагонистов сероводорода и комбинаций указанных соединений. I – до стрессового воздействия; II – через 2 ч после 10 мин прогрева при 46°C. 1 – контроль; 2 – СК (10 мкМ); 3 – NaHS (0.1 мМ); 4 – гидроксиламин (0.3 мМ); 5 – пируват калия (0.3 мМ); 6 – СК (10 мкМ) + гидроксиламин (0.3 мМ); 7 – СК (10 мкМ) + пируват калия (0.3 мМ); 8 – СК (10 мкМ) + NaHS (0.1 мМ).

Через 2 ч после повреждающего прогрева активность СОД в контрольном варианте увеличивалась, но не значительно. Более существенно ее активность повышалась в ответ на действие высокой температуры после обработки СК и донором H2S (рис. 4а). В корнях проростков, обработанных пируватом калия, активность СОД после прогрева не изменялась, а после воздействия гидроксиламина – несколько увеличивалась. При комбинированной обработке проростков СК и ингибиторами синтеза H2S после теплового стресса активность СОД увеличивалась, однако этот эффект был достоверным только при P ≤ 0.1. При этом абсолютные значения активности фермента были ниже, чем при воздействии только СК, что позволило предположить участие H2S в реализации влияния СК на активность СОД. Примечательно, что в корнях проростков, обработанных комбинацией СК и донора H2S, активность СОД после теплового стресса не повышалась. Можно предположить, что повышенная активность этого и других антиоксидантных ферментов после обработки комбинацией СК и донора H2S была достаточной для антиоксидантной защиты в стрессовых условиях.
Под влиянием СК и донора H2S активность каталазы в корнях увеличивалась (рис. 4б). Обработка ингибиторами синтеза H2S сама по себе существенно не влияла на активность фермента. При этом оба ингибитора полностью устраняли эффект повышения активности каталазы, вызываемый СК, что свидетельствовало в пользу предположения о роли H2S в салицилатиндуцируемом изменении активности фермента. При комбинированной обработке проростков СК и донором сероводорода активность фермента достоверно превышала значения, которые наблюдались после обработки только с СК или только NaHS (рис. 4б).
После прогрева активность каталазы в контроле существенно не изменялась, а в варианте с СК она повышалась. В то же время в корнях проростков, обработанных донором сероводорода, активность каталазы незначительно снижалась (рис. 4б). При воздействии гидроксиламина или пирувата калия активность фермента в корнях после прогрева немного увеличивалась, однако этот эффект не был достоверным при P ≤ 0.05. При комбинированной обработке проростков ингибиторами L-цистеиндесульфгидразы и СК активность фермента в корнях в ответ на гипертермию несколько увеличивалась, однако абсолютные ее значения были заметно ниже, чем при обработке только СК, что указывало на участие H2S в реализации эффектов СК (рис. 4б). В варианте с комбинацией СК и донора сероводорода активность каталазы после теплового стресса существенно не изменялась, при этом ее абсолютные величины заметно превышали соответствующие значения в контроле и после воздействия только NaHS.
Обработка СК вызывала некоторое повышение активности гваяколпероксидазы в корнях (рис. 4в). При их обработке донором H2S отмечалась только тенденция к небольшому повышению активности фермента. При воздействии на корни гидроксиламина активность гваяколпероксидазы немного снижалась, а при обработке пируватом калия не изменялась. При комбинированной обработке проростков СК и ингибиторами синтеза H2S активность фермента практически не отличалась от величин контроля.
Таким образом, эти ингибиторы устраняли повышение активности гваяколпероксидазы, вызываемое СК. При комбинированном действии СК и донора H2S активность гваяколпероксидазы в корнях не отличалась от величин в варианте с воздействием только СК (рис. 4в).
После теплового стресса активность гваяколпероксидазы во всех вариантах опыта изменялась незначительно. Заметным было лишь ее снижение после обработки проростков гидроксиламином (рис. 4в).
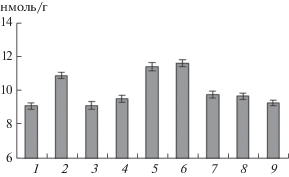
Через 1 сут после воздействия теплового стресса в корнях контрольных и обработанных ингибиторами синтеза H2S проростков наблюдалось повышение содержания МДА, продукта ПОЛ (рис. 5). Обработка проростков СК и NaHS, а также их комбинацией практически полностью устраняла этот эффект. Таким образом, СК и донор H2S смягчали проявление окислительного стресса, вызываемого гипертермией. Ингибиторы синтеза H2S уменьшали защитный эффект СК, но не устраняли его полностью (рис. 5).
Рис. 5.
Содержание МДА в корнях проростков пшеницы, обработанных СК, NaHS, антагонистами сероводорода и комбинациями указанных соединений, через 24 ч после 10 мин прогрева при 46°C. 1 – контроль (без прогрева); 2 – прогрев; 3 – прогрев + СК (10 мкМ); 4 – прогрев + NaHS (0.1 мМ); 5 – прогрев + + гидроксиламин (0.3 мМ); 6 – прогрев + пируват калия (0.3 мМ); 7 – прогрев + СК (10 мкМ) + гидроксиламин (0.3 мМ); 8 – прогрев + СК (10 мкМ) + пируват калия (0.3 мМ); 9 – прогрев + СК (10 мкМ) + + NaHS (0.1 мМ).
В целом полученные результаты указывали на участие сероводорода в реализации влияния СК на устойчивость проростков пшеницы к гипертермии. Об этом, в частности, свидетельствовало транзиторное увеличение его содержания в корнях (рис. 2). Следует отметить, что эффекты действия СК, зарегистрированные в корнях пшеницы, несколько отличались от тех, которые описаны для побегов кукурузы [22]. В цитируемой работе при обработке СК наблюдалось не транзиторное, а монотонное увеличение содержания H2S. Возможно, это связано с особенностями различных органов проростков. Известно, что для клеток корней свойственна более высокая степень изменений многих биохимических показателей по сравнению с клетками надземных органов [24, 25]. Следует отметить, что в целом для соединений, выполняющих сигнальные функции, в том числе газотрансмиттеров, характерно в основном транзиторное изменение их содержания в клетках в ответ на те или иные воздействия [4].
Аргументом в пользу участия H2S в реализации стресс-протекторного действия СК является и устранение ее положительного влияния на теплоустойчивость проростков пшеницы двумя различными ингибиторами L-цистеиндесульфгидразы – основного фермента синтеза сероводорода (рис. 3). Эти результаты полностью согласовывались с данными, полученными в работе Ли и соавт. для проростков кукурузы [22].
К одной из защитных систем, индуцируемых обработкой проростков СК, относится ферментативная антиоксидантная система (рис. 4). Вероятно, в реализации этого эффекта задействован и H2S. В пользу такого предположения свидетельствовало нивелирование после обработки ингибиторами его синтеза повышения активности СОД, каталазы и гваяколпероксидазы в корнях, вызываемого СК. Для СОД и каталазы такой эффект отмечался в корнях проростков и после теплового стресса (рис. 4).
При комбинированном действии СК и донора H2S наблюдалось дополнительное увеличение активности каталазы и тенденция к этому для активности СОД. В то же время после стрессового воздействия активность СОД и гваяколпероксидазы в корнях, обработанных комбинацией СК и NaHS, была ниже, чем при воздействии только СК. Можно предположить, что это связано с активацией других компонентов протекторных систем под влиянием H2S и меньшей “нагрузкой” на ферментативные составляющие антиоксидантной системы. Известно, что при действии H2S у растений может усиливаться функционирование аскорбат-глутатионового цикла, что приводит к повышению содержания аскорбата и восстановленного глутатиона [28]. Получены также сведения об усилении при влиянии H2S накопления у растений различных низкомолекулярных соединений, обладающих антиоксидантными свойствами: антоцианов, пролина, глицин-бетаина и трегалозы [7, 29]. Следует отметить, что при исследовании комбинированного влияния СК и NaHS на активность антиоксидантных ферментов в побегах проростков кукурузы обнаружен более заметный синергический эффект [23], чем в корнях проростков пшеницы, наблюдаемый в настоящей работе. Это может быть связано как с особенностями различных органов, так и с различиями в экспериментальных условиях.
В целом есть основания утверждать, что индуцирование теплоустойчивости проростков пшеницы как СК, так и донором сероводорода сопряжено с активацией антиоксидантной системы. Об этом свидетельствует и устранение при обработке проростков этими соединениями накопления МДА, вызываемого тепловым стрессом (рис. 5). При этом положительное влияние СК частично снималось ингибиторами синтеза сероводорода. Не полное устранение физиологических эффектов СК ингибиторами синтеза H2S может указывать на наличие путей салицилатного сигналинга, независимых от сероводорода. Для выяснения их вклада в реализацию эффектов СК целесообразны специальные исследования.
Стресс-протекторное действие как СК, так и сероводорода, может быть связано с активацией не только антиоксидантной, но и других защитных систем. Так, известно, что СК способна индуцировать синтез дегидринов [21]. Действие экзогенного H2S, индуцирующее развитие теплоустойчивости растений земляники, сопровождалось усилением экспрессии генов БТШ 90, БТШ 80, БТШ 70, а также аквапоринов в корнях [28].
Таким образом, полученные результаты дают основания полагать, что сероводород участвует в процессе индуцирования теплоустойчивости проростков пшеницы экзогенной СК. Вероятно, что эти эффекты реализуются в тесной функциональной связи с другими сигнальными посредниками, в частности, с АФК и оксидом азота, количество которых в растительных клетках также изменяется при действии СК [4, 16, 30]. Характер такого взаимодействия H2S с другими компонентами сигнальной сети при реализации физиологических эффектов СК может стать предметом дальнейших исследований. В свою очередь комбинированное воздействие на растения СК и доноров H2S может быть перспективным приемом индуцирования их устойчивости к гипертермии и другим стресс-факторам.
Список литературы
Li Z.-G., Min X., Zhou Z.-H. // Front. Plant Sci. 2016. V. 7. 1621. https://doi.org/10.3389/fpls.2016.01621
Singh S., Kumar V., Kapoor D., Kumar S., Singh S., Dhanjal D.S., Datta S., Samuel J., Dey P., Wang S., Prasad R., Singh J. // Physiol. Plant. 2020. V. 168. № 2. P. 301–317.
Chen X., Chen Q., Zhang X., Li R., Jia Y., Ef A.A., Jia A., Hu L., Hu X. // Plant Physiol. Biochem. 2016. V. 104. P. 174–179.
Kolupaev Yu.E., Karpets Yu.V., Beschasniy S.P., Dmitriev A.P. // Cytol. Genet. 2019. V. 53. № 5. P. 392–406.
Liu Z., Li Y., Cao C., Liang S., Ma Y., Liu X., Pei Y. The role of H2S in low temperature-induced cucurbitacin C increases in cucumber // Plant Mol. Biol. 2019. V. 99. № 6. P. 535–544.
Shi H., Ye T., Chan Z. // Plant Physiol. Biochem. 2014. V. 74. P. 99–107.
Chen J., Shang Y.T., Wang W.H., Chen X.Y., He E.M., Zheng H.L., Shangguan Z. // Front. Plant Sci. 2016. V. 7. 1173. https://doi.org/10.3389/fpls.2016.01173
Колупаев Ю.Е., Фирсова Е.Н., Ястреб Т.О., Луговая А.А. // Прикл. биохимия и микробиология. 2017. Т. 53. № 5. С. 502–509.
Fang H., Liu Z., Long Y., Liang Y., Jin Z., Zhang L., Liu D., Li H., Zhai J., Pei Y. // Plant J. 2017. V. 91. № 6. P. 1038–1050.
Li Z.-G., Gong M., Liu P. // Acta Physiol. Plant. 2012. V. 34. № 6. P. 2207–2213.
Ma Y., Zhang W., Niu J., Ren Y., Zhang F. // Funct. Plant Biol. 2019. V. 46. № 2. P. 136–145.
Li Z.G., Yang S.Z., Long W.B., Yang G.X., Shen Z.Z. // Plant Cell Environ. 2013. V. 36. № 8. P. 1564–1572.
Shi H., Ye T., Han N., Bian H., Liu X., Chan Z. // J. Integr. Plant Biol. 2015. V. 57. № 7. P. 628–640.
Tian B., Zhang Y., Jin Z., Liu Z., Pei Y. // Front. Biosci. (Landmark). 2017. V. 22. P. 530–538.
Shakirova F.M., Bezrukova M.V., Maslennikova D.R. // Salicylic Acid / Eds. S. Hayat, A. Ahmad, M.N. Alyemeni. Dordrecht: Springer Science + Business Media, 2013. P. 119–140.
Колупаев Ю.Е., Ястреб Т.О., Швиденко Н.В., Карпец Ю.В. // Прикл. биохимия и микробиология. 2012. Т. 48. № 5. С. 550–556.
Esim N., Atici Ö. // Front. Life Sci. 2015. V. 8. № 2. P. 124–130.
Alavi S.M.N., Arvin M.J., Kalantari K.M. // J. Plant Interact. 2014. V. 9. № 1. P. 683–688.
Сахабутдинова А.Р., Фатхутдинова Д.Р., Шакирова Ф.М. // Прикл. биохимия и микробиология. 2004. Т. 40. № 5. С. 579–583.
Tewari R.K., Paek K.Y. // J. Plant Growth Regul. 2011. V. 30. № 4. P. 396–404.
Shakirova F.M., Allagulova Ch.R., Maslennikova D.R., Klyuchnikova E.O., Avalbaev A.M., Bezrukova M.V. // Environ. Exp. Bot. 2016. V. 122. P. 19–28.
Li Z.-G., Xie L.-R., Li X.-J. // J. Plant Physiol. 2015. V. 177. P. 121–127. https://doi.org/10.1016/j.jplph.2014.12.018
Li Z.-G. // Plant Signal. Behav. 2015. V. 10. № 9. e1051278. https://doi.org/10.1080/15592324.2015.1051278
Часов А.В., Минибаева Ф.В. // Физиология растений. 2014. Т. 61. № 5. С. 668–675.
Колупаев Ю.Е., Обозный А.И., Швиденко Н.В. // Физиология растений. 2013. Т. 60. № 2. С. 221–229.
Li Z.-G., Luo L.-J., Zhu L.-P. // Bot. Stud. 2014. V. 55. 20. https://doi.org/10.1186/1999-3110-55-20
Фазлиева Э.Р., Киселева И.С., Жуйкова Т.В. // Физиология растений. 2012. Т. 59. № 3. С. 369–375.
Christou A., Manganaris G.A., Papadopoulos I., Fotopoulos V. // J. Exp. Bot. 2013. V. 64. № 7. P. 1953–1966.
Колупаев Ю.Е., Горелова Е.И., Ястреб Т.О., Рябчун Н.И., Кириченко В.В. // Физиология растений. 2019. Т. 66. № 4. С. 277–285.
Corpas F.J., González-Gordo S., Canas A., Palma J.M. // J. Exp. Bot. 2019. V. 70. № 17. P. 4391–4404.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


