Прикладная биохимия и микробиология, 2020, T. 56, № 4, стр. 373-382
Конверсия соевого фитостерина в андроста-4,9(11)-диен-3,17-дион
Т. С. Савинова 1, *, Д. В. Довбня 2, С. М. Хомутов 2, А. В. Казанцев 1, Л. Д. Ху 3, Н. В. Лукашев 1, М. В. Донова 2
1 Московский государственный университет им. М.В. Ломоносова, химический факультет
119991 Москва, Россия
2 Институт биохимии и физиологии микроорганизмов РАН
142290 Московская область, Пущино, Россия
3 Институт химии Вьетнамской академии наук и технологии
А18 Ханой, Вьетнам
* E-mail: tatiana_savinova@rambler.ru
Поступила в редакцию 08.11.2019
После доработки 10.12.2019
Принята к публикации 23.12.2019
Аннотация
Разработан метод получения андроста-9(11)-диен-3,17-диона (Δ9(11)-AД), представляющий собой комбинацию микробного окисления боковой цепи фитостерина с одновременным 9α-гидроксилированием и последующей химической региоселективной дегидратацией образованного 9α–гидрокси-3,17-дикето-интермедиата без его выделения и очистки. В процессе культивирования штамма Mycobacterium sp. ВКМ Ac-1817D дикого типа фитостерин трансформировался в 9α-гидроксиандрост-4-ен-3,17-дион (9-ОН-АД). Продукт экстрагировали из культуральной жидкости органическим растворителем и дегидратировали в экстракте минеральной кислотой. Образованный Δ9(11)-AД очищали с использованием метода селективной кристаллизации. Минорные продукты выделены и идентифицированы. Показана способность штамма трансформировать стерины с образованием метилового эфира 9α-гидроксипрегн-4-ен-3-он-20-карбоновой кислоты. Предлагаемый подход позволил упростить технологическую схему получения целевого соединения и не только исключить потери 9-ОН-АД, но и минимизировать количество отходов.
Фитостерины – растительные стерины – производятся в промышленности из масличного растительного сырья (соя, рапс и др.) при очистке растительных масел или отходов целлюлозно-бумажной промышленности [1]. В настоящее время фитостерины являются дешевым и доступным исходным материалом для производства различных терапевтических стероидов [2]. Обычно коммерчески доступный фитостерин представляет собой смесь нескольких стеринов, в основном β‑ситостерина, стигмастерина, кампестерина и брассикастерина, содержащих в молекулярной структуре 3β-гидроксильную группу и 5,6-двойную связь (рис.1). Схемы получения терапевтических стероидов включают микробиологическую конверсию фитостеринов в ключевые интермедиаты, такие как андрост-4-ен-3,17-дион (АД), его 1-дегидро-аналог (АДД) и 9α-гидроксилированное производное (9-ОН-АД) [3–5].
Рис. 1.
Синтез Δ9(11)-AД (3) из стеринов через образование 9-ОН-AД (2): R = C2H5 – β-ситостерин; R = CH3 – кампестерин; R = C2H5 и ∆22(23) – стигмастерин, R = CH3 и ∆22(23) – брассикастерин.
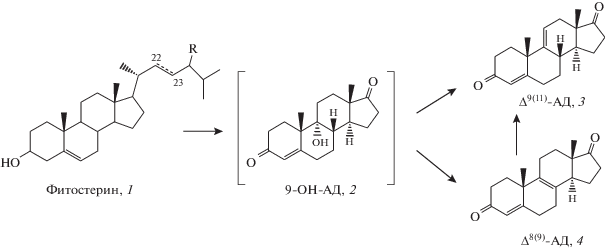
Известно несколько подходов к получению 9-OH-AД из фитостеринов. Один из них включает микробиологическое окисление фитостеринов до АД, его выделение, кристаллизацию и последующее гидроксилирование в положение C9α [6–9]. Способностью к 9α-гидроксилированию АД обладают бактерии и грибы, относящиеся к родам Corynebacterium, Corinespora, Mycobacterium, Nocardia, Rhodococcus, Cunninghamella и Neurospora [10, 11]. Другим подходом к получению 9-ОН-АД является двухстадийная биоконверсия, включающая микробное окисление фитостеринов до AД и последующее его гидроксилирование в положение С9α без извлечения АД из ферментационной среды и кристаллизации с последовательным использованием штаммов Mycobacterium neoaurum и Rhodococcus erythropolis [12].
Экономически наиболее целесообразным в синтезе 9-ОН-АД из фитостеринов является подход, основанный на использовании штаммов актинобактерий, способных в одностадийной биоконверсии накапливать 9-OH-AД в качестве основного продукта. Ранее сообщалось, что некоторые штаммы микобактерий, полученные методом мутагенеза, конвертировали β-ситостерин в 9-OH-AД [13, 14 ] . Однако не меньший интерес представляют природные штаммы, обладающие способностью к селективному образованию и накоплению 9-OH-AД в процессе катаболической модификации фитостеринов. Одним из таких штаммов является сапротрофный быстро растущий выделенный из почвы непатогенный штамм Mycobacterium sp. ВКМ Ac-1817D, способный отщеплять боковую цепь при С17 и вводить гидроксильную группу в положение С9 стерина с образованием 9-OH-AД в качестве основного продукта [15–17]. Было проведено полное геномное профилирование штамма Mycobacterium sp. ВКМ Ac-1817D и найдено, что штамм обладает множеством генов, кодирующих ферменты катаболизма стеринов, в том числе окислительной деструкции боковой цепи, разрушения стероидного ядра и транспорта стероидов [18]. Полная последовательность генома, необходимая для осуществления генетических манипуляций с целью создания новых стерин-трансформирующих биокатализаторов, была депонирована в GenBank под регистрационным номером CP009914 [19]. Таким образом, штамм Mycobacterium sp. ВКМ Ac-1817D является перспективным объектом для создания на его основе новых промышленных штаммов.
Мультистадийные синтезы субстанций стероидных лекарственных средств из 9-ОН-AД часто включают комбинацию химических и биотехнологических стадий. При этом, как правило, на первом этапе проводят региоселективную дегидратацию 9α-гидроксильной группы с образованием андроста-4,9(11)-диен-3,17-диона (Δ9(11)-AД). 9,11-Двойная связь обеспечивает бόльшую стабильность стероидной молекулы по сравнению с 9α-гидроксильной группой в условиях дальнейшей структурной модификации 17-кетогруппы, которая необходима при построении прегнановой цепи. Такой подход помогает предотвратить возможные перегруппировки с участием третичной гидроксильной группы при С9 и, в частности, модификацию кольца А молекулы стероида [20]. Так, получение Δ9(11)-AД из 9-OH-AД было проведено на первой стадии в синтезах Δ9(11)-прекурсоров 11β-гидроксилированных кортикостероидов (например, гидрокортизона и преднизолона [21–23]), а также других ключевых интермедиатов коммерчески важных кортикостероидов, молекулярная структура которых содержит атом галогена в положении C9α, например, дексаметазона, триамцинолона, бетаметазона и др. [24–27]. В синтезе андрогенного средства флюоксиместерона из 11α-OH-AД [28] последний также сначала превращали в Δ9(11)-AД.
Следует отметить, что эффективность технологии микробного производства ключевых стероидных интермедиатов зависит не только от активности штамма, селективности процесса и ряда других факторов, но и, в не меньшей степени, от эффективности методов выделения и очистки целевого продукта.
Цель работы – создание эффективной комбинированной схемы получения Δ9(11)-AД из соевого фитостерина, включающей биоконверсию фитостерина в 9-ОН-АД культурой Mycobacterium sp. ВКМ Ac-1817D и региоселективную дегидратацию 9α-гидроксильной группы молекулы 9-OH-AД в органическом экстракте ферментационной жидкости без выделения и очистки его кристаллов.
МЕТОДИКА
Использованные реактивы. Соевый фитостерин (“Jiangsu Spring Fruit Biological Products Co.”, Китай) в соответствии с сертификатом производителя содержал: трансформируемые стерины – 95.5%, в том числе (%): β-ситостерин – 42.4; кампестерин – 23.5; стигмастерин – 26.1; брассикастерин – 3.5.
9-OH-AД (CAS No. 560-62-3, С19Н26О3, M.м. 302.41) 99.3%-ного содержания (ВЭЖХ, 1H-ЯМР) и 9α-гидроксипрегн-4-ен-3-он-20-карбоновая кислота (синоним 9α-гидрокси-3-кето-23,24-биснорхол-4-ен-22-овая кислота, 9-ОН-БНК) 95%-ного содержания были получены в лаборатории микробиологической трансформации органических соединений ИБФМ РАН (Россия). AД (CAS No. 63-05-8, С19Н26О2, M.м. 286.41), AДД (CAS No. 897-06-3, С19Н24О2, M.м. 284.39) и Δ9(11)-AД (CAS 1035-69-4, С19Н24О2, M.м. 284.39) производства “Steraloids Inc.” (США) были использованы в качестве аналитических стандартов.
Агар, дрожжевой экстракт (тип Д) и органические растворители для ВЭЖХ (LC-MS или Supergradient grade) – “Panreac” (Испания), очищенная вода для ВЭЖХ “MilliQ ultrapure water” (“Merck Millipore KGaA”, Германия). Реагенты для стадии дегидратации были производства “Sigma-Aldrich Co.” (США). Органические растворители для экстракции стероидов, компоненты питательных сред и другие материалы – “Экос-1” (Россия). Для мониторинга процесса дегидратации и препаративной ТСХ были использованы пластинки Silica gel 60 F254, (“Merck KGaA”, Германия).
Микроорганизм и условия его культивирования. Быстро растущий непатогенный штамм Mycobacterium sp. ВКМ Ac-1817D (по современной классификации Mycolicibacterium sp.) был получен из Всероссийской коллекции микроорганизмов (ВKM ИБФМ РАН). Культуру поддерживали на скошенном агаре, посевную культуру выращивали в качалочных колбах емкостью 750 мл на питательной среде с глицерином и дрожжевым экстрактом, как было описано ранее [14].
Биоконверсия фитостерина. Биотрансформацию фитостерина проводили аэробно на орбитальной качалке при 220 об./мин и температуре 30°C в качалочных колбах на 750 мл со 100 мл конверсионной среды следующего состава (г/л дистиллированной воды): KH2PO4 – 0.8; K2HPO4 ⋅ · 3H2O – 4.2; (NH4)2SO4 – 3.0; глицерин – 5.0; карбамид – 0.13; MgSO4 ⋅ 7H2O – 0.2; FeSO4 ⋅ · 7H2O – 0.01; ZnSO4 ⋅ 7H2O – 0.002; твин-80 – 1.0; фитостерин – 5.0 (в расчете на сумму трансформируемых стеринов); pH 7.2.
По окончании стерилизации среды в автоклаве фитостерин гомогенизировали с помощью ультразвука (42 кГц, 100 Вт) в течение 2 мин. Биоконверсию начинали с внесения посевной культуры (10% по об.). Пробы культуральной жидкости (КЖ) отбирали каждые 12 ч, содержание 9-ОН-АД и фитостерина контролировали с помощью ВЭЖХ. Для препаративной дегидратации 9-OH-АД биотрансформацию проводили в 10 колбах и останавливали после 60 ч инкубации, когда глубина конверсии фитостерина достигала ~80%, а селективность образования 9-OH-AД ~55% (в расчете на конвертированный фитостерин).
Получение экстракта. После завершения биоконверсии из КЖ (~980 мл, рН 6.5–6.7), содержащей клетки микобактерий и остаточный субстрат, экстрагировали 9-ОН-АД толуолом трижды по 0.5 л. Экстракт, содержащий 9-OH-AД, промывали дважды по 100 мл 5%-ного водного раствора NaHCO3 для удаления 9-ОН-БНК и дистиллированной водой до рН 7.0. Затем экстракт, содержащий 1.59 г 9-OH-AД по данным ВЭЖХ анализа, концентрировали в вакууме до объема ~300 мл и далее использовали в реакции дегидратации без выделения кристаллического продукта.
Дегидратация. Толуольный экстракт (~300 мл), содержащий 1.59 г (5.258 ммоль) 9-OH-AД, помещали в колбу с насадкой Дина Старка и добавляли 0.57 мл 85%-ной H3PO4 из расчета ~1.6 моль на 1 моль 9-OH-AД. Реакционную массу нагревали до кипения. Отгоняемую воду собирали в насадке. Реакция завершалась через 5 мин после начала кипения. Окончание реакции контролировали методом ТСХ. Затем реакционную смесь охлаждали до комнатной температуры и добавляли 5%-ный водный раствор NaCl в количестве, равном 1/2 об. реакционной массы. Органическую фазу отделяли, а водный слой экстрагировали толуолом. Объединенную органическую фазу промывали 5%-ным водным раствором NaCl до нейтральной реакции и водой, а затем сушили над Na2SO4, растворитель упаривали в вакууме досуха. Содержание Δ9(11)-AД и остаточного количества 9-OH-AД в сухом остатке после упаривания (2.11 г) определяли с помощью ВЭЖХ анализа. Согласно ВЭЖХ анализу содержание Δ9(11)-AД составляло 1.477 г (селективность 98.8%), при этом сухой остаток не содержал 9-OH-AД.
Очистка ∆9(11)-AД. Сухой остаток, полученный после упаривания растворителя (2.11 г) и содержащий ∆9(11)-AД (70% основного вещества согласно ВЭЖХ или 1.477 г в 100% исчислении) растворяли в 80 мл ацетона, раствор осветляли активированным углем (10% от веса стероида), уголь отфильтровывали, промывали на фильтре ацетоном. Затем к фильтрату (84 мл) медленно добавляли 56 мл дистиллированной воды в объемном соотношении 3 : 2 (раствор-вода). Суспензию перемешивали в течение 30 мин при комнатной температуре. Осадок, содержащий стерины и побочные продукты, отфильтровывали и промывали на фильтре 60%-ным водным (об./об.) ацетоном. Фильтрат упаривали в вакууме для удаления ацетона. Суспензию охлаждали до 8–10°С, осадок ∆9(11)-AД отделяли фильтрацией и промывали дистиллированной водой. После сушки получали 1.457 г целевого продукта ∆9(11)-AД в виде почти белого кристаллического порошка с температурой плавления (Тпл) 203.5–206.5°C (Тпл 201–204.5°С [29]) и выходом 97.46%, при рассчете на 9-ОН-АД.
Спектр ЯМР 1H (400 МГц, CDCl3): выбранные сигналы, δ, м.д.: 5,75 (д, J = 1.8 Гц, 1H, 4-CH); 5.55 (м, 1H, 11-CH); 1.35 (с, 3H, 19-CH3); 0.87 (с, 3H, 18-CH3).
Спектр ЯМР 13C (100.6 МГц, CDCl3): δ, м.д.: 221.0 (17-C(O)); 199.0 (3-C(O)); 168.9 (5-C); 145.1 (9-C); 124.2 (4-CH); 118.1 (11-CH); 48.0; 45.8; 41.1 36.8; 36.2; 34.2; 33.8; 33.4; 32.6; 31.1; 26.2; 22.6; 13.9 (19-СН3).
Содержание основного вещества (Δ9(11)-AД) и примеси Δ8(9)–изомера в продукте определяли с помощью ВЭЖХ анализа. Продукт содержал 97.38% Δ9(11)-АД, 0.86% Δ8(9)-АД и 0.69% АД.
Разделение смеси стеринов и побочных продуктов. Влажный осадок, полученный после фильтрации раствора ∆9(11)-AД в 60%-ном водном ацетоне и содержащий стерины и побочные продукты, сушили до постоянного веса. К сухому остатку (0.65 г) добавляли 10 мл метанола, суспензию кипятили в течение 10 мин при перемешивании, затем через холодильник медленно добавляли 3 мл воды и кипятили еще в течение 10 мин. Реакционную массу медленно охлаждали до комнатной температуры, выдерживали 30 мин без перемешивания, осадок отфильтровывали и промывали на фильтре водным метанолом в соотношении вода–метанол 10 : 3 (об./об.). Получили 0.49 г фитостерина (содержание трансформируемых стеринов 93.7% суммарно).
Метанольно-водный маточный раствор, содержащий побочные продукты, упаривали в вакууме. Остаток сушили до постоянного веса. Для разделения смеси использовали препаративную ТСХ. Для этого 151 мг сухого остатка растворяли в минимальном количестве смеси дихлорметана и метанола 1 : 1 (об./об.), наносили раствор на пластинки для ТСХ полосой на линии старта и хроматографировали восходящим методом в системе бензол–ацетон 9 : 1 (об./об.). В УФ-свете определяли зоны, соответствующие индивидуальным соединениям. Положение зоны, соответствующей фитостерину, определяли, проявляя контрольную пластинку 1%-ным раствором ванилина в 10%-ном растворе HClO4. Для элюирования индивидуальных соединений использовали смесь дихлорметана и ацетона в соотношении 95 : 5 (об./об.). Элюаты упаривали досуха. При этом получали три мажорных продукта: метиловый эфир прегна-4,9(11)-диен-3-он-20-карбоновой кислоты (МЭ Δ9(11)-БНК) – 117 мг, Rf = 0.625; смесь стеринов – 17 мг, Rf = 0.5; и Δ9(11)-AД – 15 мг, Rf = 0.41. Кроме того, тестостерон (ТС) и Δ9(11)-тестостерон (Δ9(11)-ТС) были идентифицированы как минорные продукты с помощью ЯМР и ВЭЖХ анализа.
МЭ Δ9(11)-БНК кристаллизовали в диэтиловом эфире. После фильтрации и сушки до постоянного веса получили 71 мг аналитически чистого образца в виде почти белого кристаллического порошка с Тпл 196–198°C (Тпл 194–200°C [30]). Масс-спектр: MALDI-TOF: m/z [M + H]+ 357. Вычислено для С23Н32О3 (%): С 77.49, Н 9.05. Найдено (%): С 76.98%, Н 8.96.
Спектр ЯМР 1H (400 МГц, CDCl3): выбранные сигналы, δ, м.д.: 5.73 (1H, д, J 1.4 Гц, H-4), 5.45 (1H, м, H-11), 3.64 (3H, с, OCH3), 1.32 (3H, с, H-19), 1.18 (3H, д, J 6.8 Гц, H-21), 0.66 (3H, с, H-18).
Спектр ЯМР 13C (100.6 МГц, CDCl3): δ, м.д.: 199.2 (C-3), 177.1 (C-22), 169.8 (C-5), 144.6 (C-9), 123.9 (C-4), 118.7 (C-11), 52.8, 52.3, 51.3, 42.4, 41.5, 40.8, 37.3, 34.2, 33.7, 32.8, 32.1, 27.4, 26.1, 25.2, 16.7 (C-21), 11.6 (C-18).
Тонкослойная хроматография (ТСХ). Реакцию дегидратации контролировали с помощью ТСХ на пластинках Silica gel 60 F254 в системе дихлорметан – ацетон (10 : 1, об./об.). Пластинку просматривали в УФ свете (254 нм), затем опрыскивали 1%-ным раствором ванилина в 10%-ном водном растворе HClO4 и проявляли при температуре 100–120°C.
Высокоэффективная жидкостная хроматография (ВЭЖХ). Анализ продуктов биотрансформации проводили на приборе Infinity 1260 (“Agilent”, США), снабженном предколонкой Symmetry C18, 5 мкм, 3.9 мм × 20 мм и колонкой Symmetry C18, 5 мкм, 4.6 мм × 250 мм (“Waters”, США), в следующих условиях: мобильная фаза (об./об.): ацетонитрил – 52, деионизированная вода – 48, уксусная кислота – 0.01; скорость протока 1 мл/мин; температура колонки 50°С. Стероиды детектировали при длине волны 240 нм, для количественного определения использовали метод внешнего стандарта. Содержание минорных сигналов продуктов биотрансформации, для которых отсутствовали стандартные соединения – 9α-гидрокситестостерон (9-OH-ТС) и 9α,21–дигидрокси-20-метилпрегн-4-ен-3-он (синоним 9α,22-дигидрокси-23,24-биснорхол-4-ен-3-он (9,22-OH-БНХ) и др. вычисляли полуколичественно с использованием в качестве внешнего стандарта AД (99% AД, “Bayer HealthCare Pharmaceuticals”, Германия), имеющего 3-кето-4-ен-хромофорную группу, как в большинстве известных продуктов окисления стеринов. Значение времени удерживания Rt для 9-OH-AД составляло 4.27 мин.
Анализ фитостерина осуществляли методом ВЭЖХ в тех же условиях, но с использованием мобильной фазы (об./об.): ацетонитрил – 50, изопропанол – 45, деионизированная вода – 5. Детекцию проводили при длине волны 200 нм. Для количественного определения калибровку сигнала фитостерина строили на основе профиля субстрата биоконверсии без выделения индивидуальных пиков.
Для анализа пробы КЖ разводили 50%-ным водным раствором ацетонитрила 1 : 50 (для анализа продуктов) или 1 : 20 смесью ацетонитрил – 50, изопропанол – 45 (об./об.) и отделяли осадок.
Анализ продуктов дегидратации проводили на том же оборудовании с использованием мобильной фазы (об./об.): ацетонитрил – 40, деионизированная вода – 60, уксусная кислота – 0.01. Стероиды детектировали при длине волны 250 нм. Элюировали со скоростью потока 1 мл/мин при температуре 50°C.
Значения Rt составляли (мин): 9-OH-AД – 6.62; Δ8(9)-AД – 16.55; Δ9(11)-AД – 17.27; АД – 18.4.
ЯМР-спектроскопия. Спектры ЯМР 1Н и ЯМР 13С регистрировали на спектрометре “Bruker Avance 400” (“Bruker”, США) с рабочими частотами 400 МГц для ЯМР 1Н и 100.6 МГц для ЯМР 13С (с полной развязкой протонов). Химические сдвиги измеряли в м.д. относительно сигналов растворителя в качестве внутреннего стандарта (CDCl3, δ 1H: 7.26 м.д., 13C: 77.1 м.д.) и относительно тетраметилсилана (TMС), константы спин-спинового взаимодействия (J) приведены в Гц.
Масс-спектрометрия высокого разрешения. Спектры высокого разрешения регистрировали на Bruker micrOTOF II с электрораспылительной ионизацией, на положительных ионах (4500 V) со шприцевым вводом вещества. Для регистрации спектров использовали фракции ВЭЖХ, собранные из нескольких вводов образцов.
Масс-спектры MALDI-TOF регистрировались на приборе Bruker Daltonics UltraFlex (“Bruker”, США).
Элементный анализ проведен с использованием прибора Elementar Vario MICRO cube (“Elementar Analysensysteme GmbH”, Германия).
Температуры плавления выделенных соединений были определены на приборе Melting Point M-565 (“Büchi Labor Technik AG”, Швейцария).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В работе использовали сапротрофный штамм Mycobacterium sp. ВКМ Ac-1817D дикого типа для получения Δ9(11)-AД из соевого фитостерина комбинированным химико-биотехнологическим методом.
Схема синтеза Δ9(11)-AД (3) из фитостерина (1) через 9-ОН-АД (2) изображена на рис. 1.
На первом этапе была проведена биотрансформация фитостерина (1) с нагрузкой 5 г/л в водной среде с образованием 9-OH-AД (2) в качестве основного продукта. Накопление продукта происходило быстро в период от 12 до 48 ч, а затем биоконверсия значительно замедлялась (рис. 2).
Рис. 2.
Профиль биоконверсии фитостерина (5 г/л) растущей культурой Mycobacterium sp. ВКМ Ac-1817D. 1 – фитостерин, 13 – суммарное содержание всех 3‑кето-Δ4-стероидов и фитостерина (ось справа); 2 – 9-OH-АД, 5 – 9-OH-БНК, 6 – 9-ОН-ТС, 7 – 9‑OH-БНХ, 10 – МЭ 9-OH-БНК (ось слева). Указаны величины стандартных ошибок, рассчитанные на основании данных трех независимых экспериментов биотрансформации.

После 36-часовой инкубации накопление 9‑OH-AД (2) происходило с меньшей скоростью, а после 72 ч – прекращалось. При инкубации до 144 ч глубина конверсии фитостерина достигала 99–100%. Однако при этом селективность накопления 9-OH-AД (2) снижалась. Вероятно, последнее является результатом частичной деструкции стероидного скелета продукта, которая имела место одновременно с образованием 9-OH-АД (2) и происходила вследствие активности стероид-1-дегидрогеназы (St1DH) [31]. Для препаративного получения Δ9(11)-AД (3) после 60 ч прерывали культивирование в фазе замедления роста, когда глубина превращения фитостерина (1) достигала ~80%. При этом бόльшая часть желаемого продукта 9-OH-AД (2) была растворена (или солюбилизирована) в жидкой фазе (~97% от общего количества).
Таким образом, селективность процесса оценивалась как 54 ± 0.5 мол. % в расчете на конвертированный фитостерин, а молярный выход 9‑OH-AД составил 43.4%, при рассчете на сумму трансформируемых стеринов, содержащихся в исходном субстрате. Структуры побочных продуктов биоконверсии, накапливающихся при биотрансформации в заметных количествах, показаны на рис. 3. Это – 9-OH-БНК (5, 5.6–7.7%), 9-ОН-ТС (6, 2.7–3.5%) и 9,22-OH-БНХ (7, 6.0–6.2%).
Рис. 3.
Основные побочные продукты биоконверсии фитостерина в 9-OH-AД (5–10) и реакции дегидратации (11 и 12).
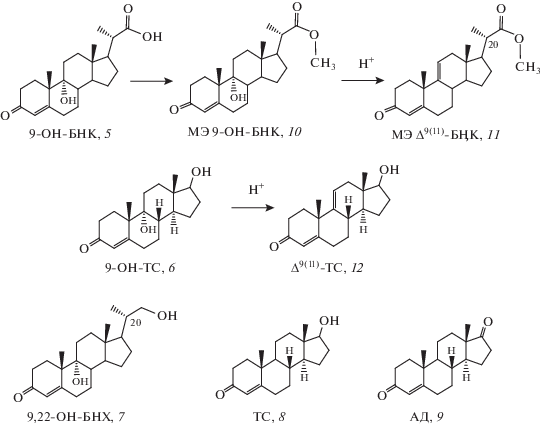
Следует отметить, что способность микобактерий накапливать С22-спирты и соответствующие С-22 кислоты была подтверждена ранее в ряде работ по изучению трансформации стеринов штаммами рода Mycobacterium [32].
Стероиды экстрагировали из КЖ толуолом. Выбирая растворитель для экстракции, руководствовались требованиями последующего процесса дегидратации. Использовали толуол, образующий азеотропную смесь с водой (20.2% воды, Ткип – 85°С). Стадию дегидратации проводили без выделения 9-OH-AД (2) из упаренного в вакууме толуольного экстракта с использованием 85%-ной H3PO4 в качестве дегидратирующего агента.
Ранее [29] было показано, что проведение реакции в среде апротонного органического растворителя с 85%-ной H3PO4 при температуре кипения приводит к регионаправленной дегидратации. При этом оптимальным растворителем является толуол, продолжительность процесса в котором минимальна и не превышала 30 мин, селективность образования при этом Δ9(11)-AД (3) достигала 98–99%, а содержание побочного андроста-4,8(9)-диен-3,17-диона (Δ8(9)-AД, 4) в продукте составляла менее 1%. Следует отметить, что изомерные Δ9(11)-и Δ8(9)-олефины имеют одинаковое значение Rf на ТСХ и не могут быть разделены кристаллизацией. Количество примеси ∆8(9)-изомера (4) может быть детектировано спектроскопически (1Н-ЯМР, 13С-ЯМР) [33, 34] или хроматографическими методами – ВЭЖХ [33, 34], ГЖХ [35].
Возможность количественной изомеризации нежелательной примеси побочного продукта Δ8(9)-AД (4) в Δ9(11)-AД (3), позволяющей повысить выход целевого соединения, была показана ранее [29]. Было обнаружено, что проведение реакции изомеризации 8,9-двойной связи в 9,11-двойную связь возможно в среде ароматического углеводорода под действием каталитического количества сильной кислоты, при этом процесс полностью завершался за 48 ч. Следует отметить, что согласно нашим наблюдениям пролонгация процесса дегидратации в толуоле с H3PO4 с 30 мин до 48 ч с целью проведения процесса изомеризации примеси Δ8(9)-AД (4) в Δ9(11)-AД (3) уменьшала содержание примеси Δ8(9)-олефина с 1.0% практически до 0%. Однако при этом происходило осмоление реакционной массы, и содержание целевого продукта 3 снижалось до 90%.
В связи с этим в работе проводили интенсификацию процесса дегидратации в среде толуола с использованием метода азеотропной отгонки для удаления воды во время реакции. В качестве дегидратирующего агента использовали 85%-ную H3PO4. Реакция дегидратации проходила со 100% конверсией 9-OH-AД (2) в течение 5 мин кипячения реакционной массы и селективностью до 99%. На основании полученных результатов было сделано заключение, что реакция с азеотропным удалением воды протекает значительно быстрее, не оказывая при этом влияния на выход и качество Δ9(11)-AД (3).
В общем случае, обработка органическим растворителем ферментационной суспензии позволяла извлекать все стероидные соединения, включая стерины и продукты неполного окисления боковой цепи. Экстракция стероидов толуолом обеспечивала полное извлечение как основного и побочных стероидных продуктов, так и нетрансформированного субстрата. В то же время в этих условиях 9-OH-БНК (5) частично в виде соли оставалась в водной фазе. Промывка толуольного экстракта 5%-ным водным раствором гидрокарбоната натрия обеспечивала полный возврат 9-OH-БНК (5) в водную фазу, из которой после подкисления до рН 2.5–3.0 она далее была экстрагирована. Подобный подход для эффективного отделения побочной 9-гидрокси-С20-кислоты (5) был предложен ранее в работе [36].
Для отделения стеринов от 3,17-дикетоандростанов обычно используют хорошо известные способы. Это колоночная хроматография, селективная кристаллизация, использование адсорбционных материалов, селективно сорбирующих C19 стероиды. Метод селективного разделения стеринов и C19-стероидов из их смесей путем кристаллизации из 60–70% водного ацетона был описан ранее для биотехнологического процесса получения АД (9) из стеринов [37]. Однако метод селективной кристаллизации ранее не использовался для разделения смеси, содержащей Δ9(11)-AД (3) и стерины. Сухой остаток после упаривания растворителя, полученный, как описано в разделе Методы (см. Дегидратация), содержащий Δ9(11)-AД (3) и различные примеси, включая нетрансформированные стерины, кристаллизовали из водного ацетона в условиях, описанных ранее [37]. Нетрансформированные стерины и примеси осаждали из раствора продукта в ацетоне, медленно добавляя воду до тех пор, пока концентрация ацетона в водной среде не достигала 60%. Образованный осадок отфильтровывали. Таким образом, в водно-ацетоновом фильтрате отсутствовали стерины, а в осадке содержалось незначительное количество С19-стероидов. Для отделения фитостерина (1) из осадка использовали метод кондиционирования стеринов, разработанный ранее [7], без применения щелочи. Следует отметить, что нетрансформированный фитостерин может быть использован повторно.
Очевидно, что побочные соединения, образовавшиеся на стадии биоконверсии и имеющие в своей структуре 9α-гидроксильную группу, будут подвергаться дегидратации с образованием 9(11)-двойной связи. Разделение стеринов и побочных продуктов, содержащих 9(11)-двойную связь, проводили методом препаративной ТСХ стерин-содержащего осадка после отделения водно-ацетонового раствора Δ9(11)-AД (3). Одним из продуктов дегидратации, выделенных из осадка, был метиловый эфир 3-кето-23,24-биснорхола-4,9(11)-диен-22-овой кислоты (МЭ Δ9(11)-БНК, 11), образованный из метилового эфира 9-ОН-БНК (МЭ 9-ОН-БНК, 10). Брутто-формулу МЭ 9-OH-БНК подтверждали методом масс-спектрометрии высокого разрешения: m/z = 397.23493 (рассчитано для C23H34O4Na+); m/z = 397.23535 (получено для C23H34O4Na+, отклонение м.д. 1.055).
Образование соединения 10 как минорного продукта биотрансформации фитостерина штаммом Mycobacterium sp. ВКМ Ac-1817D было обнаружено впервые. Его образование в процессе трансформации стеринов в 9-OH-AД (2) штаммом Mycobacterium roseum было установлено ранее [38]. Об образовании 9-гидроксилированных продуктов неполного расщепления боковой цепи, включая соединение 10, в процессе микробиологической конверсии β-ситостерина культурой рода Mycobacterium, было сообщено Амбрус с соавт. [39].
Известно, что ферментативное О-метилирование гидроксильных и карбоксильных групп молекул органических соединений, приводящее к увеличению их гидрофобности, происходит в различных живых организмах, включая бактерии, грибы, растения и млекопитающих, с целью регулирования различных функциональных процессов их жизнеобеспечения. Ферментативное О-метилирование карбоксильной группы продуктов деградации боковой цепи стеринов характерно также для представителей рода Mycobacterium. Ферментативное О-метилирование катализируется О-метилтрансферазами [EC 2.1.1.6.x] и включает перенос метильной группы S-аденозил-L-метионина (AdoMet) на гидроксильную группу молекулы акцептора с образованием его метилового эфира и S-аденозил-L-гомоцистеина в качестве продуктов [40]. Таким образом, образование метилового эфира 10, характерное для стерин-трансформирующих штаммов микобактерий, происходит, по-видимому, так же под действием О-метилтрансферазы, использующей в качестве донора метильной группы S-аденозил-L-метионин [41, 42].
В выделенной смеси стеринов по данным 1Н‑ЯМР спектра отсутствовали сигналы, соответствующие протонам при 22(23)-двойной связи боковой цепи. Это свидетельствовало о том, что, по-видимому, стерины с Δ22(23)-связью (стигмастерин и брассикастерин) конвертировались в первую очередь. Кроме того, с помощью ВЭЖХ анализа были идентифицированы тестостерон (ТС, 8) и Δ9(11)-тестостерон (Δ9(11)-ТС, 12).
Таким образом, наличие метилового эфира прегна-4,9(11)-диен-3-он-20-карбоновой кислоты (11) как мажорной примеси среди побочных продуктов дегидратации свидетельствовало о способности штамма Mycobacterium sp. ВКМ Ac-1817D не только трансформировать стерины с образованием 9α-гидроксипрегн-4-ен-3-он-20-карбонововой кислоты (5), но и метилировать гидроксильную группу кислотного фрагмента с образованием метилового эфира (10).
Аналогичный результат трансформации стеринов был ранее описан в работе [43]. Авторы сообщили, что мутантный штамм M. fortuitum NRRL B-8119, у которого была блокирована способность деградировать систему стероидных колец, эффективно конвертировал β-ситостерин в 9-ОН-АД (2) с образованием небольших количеств 9-ОН-ТС (6); 9,22-ОН-БНХ (7), 9-ОН-БНК (10) и соответствующего метилового эфира 11.
Соединения 10 и 11 могут представлять интерес для изучения их биологической активности. Кроме того, соединение 11 может быть использовано как исходный субстрат для перехода, например, к 11-гидроксилированным, 9-галоидированным и другим 9,11-замещенным производным, а соединение 10 – в синтезе дезоксихолевой кислоты [44] и новых производных брассиностероидов [45].
Известные методы получения Δ9(11)-AД (3) предусматривают использование в реакции дегидратации кристаллического 9-OH-AД (2). В работе показана возможность объединения двух стадий синтеза Δ9(11)-AД (3) из фитостерина (1): стадии микробиологической трансформации фитостерина с образованием 9-OH-AД (2) и химической стадии дегидратации 9-OH-AД (2), которая может быть проведена без выделения промежуточного соединения 9-OH-AД (2) из экстракта культуральной среды.
Такой подход позволяет исключить потери 9-ОН-АД при его выделении в кристаллическом виде. Показано, что реакцию дегидратации в среде органического растворителя можно проводить с минимальным количеством дегидратирующего агента (1.6 моль на 1 моль 9-OH-AД) и интенсифицировать процесс, удаляя воду путем азеотропной отгонки без ущерба для селективности превращения. При этом достигается высокая региоселективность реакции дегидратации. Продемонстрирована возможность очистки Δ9(11)-АД от остаточного стерина и продуктов неполной деградации его боковой цепи путем селективной кристаллизации из водного ацетона. Кроме того, впервые выявлена способность природного штамма Mycobacterium sp. ВКМ Ac-1817D трансформировать стерины с образованием метилового эфира 9α-гидроксипрегн-4-ен-3-он-20-карбонововой кислоты (10). Таким образом, штамм Mycobacterium sp. ВКМ Ac-1817D может быть использован для получения новых штаммов, способных к накоплению соединений 5 и 10 в качестве основных продуктов катаболизма стеринов.
Разработанный метод получения Δ9(11)-АД комбинацией микробиологического окисления фитостерина и химической дегидратации без выделения кристаллического 9-ОН-АД может быть также использован в биотехнологических процессах с применением других штаммов микобактерий, трансформирующих фитостерин в 9-ОН-АД. Метод позволяет упростить технологическую схему получения Δ9(11)-АД и не только исключить потери 9-ОН-АД, но и минимизировать количество производственных отходов, что позволит усовершенствовать процесс без потери его эффективности.
Работа выполнена при частичной поддержке грантом Российского научного фонда (№ 14-24-00169).
Список литературы
Савинова T.С., Лукашев Н.В., Хомутов С.M., Дов-бня Д.В., Донова M.В. // Масла и жиры. 2014. Т. 3. № 155. С. 14–15. http://www.oilbranch.com/publ/view/424.html
Al Jasem Y., Khan M., Taha A., Thiemann T. // Med. J. Chem. 2014. V. 3. № 2. P. 796–830
Szentirmai A. // J. Ind. Microbiol. 1990. V. 6. № 2. P. 101–115.
Войшвилло Н.Е., Андрюшина В.А., Савинова Т.С., Стыценко Т.С. // Прикл. биохимия и микробиология. 2004. Т. 40. № 5. С. 536–543.
Wang F.-Q., Yao K. and Wei D.-Z. From Soybean Phytosterols to Steroid Hormones. In Soybean and Health. / Ed. H. El-Shemy. InTechOpen, 2011. P. 231–252.
Datcheva V.K., Voishvillo N.E., Kamernitskii A.V., Vlahov R.J., Reshetova I.G. // Steroids. 1989. V. 54. № 3. P. 271–286.
Савинова Т.С., Diep N.T., Войшвилло Н.Е., Андрюшина В.А., Карпова Н.Е., Белецкая И.П., Huy L.D. // Хим.-фарм. журн. 2012. Т. 46. № 3. С. 40–43.
Donova M.V., Egorova O.V. // Appl. Microbiol. Biotechnol. 2012. V. 94. P. 1423–1447.
Zhang X., Zhu M., Han R., Zhao Y., Chen K., Qian K., Shao M., Yang T., Xu M., Xu J., Rao Z. // Molecules. 2019. V. 24. Article 2534.
Van der Geize R., Hessels G.I., Dijkhuizen L.// Microbiology. 2002. V. 148. P. 3285–3292.
Donova M.V. // Прикл. биохимия и микробиология. 2007. V. 43. № 1. P. 5–18.
Андрюшина В.А., Родина Н.В., Стыценко Т.С., Huy L.D., Дружинина А.В., Ядерец В.В., Войшвилло Н.Е. // Прикл. биохимия и микробиология. 2011. Т. 47. № 3. С. 297–301.
Seidel L., Hörhold C. // J. Basic Microbiol. 1992. V. 32. № 1. P. 49–55.
Donova M.V., Gulevskaya S.A., Dovbnya D.V. Puntus I.F. // Appl. Microbiol. Biotechnol. 2005. V. 67. P. 671–678.
Donova M.V., Dovbnya D.V., Koshcheyenko K.A. Proceedings of the Eighth International Symposium on Cyclodextrins., March 31–Apri12, 1996, Budapest, Hungary. / Ed. J. Szejtli, L. Szente 1997. P. 527–530.
Donova M.V., Dovbnya D.V., Sukhodolskaya G.V., Khomutov S.M., Nikolayeva V.M., Kwon I., Han K. // J. Chem. Technol. Biotechnol. 2005. V. 80. № 1. P. 55–60.
Bragin E.Y., Shtratnikova V.Y., Schelkunov M.I., Dovbnya D.V., and Donova M.V. // BMC Biotechnology. 2019. V. 19. № 1. P. 1–16.
Bragin E.Y., Shtratnikova V.Y., Dovbnya D.V., Schelkunov M.I., Pekov Y.A., Malakho S.G., Egorova O.V., Ivashina T.V., Sokolov S.L., Ashapkin V.V., Donova M.V. // J. Steroid Biochem. Mol. Biol. 2013. V. 138. P. 41–53.
Shtratnikova V.Y., Schelkunov M.I., Dovbnya D.V., Pekov Y.A., Bragin E.Y., Ashapkin V.V., Donova M.V. // Genome Announc. 2015. V. 3. № 1. e01447-14.
Chinn L., Dodson R. // J. Org. Chem. 1959. V. 24. № 6. P. 879–879.
VanRheenen V., Shephard K.P. // J. Org. Chem. 1979. V. 44. № 9. P. 1582–1584.
Reid J.G., Debiak-Krook T. // Tetrahedron Lett. 1990. V. 31. № 26. P. 3669–3672.
Huy L.D., Diep N.T., Chang-Hee L., Hung N.D. // Vietnam J. Chem. 2014. V. 52. № 2.
Turuta A.M., Kamernitsky A.V., Fadeeva T.M., Huy L.D. //Mendeleev Commun. 1992. V. 2. № 2. P. 47–48.
Huy L.D., Diep N.T., Nhung L.T.K. //Pharm. Chem. J. 2014. V. 48. № 3. P. 220–223.
Пaтeнт PФ. 2014. № 2532902
Wang W., Ge F., Ma C., Li J., Ren Y., Li W., Fu J. // 3 Biotech. 2017. V. 7. P. 19.
Патент КНР. 2011. № 102040639
Савинова Т.С., Казанцев А.В., Huy L.D., Лукашев Н.В. // Хим.-фарм. журн. 2017. Т. 51. № 7. С. 50–53.
Патент Венгрии. 1990. № 200203
Sukhodolskaya G.V., Nikolayeva V.M., Khomutov S.M., Donova M.V. // Appl. Microbiol. Biotechnol. 2007. V. 74. P. 867–873.
Galán B., Uhía I., García-Fernández E., Martínez I., Bahíllo E., de la Fuente J.L., Barredo J.L., Fernández-Cabezón L., García J.L. // Microb. Biotechnol. 2017. V. 10. P. 138–50.
Европейский патент. 1988. № 0253415.
Европейский патент. 1988. № 0294911.
Патент США. 1978. № 4102907.
Патент США. 1977. № 4029549.
Пaтeнт PФ. 1999. № 2126837.
Патент Германии.1988. № 3739017.
Патент США. 1992. № 5112815.
Ibrahim R.K., Bruneau A., Bantignies B. // Plant Mol. Biol. 1998. V. 36. P. 1–10.
Li X., Chen X., Wang Y., Yao P., Zhang R., Feng J., Wu Q., Zhu D., Ma Y. // Steroids. 2018. V. 132. P. 40–45
Roje S. // Phytochemistry. 2006. V. 67. № 15. P. 1686–1698.
Wovcha M.G., Antosz F.J., Knight J.C., Kominek L.A., Pyke T.R. // Biochim. Biophys. Acta. 1978. V. 531. P. 308–321.
Европейский патент. 2019. № 3464315.
Antonchick A.P., Schneider B., Zhabinskii V.N., Khripach V.A. // Steroids. 2004. V. 69. № 10. P. 617–628.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


