Прикладная биохимия и микробиология, 2021, T. 57, № 5, стр. 458-466
Образование и свойства внеклеточной протеиназы микромицета Aspergillus flavus O-1, активной по отношению к фибриллярным белкам
А. А. Галиакберова 1, Д. М. Бедненко 1, В. Г. Крейер 1, А. А. Осмоловский 1, *, Н. С. Егоров 2
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет
119234 Москва, Россия
2 Международный биотехнологический центр Московского государственного университета им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: aosmol@mail.ru
Поступила в редакцию 17.03.2021
После доработки 15.04.2021
Принята к публикации 23.04.2021
Аннотация
Показано, что микромицет A. flavus О-1 секретирует комплекс по меньшей мере из двух протеолитических ферментов. Методом препаративного изоэлектрофокусирования был выделен наиболее активный фермент и охарактеризован как сериновая протеиназа с молекулярной массой 17 кДа и pI 7.82. Протеиназа обладала широкой субстратной специфичностью и была способна расщеплять такие фибриллярные белки, как коллаген, эластин и фибрин.
Протеиназы микроорганизмов составляют около 60% всех промышленных ферментов в мире [1]. Микроскопические грибы – микромицеты, способны продуцировать различные протеолитические ферменты, в большинстве случаев – внеклеточные, относящиеся к классам сериновых, аспартильных и металлопротеиназ [2]. Протеиназы микромицетов разнообразны как по условиям секретирования, условиями действия (температура, рН), так и по молекулярной массе, строению и субстратной специфичности.
В настоящее время протеолитические ферменты активно применяются в различных отраслях, таких как пищевая промышленность (обработка мяса, ускорение созревания сыров и пр.), сельское хозяйство, кожевенное и меховое производство (для удаления волос, размягчения и обезжиривания), бытовая химия (в качестве детергентов в моющих средствах). Целевое применение они приобрели также в фармакологии и медицине, так как входят в основу препаратов, направленных на улучшение пищеварения, уменьшение воспаления, ускорение ранозаживления, восстановление гемостаза [3, 4]. Наиболее широко применяются протеиназы, активные в щелочных условиях: при получении моющих средств, в пищевой промышленности, при выделке кож, в медицине [5]. В медицине и косметологии в основном используются ферменты, расщепляющие коллаген (коллагенолитическая активность), эластин (эластолитическая активность), фибрин (фибринолитическая активность) и фибриноген (фибриногенолитическая активность) [5].
Большинство видов аспергиллов в процессе роста и развития секретируют протеиназы с разными свойствами, что определяет их прикладное значение. Aspergillus flavus – условно патогенный представитель рода Aspergillus, наиболее часто выделяемый из почвы, воздуха, обитающий на старых книгах и перьевых подушках, в кондиционерах и увлажнителях воздуха. Отдельные штаммы A. flavus выделены из зерен пшеницы и бобовых [6].
Известно, что микромицет A. flavus образует протеиназы, способные расщеплять эластин [7], гидролизовать фибрин, проявляя плазминоподобную активность, и активировать некоторые проферменты системы гемостаза [8]. В экзопротеоме A. flavus преобладают различные изоформы щелочной сериновой протеиназы, а также металлопротеиназы с эластолитической активностью [9]. Металлопротеиназы микромицета были охарактеризованы как эластазы, способные расщеплять не только эластин, но также коллаген, овальбумин и др. [10, 11]. Для некоторых изоформ сериновых протеиназ была также показана эластолитическая активность [12, 13]. Предположительно, именно сериновая протеиназа является основным IgE-связывающим аллергеном A. flavus [14]. В определенных условиях культивирования A. flavus способен выделять протеиназы, обладающие коллагенолитической активностью [15].
Цель работы – изучение особенности образования и протеолитические свойства внеклеточных протеиназ микромицета A. flavus О-1 по отношению к фибриллярным белкам.
МЕТОДИКА
Культивирование микромицета. Микромицет A. flavus О-1 был получен из коллекции микроорганизмов кафедры микробиологии биологического факультета МГУ. Культуру поддерживали на скошенном сусло-агаре, хранили при температуре 25°С.
Получение препарата внеклеточных протеиназ микромицета A. flavus О-1. Для выделения протеолитических ферментов микромицет культивировали в глубинных условиях в шейкере-инкубаторе ES – 20/60 (“Biosan”, Латвия) при 200 об./мин в качалочных колбах объемом 750 мл со 100 мл питательной среды при 28°С в течение 2 сут на посевной среде (%): сусло – 6.7, глюкоза – 2.0, пептон – 0.1. После окончания сроков выращивания часть полученного посевного материала переносили в ферментационную среду следующего состава (в %): глюкоза – 3.0, глицерин – 7.0, гидролизат рыбной муки – 0.5, NaNO3 – 0.2, KH2PO4 – 0.05, MgSO4 – 0.05.
Для подбора оптимальных условий для секреции культурой A. flavus О-1 внеклеточных протеиназ, поддерживали различные значения pH среды (от 3 до 9), и температуры (24, 28, 30 и 32°С). Изучали динамику роста и образования протеиназ микромицетов в течение 7 сут, ежедневно определяя прирост биомассы и накопление протеолитических ферментов. Биомассу гриба отделяли фильтрованием, а затем высушивали при 86°С до постоянной массы, рассчитывая ее прирост в мг/мл среды.
Для получения препарата внеклеточных протеиназ продуцента биомассу отделяли от культуральной жидкости фильтрованием через фильтровальную бумагу (“ФС”, Россия). Внеклеточные белки осаждали сульфатом аммония, доводя его концентрацию до 80% от насыщения. Осадок белков формировался при 4°С в течение 12 ч, после чего его отделяли центрифугированием при 15000 g 20 мин при 4°С, затем растворяли в минимальном объеме 0.01 М Трис-HCl-буфера, рН 8.2, с 0.002 М ацетатом кальция, а затем диализовали в диализных мешочках против этого же буфера 12 ч при 4°С на магнитной мешалке. Диализованный раствор белков центрифугировали в тех же условиях для удаления нерастворимой части осадка и лиофильно высушивали.
Определение белка. Концентрацию белка определяли спектрофотометрическим методом по поглощению при 280 нм. Поглощение при 280 нм в кювете с длиной оптического пути 1 см, равное 1.0 в 1 мл принимали за одну оптическую единицу (о.е., А280) [16].
Разделение препарата внеклеточных протеиназ. Фракционирование протеиназ лиофильно высушенного препарата осуществляли в колонке объемом 110 мл (“LKB”, Швеция) в градиенте плотности сахарозы 0–40% по методу Вестерберга [17], используя амфолины с рН 3.5–10 (“LKB”, Швеция) при 4°С, напряжении 800 В в течение 36 ч. После проведения изоэлектрофокусировки содержимое колонки собирали фракциями объемом 1.5 мл с помощью коллектора фракций. В каждой фракции определяли потенциометрически изоэлектрическую точку (рI), поглощение при 280 нм и протеолитическую активность.
Электрофорез белков в ПААГ. Для определения молекулярной массы протеиназы использовали электрофорез в ПААГ c ДСН по Лэммли [18] на приборе для вертикального электрофореза VE-10 (“Helicon”, Россия). Концентрация акриламида в верхнем слое геля была 6.0%, нижнем – 7.5%. Электрофоретическое разделение белков проводили при силе тока 100 мА и напряжении 200 В. Для определения молекулярной массы протеиназ использовали набор метчиков Unstained Protein Molecular Weight Marker (“Thermoscientific”, США). Окрашивание белков в геле проводили раствором Кумасси G-250 в 3.5%-ной хлорной кислоте. Отмывку гелей от красителя осуществляли 7%-ной уксусной кислотой.
Ингибиторный анализ. Для изучения действия ингибиторов на активность протеиназ, секретируемых культурой A. flavus O-1, использовали следующие соединения: ЭДТА (1.1 мг/мл) – ингибитор металлопротеиназ, п-хлормеркурибензоат (п‑ХМБ, 0.5 мг/мл) – ингибитор цистеиновых протеиназ, фенилметилсульфонил фторид (PMSF, 0.3 мг/мл) – ингибитор сериновых протеиназ, TLSK (0.4 мг/мл) – ингибитор трипсиновых протеиназ и TPSK (0.4 мг/мл) – ингибитор химотрипсиновых протеиназ; соевый ингибитор трипсина (1.1 мг/мл) – ингибитор трипсиновых протеиназ. Действие ингибиторов исследовали при соотношении фермент : ингибитор – 1 : 10 и 1 : 100 [19]. После инкубации фермента с ингибитором в течение 1 ч определяли остаточную активность фермента по описанному выше методу и выражали в процентах от контроля (без ингибитора).
Определение протеолитической активности с нативными белковыми субстратами. Общую протеолитическую активность проверяли с помощью реакции расщепления казеина модифицированным методом Ансона-Хагихары [20, 21], определяя количество тирозина в неосаждаемых трихлоруксусной кислотой (ТХУ) продуктах протеолиза после десятиминутного гидролиза 1%-ного раствора казеина в 0.1 М Трис-HCl буфере, рН 8.0–8.2 при 37°С. К 200 мкл пробы добавляли 400 мкл раствора казеина. Реакцию останавливали добавлением 600 мкл 10%-ной ТХУ. Осадок центрифугировали 10 мин при 12 400 g и определяли поглощение раствора при 275 нм. За единицу активности (ЕТир) принимали количество мкмоль тирозина, образовавшегося за 1 мин в заданных условиях.
Фибринолитическую активность определяли, добавляя к 200 мкл пробы 400 мкл 1%-ной суспензии фибрина в 0.1 М Трис-HСl буфере, рН 8.2. Время реакции при 37°С составляло 30 мин. Реакцию останавливали добавлением 600 мкл 10%-ной ТХУ, осадок отделяли центрифугированием и определяли поглощение при 275 нм. Активность выражали в ЕТир.
Определение протеолитической активности с окрашенными белковыми субстратами. Определение коллагенолитической активности проводили с использованием в качестве субстрата азоколла (“Sigma-Aldrich”, США). К 200 мкл пробы добавляли 400 мкл суспензии 2%-ного азоколла в 0.05 М Трис-HСl буфере, рН 8.2. Полученную смесь инкубировали при 37°С на термошейкере (600 об./мин) в течение 30 мин. Реакцию останавливали добавлением 600 мкл 10%-ной ТХУ, после чего осадок отделяли ценнтрифугированием и спектрофотометрически определяли поглощение пробы при длине волны 519 нм. За единицу активности (Eазк) принимали количество фермента, приводящее к увеличению оптической плотности продуктов реакции на 0.1 ед.
Протеолитическую активность с High Powder Azur (HPA, “Calbiochem”, США) определяли, добавляя к 250 мкл пробы 400 мкл суспензии 0.2%‑ного HPA в 0.05 М Трис-HСl буфере, рН 8.2. Полученную смесь инкубировали при 37°С на термошейкере при 600 об./мин в течение 15 мин. Реакцию останавливали добавлением 750 мкл 10% ТХУ, после чего осадок центрифугировали и спектрофотометрически определяли поглощение пробы при длине волны 525 нм. За 1 ед. активности принимали количество фермента, приводящее к увеличению оптической плотности продуктов реакции на 0.1.
Азоказеиназную активность определяли с использованием субстрата азоказеина (“Sigma-Aldrich”, США). В реакционной смеси к 100 мкл пробы добавляли 250 мкл суспензии 0.2%-ного азоказеина в 0.1 М Трис-HСl буфере, рН 8.2. Полученную смесь инкубировали при 25°С в течение 30 мин. Реакцию останавливали добавлением 100 мкл 10%-ного ТХУ, после чего осадок центрифугировали и спектрофотометрически определяли поглощение пробы при длине волны 340 нм. За 1 ед. активности принимали количество фермента, приводящее к увеличению оптической плотности продуктов реакции на 0.1.
Определение амидолитической активности с хромогенными пептидными субстратами. Активность определяли по реакции с субстратами эластазы (Suc-Ala-Ala-Ala-pNA), субтилизина (Z-Ala-Ala-Leu-pNA), плазмина (H-DVal-Leu-Lys-pNA), тромбина (Tos-Gly-Pro-Arg-pNA), тканевого активатора плазминогена (dIle-Pro-Arg-pNA), урокиназы (pGlu-Gly-Arg-pNA), фактора Ха (Z-D-Arg-Gly-Arg-pNA), активированного протеина С (pGlu-Pro-Arg-pNA) и химотрипсина (Ac-Phe-pNA). Для проведения реакций к 200 мкл пробы добавляли по 100 мкл субстрата 0.5 мг/мл в Трис-HCl буфере, pH 8.2 и 50 мкл 0.05 М Трис-HСl буфера, рН 8.2. Время реакции при 37°С – 5 мин. Реакцию останавливали добавлением 200 мкл 50%-ной уксусной кислоты, после чего определяли поглощение спектрофотометрически при 405 нм. За 1 ед. активности (ЕрNA) принимали количество отщепившегося pNA за 1 мин.
Определение протеолитической активности методом фибриновых пластин. Фибринолитическую и активаторную по отношению к плазминогену активности определяли на фибриновых пластинках по методу Аструпа–Мюллерца-Лассена [22, 23]. Для приготовления фибриновой пластинки в чашке Петри смешивали 9 мл раствора 0.5%-ного фибриногена (“Sigma-Aldrich”, США) и 250 мкл 0.4%-ного тромбина. На поверхность пластинок наносили по 30 мкл пробы, после чего чашки инкубировали в термостате при 37°С. Измерения зон лизиса проводили через 3 и 24 ч инкубации. Активность выражали в условных единицах на 1 мл пробы. За 1 усл. ед. принимали количество фермента вызывающего зону гидролиза фибриновой пластины в 1 мм2.
Для приготовления фибриновой пластины со смесью фибриллярных белков в чашке Петри смешивали 9 мл раствора, содержащего 0.5% фибриногена, 0.5% коллагена (“Sigma-Aldrich”, США), 0.5% эластина (“Sigma-Aldrich”, США) и 250 мкл 0.4%-ного тромбина (“Sigma-Aldrich”, США). Для растворения фибриллярных белков и тромбина использовали смесь физиологического раствора и 0.05 М Трис-HCl буфера, рН 8.2. На поверхность пластинок наносили по 30 мкл пробы, после чего чашки инкубировали в термостате при 37°С. Измерения зон лизиса проводили через 3 и 24 ч инкубации. Активность выражали в условных единицах на 1 мл пробы.
Определение наличия углеводных фрагментов в составе протеиназы A. flavus O-1. Реакцию на гликопротеины, присутствующие в белковом образце, проводили методом дот-блоттинга на нитроцеллюлозных мембранах, как описано ранее [24]. В качестве положительного контроля на реакцию использовали раствор внеклеточной дрожжевой инвертазы, в качестве отрицательного – БСА, в концентрациях 0.5 мг/мл.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Микромицет Aspergillus flavus Link принадлежит к анаморфам грибов аскомицетного аффинитета: роду Aspergillus, семейству Aspergillaceae, порядка Eurotiales, класса Eurotiomycetes, отдела Ascomycota. Обычно представителей этого вида выделяют из почвы, растительных и животных остатков; встречаются условно-патогенные и патогенные виды.
Подбор оптимального рН среды для роста и образования протеаз A. flavus О-1 показал, что наибольшая общая протеолитическая (казеинолитическая) активность наблюдалась при рН 6–6.5, в то время как продуктивность мицелия по образованию фермента была выше при культивировании в среде с рН 8.0–9.0 (рис. 1а). Максимальное значение фибринолитической активности и продуктивность образования фермента наблюдали при трех значениях pH – 9.0, а также 6.0 и 7.0, при рН 4.0 фермент не секретировался в среду совсем (рис. 1в). Наибольшая эластолитическая активность A. flavus О-1 и ее образование на единицу биомассы наблюдались на среде с pH 3.0 и 4.0, при выращивании на среде с pH 5.0 и 5.5 активность не детектировалась (рис. 1г). Результаты определения активности коллагеназы в культуральной жидкости (КЖ) A. flavus О-1 показали, что оптимальный pH среды для синтеза фермента – 6.5. При этом pH наблюдались высокие как активность фермента, так и продуктивность мицелия гриба. Также высокая продуктивность наблюдалась при pH 3.0 и 8.0. При выращивании на среде с pH 4.0 и 5.0 активность не обнаруживали (рис. 1б).
Рис. 1.
Влияние рН среды культивирования на активность протеолитических ферментов A. flavus О-1: а – общая протеолитическая активность (1) и продуктивность (2), б – коллагенолитическая активность (1), продуктиность (2), в – фибринолитическая активность (1), продуктивность (2), г – эластолитическая активность (1), продуктивность (2).

В результате эксперимента по подбору оптимальной температуры, для образования протеиназ у A. flavus О-1 установлен диапазон температур от 24 до 30°С (рис. 2а). Фибринолитическая и эластолитическая активности, а также продуктивность микромицета, были наибольшими при температуре культивирования 24° (рис. 2б, 2г), а коллагенолитическая –30°С (рис. 2в).
Рис. 2.
Влияние температуры на активность протеолитический ферментов A. flavus О-1: а – общая протеолитическая активность, б – коллагенолитическая активность, в – фибринолитическая активность, г – эластолитическая активность. 1 – общая активность; 2 – продуктивность.

Таким образом, для A. flavus О-1 характерно образование нескольких протеолитических ферментов с различной специфичностью при различных условиях культивирования при различных температурах и рН среды.
Дальнейшее культивирование гриба проводили при pH среды 6.5 и температуре 28°С. Изучение динамики образования протеолитических ферментов культурой A. flavus О-1 показало, что фибринолитическая активность имела один максимум, соответствующий экспоненциальной фазе роста, приходящейся на 1 сут роста, а казеинолитическая – несколько. Первый пик протеолитической (казеинолитической) активности приходился на 2 сут и соответствовал фазе замедления роста. Второй пик приходился на 4 сут и соответствовал фазе отмирания (рис. 3а).
Рис. 3.
Динамика роста культуры A. flavus О-1 (б) и образования внеклеточных протеиназ (а): 1 – биомасса, 2 – общая протеолитическая активность, 3 – фибринолитическая активность, 4 – эластазная активность, 5 – коллагенолитическая активность.

Для коллагенолитической и эластолитической активности выявлено несколько максимумов образования – на 1 и 4 сут для первой и на 1 и 3 для второй соответственно. Первые максимумы активности соответствовали экспоненциальной фазе роста культуры, тогда как вторые – фазе отмирания (рис. 3б). Так как максимумы изученных активностей приходились на одни и те же сутки культивирования, то, можно предположить, что микромицет секретировал фермент, обладающий обоими типами активности.
Для всех изученных видов активности наблюдался волнообразный характер образования ферментов, что часто встречается у микромицетов, и вероятнее всего связано с особенностями транспорта внеклеточных ферментов из клеток.
Таким образом, по результатам изучения динамики накопления протеиназ, можно предположить, что A. flavus О-1 секретировал два фермента. Один фермент обладал фибринолитической, коллагенолитической и эластолитической активностью с максимумом активности на 1 сут, второй – с общей протеолитической активностью и максимумом на 2 сут.
На следующем этапе был получен лиофилизированный комплексный препарат протеиназ A. flavus О-1, который исследовали на протеолитическую активность по отношению к фибриллярным белкам. Анализ проводили с использованием азоколлагена, НРА (High Power Azur), азоказеина, фибриновых пластин и пластин со смесью белков (коллаген, фибрин, эластин) (табл. 1 и 2). Протеазы комплексного препарата микромицета A. flavus О-1 в концентрации 5 мг/мл показали невысокую протеолитическую активность с НРА и высокую казеинолитическую активность (табл. 1).
Таблица 1.
Протеолитическая активность комплексного препарата протеиназ A. flavus О-1
| Субстрат | Единицы измерения | Активность комплексного препарата | Активность выделенной после ИЭФ протеиназы |
|---|---|---|---|
| Азоколлаген | Eазк/мг | 0.199 | 2.48 |
| Азоказеин | Усл. ед./ мг | 7.68 | 69.05 |
| НРА | Усл.ед./мг | 0.1 | 1.61 |
| Suc-Ala-Ala-Ala-pNA | ЕpNA/мг | 2.099 | 9.48 |
Таблица 2.
Действие комплексного препарата протеиназ A. flavus О-1 на фибриновые пластины разного состава
| Вариант фибриновой пластины | Время инкубации, ч | Активность препарата, усл. ед./мл | ||
|---|---|---|---|---|
| 2 мг/мл | 1 мг/мл | 0.5 мг/мл | ||
| Фибрин с добавлением плазминогена | 3 | 519.48 | 417.9 | 284.7 |
| Фибрин | 748.41 | 417.9 | 367.13 | |
| Фибрин с добавлением коллагена и эластина | 479.5 | 384.6 | 333 | |
| Фибрин с добавлением плазминогена | 24 | 3625.5 | 2800.5 | 1998 |
| Фибрин | 4375.6 | 2251.08 | 1995.5 | |
| Фибрин с добавлением коллагена и эластина | 4495.5 | 3476.5 | 2562.4 | |
Выраженная фибринолитическая, а также сопутствующие ей коллагенолитическая и эластолитическая активности исследуемых протеиназ показаны на рис. 4, видны четкие зоны лизиса фибриновых пластин и модифицированных пластин со смесью фибриллярных белков. Активаторная к плазминогену активность протеиназ наблюдалась на непрогретых фибриновых пластинах. Кроме того, наблюдали четкую зависимость активности протеиназы от ее концентрации. Как видно из рис. 4, площадь зоны лизиса через 3 ч инкубации возрастала с увеличением концентрации раствора фермента, нанесенного на фибриновые пластины (рис. 4а, 4в, 4д). Эта зависимость сохранялась и через 24 ч инкубации (рис. 4б, 4г, 4е). В табл. 2 представлены значения протеиназы препарата, рассчитанные из величины площадей зон лизиса фибриновых пластин. Наличие на модифицированных пластинах со смесью фибриллярных белков вкраплений в зоне лизиса указывало на неполное расщепление протеазами коллагена и эластина в условиях эксперимента.
Рис. 4.
Протеолитическая активность комплексного препарата протеиназ A. flavus О-1 по отношению к фибриллярным белкам: а, б – фибриновая пластина с примесью плазминогена (фибринолитическая и активаторная к плазминогену активность); в, г – фибриновая пластина (фибринолитическая активность); д, е – модифицированная фибриновая пластина примесью коллагена и эластина, а, в, д – 3 ч, б, г, е – 24 ч инкубации.

Для дальнейшего исследования состава комплексного препарата белков микромицета A. flavus О-1 и их разделения использовали метод и-зоэлектрофокусирования, который показал присутствие основного активного белка с протеолитической активностью с pI 7.82 (рис. 5).
Рис. 5.
Изоэлектрофокусирование препарата внеклеточных протеиназ микромицета A. flavus О-1. 1 – протеолитическая активность, 2 – рН, 3 – белок.

В результате проведения электрофореза в ПААГ с ДСН была установлена молекулярная масса фермента около 17 кДа (рис. 6).
Рис. 6.
Электрофорез в ПААГ в присутствии ДСН активных фракций после изоэлектрофокусирования. М – метчики, фракции: Ф13 (№ 13), Ф 27 (№ 27) и Ф 30 (№ 30). (В скобках номера фракций, полученных при изоэлектрофокусировании).

Изучение активности выделенной протеиназы по отношению к различным белковым субстратам – азоказеину, азоколлагену и НРА показало, что протеиназа обладала выраженной казеинолитической активностью, а также гидролизовала субстраты азоколлаген и НРА (табл. 1). Изучение субстратной специфичности фермента с различными хромогенными пептидными субстратами позволило выявить активность эластазы, а также высокие плазминоподобную и тромбиноподобную активности (табл. 3). Наличие плазминоподобной активности могло свидетельствовать о способности фермента к лизису фибрина. Активность по отношению к остальным протестированным субстратам не была выявлена.
Таблица 3.
Амидолитическая активность протеиназы A. flavus О-1
| Хромогенный пептидный субстрат | Расщепляющий фермент | ЕpNA/мл |
|---|---|---|
| Suc-Ala-Ala-Ala-pNA | Эластаза | 10.44 |
| Z-Ala-Ala-Leu-pNA | Субтилизин | 0 |
| H-DVal-Leu-Lys-pNA | Плазмин | 37.18 |
| Tos-Gly-Pro-Arg-pNA | Тромбин | 48.14 |
| dIle-Pro-Arg-pNA | Тканевой активатор плазминогена | 0 |
| pGlu-Gly-Arg-pNA | Урокиназа | 0 |
| z-D-Arg-Gly-Arg-pNA | Фактор Xа | 0 |
| Pyr-Glu-Arg-pNA | Протеин С | 0 |
| Ac-Phe-pNA | Химотрипсин | 0 |
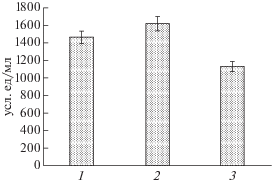
Методом фибриновых пластин было показано, что протеиназа обладала способностью к расщеплению фибрина и комплексного субстрата из фибриллярных белков, состоящего из фибрина, коллагена и эластина (рис. 7).
Рис. 7.
Протеолитическая активность протеиназы A. flavus О-1 по отношению к фибриллярным белкам. 1 – фибрин с примесью плазминогена; 2 – фибрин; 3 – фибрин с примесями коллагена и эластина.
Для определения типа катализа протеиназы был проведен ингибиторный анализ, с использованием ингибиторов на различные классы протеиназ (табл. 4). В реакции с PMSF, ингибитором сериновых протеиназ, при соотношении фермент : ингибитор, равном 1 : 100, наблюдалось почти полное ингибирование активности фермента. Принадлежность изучаемой протеиназы к классу сериновых протеиназ подтверждалось также реакцией с TPSK – ингибитором химотрипсиновых протеиназ, при которой происходило ингибирование активности почти в два раза (табл. 4). Кроме того, наблюдалось слабое ингибирование фермента ЭДТА – ингибитором металлопротеиназ.
Таблица 4.
Ингибиторный анализ протеиназы A. flavus О-1
| Ингибитор | Соотношение фермент : : ингибитор |
Остаточная активность, % |
|---|---|---|
| Контроль (без ингибитора) | – | 100.0 |
| ЭДТА | 1 : 10 | 69.8 |
| 1 : 100 | 86.6 | |
| п-ХМБ | 1 : 10 | 100.0 |
| 1 : 100 | 100.0 | |
| TLSK | 1 : 10 | 100.0 |
| 1 : 100 | 100.0 | |
| TPSK | 1 : 10 | 55.7 |
| 1 : 100 | 60.7 | |
| Соевый ингибитор трипсина | 1 : 10 | 100.0 |
| 1 : 100 | 100.0 | |
| PMSF | 1 : 10 | 48.7 |
| 1 : 100 | 2.6 |
Поскольку после синтеза в клетке фермент может подвергаться посттрансляционной модификации, например, в том числе присоединяя углеводные фрагменты, было проведено определение их присутствия в составе выделенной протеиназы A. flavus O-1. Результаты показали отсутствие углеводных фрагментов в составе протеиназы, то есть фермент не гликозилирован (рис. 8).
Рис. 8.
Дот-блоттинг гликопротеинов в молекулах протеиназы A. flavus О-1 (Ф30) с ШИК–реактивом, инвертаза (К+, положительный контроль) и БСА (К–, отрицательный контроль).

Ранее из различных штаммов A. flavus были выделены различные протеиназы, обладающие эластинолитической активностью. Так, была выделена протеиназа с молекулярной массой 23 кДа и изоэлектрической точкой 7.6 с оптимумом активности при pH 8.0 и 50°C [10]. Штамм A. favus NRRL 18543 секретировал эластазу с молекулярной массой 35 кДа, которая впоследствии подвергалась автолизу в культуре до более стабильной формы с молекулярной массой 23 кДа. Очищенная протеиназа с массой 23 кДа, по-видимому, была членом семейства металлопротеаз из-за сильного ингибирования хелатирующими агентами ЭДТА и 1,10-фенантролином. Показано, что эта эластаза термостабильна, устойчива к протеолизу и способна гидролизовать широкий спектр белковых субстратов, включая как гидрофобные белки (эластин, запасной белок семян хлопка, коллаген), так и растворимые белки (овальбумин, альбумин бычьей сыворотки) [11]. Поиск основного белка-аллергена A. flavus показал, что таковым является сериновая протеиназа с массой 34 кДа, которая имела значительное сходство с эластинолитической протеиназой A. fumigatus [13, 14].
Таким образом, по-видимому A. flavus способен образовывать несколько протеиназ с различными молекулярными массами.
Дальнейшие исследования показали, что щелочная протеиназа – один из широко распространенных белков экзопротеома A. flavus. Этот фермент принадлежит к семейству сериновых протеиназ с эластинолитической активностью [24]. Оказалось, что данная протеиназа существует в виде 24 различных протеоформ с разной pI и молекулярной массой. На основе спектральных подсчетов было показано, что среди идентифицированных экзоферментов наиболее распространенным белком является внеклеточная металлопротеиназа, а на втором месте – щелочная протеиназа [9].
В работе было показано, что штамм A. flavus О-1 секретирует комплекс по меньшей мере из двух протеолитических ферментов. Препаративным изоэлектрофокусированием был выделен наиболее активный фермент. Им оказалась негликозилированная сериновая протеиназа с молекулярной массой 17 кДа и pI 7.82. Протеиназа обладала широкой субстратной специфичностью и была способна расщеплять такие фибриллярные белки, как коллаген, эластин и фибрин.
Список литературы
Gupta R., Beg Q.K., Lorenz P. // Appl. Microbiol. Biotechnol. 2002. V. 59. № 1. P. 15–32.
Павлюкова Е.Б., Белозерский М.А., Дунаевский Я.Е. // Биохимия. 1998. Т. 63. № 8. С. 1059–1089.
Rosenberg L., Krieger Y., Silberstein E., Arnon O., Sinelnikov I.A., Bogdanov-Berezovsky A., Singer A. // J. Burns. 2012. V. 38. № 7. P. 1035–1040.
Montoya C.A., Rutherfurd S.M., Olson T.D., Purba A.S., Drummond L.N., Boland M.J., Moughan P.J. // Br. J. Nutr. 2014. V. 111. № 6. P. 957–967
Kumar C.G., Takagi H. // Biotechnol. Adv. 1999. V. 17. № 7. P. 561–594.
Hedayati M.T., Pasqualotto A.C., Warn P.A., Bowyer P., Denning D.W. // Microbiology. 2007. V. 153. № 6. P. 1677–1692.
Okumura Y., Ogawa K., Nikai T. // J. Med. Microbiol. 2004. V. 53. № 5. P. 351–354.
Клечковская В.В., Егоров Н.С. // Микробиология. 1983. Т. 52. № 3. С. 396–403.
Selvam R.M., Nithya R., Devi P.N., Shree R.S., Nila M.V., Demonte N.L., Thangavel C., Maheshwari J.J., Lalitha P., Prajna N.V., Dharmalingam K. // J. Proteomics. 2015. V. 115. P. 23–35.
Rhodes J.C., Amlung T.W., Miller M.S. // Infect. Immun. 1990. V. 58. № 8. P. 2529–2534.
Mellon J.E., Cotty P.J. // Appl. Microbiol. Biotechnol. 1996. V. 46. P. 138–142.
Ramesh M.V., Sirakova T., Kolattukudy P.E. // Infect Immun. 1994. V. 62. № 1. P. 79–85.
Yu C.J., Chiou S.H., Lai W.Y., Chiang B.L., Chow L.P. // Biochem. Biophys. Res. Commun. 1999. V. 261. № 3. P. 669–675.
Chou H., Lin W.L., Tam M.F., Wang S.R., Han S.H., Shen H.D. Int. Arch. Allerg. Immunol. 1999. V. 119. № 4. P. 282–290.
Сухосырова Е.А., Никитина З.К., Яковлева М.Б., Вещикова Е.В., Быков В.А. // Бюлл. эксперим. биол. мед. 2003. Т. 35. № 5. С. 526–530.
Gertler A., Trop M. // Eur. J. Biochem. 1971. V. 19. № 1. P. 90–96.
Vesterberg O. // Biochem. Biophys acta. 1972. V. 1. P. 11–19.
Laemmli U.K. // Nature. 1970. V. 227. P. 680–685.
Крейер В.Г., Руденская Г.Н., Ландау Н.С., Покровская С.С., Степанов В.М., Егоров Н.С. // Биохимия. 1983. Т. 48. № 8. С. 1365–1373.
Anson M.L. // Science. 1935. V. 81. P. 467–470.
Осмоловский А.А., Попова Е.А., Крейер В.Г., Баранова Н.А., Егоров Н.С. // Вестн. Моск. ун-та. Сер. 16. Биология. 2016. № 1. С. 71–75.
Осмоловский А.А., Крейер В.Г., Баранова Н.А., Кураков А.В., Егоров Н.С. // Прикл. биохимия и микробиология. 2015. Т. 51. № 1. С. 86–92.
Шаркова Т.С., Кураков А.В., Осмоловский А.А., Матвеева Э.О., Крейер В.Г., Баранова Н.А., Егоров Н.С. // Микробиология. 2015. Т. 84. № 3. С. 316–322.
Chen Z.-Y., Brown R.L., Cary J.W., Damann K.E., Cleveland T.E. // Toxin Rev. 2009. V. 28. P. 187–197.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


