Прикладная биохимия и микробиология, 2021, T. 57, № 5, стр. 417-431
Неферментативные реакции в метаболизме: роль в эволюции и адаптации
О. В. Космачевская 1, А. Ф. Топунов 1, *
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: aftopunov@yandex.ru
Поступила в редакцию 02.04.2021
После доработки 15.04.2021
Принята к публикации 22.04.2021
Аннотация
Метаболизм может быть представлен как сеть ферментативных и неферментативных (спонтанных) биохимических процессов. Одной из важнейших частей неферментативного метаболизма являются реакции, включающие образование и окислительно-восстановительные превращения высоко реакционноспособных соединений: активных форм кислорода, азота, серы, галогенов и активных карбонильных соединений. Все эти активные формы объединяет одно общее свойство – спонтанное взаимодействие с аминокислотными остатками белков. Активные формы (или активные метаболиты) долгое время изучали с позиций их способности оказывать токсическое действие на клетки. Позже направление исследований сместилось в сторону изучения их сигнальных и регуляторных свойств. Стало понятно, что эти реакционноспособные соединения в низких концентрациях необходимы живым системам. Они могут регулировать рост и развитие организма. С одной стороны, они обеспечивают устойчивость биологических макромолекул и живых систем, с другой, способствуют фенотипической изменчивости через демаскирование скрытой вариабельности. В обзоре обсуждается роль этих соединений как регуляторов метаболической пластичности и эволюционируемости.
Формирование представления о метаболизме происходило на протяжении длительного времени и по мере развития биологического знания обогащалось новыми реакциями и процессами. При этом в классическом учебнике “Биохимия” Ленинджера [1], изданном в 1970 г., не было раздела, посвященного биохимии высоко реакционноспособных соединений (редокс-активных веществ). Нет такого раздела и в последующих изданиях, а также в других известных учебниках по биохимии. Дело в том, что редокс-активные вещества не причисляют к биомолекулам. Считалось, что, если они и образуются в живых организмах, то, как правило, случайно. Это мнение господствовало до тех пор, пока не накопилось достаточно доказательств их необходимости для нормальной жизнедеятельности клетки и организма [2].
Редокс-активными метаболитами чаще всего называют активные формы кислорода, азота, серы и галогенов. У этих разных по химическому строению веществ есть ряд общих свойств, благодаря которым их можно отнести к одной группе реакционноспособных биологических соединений или просто активных соединений. Во-первых, многие из этих веществ являются “побочными” продуктами метаболизма. Во-вторых, их реакционная активность зависит от окислительно-восстановительных условий в клетке. В-третьих, они спонтанно (не контролируемо энзиматически) вступают в реакции с биомолекулами – белками, углеводами, липидами, нуклеиновыми кислотами, образуя широкий спектр модифицированных веществ с измененными структурными и функциональными свойствами. В-четвертых, эти вещества в зависимости от концентрации оказывают разнонаправленное действие на биологические системы.
В живых организмах активные метаболиты образуются либо целенаправленно при участии ферментов, либо спонтанно в неферментативных реакциях (табл. 1). Превышение этими веществами базального уровня приводит к развитию определенного типа метаболического стресса: окислительного (или оксидативного), вызванного действием активных форм кислорода (АФК), нитрозативного – действием активных форм азота (АФА), карбонильного – действием активных кабонильных соединений (АКС), галогенирующего – действием активных соединений галогенов. Все эти стрессы являются разновидностями редокс-стресса [3], который также включает редуктивный и электрофильный стресс. Известно, что АФК и АФА играют в метаболизме клетки двоякую роль: в низких концентрациях они выступают в роли сигнальных молекул, а в высоких концентрациях оказывают повреждающее действие на биомолекулы [2, 4–8]. Двойственным действием обладают и активные карбонильные соединения (метилглиоксаль, глиоксаль, малоновый диальдегид, кротоновый альдегид, акролеин, 4-гидрокси-2-ноненаль, 4-гидрокси-2-гексаналь) [9–12]. Еще Сент-Дьердьи в 1970 гг. показал, что усиленная утилизации активных карбонильных соединений приводит к прекращению роста клеток, точно так же, как и нарушения в системе детоксикации АКС [13].
Таблица 1.
Ферментативные и неферментативные пути образования редокс-активных метаболитов в клетке
| ФЕРМЕНТАТИВНЫЕ МЕХАНИЗМЫ |
Активные метаболиты |
НЕФЕРМЕНТАТИВНЫЕ МЕХАНИЗМЫ |
|---|---|---|
| 1. Электрон-транспортная цепь 2. Оксидоредуктазы 3. НАДФН-оксидаза 4. Липоксигеназа 5. Циклооксигеназа 6. Ксантиноксидаза 7. NO-синтазы в состоянии разобщения 8. Цитохром P-450 монооксигеназа |
${\text{O}}_{2}^{{\centerdot - }}$ | 1. Автоокисление флавина, хинола, железа, катехоламинов 2. Реакция кислорода со свободными радикалами семихинона 3. Ионизирующая радиация |
| 1. Электрон-транспортная цепь 2. Супероксиддисмутаза 3. НАДН-убихинонредуктаза 4. Убихинол-цитохром с редуктаза 5. Оксидазы аминокислот 6. Цитохром Р450 7. Восстановление ONOO− цитохромоксидазой |
H2O2 | 1. Спонтанная дисмутация ${\text{O}}_{2}^{{\centerdot - }}$ 2. Реакции гидроперекисного радикала с убихинолом 3. Взаимодействие ONOO− с GSH |
| Реакция пероксида водорода с ионами хлора, катализируемая миелопероксидазами, пероксидазой эозинофилов, лактопероксидазой, тироидпероксидазой | HOCl | |
| 1. NO-синтаза 2. Нитритредуктазная реакция, катализируемая гемопротеидами 3. Одноэлектронное восстановление ONOO– цитохромоксидазой |
NO | 1. Восстановление нитритов эндогенными восстановителями в условиях ацидоза 2. Восстановление нитро- и нитрозо- органических соединений 3. Восстановление азотистой кислоты (растения) |
| ONOO– | 1. Реакция NO с супероксидным-анион радикалом 2. Реакция NO– с молекулярным кислородом |
|
| 4-HNE* | Перекисное окисление ненасыщенных жирных кислот, фосфолипидов, гликолипидов и холестерина активными формами кислорода | |
| 1. Метилглиоксаль-синтаза (прокариоты) 2. Псевдометилглиоксальсинтазная реакция, катализируемая цитохромом Р450, миелопероксидазами, аминооксидазами |
MG** | 1. Спонтанный гидролиз фосфатной группы
от дигидроксиацетонфосфата 2. Окислительная фрагментация глюкозы 3. Перекисное окисление липидов 4. Окисление ацетола |
К настоящему времени накоплено достаточно фактов, показывающих, что как недостаток реакционно-активных соединений, так и их избыток негативно сказывается на состоянии клетки. Метаболизм клетки как бы запрограммирован на определенный баланс окислителей и восстановителей, акцепторов и доноров. Смещение этого баланса в сторону окислителей или акцепторов приводит к возникновению окислительного или электрофильного стресса. Напротив, смещение баланса в сторону восстановителей или доноров приводит к возникновению редуктивного стресса.
ПРЕДСТАВЛЕНИЕ О НЕФЕРМЕНТАТИВНОМ МЕТАБОЛИЗМЕ
Понятие “метаболизм” является одним из фундаментальных понятий биохимии и физиологии. В современном понимании метаболизм рассматривается как сложная система с большим количеством веществ и взаимосвязей между ними. За последние 20 лет в нее вошли и реакции, не вполне укладывающиеся в традиционное понимание метаболизма, хотя бы потому, что они не высоко интегрированы и не всегда целенаправлены. Эти реакции образуют так называемый альтернативный метаболизм, для обозначения которого в литературе можно встретить следующие термины: “параметаболизм”, “скрытый метаболизм”, “неканонический метаболизм”, “паралогический метаболизм”.
Первым, кто обратил внимание на присутствие в метаболизме неферментативных реакций и указал на их значение для живых систем, был Бартош [14]. Затем Голубевым была описаны основные спонтанно протекающие реакции и приведен перечень продуктов неферментативных взаимодействий [15]. Даже самим названием своей статьи “Изнанка метаболизма” он пытался показать, что понятие “метаболизм” шире традиционных представлений и включает реакции, не подчиняющиеся “молекулярной логике живого”. Для обозначения этой оборотной стороны метаболизма и были введены термины “параметаболизм” и “параметаболиты”.
Параметаболиты – это побочные продукты канонических метаболических путей и продукты неканонических метаболических путей. Список веществ, которые можно отнести к группе параметаболитов, достаточно обширен и включает вышеупомянутые АФК и АФА, реакционоспособные соединения серы и галогенов [12, 15, 16]. Отдельную группу реакционно-активных параметаболитов образуют продукты окисления глюкозы и липидов – АКС, вступающие в реакции неферментативного гликирования [9–12]. Описано около 500 неферментативных реакций, обнаруженных в биологических системах [17], большинство из которых наблюдаются крайне редко, поскольку в них участвуют малораспространенные соединения. Среди неферментативных реакций наиболее широко представлены реакции с участием свободных радикалов и реакции неферментативного гликирования.
В 1998 г. в биологическую науку было введено понятие о “скрытом метаболизме” (underground metabolism) [18]. Скрытый метаболизм включает реакции, которые катализируются нативными ферментами, в случае использования ими эндогенных метаболитов в качестве альтернативных субстратов. В 2015 г. Келлер с соавторами предложил использовать понятие “неканонического метаболизма”, объединяющего неферментативные реакции и побочные ферментативные [19, 20].
Появление реакционноспособных “случайных” метаболитов обусловлено несколькими причинами: 1) избыточной химической активностью метаболитов и 2) низкой избирательностью ферментов – появлением субстратной и/или каталитической мультиспецифичности, 3) реорганизацией метаболического потока.
Келлер предложил разделить неферментативные реакции, протекающие в клетке, на низкоспецифичные, задействующие широкий диапазон субстратов, специфичные и реакции, протекающие одновременно с ферментативными и неферментативными путями [19]. В табл. 2 приведены примеры таких реакций.
Таблица 2.
Примеры реакций в современном метаболизме, осуществляющиеся неферментативным способом
| Неферментативные реакции | Реакции, имеющие ферментативный путь | |
|---|---|---|
| Низкоспецифичные реакции | Специфичные реакции | |
| ▪ Нитрозилирование, нитрование биомолекул и образование нитрозаминов в реакции с АФА | ▪ Синтез витамина D3 под действием УФ лучей |
▪ Трансаминирование глиоксиловой кислоты |
| ▪ Образование оснований Шиффа и аддуктов Михаэля в реакции электрофильных соединений
с лизином, аргинином, гистидином и цистеином полипептидов ▪ Образование дисульфидной связи между остатками цистеина в полипептидах ▪ Карбоксилирование остатков лизина в белках ▪ Деамидирование остатков аспарагина и глутамина в полипептидах ▪ Образование нейротоксинов в реакции Пикте-Шпенглера (взаимодействие биогенных аминов с карбонилсодержащими соединениями) |
▪ Фотоиндуцированная цис/транс изомеризация ретиноевой кислоты в родопсине | ▪ Декарбоксилирование аминомалоновой кислоты ▪ Образование оксистеролов из холестерина ▪ Глутатионирование белков. ▪ Ацилирование белков ▪ Изомеризация дигидроксиацетонфосфата в глицеральдегид-3-фосфат ▪ S-глутатионилирование и S-нитрозилирование тиоловых групп цистеина белков ▪ Гликозилирование белков ▪ Сульфирование белков ▪ Восстановление дисульфидной связи в полипептидах ▪ Образование NO в реакции восстановления нитрит-ионов. ▪ Образование супероксидного радикала ▪ Восстановление пероксида водорода |
В живых системах предусмотрены различные пути управления ферментативными и неферментативными реакциями. Регуляция ферментативных реакций (скорость и направленность) происходит за счет изменения конформации молекулы фермента, в то время как регуляция неферментативных реакций осуществляется за счет изменения физико-химических параметров среды, а также на уровне генерации и/или детоксикации активных форм (табл. 3). Между этими двумя путями нет четкой границы. С одной стороны, участвующие в неферментативных реакциях активные формы, осуществляя посттрансляционную модификацию белков и регуляторных РНК, изменяют их конформацию и тем самым влияют на ферментативный метаболизм [21]. С другой стороны, функционирование антиоксидантных и антигликирующих ферментов определяет стационарные концентрации активных форм.
Таблица 3.
Пути управления ферментативными и неферментативными реакциями
| Неферментативные реакции | Ферментативные реакции |
|---|---|
| ▪ Изменение стационарных концентраций активных форм за счет их элиминации антиоксидантами
или связывания в малоактивные и неактивные комплексы ▪ Действие неспецифических катализаторов (например, Fe, Cu) и ингибиторов (например, хелаторы Fe и Cu) ▪ Изменение параметров среды (например, рН, температура, ионная сила, слабые магнитные поля) ▪ Саморегуляция за счет организации реакций в сопряженные редокс-циклы |
▪ Генетический/транскрипционный механизм. ▪ Доступность кофактора ▪ Аллостерический механизм ▪ Посттрансляционные модификации ▪ Диссоциация/ассоциация каталитической и регуляторной субъединиц ▪ Адсорбция на компонентах мембраны ▪ Самосборка белков в мультиферментные комплексы ▪ Специфический протеолиз |
| Системы генерации и/или детоксикации активных форм | |
РОЛЬ НЕФЕРМЕНТАТИВНЫХ РЕАКЦИЙ В БИОЛОГИЧЕСКОЙ ЭВОЛЮЦИИ
Несмотря на то, что многие активные метаболиты играют значительную роль в развитии различных патологий, все чаще отмечается целесообразность их присутствия в клетке. Основные функции неферментативных реакций и процессов в клеточном метаболизме перечислены в табл. 4.
Таблица 4.
Функции ферментативного и неферментативного метаболизма в клетке
| Неферментативный метаболизм | Ферментативный метаболизм | |
|---|---|---|
| Неферментативные реакции | Изменение ионного баланса | |
| ▪ Участие во внутриклеточной и межклеточной сигнализации | ▪ Создание электрического мембранного потенциала |
▪ Расщепление сложных органических соединений с высвобождением энергии |
| ▪ Защита от чужеродных микробных агентов ▪ Регуляция деградации мембранных фосфолипидов посредством активации различных форм фосфолипаз ▪ Регуляция физико-химических свойств фосфолипидных мембран ▪ Регуляция ионных каналов ▪ Создание редокс-среды, формирующей определенные структурные и функциональные свойства макромолекул ▪ Фактор стресс-индуцированного мутагенеза в бактериальной популяции для формирования фенотипического полиморфизма |
▪ Поддержание осмотического давления ▪ Обеспечение необходимого значения рН ▪ Регуляция трансмембранного переноса различных веществ ▪ Участие во внутри- и межклеточной сигнализации ▪ Регуляция вязкости наружных и внутренних мембран ▪ Создание микросреды, формирующей определенные структурные и функциональные свойства макромолекул ▪ Создание условий молекулярного краудинга |
▪ Процессы биосинтеза веществ для построения и обновления клеточных структур и тканей ▪ Реализация генетической информации ▪ Поддержание электролитного баланса и рН ▪ Обеспечение функционирование систем клеточной сигнализации ▪ Борьба с неферментативными реакциями ▪ Репарация повреждений макромолекул ▪ Механическая работа |
Появление активных метаболитов приобретает особое значение в условиях стресса, когда они выступают в роли медиаторов фенотипической и генетической изменчивости. Зачастую происходящая в условиях стресса реорганизация метаболических сетей допускает усиленную генерацию активных форм (АФК и АКС) [12, 22], которые могут разными путями повышать вероятность адаптации клетки или популяции клеток.
Влияние стрессовых состояний на метаболизм и метаболом подробно рассмотрено в статье [20]. Здесь мы лишь вкратце опишем основные способы повышения эволюционного потенциала биологических систем при участии случайных химически активных метаболитов.
Защитное действие активных форм может проявляться напрямую и опосредованно. Прямая защита заключается в стабилизации белков клетки, например за счет образования внутрибелковых дисульфидных связей [23, 24] и комплексов с металлами [25, 27]. Опосредованная защита включает следующие процессы:
1) Регуляция центральных сигнальных путей клетки, в том числе ответственных за реакцию на стресс [11, 12, 28];
2) Перепрограммирование эпигенома через непосредственную модификацию гистонов и опосредованно через модификацию гистон-деацетилаз и ДНК-метилаз [11, 12];
3) Реорганизация метаболизма, появление дополнительных реакций за счет мультиспецифичности ферментов [29];
4) Запуск механизма стресс-индуцированного мутагенеза [22, 30].
Функционирование активных метаболитов в качестве датчиков стресса и регуляторов метаболической памяти мы описали в статье [12]. Здесь мы рассмотрим роль активных форм в реорганизации метаболизма и запуске стресс-индуцированного мутагенеза.
АФК, АФА и АКС, действуя как посттрансляционные модификаторы ферментов, могут влиять на их избирательность по отношению к каноническим субстратам или катализируемым реакциям. В результате этого в метаболизме появляются дополнительные реакции, некоторые из которых могут оказаться полезными для организма в изменившихся (стрессовых) условиях. Вышесказанное проиллюстрировано на рис. 1. Описанный механизм имеет большое значения для повышения адаптивного потенциала популяций бактериальных клеток [22].
Рис. 1.
Роль реакционноспособных метаболитов в реорганизации метаболизма в стрессовых условиях: выключение одних реакций из-за инактивации ферментов и появление дополнительных реакций, катализируемых модифицированными формами ферментов. Среди продуктов реакций могут быть активные формы: АФК, АФА и АКС.

Для закрепления нового типа организации метаболических путей необходимы кодовые системы, которые не обязательно являются новыми, а могут быть побочным продуктом процессов, изначально направленных на другие цели. Такими кодовыми системами могут быть некоторые посттрансляционные модификации, которые возникли как случайные и вредные, но впоследствии были приспособлены для нужд метаболизма. Например, неферментативный характер нитрозилирования – широко распространенной модификации белков, использующейся в трансдукции сигнала, указывает на ее “случайное” прошлое в метаболизме [31].
Рассмотрим и другой потенциальный способ защиты клетки в стрессовых условиях, заключающийся в запуске механизма стресс-индуцированного мутагенеза. Считается, что эволюция организмов происходит в направлении уменьшения энтропии. Контроль над энтропией последовательно распространяется по этапам передачи информации от ДНК к белку [20]. Самый значительный антиэнтропийный механизм – многоуровневая система контроля частоты ошибок, действующая на уровне репликации, транскрипции, трансляции, укладки и сортировки белков. Однако глобальная антиэнтропийная направленность эволюции не исключает одновременного существования механизмов, повышающих частоту ошибок.
Можно допустить, что образование редокс-активных молекул метаболически запрограммировано с целью поддержания определенной частоты фенотипических мутаций, которые не могут быть устранены антиэнтропийными механизмами, с целью обеспечения изменчивости, необходимой для эволюции. Обычно под фенотипическими мутациями понимают последствия ошибок транскрипции и трансляции. Мы полагаем, что вполне допустимо к фенотипическим мутациям отнести и стабильные неферментативные посттрансляционные модификации, вызванные химически активными метаболитами. В поддержку этой идеи выступает тот факт, что образование активных метаболитов в сильной степени стимулируется различными видами стресса. Эти соединения увеличивают фенотипическую изменчивость через совместный эффект посттрансляционных модификаций (непосредственное образование изменчивости) и проявления скрытой изменчивости (например, через HSP90) [12].
Описана роль АФК в эволюционном процессе и адаптации к стрессу [32, 33]. АКС в этом контексте менее изучены. В настоящее время активно обсуждается их роль в метаболизме, как посредников сигналов АФК [34, 36]. АФК индуцируют реакции перекисного окисления липидов, продукты которых – ненасыщенные альдегиды и кетоны, ковалентно модифицируют белки в неферментативных реакциях образования оснований Шиффа и аддуктов Михаэля.
К настоящему времени достаточно хорошо изучен механизм эволюционируемости с участием прионоподобных белков грибов. Показано функционирование прионов в качестве эволюционного “конденсатора”, накапливающего критические генетические вариации и обнажающего их в стрессовых условиях [37]. Прионы обеспечивают механизм быстрого появления в условиях стресса новых фенотипов, некоторые из которых могут иметь адаптивную ценность. Можно провести параллель между прионным механизмом эволюционируемости и аналогичным механизмом с участием активных форм. Во-первых, образование прионов и активных метаболитов стимулируется стрессом. Во-вторых, и прионы и активные метаболиты прежде всего оказывают влияние на гомеостаз белков. В-третьих, эти вещества участвуют в передаче информации, построенной на основе белков. Прионы индуцируют автокаталитическую пролиферацию белковых агрегатов, активные метаболиты через посттрансляционные модификации индуцируют образование белковых агрегатов, а также влияют на белковые детерминанты эпигенетической наследственности. В обычных условиях прионные белки и активные метаболиты вредны, поскольку первые снижают точность трансляции, а вторые вызывают неконтролируемые посттрансляционные модификации. Однако в условиях стресса эти вещества обеспечивают возможный механизм для быстрого приобретения новых фенотипов.
Обобщая вышесказанное, можно заключить, что в основе своей организации биологические системы являются квази-детерминированными, т. е. сочетают предопределение и случайность. Случайность в сочетании с естественным отбором является инструментами эволюции не только обмена веществ, но и генома [38].
РОЛЬ АКТИВНЫХ ФОРМ В РАЗВИТИИ АДАПТАЦИОННЫХ РЕАКЦИЙ КЛЕТКИ
Неспецифический адаптационный синдром клетки. Всем живым организмам для выживания необходимо адаптироваться к меняющимся условиям окружающей среды. Структурной и функциональной единицей организма является клетка, поэтому изменения в организме, происходящие при развитии адаптационных реакций, не могут не затрагивать клеточные системы. Ответ клеток на действие различных факторов сочетает общие (неспецифические) и специфические черты. Особенно отчетливо неспецифические реакции проявляются при высокоинтенсивных воздействиях, вызывающих повреждения.
Впервые стереотипный, неспецифический характер реакции на клеточном или тканевом уровне на действие разнообразных факторов описал Введенский [39]. Им был предложен термин “парабиоз” (около жизни), обозначающий состояние, близкое к смерти. В литературе можно встретить другие термины с аналогичным содержанием – “некробиоз” (на грани смерти и жизни) и “паранекроз” (около смерти). Все эти термины обозначают состояние клеток, развивающих комплекс признаков, соответствующих последним обратимым фазам повреждения.
Изучению стресса на клеточном уровне было посвящено огромное количество работ. Особого внимания заслуживают идеи основоположника этого направления в науке Насонова, и его последователей Александрова и Брауна. Насонов, воздействуя на различные клетки возрастающими дозами факторов различной природы, обнаружил двухфазный ответ клетки на стресс [40]. Впоследствии ученики Насонова связали это явление с разворачиванием нативной структуры белков и к освобождению реакционных центров, прежде всего SH-групп [41]. В этих работах было показано, что белки обнаруживают сходные изменения при раздражении и повреждении клетки, что позволило сформулировать “денатурационную теорию повреждения и возбуждения” [40]. Была также установлена роль конформационных изменений белков (лабилизации и стабилизации) в адаптации клеток [41]. Существование однотипных, неспецифических изменений физико-химических и метаболических параметров было описано при развитии адаптационной реакции клетки, что позволило применить по отношению к клетке понятие неспецифического адаптационного синдрома [42], которое ранее употребляли только по отношению к организму [43, 44]. Матвеев предложил обозначать неспецифическую компоненту клеточного ответа термином универсальная клеточная реакция [45].
Развитие адаптационного синдрома клетки сопровождается изменениями морфологических, физико-химических и биохимических параметров. Приведем наиболее общие, ранние и постоянные признаки повреждения клетки:
1) активация свободнорадикального окисления фосфолипидов мембран;
2) нарушение функционирования мембранных ферментов;
3) изменение свойств мембран – микровязкости, фосфолипидного состава, проницаемости и т.д.;
4) выход из клеток различных веществ (неорганических ионов, молочной, пировиноградной, кетоглутаровой кислот, белков, аминокислот);
5) разобщение окислительного фосфорилирования, прекращение дыхания;
6) усиление аэробного гликолиза;
7) ацидотический сдвиг (сдвиг pH цитоплазмы с 7.32–7.45 до 6.5–5.39);
8) выход из клетки калия, вход натрия и воды.
Эти изменения могут быть биологически целесообразными, т.е. до определенной степени выраженности они носят адаптивный характер и направлены на стабилизацию метаболизма при стрессе. В табл. 5 мы привели некоторые такие процессы, которые происходят в клетке на ранних стадиях действия стрессовых факторов до синтеза стрессовых белков.
Таблица 5.
Первичные неспецифические процессы, происходящие в клетках при действии различных факторов (механической деформации, света, химических агентов, температуры, электромагнитных волн) и их биологическое адаптивное значение
| Процесс | Биологическое значение |
|---|---|
| Образование АФК | Изменение функции ключевых регуляторных белков за счет окислительно-восстановительных
модификаций. Окисление белковых цистеинов, образование S–S связей и комплексов с металлами, что приводит к временному снижению активности и увеличению стабильности белка. Увеличение проницаемости мембран и торможение H+-АТФ-азы как следствие закисления цитоплазмы |
| Инициация реакций ПОЛ, приводящих к появлению АКС | Модификация остатков цистеина и гистидина за счет образования аддуктов Михаэля и оснований Шиффа. Блокирование ряда идущих в нормальных условиях ферментативных процессов |
| Внутриклеточный ацидоз | Активация гидролитических ферментов с оптимум в кислой зоне. Усиление распада белков
и липидов, приводящее к увеличению пула низкомолекулярных соединений (аминокислот,
полиаминов, карнозина, неорганического фосфата, свободных жирных кислот и др.). Участие продукты биодеградации в синтезе биополимеров, востребованных в условиях стресса. Полимеризация актина, уменьшение доли реакционноспособных остатков цистеина в белках, торможение физиологических процессов. Стабилизирующее действие внутриклеточной кислой среды на клеточную мембрану |
| Адсорбция белков на мембране | Адсорбция нефункционирующих белков на мембранах удлинняет время их жизни, в том числе за счет повышения устойчивости к протеолизу. Адсорбированные белки оказывают стабилизирующее действие на мембрану |
| Разобщением окислительного фосфорилирования с дыханием | Начальная активация дыхания сменяется разобщением окислительного фосфорилирования с дыханием, что приводит к снижению уровня АТФ и прекращению энергозатратных процессов |
| Активация аэробного гликолиза |
Переход на гликолиз позволяет клетке поддерживать энергетическую функцию в стрессовых условиях, поскольку гликолитический механизм синтеза АТФ более устойчив, чем окислительное фосфорилирование |
| Снижение содержания NADH и NAD(P)H | “Выжигание” избытков восстановительных эквивалентов” снижает продукцию активных форм кислорода |
| Выход K+ из клетки |
Снижение активности ферментов, функционирование которых зависит от присутствия ионов калия |
| Повышение свободного Ca2+ | Ионы Ca2+ оказывают стабилизирующее действие на белки и липиды мембраны, стимулируют активность фосфолипаз и НАДФН-оксидаз, что приводит к усилению продукции АФК |
| Полимеризация актина | Увеличение вязкости цитоплазмы, замедляющее диффузию |
Многие из этих процессов направлены на повышение стабильности макромолекул, снижение чувствительности и функциональности клетки, что приводит к снижению метаболической активности. Это состояние можно обозначить как “аварийный режим”. Переход клетки в такой режим сопровождается блокировкой ряда реакций, без которых можно обойтись, и включением других реакций, обеспечивающих устойчивость клеточной системы. Сужение метаболической активности направлено на сохранение резервов клетки для последующего восстановления.
Одним из факторов, стабилизирующих белковые молекулы и снижающих их реакционную активность, являются активные метаболиты (АФК и АКС), уровень которых повышается на начальных стадиях повреждения (развития стрессовой реакции) [46]. АФК продуцируются в результате нарушения метаболизма или как часть сети восприятия и передачи стрессового сигнала. Метаболические АФК напрямую изменяют окислительно-восстановительный статус ферментов, тем самым перестраивая метаболические потоки. Кроме того, они могут влиять на транскрипцию и трансляцию, изменяя активность ключевых регуляторных белков. Сигнальные АФК генерируются в ответ на стресс датчиками стресса, например, НАДФН-оксидазой.
Приспособление клетки к стрессовым условиям окружающей среды может быть краткосрочным или долговременным. Во втором случае включаются изменения в аппарате транскрипции, что приводит к синтезу стрессовых белков (белки теплового шока, шапероны, антиоксидантные ферменты, белки-антифризы и др.) Кроме того длительное и систематическое повторение воздействия, не выходящего за границы физиологического стресса, может индуцировать перестройки в эпигеноме [47]. Поскольку для реализации ответа, затрагивающего генную экспрессию, требуется время, в клетке предусмотрены механизмы быстрого ответа, формирующие краткосрочную адаптацию. Примером последнего является изменение конформации и биологической активности фермента при связывании активного метаболита с его регуляторным центром. Регуляторными центрами могут быть как структуры, комплементарные структуре биорегулятора, так и реакционноспособные аминокислотные остатки (например, цистеина или гистидина) в определенном участке полипептидной цепи. Первый тип регуляции является аллостерическим, второй – сайт-специфическим [12].
Активные метаболиты – индукторы метаболической пластичности. На различных экспериментальных моделях показано, что механизмы адаптации живых систем подчиняются правилу гормезиса. Гормезисом назван процесс, благодаря которому низкие дозы токсических веществ или факторов стресса делают клетку или весь организм более устойчивым к более высоким токсичным дозам стрессора за счет активации механизмов стрессоустойчивости. Гормезис – эволюционно консервативный универсальный адаптационный ответ, обеспечивающий метаболическую пластичность живых систем [48–50]. Графически он выражается в виде двухфазной U-образной или перевернутой U-образной кривой в координатах доза-ответ (рис. 2). Эта кривая описывает изменение уровня реактивности живой системы в зависимости от силы воздействия какого-либо фактора. Две фазы на гормезисной кривой (фаза активации и фаза угнетения функции) рассматриваются не как разные процессы, а как разные стадии одного и того же процесса развития адаптивного ответа [49]. Гормезисная кривая описывает пределы, до которых функции клетки (пролиферация, рост, миграция и др.) или организма (сложное поведение, обучение, память и др.) могут изменяться под действием химических или физических факторов [50].
Рис. 2.
Кривая, описывающая двухфазный ответ живой системы на различные факторы в зависимости от интенсивности воздействия.

История изучения двухфазных реакций берет начало с 1880 гг., когда Шульц испытывал различные дезинфицирующие средства на дрожжевых клетках [51]. Термин “гормезис” впервые был упомянут в 1943 г. в работе Соутхама и Эрлиха, исследовавших действие экстрактов красного кедра на метаболизм грибов [52]. В настоящее время концепция гормезиса активно развивается группой Калабрезе [49, 50, 53].
Гормезисный ответ присущ разным уровням организации живой материи – от белков до целого организма [50]. Живые организмы таким образом адаптируются к краткосрочным и долгосрочным стрессам [50, 54]. Однако до сих пор нет полного понимания молекулярных механизмов, обеспечивающих гормезис. Можно лишь сказать, что на каждом уровне структурной организации действуют свои механизмы. Реакция клетки, как правило, включает комплексную адаптивную программу, направленную на повышение антиоксидантной и электрофильной защиты. Происходит это благодаря двойственному действию активных метаболитов (АФК, АФА и АКС), которые в низких дозах активируют сигнальные пути ответа на стресс через неферментативные ПТМ метаболических и сигнальных ферментов, белков цитоскелета и факторов транскрипции (NF-kB, FoxOs, Nrf2 и другие редокс-регулируемые факторы) [11]. На рис. 3 показана роль активных метаболитов как индукторов гормезиса. Активные метаболиты опосредуют адаптивный гормезисный ответ клетки или организма на стресс через неферментативные посттрансляционные модификации (ПТМ) белков: окисление, нитрование, нитрозилирование, хлорирование, липоксидирование, гликирование.
Рис. 3.
Опосредование адаптивного гормезисного ответа клетки или организма на стресс через неферментативные посттрансдяционные модификации белков. HNE – 4-гидрокси-2-ноненаль, MDA – малоновый диальдегид, MG – метилглиоксаль, TPI – триозофосфатизомераза, GAPDH – глицеральдегид-3-фосфатдегидрогеназа, OXPHOS – окислительное фосфорилирование, NOS – NO-синтаза.

Существенная роль в обеспечении гормезиса отводится АФК [55, 57]. Считается, что их продукция при низком и умеренном стрессе помогает клетке или организму адаптироваться к более сильным воздействиям. Поэтому для улучшения состояния здоровья и общей резистентности организма рекомендуют регулярную умеренную физическую активность, при которой образуются АФК [56]. Источником АФК при физических упражнениях выступают не только митохондрии, но и ферментативные реакции, катализируемые НАДФН-оксидазой, ксантиноксидазой и моноаминоксидазой. Образование АФК может быть вызвано кратковременной гипоксией из-за интенсивного потребления кислорода скелетными мышцами [58]. Активация антиоксидантных систем происходит и в других случаях, например, при умеренном потреблении алкоголя, вызывающем продукцию АФК [59].
Помимо физической активности, улучшению здоровья и увеличению продолжительности жизни способствует снижение калорийности питания или низкоуглеводная диета [60–62]. Этот эффект связан с уменьшением гликолитического потока, что сопряжено со снижением продукции метилглиоксаля, который за счет реакций неферментативного гликирования способствует старению клетки. С другой стороны, незначительные количества MG необходимы клетке для поддержания активности шаперона и антиапоптотического белка Hsp27 [62]. Поэтому обсуждается благотворный эффект периодического голодания, благодаря которому возможно поддержание продукции MG и АФК на уровне, достаточном для активации сигнальных путей защиты, и недостаточном для проявления токсического действия [61, 62].
Тот факт, что АФК и АКС необходимы организму для поддержания активности защитных систем, ставит под сомнение целесообразность приема больших количеств антиоксидантов и исключение из диеты углеводов.
БЕЛКОВЫЕ ЦИСТЕИНЫ – СЕНСОРЫ АКТИВНЫХ МЕТАБОЛИТОВ
Проявление неспецифической компоненты в адаптационном ответе клетки во многом является следствием взаимодействия активных метаболитов с реакционноспособными остатками цистеинов различных белков, в том числе ферментов, факторов транскрипции, мембранных каналов, рецепторов, белков цитоскелета [63–65]. Окислительно-восстановительные модификации цистеинов влияют на каталитическую активность, скорость обмена, субклеточную локализацию белков, белок-белковые [66] и белок-мембранные взаимодействия [67]. Они часто сочетаются с фосфорилированием/дефосфорилированием и с кальций-зависимыми путями передачи сигнала [68]. Таким образом происходит интеграция случайных реакций с ферментативным метаболизмом.
Цистеин не случайно был эволюционно выбран на роль датчика редокс-состояния клетки и активных метаболитов. Во-первых, эта аминокислота взаимодействует со многими АФК и АКС [36, 63, 64], а во-вторых, большая часть модификаций цистеина обратима. Обычно реакции между активными формами и белковыми цистеинами являются сайт-специфическими. Они зависят от микроокружения в молекуле белка, определяющего степень ионизации и доступность для воздействия активных метаболитов [12, 64, 69]. Белки, содержащие реакционноактивные SH-группы, получили название редокс-переключателей [36, 68]. На рис. 4 представлены основные продукты реакции цистеина с активными метаболитами. Совокупность посттрансляционных модификаций белковых цистеинов формирует так называемый цистеиновый протеом клетки.
Рис. 4.
Сопряжение окислительно-восстановительного метаболизма с ферментативным через цистеиновый протеом. CMC – карбоксиметилцистеин, CEC – карбоксиэтилцистеин, MG – метилглиоксаль.
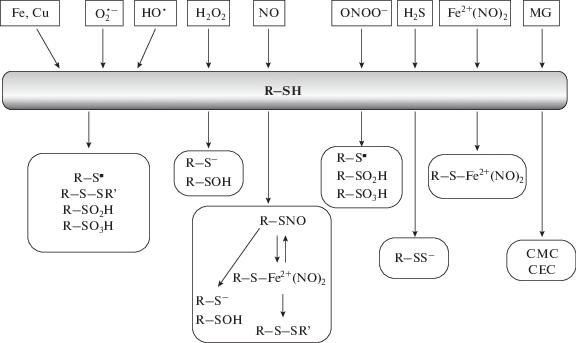
Благодаря высокой чувствительности к редокс-активным метаболитам, цистеины функционируют как датчики окислительно-восстановительной среды клетки и активных метаболитов (окислителей и электрофилов). Окисленные или восстановленные тиолы – это своего рода переключатели для путей передачи сигнала, чувствительных к изменению окислительно-восстановительного состояния в условиях стресса [68]. Чаще всего цистеины подвергаются атаке со стороны АФК, а именно H2O2 и органических перекисей. В реакцию вступают только депротонированные цистеины в форме тиолата (–S–). Окисление тиолата пероксидами приводит к образованию сульфеновой кислоты (–SOH), которая является ключевым игроком в окислительно-восстановительной передаче сигналов [64, 70]. Цистеинсульфеновые кислоты нестабильны и могут быть дополнительно окислены до необратимых форм: сульфиновой (‒SO2H) и сульфоновой (–SO3H) кислот. Возможны и другие модификации: образование дисульфидных связей (–SS–), S-глутатионилирование (–SSG) и образование сульфенамида (–SN=).
Разнонаправленное действие активных метаболитов отчасти объясняется их способностью активировать или блокировать сульфгидрильные группы белков редокс-переключателей в зависимости от концентрации. Благодаря этому настраивается чувствительность и резистентность клетки к данным окислительно-восстановительным условиям. В определенном интервале концентраций эти вещества могут высвобождать реакционный потенциал SH-групп. Механизмы активации могут быть разными. Наиболее интересен путь повышения реакционной способности SH-групп за счет распада лабильного комплекса, в состав которого они входят [23, 26, 69]. Это могут быть и комплексы с металлами (Fe, Zn, Сu, Ca).
Связывание белками металлов может быть одним из механизмов временного “выключения” белка из метаболических превращений в условиях сильного нарушения редокс-условий (окислительный, нитрозативный и карбонильный стресс).
В белках по мере нарушения пространственной структуры возникают дополнительные центры связывания металлов, в результате чего в клетке образуются стабильные белковые агрегаты со сниженной функциональной активностью [71]. Прогрессивное образование металл-белковых комплексов наблюдается при старении и в результате действия на белок повреждающих агентов, накапливающихся при развитии окислительного стресса и/или нарушении обменных процессов в организме [72, 73].
Одним из способов стабилизации белков и снижения их реакционной способности может быть включение белковых SH-групп в комплексы с NO (R–S–Fe2+(NO)2) [69] (рис. 4). Образование таких комплексов блокирует цистеиновые остатки в нормальных условиях и сенсибилизирует их в условиях электрофильного/окислительного стресса, поскольку тиолы в составе комплекса находятся в активной ионизированной форме (в виде тиолят-аниона) и не нуждаются в предварительном депротонировании.
АКТИВНЫЕ МЕТАБОЛИТЫ – РЕГУЛЯТОРЫ МЕТАБОЛИЗМА РАКОВЫХ КЛЕТОК
Очень важным процессом, который может обсуждаться в данном контексте, является роль АФК в регуляция метаболизма раковых клеток. Такая регуляция также подчиняется механизму гормезиса. Антиоксидантный потенциал опухолевых клеток поддерживает определенный уровень АФК, активирующих проонкогенные сигналы, которые увеличивают выживаемость и пролиферацию клеток, а также устойчивость к апоптозу, но при этом не оказывают повреждающего действия [74].
Как известно, выраженными особенностями метаболизма раковых клеток является усиленный гликолиз даже при наличии высокой концентрации кислорода (эффект Варбурга или аэробный гликолиз) и постоянные высокие уровни АФК [5, 74, 75]. Сначала в ответ на АФК раковые клетки активируют гликолиз, затем АФК ингибируют ферменты гликолиза – глицеральдегид-3-фосфатдегидрогеназу, пируваткиназу M2 и фосфофруктокиназу [76]. Благодаря этому метаболический поток глюкозы перенаправляется на альтернативный пентозофосфатный путь [75], в котором образуется НАДФН – восстановительный эквивалент для антиоксидантных ферментов, включая систему глутатиона и тиоредоксинов [77]. Однако инактивация или ингибирование глицеральдегид-3-фосфатдегидрогеназы способствует поступлению триозофосфатных интермедиатов гликолиза в глиоксалазный путь, в котором образуется активное карбонильное соединение – метилглиоксаль [78], чрезмерное накопление которого может привести к гибели клетки. Благодаря этому, глицеральдегид-3-фосфатдегидрогеназа является важной терапевтической мишенью при лечении рака.
АКТИВНЫЕ ФОРМЫ – ПРОТОБИОРЕГУЛЯТОРЫ
В биологических системах существует особый вид трансдукции сигналов, в основе которого лежит модификация белков активными формами (окислителями и электрофилами). Отрицательные и положительные стороны такой сигнализации продиктованы историей возникновения живых систем, корни которой уходят в глубь эволюционного прошлого клетки, возможно даже в доклеточную эпоху, когда только возникли первые белковые катализаторы.
Восприятие и передача сигнала в современных биологических системах осуществляются белками, которые при действии определенных веществ изменяют структуру и свойства. Современный метаболизм построен на избирательном взаимодействии белков с веществами, однако в протометаболических системах избирательность была скорее исключением, нежели правилом. Белки, скорее всего, реагировали комплексно всеми своими доступными реакционными центрами на различные агенты, воспринимая их как сигналы (раздражители). Способность неспецифически реагировать сохранилась и у современных белков. Она обнаруживается в условиях действия высоких доз раздражителей. Если в современном метаболизме неспецифические реакции, как правило, нежелательны, то в протометаболизме это был обычный способ рецепции сигналов, позволяющей системе приспосабливаться к окружающей среде. Последствия неспецифических взаимодействий могли быть как полезны, так вредны для системы.
Способность активных форм обратимо взаимодействовать с реакционными остатками цистеинов в белках составляет основу внутриклеточной окислительно-восстановительной сигнализации. Именно в спонтанном характере этих реакций, в отсутствие строгой избирательности, кроется причина двойственности их эффектов. В низких концентрациях редокс-активные молекулы преимущественно модифицируют регуляторные белки, в более высоких – и другие белки клетки. В первом случае они действуют как адекватные раздражители (сигнальные молекулы), во втором – как неадекватные, индуцируя комплекс неспецифических адаптационных изменений, которые могут перейти в патологические.
АФК, АФА и АКС можно причислить к универсальным агентам, которые действуют в качестве неспецифических аллостерических эффекторов, доставшихся в наследство современному метаболизму от его эволюционного прошлого, а неспецифическую рецепцию – как одну из ступеней на пути возникновения специфической рецепции. Предположительно, окислительно-восстановительная сигнализация возникла благодаря стабилизации адаптивно ценных посттрансляционных изменений белков, которым они подвергались при нарушении гомеостатических параметров внутриклеточной среды еще на стадии первичных клеток. Такой сценарий происхождения рецепторов из пула белков, изначально подверженных модификации редокс-активными соединениями или участвующих в их метаболизме, представляется вполне правдоподобным.
Следует отметить и тот факт, что многие АФК и АКС являются побочными продуктами путей энергообеспечения клетки: электронтранспортных цепей митохондрий и гликолиза. Это означает, что их внутриклеточная концентрация несет информацию о состоянии катаболических путей, о недостатке пищевых субстратов или, наоборот, об их избытке. Например, побочный продукт гликолиза – метилглиоксаль сигнализирует о неспособности ферментативных путей утилизировать глюкозу. Кроме того, в условиях действия стрессовых факторов энергетические системы клетки страдают в первую очередь. В этом случае АФК и АКС выполняют функцию медиаторов стресса.
* * *
К настоящему времени перечень физиологических процессов пополнился такими явлениями, как окислительный митогенез, эпигенетическое наследование, фенотипическая пластичность, гормезис. Для объяснения механизмов, лежащих в основе этих явлений, представлений о ферментативных метаболических путях оказалось недостаточно. Поэтому назрела необходимость обозначить область в общем метаболизме клетки, которая лишь отчасти обусловлена функционированием ферментных систем и по сути является сетью неферментативных окислительно-восстановительных реакций, вызывающих посттрансляционные модификации белков: окисление, нитрозилирование, нитрование, липоксидирование, хлорирование, гликирование, ацилирование, тиолирование, образование продуктов Михаэля и др.
Возникновение специфичности, основанной на комплементарности структур взаимодействующих молекул, стало предпосылкой для каналирования метаболизма. Как известно, ферменты катализируют реакции, которые могут протекать и в их отсутствие, поскольку они термодинамически возможны. За счет повышения скорости нужных реакций, вероятность побочных реакций сводится к минимуму. Несмотря на то, что большинство метаболических процессов взято под ферментативный контроль, неферментативные реакции присутствуют в метаболизме и современных организмов.
Активные метаболиты играют важную роль в регуляции метаболической пластичности и эволюционируемости живых систем. С одной стороны, они обеспечивают устойчивость биологических макромолекул и систем, с другой, способствуют фенотипической изменчивости через демаскирование скрытой вариабельности. Сложно организованная система редокс-реакций с участием активных метаболитов и цистеинового протеома, а также широкое распространение этих реакций у всех живых организмов от бактерий до человека, не оставляет сомнений, что образование этих “случайных” активных форм совсем не случайно и представляет собой один из механизмов метаболической регуляции.
Список литературы
Ленинджер А. Биохимия. М.: Мир, 1974. 957 с. (Lehninger A.L. Biochemistry: The Molecular Basis of Cells Structure and Function. New York: Worth Publ., 1970. 833 p.)
Zarkovic N. // Cells. 2020. V. 9. № 3. e767. https://doi.org/10.3390/cells9030767
Gutteridge J.M.C., Halliwell B. // Biochem. Biophys. Res. Commun. 2018. V. 502. № 2. P. 183–186.
Beckman J.S., Koppenol W.H. // Am. J. Physiol. Cell. Physiol. 1996. V. 271. P. 1424–1437.
Moloney J.N., Cotter T.G. // Seminars in Cell and Developmental Biology. 2017. V. 80. P. 50–64.
Abalenikhina Yu.V., Kosmachevskaya O.V., Topunov A.F. // Appl. Biochem. Microbiol. 2020. V. 56. № 6. P. 611–623.
Moldogazieva N.T., Mokhosoev I.M., Mel’nikova T.I., Zavadskiy S.P., Kuz’menko A.N., Terentiev A.A. // Biochemistry (Moscow). 2020. V. 85. Suppl. 1. P. S56–S78.
Sies H., Jones D.P. // Nat. Rev. Mol. Cell. Biol. 2020. V. 21. № 7. P. 363–383.
Ayala A., Muñoz M.F., Argüelles S. // Oxid. Med. Cell. Longev. 2014. V. 2014. P. 360438.
Semchyshyn H.M. // Sci. World J. 2014. article ID 417842.
Kosmachevskaya O.V., Shumaev K.B., Topunov A.F. // Appl. Biochem. Microbiol. 2017. V. 53. № 3. P. 273–289.
Kosmachevskaya O.V., Shumaev K.B., Topunov A.F. // Biochemistry (Moscow). 2019. V. 84. Suppl. 1. P. S206–S224.
Szent-Gyorgyi A. Bioelectronics. A Study in Cellular Regulations, Defense, and Cancer. New York: Acad. Press, 1968. 89 p.
Bartosz G. // J. Theor. Biol. 1981. V. 91. P. 233–235.
Голубев А.Г. // Биохимия. 1996. Т. 61. № 11. С. 2018–2039.
Голубев А.Г. Биология продолжительности жизни и старения. СПб.: издательство Л-Н, 2015. 384 с.
Danchin A. // Microb. Biotechnol. 2017. V. 10. P. 57–72.
D’Ari R., Casadesus J. // Bioessays. 1998. V. 20. P. 181–186.
Keller M.A., Piedrafita G., Ralser M. // Current Opinion in Biotechnology. 2015. V. 34. P. 153–161.
Piedrafita G., Keller M. A., Ralser M. // Biomolecules. 2015. V. 5. P. 2101–2122.
Козлов В.А., Сапожников С.П., Шептухина А.И., Голенков А.В. // Вестник РАМН. 2015. Т. 70. № 4. С. 397–402.
Kosmachevskaya O.V., Shumaev K.B., Topunov A.F. // Biochemistry (Moscow). 2015. V. 80. № 13. P. 1655–1671.
Giles N.M., Watts A.B., Giles G.I., Fry F.H., Littlechild J.A., Jacob C. // Cell Chemical Biology. 2003. V. 10. № 8. P. 677–693.
Karimi M., Ignasiak M.T., Chan B., Croft A.K., Radom L., Schiesser C.H., Pattison D.I., Davies M.J. // Sci. Rep. 2016. V. 6. № 1. P. 38572.
Desmet J., Joniau M., Van Dael H. // Studies in Organic Chemistry. 1993. V. 47. P. 299–307.
Arnold F.H., Zhang J.H. // Trends Biotechnol. 1994. V. 12. № 5. P. 189–192.
Sayre L.M., Moreira P.I., Smith M.A., Perry G. // Ann. Ist. Super Sanità. 2005. V. 41. № 2. P. 143–164.
Evans J.L., Goldfine I.D., Maddux B.A., Grodsky G.M. // Endocrine Reviews. 2002. V. 23. № 5. P. 599–622.
Carbonell P., Lecointre G., Faulon J.-L. // J. Biol. Chem. 2011. V. 286. № 51. P. 43994–44004.
Tenaillon O., Denamur E., Matic I. // Trends in Microbiology. 2004. V. 12. № 6. P. 264–270.
Moldogazieva N.T., Mokhosoev I.M., Feldman N.B., Lutsenko S.V. // Free Radic. Res. 2018. V. 52. № 5. P. 507–543.
Forman H.J. // // Ann. N.Y. Acad. Sci. 2010. V. 1203. P. 35–44.
Tauffenberger A., Magistretti P.J. // Neurochem. Res. 2021. V. 46. № 1. P. 77–87.
Domingues R.M., Domingues P., Melo T., Pérez-Sala D., Reis A., Spickett C.M. // J. Proteomics. 2013. V. 92. P. 110–131.
Mano J., Biswas M.S., Sugimoto K. // Plants. 2019. V. 8. № 10. e391. https://doi.org/10.3390/plants8100391
Viedma-Poyatos Á., González-Jiménez P., Langlois O., Company-Marín I., Spickett C.M., Pérez-Sala D. // Antioxidants. 2021. V. 10. № 2. e295. https://doi.org/10.3390/antiox10020295
Tyedmers J., Madariaga M.L., Lindquist S. // PLoS Biol. 2008. V. 6. № 11. e294. https://doi.org/10.1371/journal.pbio.0060294
Кунин Е.В. Логика случая. М.: Центрполиграф, 2014. 527 с. (Koonin E.V. The Logic of Chance. The Nature and Origin of Biological Evolution. Upper Saddle River, NJ, USA: FT Press, 2012. 520 p.)
Введенский Н.Е. Избранные произведения. Т. 2. М.: Издательство Академии Наук СССР, 1951. С. 507–855.
Насонов Д.Н. Местная реакция протоплазмы и распространяющееся возбуждение. М.–Л.: Издательство Академии Наук, 1962. 426 с.
Александров В.Я. Реактивность клеток и белки. Л.: Наука, 1985. 318 с.
Браун А.Д., Моженок Т.П. Неспецифический адаптационный синдром клеточной системы. Л.: Наука, 1987. 232 с.
Selye H. The Case for Supramolecular Biology. N.Y.: Liveright, 1967. 168 p.
Гаркави Л.Х., Квакина Е.Б., Уколова М.А. Адаптационные реакции и резистентность организма. Ростов-на-Дону: Изд-во Ростовского ун-та, 1979. 128 с.
Matveev V.V. // Cell Mol. Biol. 2005. V. 51. № 8. P. 715–723.
Choudhury F.K., Rivero R.M., Blumwald E., Mittler R. // Plant Abiotic Stress. 2017. V. 90. № 5. P. 856–867.
Vaiserman A.M. // Ageing Res. Rev. 2011. V. 10. P. 413–421.
Agutter P.S. // Bioessays. 2007. V. 29. № 4. P. 324–333.
Calabrese E.J. // Environ. Pollut. 2013. V. 182. P. 452–460.
Calabrese E.J. // Microb. Cell. 2014. V. 1. № 5. P. 145–149.
Schulz H. // Virch. Archiv Pathol. Anat. Phys. Klin. Med. 1887. V. № 108. P. 423–445.
Southam C.M., Ehrlich J. // Phytopathology. 1943. V. 33. P. 517–524.
Calabrese E.J., Dhawan G., Kapoor R., Iavicoli I., Calabrese V. // Gerontology. 2016. V. № 62. P. 530–535.
Zimmermann A., Bauer M.A., Kroemer G., Madeo F., Carmona-Gutierrez D. // Microbial. Cell. 2014. V. 1. № 5. P. 150–153.
Radák Z., Chung H.Y., Koltai E., Taylor A.W., Goto S. // Ageing Res. Rev. 2008. 7. P. 34–42.
Goto S., Radák Z. // Dose Response. 2010. V. 8. № 1. P. 68–72.
Oliveira M.F., Geihs M.A., França T.F.A., Moreira D.C., Hermes-Lima M. // Front. Physiol. 2018. V. 9. P. 945.
Clanton T.L. // J. Appl. Physiol. 2007. V. 102. P. 2379–2388.
Wang Q., Sun A.Y., Simonyi A., Kalogeris T.J., Miller D.K., Sun G.Y., Korthuis R.J. // Free Radic. Biol. Med. 2007. V. 43. P. 1048–1060.
Yu B.P., Chung H.Y. // Ann. N.Y. Acad. Sci. 2006. V. 928. P. 39–47.
Hipkiss A.R. // Ann. N.Y. Acad. Sci. 2006. V. 1067. P. 361–368.
Hipkiss A.R. // Biogerontology. 2007. V. 8. № 2. P. 221–224.
Winterbourn C.C., Hampton M.B. // Free Radic. Biol. Med. 2008. V. 45. № 5. P. 549–561.
Trost P., Fermani S., Calvaresi M., Zaffagnini M. // Plant Cell Environ. 2017. V. 40. № 4. P. 483–490.
Day N.J., Gaffrey M.J., Qian W.-J. // Antioxidants. 2021. V. 10. № 3. e499. https://doi.org/10.3390/antiox10030499
Liebthal M., Schuetze J., Dreyer A., Mock H.-P., Dietz K.-J. // Antioxidants. 2020. V. 9. № 6. e515. https://doi.org/10.3390/antiox9060515
Kosmachevskaya O.V., Nasybullina E.I., Blindar V.N., Topunov A.F. // Appl. Biochem. Microbiol. 2019. V. 55. № 2. P. 83–98.
Klomsiri C., Karplus P.A., Poole L.B. // Antioxid. Redox Signal. 2011. V. 14. № 6. P. 1065–1077.
Kosmachevskaya O.V., Nasybullina E.I., Shumaev K.B., Novikova N.N., Topunov A.F. // Appl. Biochem. Microbiol. 2020. V. 56. № 5. P. 512–520.
Claiborne A., Mallett T.C., Yeh J.I., Luba J., Parsonage D. // Adv. Protein Chem. 2001. V. 58. P. 215–276.
Reeg S., Grune T. // Antioxid. Redox Signal. 2015. V. 23. № 3. P. 239–255.
Novikova N.N., Kovalchuk M.V., Yurieva E.A., Konovalov O.V., Stepina N.D., Rogachev A.V., Yalovega G.E., Kosmachevskaya O.V., Topunov A.F., Yakunin S.N. // J. Phys. Chem. B. 2019. V. 123. № 40. P. 8370–8377.
Konovalov O.V., Novikova N.N., Kovalchuk M.V., Yalovega G.E., Topunov A.F., Kosmachevskaya O.V., Yurieva E.A., Rogachev A.V., Trigub A.L., Kremennaya M.A., Borshchevskiy V.I., Vakhrameev D.D., Yakunin S.N. // Materials. 2020. V. 13. № 20. e4635. https://doi.org/10.3390/ma13204635
Moloney J.N., Cotter T.G. // Seminars in Cell and Developmental Biology. 2017. V. 80. P. 50–64.
Movahed Z.G., Rastegari-Pouyani M., Mohammadi M.H., Mansouri K. // Biomed. Pharmacother. 2019. V. 112. e108690. https://doi.org/10.1016/j.biopha.2019.108690
Mullarky E., Cantley L.C. // Innovative Medicine: Basic Research and Development. Tokyo: Springer, 2015. P. 3–23.
Stincone A., Prigione A., Cramer T., Wamelink M., Campbell K., Cheung E., Olin-Sandoval V., Gruning N.M., Kruger A., Tauqeer Alam M., Keller M.A., Breitenbach M., Brindle K.M., Rabinowitz J.D., Ralser M. // Biol. Rev. 2015. V. 90. P. 927–963.
Kosmachevskaya O.V., Novikova N.N., Topunov A.F. // Antioxidants. 2021. V. 10. № 2. e253. https://doi.org/10.3390/antiox10020253
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


