Прикладная биохимия и микробиология, 2023, T. 59, № 2, стр. 150-166
Использование фаговых антител для определения микробных клеток (обзор)
О. И. Гулий 1, *, С. С. Евстигнеева 1, Л. А. Дыкман 1
1 Институт биохимии и физиологии растений и микроорганизмов – обособленное структурное подразделение Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Саратовский научный центр Российской академии наук” (ИБФРМ РАН)
410049 Саратов, Россия
* E-mail: guliy_olga@mail.ru
Поступила в редакцию 05.08.2022
После доработки 12.09.2022
Принята к публикации 25.09.2022
- EDN: LLHLMZ
- DOI: 10.31857/S0555109923020083
Аннотация
Технология фагового дисплея антител произвела революцию в области иммунодетекции бактерий. Данная технология позволяет экспрессировать антитело, слитое с белком оболочки нитевидного бактериофага. Применение фагового дисплея позволяет получать высокоаффинные антитела, минуя этап иммунизации животных, сокращая время получения стабильных клонов, продуцирующих антитела, с нескольких месяцев до нескольких недель, заметно удешевляя процесс. Данные преимущества делают фаговые антитела важным инструментом для детекции бактерий. В работе представлено краткое описание технологических приемов при получении фаговых антител к микробным клеткам. Обсуждаются возможности и перспективы применения фаговых антител в качестве селективного агента в аналитических системах, в том числе в биосенсорах.
Успехи современной биотехнологии, медицины и сельского хозяйства зачастую зависят от того, насколько быстро можно обнаружить специфичные антигены. Антитела, благодаря специфическому связыванию с комплементарными участками антигенов, используются для решения ряда биотехнологических задач [1–5].
Наиболее распространенным вариантом получения антител, обладающих специфичностью к конкретному антигену, является иммунизация, в ходе которой данный антиген вводится вместе с компонентами, которые усиливают иммунный ответ (адъювантами), в организм животного (кролика, мыши, овцы и др.). Сыворотка крови иммунизированного животного будет содержать поликлональные антитела, представляющие собой гетерогенную по строению, эпитопной специфичности и аффинности популяцию антител [6]. Недостатком поликлональных антител является их специфичность к ряду детерминант антигена [7].
Следует отметить, что эффективность диагностических иммунохимических методов зависит, в первую очередь, от качества используемых специфических антител. Поэтому дальнейшее развитие методов получения антител привело к созданию гибридомной технологии. Получаемые при помощи данной технологии моноклональные антитела продуцируются одним клеточным клоном, узнают один эпитоп и сохраняют свои свойства во многих генерациях гибридной клетки [8]. Высокая специфичность моноклональных антител при взаимодействии с антигенами, а также возможность их оперативного получения, позволяют использовать данные антитела для исследования и детекции разнообразных по природе и свойствам антигенов. В настоящее время с привлечением гибридомной технологии получены антитела, которые применяются для выявления различных соединений (гормонов, витаминов, лекарственных препаратов), патогенных микроорганизмов и их токсинов, а также успешно используются в иммунотерапии [5, 9]. К примеру, при использовании моноклональных антител показана возможность определения холерного токсина [10], рекомбинантных и вирусных белков лихорадки Эбола и Марбурга [11].
Большой научный и практический интерес представляет фаговый дисплей, направленный на получение и наработку антител к известным антигенам. Фаговые антитела в качестве биорецепторов имеют ряд преимуществ перед стандартными иммуноглобулинами: они намного меньше по размеру и обычно содержат менее 100 аминокислотных остатков, обладают высокой стабильностью и химической устойчивостью, а также дешевле в производстве. Таким образом, фаговые антитела отлично подходят для создания биосенсоров, которые могут найти применение во многих сферах деятельности, в том числе в пищевой промышленности, медицине, фармакологии, биотехнологии, экологии и т.д.
Несмотря на то, что с начала 2000 гг. было опубликовано несколько блестящих обзоров, посвященных фаговому дисплею антител [12–14], проблема их использования в аналитических методах не нашла достаточно полного освещения в литературе. Поэтому цель настоящего обзора заключается не только в описании преимуществ технологии фагового дисплея применительно к получению специфичных антител, но и в оценке возможности их использования для детектирования бактерий.
ОСОБЕННОСТИ ВЗАИМОДЕЙСТВИЯ АНТИГЕН-АНТИТЕЛО
Свойство аффинности предоставляет уникальные возможности для изучения взаимодействий, в частности, антиген-антитело или бактериофаг-микробная клетка [15–18]. Под аффинным взаимодействием понимают способность двух или более молекул к образованию химической связи, в том числе между паратопом антитела и эпитопом антигена. Аффинитет, или прочность комплементарного связывания антигена с антителом, можно количественно измерить при помощи определения константы ассоциации.
Важную функцию при взаимодействии антитела с антигеном выполняют гипервариабельные участки молекулы антитела – области CDR (complementarity determining regions). Данные участки представляют собой петли, расположенные между β-складками, причем по протяженности и аминокислотной последовательности у различных антител они могут существенно отличаться. Формируемая из шести петель CDR трехмерная структура антитела участвует в распознавании комплементарного ей эпитопа на поверхности антигена [7].
Аминокислотные остатки (а.о.), входящие в состав CDR и взаимодействующие с эпитопом, называют участками, определяющими специфичность, или участками SDR (specificity determining regions). Во взаимодействии антигена и антитела могут участвовать от 5 до 15 а.о., входящих в состав эпитопа, и, как правило, столько же а.о. паратопа [19]. Помимо а.о., непосредственно контактирующих с эпитопом, ключевую роль в распознавании антигена играют а.о., которые выполняют структурную функцию и обеспечивают необходимую конформацию CDR-петель, тем самым осуществляя правильное взаимное расположение в пространстве взаимодействующих поверхностей [20]. Связь антигена с антителом является обратимой и осуществляется за счет водородных связей, электростатических и гидрофобных взаимодействий, а также за счет сил Ван-дер-Ваальса. Несмотря на то, что данные виды связей слабее ковалентной, в совокупности они обеспечивают высокоаффинное взаимодействие эпитопа и паратопа [21].
ОСНОВНЫЕ МЕТОДИЧЕСКИЕ ЭТАПЫ ТЕХНОЛОГИИ ФАГОВОГО ДИСПЛЕЯ
Д. Маккаферти с соавт. [22] предложили использовать метод фагового дисплея антител. В своей работе авторы показали возможность отбора антигенсвязывающих фрагментов антител (Fab), которые экспонированы на поверхности нитевидного фага, на иммобилизованном антигене.
Предложенный метод получения рекомбинантных моноклональных антител стал широко использоваться и зарекомендовал себя как высоко эффективный подход для изучения белок-белковых, белок-пептидных, ДНК-белковых взаимодействий [23]. Метод позволяет использовать бактериофаги для соотнесения генотипа (гены вариабельной области антитела) с фенотипом (белок с требуемой связывающей функцией). Для выявления соответствия между генотипом и фенотипом требуется тщательный скрининг и амплификация белковых библиотек в процессе, называемом in vitro селекцией, который аналогичен естественному отбору [24, 25].
Данная технология является альтернативой гибридомной технологии, при этом фаговая система заменяет основные этапы работы по иммунизации животных процедурами манипулирования с ДНК и бактериями. При этом существенно сокращается время получения стабильных клонов, продуцирующих антитела (с месяцев до недель), а также снижаются затраты на их наработку. Молекулярно-направленные аффинные лиганды играют важную роль в исследовании патогенеза ряда заболеваний [26–29], используются в фармацевтических разработках [30–32], приложениях для нанотехнологий [33], дизайне агентов молекулярной визуализации [34–37]. Кроме того, антитела, полученные с помощью технологии фагового дисплея, проходят несколько этапов отбора по аффинности и могут быть использованы в качестве селективных рецепторов в составе биосенсоров [38, 39].
Суть технологии фагового дисплея антител состоит в получении высокоаффинных антител (или их фрагментов), экспонированных в составе оболочки бактериофагов.
Основные этапы данной технологии включают:
• конструирование фаговых библиотек или выбор из имеющихся;
• обогащение фаговой библиотеки при помощи аффинной селекции (биопэннинг).
При использовании метода фагового дисплея в геном бактериофагов встраивают последовательность, кодирующую ген химерного белка, продукт которого состоит из какого-либо фрагмента антитела и белка поверхности фаговой частицы [40]. Одним из наиболее распространенных фагов, применяемых для дисплея, является бактериофаг M13, на поверхности которого представлены фрагменты антител, связанные с белками pIII, pIV и pVIII капсида фага [41].
Селекцию частиц из фаговой библиотеки проводят, используя их свойства комплементарно связываться с антигеном. Используют различные формы отбора фаговых частиц, включая их прямое связывание с антигеном, который присоединен к определенной матрице или же сорбирован на чашках или иммунотьюбах, а также с антигеном, локализованным непосредственно на поверхности клеток. При получении антител к гаптенам, последние предварительно конъюгируют с белком-носителем. Отбор фаговых частиц может осуществляться не только на пластиковой подложке, но и на магнитных шариках. Для истощения библиотек авторы работы [42] предложили использовать парамагнитные гранулы с полистироловым покрытием, на которых были иммобилизованы антигены. Такой способ отбора связывающихся фаговых частиц оказался более эффективным, так как повышал площадь активной поверхности, на которой происходило связывание. Кроме того, существенно упростилась процедура отмывки, было получено 1.5-кратное повышение специфичности селекции по сравнению с традиционными методами. Также был разработан метод селекции антител из комбинаторных фаговых библиотек с использованием конъюгатов антигенов (в том числе гаптенов) с наночастицами золота [43].
Из фаговых частиц, прошедших не менее 3–6 раундов селекции, выделяют ДНК, в которой определяют последовательность нуклеотидов, кодирующих интересующие фрагменты антител [39, 44]. Таким образом, в результате использования данного метода, возможно получить не только высокоаффинные антитела, но и их нуклеотидную последовательность, которая также может быть клонирована и представлена в виде фрагментов иммуноглобулинов [45].
Как правило, отбор фаговых частиц библиотеки, называемый также биопэннинг, включает следующие этапы (рис. 1):
Рис. 1.
Схема аффинной селекции фаговых частиц из библиотеки: 1 – инкубация фагмидных частиц библиотеки (на поверхности которых представлены фрагменты антител) с иммобилизованным антигеном; 2 – отмывка не связавшихся с антигеном фаговых частиц; 3 – элюция связавшихся с антигеном фаговых частиц и их наработка в клетках Е. coli; 4 – следующий раунд селекции фаговых частиц библиотеки, включающий в себя повторную инкубацию отобранных после первого цикла частиц с антигеном и отмывку низкоаффинных фаговых частиц; 5 – элюция высокоаффинных фаговых частиц библиотеки и инфицирование ими клеток E. coli.

• клоны библиотеки инкубируют с иммобилизованным антигеном;
• удаляют при помощи отмывки фаговые частицы, не связавшиеся с антигеном;
• связавшиеся фаговые частицы элюируют;
• заражают отобранными клонами бактериальные клетки (Escherichia coli);
• проводят амплификацию и выделение аффинных клонов [46].
Длительность процедуры получения антител методом фагового дисплея зависит от иммуногенности антигенов, метода их иммобилизации, и соответственно количества раундов биопэннинга. В зависимости от этого процедура занимает от нескольких часов до нескольких суток.
КОМБИНАТОРНЫЕ ФАГОВЫЕ БИБЛИОТЕКИ
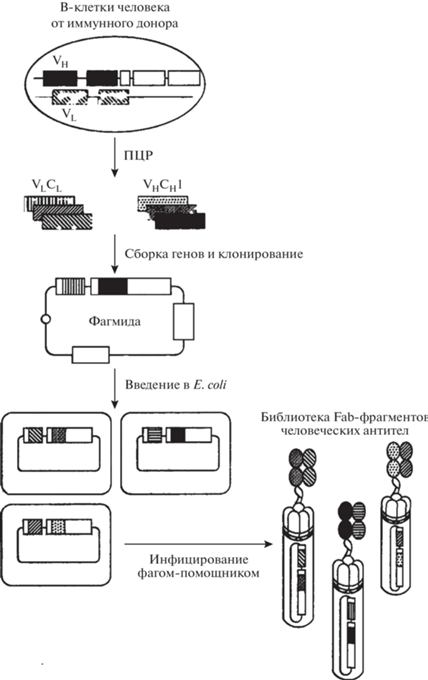
Комбинаторные фаговые библиотеки антител представляют собой своеобразный аналог популяций В-лимфоцитов, каждый из которых производит один тип антител определенной специфичности, однако бактериофаги, входящие в состав библиотеки, экспонируют на своей поверхности не целые природные антитела, а лишь их фрагменты, чаще всего одноцепочечное антитело (scFv – single chain variable fragment) или Fab-фрагмент (рис. 2) [47–49].
В некоторых исследованиях применяли нестандартные по свойствам антитела природного происхождения. Например, животные из семейства верблюдовых (Camelidae), к которому относятся верблюды, ламы и альпаки, обладают как обычными IgG (IgG1), так и неканоничными подклассами IgG (IgG2 и IgG3), которые состоят только из двух тяжелых цепей. Подобные антитела могут быть использованы в качестве перспективного биораспознающего элемента при решения различных прикладных задач в биотехнологии [50].
Каждый из двух антигенсвязывающих сайтов антитела тяжелой цепи образован только одним вариабельным доменом (VHH). Способность VHH функционировать в отсутствии двух доменов VL и CH1 в 1997 г. подтолкнула ученых к созданию первых самостоятельных рекомбинантных молекул VHH методами генной инженерии [51]. Эти молекулы были названы однодоменными антителами (sdAb). Установлено несколько преимуществ использования sdAb перед scFv: высокая стабильность, способность успешно ренатурировать после нагрева или химического воздействия, небольшие размеры (15 кДа) и кодируемость одним геном длиной 380 нуклеотидных пар [51, 52]. Показано, что подобные антитела имеют больший потенциал для использования в иммунобиотехнологии и медицине [51–53].
Общая схема получения комбинаторной фаговой библиотеки выглядит следующим образом.
1. Из иммунных или интактных В-лимфоцитов человека, мыши, кролика, цыпленка, свиньи, собаки, обезьяны, овцы, коровы и др. выделяют мРНК и клонируют гены scFv, Fab-фрагментов или др.
2. Данные гены встраивают в фагмиду в единую рамку трансляции с геном, кодирующим белок капсида (обычно pIII).
3. Полученным репертуаром фагмид заражают клетки E. coli, в которых происходит экспрессия фагмидных генов и сборка вирионов. В составе капсидных белков вирионов будут экспонированы чужеродные фрагменты антитела. В зависимости от выбранной векторной системы этот этап проходит с использованием хелперных фагов или без них.
Таким образом получают популяцию бактериофагов, каждый из которых экспонирует на своей поверхности определенный антигенсвязывающий домен [54, 55].
ТИПЫ КОМБИНАТОРНЫХ ФАГОВЫХ БИБЛИОТЕК
Существует два принципиально разных типа библиотек: естественные (наивные и иммунные) и синтетические. Наивные и иммунные библиотеки конструируют, используя естественным образом реорганизованные гены, кодирующие вариабельные домены иммуноглобулинов интактных или иммунных к какому-либо антигену доноров, соответственно. Для этого выделяют мРНК клеток лимфоидного ряда, продуцирующих антитела. Эта мРНК подвергается обратной транскрипции в кДНК, которая используется для ПЦР генов, кодирующих фрагменты антител (рис. 3) [56]. Преимущество этого метода заключается в том, что полученные антитела будут правильной конформации, так как их гены кодируют функциональные антитела. Однако основным недостатком является то, что разнообразие последовательностей ограничено охватом естественной иммунной системы, в которой существует определенная неравномерность использования тех или иных последовательностей. Также фрагменты из природных библиотек сильно отличаются по качеству и непредсказуемы по составу; многие из них могут оказаться недостаточно стабильными или неподходящими по другим причинам. Репертуар естественных библиотек составляет 107–1011 фрагментов.
При работе с фаговыми библиотеками антител возникают технические неудобства. Например, для амплификации библиотеки размером 1010 клонов требуется объем культуры в несколько десятков литров. Это во многом объясняет современную тенденцию предпочтения библиотек меньшего размера и узконаправленных репертуаров, полученных от иммунизированных доноров. Иммунные библиотеки обладают двумя основными характеристиками: они обогащены антиген-специфичными антителами, и аффинность некоторых из этих антител уже имеет высокий уровень, как следствие развития иммунного ответа. Таким образом, большую представленность в библиотеке имеют клоны, продуцирующие высокоаффинные антитела к антигену, использованному для иммунизации, появляющиеся в результате вторичного иммунного ответа на антиген. Поскольку представленность каждого семейства V-генов в популяции молекул определяет размер библиотеки и число клонов, необходимых для анализа, то в случае библиотек от иммунизированных животных достаточно получить около 106 независимых рекомбинантов, чтобы среди них нашлись продуценты антител, специфично связывающих использованный для иммунизации антиген. Тогда как библиотеки, сконструированные на основе генетического материала лимфоцитов неиммунных доноров, должны содержать, по крайней мере, 108 индивидуальных клонов для воссоздания исходного разнообразия детерминант антител [57, 58].
Конструирование синтетических библиотек основано на замене природных определяющих комплементарность областей (CDR) на набор случайных последовательностей, что позволяет создавать огромное разнообразие антигенсвязывающих сайтов. Использование синтетических и полусинтетических библиотек обусловлено их большей представленностью, чем натуральных, однако создание таких библиотек является более трудоемким процессом, сопряженным с определенными ограничениями, которые приходится учитывать. Например, введение полностью синтетических участков CDR может привести к неправильному сворачиванию и агрегации белка [59]. Потребовалось время для отработки подходов к определению того, какие CDR лучше использовать. Репертуар синтетических библиотек, как правило, доходит до 109–1011 фрагментов.
В целом, наивные и синтетические библиотеки более универсальны, так как обладают большим репертуаром. Вместе с тем, иммунные библиотеки обогащены антиген-специфичными высокоаффинными антителами. Поэтому выбор типа библиотеки зависит от характера поставленной задачи.
На сегодняшний день разрабатываются методы оценки качества фаговой библиотеки, главным образом, ее представленности и разнообразия. Обычно ее определяют методом “отпечатков пальцев” ДНК, либо секвенирования нескольких сотен случайных библиотечных элементов. Однако вывод о разнообразии из такой небольшой выборки является очень поверхностным и дает ограниченную информацию о реальном состоянии библиотеки. Недавно был предложен метод секвенирования нового поколения Next generation sequencing (NGS). Однако еще многое предстоит сделать, чтобы полностью использовать потенциал NGS для количественного анализа репертуаров антител и преодолеть существующие ограничения [55, 60–63].
ФАГОВЫЕ АНТИТЕЛА ДЛЯ ОПРЕДЕЛЕНИЯ БАКТЕРИЙ
Фаговые антитела являются весьма перспективным объектом для применения в качестве биорецепторов. Как отмечалось ранее, сама технология получения фаговых антител отличается быстротой и меньшей трудоемкостью, чем гибридомная технология, а сами фаговые антитела обладают рядом преимуществ перед природными аналогами:
• небольшой размер фрагментов антител обычно сопровождается уменьшением неспецифического связывания, часто вызываемым областью Fc интактного антитела;
• возможность более плотной иммобилизации фаговых антител в биосенсоре;
• в отличие от полноразмерных антител, фаговые антитела могут синтезироваться в бактериях, таких как E. coli, что значительно снижает стоимость производства, поскольку отсутствует необходимость в специализированном оборудовании для культивирования клеток гибридомных клеточных линий [64].
Технология фагового дисплея, созданная Д.П. Смитом [22, 65, 66] основана на упрощенных процедурах манипулирования с ДНК и бактериями, что значительно сокращает время получения и стоимость стабильных клонов [67, 68]. Данные преимущества обусловливают перспективы применения фаговых антител в биосенсорах и биочипах, в том числе для детекции патогенных бактерий, вирусов и эукариотических патогенов [58, 69, 70].
На сегодняшний день актуален вопрос мониторинга патогенных микроорганизмов, которые распространены повсеместно и представляют значительный риск для здоровья человека и животных, а также могут серьезно снижать качество сельскохозяйственной продукции. Следовательно, мониторинг этих микроорганизмов имеет первостепенное значение для профилактики внутрибольничных инфекций, поддержания здоровья населения в целом и для обеспечения соблюдения законодательных норм и стандартов качества. Быстрое обнаружение и идентификация патогена необходимы в случае анализа образцов пищевых продуктов с коротким сроком хранения или при внедрении подходящего противомикробного препарата для лечения потенциально опасной инфекции [71–73].
Примеры использования фаговых антител в составе биосенсорных датчиков для определения патогенов представлены в табл. 1. В частности, был разработан биосенсор для детекции Salmonella typhimurium и спор Bacillus anthracis на основе нескольких магнитоупругих датчиков, объединенных в одну систему. Причина выбора двух разных видов бактерий заключалась в том, чтобы продемонстрировать возможность магнитоупругих биосенсоров со специфичными фаговыми антителами одновременно определять и различать патогены, как представлено на рис. 4 [76]. В данной работе были сконструированы векторы на основе нитчатых фагов E2 (специфичных к S. typhimurium) и JRB7 (специфичных к спорам B. anthracis). Данная система показала, что высокоспецифичные фаговые антитела связывали соответствующие антигены, причем неспецифическое связывание исключалось обработкой раствором бычьего сывороточного альбумина. Подобные датчики показали хорошую устойчивость к внешним факторам в системе с проточной жидкостью, о чем свидетельствует отсутствие коррозии; пределы обнаружения датчиков оценивались в 5 × 103 КОЕ/мл, а насыщение происходило при более чем 5 × 108 КОЕ/мл. Таким образом, данный подход предполагает возможность анализировать объект на наличие сразу нескольких видов микроорганизмов, что удобно при исследовании пищевых объектов, которые обсеменены посторонней микрофлорой. Этот метод имеет значительные преимущества в мониторинге больших объемов пищевых продуктов на наличие небольшого количества биологических патогенов или загрязняющих веществ [76]. Отметим при этом, что нормативные требования к содержанию патогенов в пищевых продуктах намного ниже, и сенсор с таким пределом обнаружения может применяться лишь в сочетании с предварительными действиями по концентрированию и/или доращиванию.
Таблица 1.
Примеры биосенсорных систем с использованием рекомбинантных антител в качестве рецепторного элемента для определения бактерий
| Тип сенсорной системы | Формат фаговых антител | Бактерия | Мишень | Предел детекции | Время анализа | Ссылка |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Электрооптический и акустический датчики | scFv | Azospirillum brasilense | Клетки бактерий, флагеллин, ЛПС | 103 клеток/мл | 10 мин | [39, 74, 75] |
| Магнитоупругий биосенсор на основе нескольких типов фагов | –* | Bacillus anthracis | Споры | 5 × 103 КОЕ/мл | 15–20 мин | [76] |
| Salmonella typhimurium | Клетки бактерий | |||||
| Электрооптический датчик | scFv | Herbaspirillum seropedicae | Экзополи- сахарид, капсульный полисахарид, ЛПС | –* | 5 мин | [77, 78] |
| Электрохимический сенсор VR2 (Vantix) | scFv-Fc | Legionella pneumophila | Целые клетки | 104 клеток | 35 мин | [79] |
| Сенсор на основе поверхностного плазмонного резонанса (SPR) | scFv | Listeria monocytogenes | Белок, индуцирующий полимеризацию актина (ActA) | 2 × 106 КОЕ/мл | 2 ч | [80] |
| Колориметрический биосенсор с наночастицами золота и фаговыми антителами | –* | Staphylococcus aureus | Клетки бактерий | 19 КОЕ/мл | 30 мин | [81] |
| Датчик на основе поверхностно-усиленного рамановского рассеяния (SERS) | –* | 10 КОЕ/мл | –* | [82] | ||
| Система детекции с использованием рамановской спектроскопии | –* | Staphylococcus aureus | Клетки бактерий | 10 КОЕ/7 мл | 6 ч | [83] |
| Pseudomonas aeruginosa | ||||||
| Escherichia coli |
Рис. 4.
Принцип использования фаговых антител для обнаружения патогенов при помощи нескольких магнитоупругих датчиков 74 с изменениями.

Возможность определения бактерий Listeria monocytogenes с помощью фаговых антител и датчиков на основе эффекта поверхностного плазмонного резонанса (SPR) показана в работе [80]. Действие данных датчиков является быстрым и позволяет осуществлять прямое обнаружение целевых объектов. Авторами была подобрана концентрация фаговых антител, обеспечивающая наиболее эффективную адсорбцию к поверхности биосенсора, что значительно сократило время на их иммобилизацию. Данные эксперимента указывают на высокую специфичность фаговых антител, при этом биосенсор обеспечивает расчетный предел обнаружения 2 × 106 КОЕ/мл для целых клеток L. monocytogenes [80]. Другим коллективом авторов показана перспективность применения фаговых антител для дифференциации бактерий L. monocytogenes, E. coli и Campylobacter jejuni [84, 85].
Для идентификации клеток Legionella pneumophila с помощью фаговых антител был разработан электрохимический VR2 сенсор (Vantix) [79]. Пара антител scFv-Fc была интегрирована в биосенсор, демонстрируя специфическое и быстрое обнаружение L. pneumophila на портативном устройстве. С помощью этой системы в течение 35 мин было обнаружено около 10 000 клеток бактерий.
Колориметрический биосенсор с использованием наночастиц золота и фаговых антител был разработан для быстрой, специфичной и чувствительной идентификации Staphylococcus aureus в клинических образцах [81]. Также для быстрой и чувствительной диагностики стафилококковой инфекции с использованием фаговых частиц был разработан метод на основе спектроскопии поверхностно-усиленного рамановского рассеяния (SERS) [82]. Кроме того, предложенный SERS-зонд проявлял бактерицидные свойства в отношении S. aureus, что показывает многообещающий потенциал его использования в качестве многофункциональной платформы для одновременного обнаружения и инактивации данного патогена.
Липополисахариды (ЛПС), локализованные на поверхности внешней мембраны грамотрицательных бактерий в значительной степени определяют антигенные и поверхностные свойства микроорганизмов [86–89], а также участвуют в процессах адгезии, механизмах узнавания чужеродных объектов и индукции защитных реакций макропартнера. Данные по строению ЛПС являются основой для внутривидовой классификации бактерий. Были проведены эксперименты по отработке методики получения фаговых антител к микробным клеткам на примере ассоциативных почвенных бактерий Azospirillum brasilense Sp245. Наработанные фаговые антитела к клеткам азоспирилл использовали для определения ЛПС и флагеллина с применением иммунодота и методов электрооптического и акустического анализа клеточных суспензий [39, 74, 76]. Полученные данные позволили использовать технологию фагового дисплея для отбора антител, специфичных к ЛПС другого вида почвенных бактерий Herbaspirillum seropedicae Z78, которые применяли для их селективного определения c помощью оптической платформы [77]. Также электрооптическим методом с применением фаговых антител к основным антигенам клеток H. seropedicae Z78 (экзополисахариды, капсульные полисахариды и ЛПС) проведена оценка их комплементарного взаимодействия в системе антиген-антитело. Выявленные закономерности изменения электрофизических параметров хорошо согласовывались с компонентным составом антигенов бактерий рода Herbaspirillum, их топографическим распределением, а также были подтверждены результатами электронной микроскопии и дот-анализа [78].
Особый интерес представляет применение фаговых антител для определения бактерий в иммуноаналитических системах, одной из которых является метод иммуноферментного анализа (ИФА). ИФА, являющийся классическим методом для детекции антигенов, характеризуется высокой чувствительностью детекции ферментативной метки (вплоть до 10–12 моль в образце и ниже) [90]. В связи с широкой востребованностью метода ИФА для определения бактерий в клинической практике важно оценить возможность применения фаговых антител в качестве селективного агента. Например, в работе [91] показана возможность применения фаговых антител против пяти различных антигенов S. typhimurium для определения данного патогена методом твердофазного ИФА. Также метод ИФА с применением фаговых антител (табл. 2) был использован для идентификации бактерий родов Acinetobacter, Bacillus, Bordetella, Brucella, Chlamydophila, Chlamydia, Clostridium, Escherichia, Francisella, Klebsiella, Haemophilus, Helicobacter, Leptospira, Listeria, Moraxella, Mycobacterium, Neisseria, Porphyromonas, Pseudomonas, Ralstonia, Staphylococcus, Streptococcus, Vibrio, Yersinia. В табл. 2 представлены тип фаговых библиотек и форматы фаговых антител при определении разных патогенов [92–95, 97–106, 108–116, 118, 119, 121–128].
Таблица 2.
Рекомбинантные антитела к патогенным бактериям, полученные с помощью технологии фагового дисплея [58, c изменениями и дополнениями]
| Бактерия | Мишень фаговых антител | Тип фаговой библиотеки | Формат фаговых антител | Применение фаговых антител | Ссылка |
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 |
| Acinetobacter baumannii | Белок клеточной поверхности Bap | Иммунная | VHH | ИФА, вестерн-блоттинг, in vivo нейтрализация | [92] |
| Bacillus anthracis | Защитный антиген PA | Наивная | scFv | ИФА, in vitro ингибирование | [93] |
| Bordetella pertussis | Филаментный гемагглютинин, пертактин | Иммунная | scFv | ИФА, in vitro ингибирование, in vivo исследования | [94] |
| Brucella melitensis | Облученные бактерии | Иммунная | scFv | ИФА | [95] |
| Burkholderia mallei | Целые бактериальные клетки, убитые нагреванием | Наивная | scFv | –* | [96] |
| Burkholderia pseudomallei | |||||
| Chlamydophila psittaci | 2,4 [2, 8]2,4-связанный Kdo тетрасахарид | Иммунная | scFv | ИФА, иммунофлуоресценция | [97] |
| Chlamydia trachomatis | Клетки бактерий | Наивная | scFv | ИФА, вестерн-блоттинг, иммунофлуоресценция | [98] |
| Clostridium difficile | Протеины клеточной поверхности, включая FliC и FliD | Полусинтетическая | scFv | ИФА, вестерн-блоттинг, пробы подвижности in vitro | [99] |
| Clostridium perfringens | Эпсилон-токсин ETX | Синтетическая | scFv, VH | ИФА | [100] |
| Escherichia coli | Живые клетки бактерий | Иммунная | VHH | ИФА | [101] |
| Francisella tularensis | ЛПС | Иммунная | scFv, IgG | ИФА, вестерн-блоттинг, иммунофлуоресценция, in vitro нейтрализация | [102] |
| Klebsiella pneumoniae | –* | Наивная | scFv, scFv-Fc, IgG | ИФА, иммунофлуоресценция, тесты in vivo | [103] |
| Haemophilus influenzae | Капсульный полисахарид | Иммунная | Fab | ИФА | [104] |
| Helicobacter pylori | Уреаза | Полусинтетическая | scFv | ИФА, вестерн-блоттинг | [105] |
| Вакуолизирующий цитотоксин A VacA | Полусинтетическая | scFv | ИФА, электрофорез, вестерн-блоттинг, SPR-диагностика, проточная цитофлуориметрия, молекулярное моделирование | [106] | |
| Lactobacillus acidophilus | Белок S-слоя | Наивная | scFv | Определение клеток, активируемых флуоресценцией, вестерн-блоттинг | [107] |
| Leptospira spec. | Белок внешней мембраны LipL21 | Наивная | scFv | ИФА | [108] |
| Listeria monocytogenes | Целые клетки | Синтетическая | scFv | ИФА, вестерн-блоттинг, иммунологическая детекция | [84] |
| Пируватдегидрогеназный комплекс-фермент 2 PDC-E2 | Наивная | scFv, scFv-Fc | ИФА, вестерн-блоттинг, иммунофлуоресценция | [109] | |
| Интерналины A (InlA) и B (InlB) | Наивная | scFv-Fc | ИФА | [110] | |
| Listeria monocytogenes | Клетки, убитые нагреванием | Наивная | VHH | ИФА, вестерн-блоттинг | [111] |
| Moraxella catarrhalis | Высокомолекулярный белок наружной мембраны HMW-OMP | Полусинтетическая | scFv | ИФА, определение клеток, активируемых флуоресценцией, вестерн-блоттинг, in vitro ингибирование | [112] |
| Mycobacterium tuberculosis | Антиген 85B | Наивная | scFv, scFv-Fc | ИФА, вестерн-блоттинг | [113] |
| Липоарабиноманнан LAM | Иммунная | scFv | ИФА | [114] | |
| Липоарабиноманнан LAM | Иммунная | scFvIgG | ИФА, вестерн-блоттинг, дот-блоттинг, проточная цитометрия | [115] | |
| Neisseria, 4 strains | Бациллозамин | –* | scFv | ИФА, иммунофлуоресцентное окрашивание и конфокальная лазерная сканирующая микроскопия | [116] |
| Neisseria meningitidis | Адгезин NadA | Иммунная | VHH | Дот-блоттинг, вестерн-блоттинг, иммуногистохимия, тесты in vitro | [117] |
| Porphyromonas gingivalis | Гингипаин RgpB | Наивная | VHH | ИФА | [118] |
| Pseudomonas aeruginosa | ЛПС | Иммунная | Fab | ИФА, иммунофлуоресцентный анализ | [119] |
| Кэпирующий белок жгутика FliD | Наивная | scFv, scFv-Fc | Вестерн-блоттинг | [120] | |
| Белок, связывающий спермидин SpuE | Наивная | scFv | ИФА | [121] | |
| Ralstonia solanacearum | ЛПС | Наивная | scFv | ИФА, иммунофлуоресценция, вестерн-блоттинг | [122] |
| Salmonella typhimurium | 5 различных иммуногенных белков | Наивная | scFv | ИФА | [91] |
| Staphylococcus aureus | Клетки бактерий | Иммунная | scFvscFv-Fc | ИФА, дот-блоттинг | [123] |
| Энтеротоксин B стафилококков SEB | Иммунная | VHH | ИФА, электрофорез, вестерн-блоттинг | [124] | |
| Streptococcus suis | Клетки бактерий, экстраклеточный фактор EF | Полу- синтетическая |
scFv | ИФА, вестерн-блоттинг, дот-блоттинг | [125] |
| Vibrio cholerae | ЛПС | Иммунная | VHH | ИФА, тесты in vivo | [126] |
| Vibrio parahaemolyticus | Белок наружной мембраны OmpU | Полусинтетическая | sdAb | ИФА, in vitro ингибирование | [127] |
| Yersinia pestis | Капсулоподобный антиген F1 | Наивная | scFv | ИФА | [128] |
Дот-блот иммуноанализ и иммунохроматографические тест-системы успешно объединяют максимальную простоту проведения определения и быстрое получение результатов. Дот-блот иммуноанализ основан на визуализации специфичного взаимодействия адсорбированного на мембране антигена и меченых (коллоидными или молекулярными метками) антител. Иммунохроматографический анализ основан на движении элюента вдоль мембраны (латеральная диффузия), приводящем к образованию специфических иммунных комплексов, которые визуализируются в виде цветных полос. Дот-блот иммуноанализ и иммунохроматографические тест-системы с использованием фаговых антител применяются для определения бактерий Mycobacterium tuberculosis, Neisseria meningitidis, S. aureus, Streptococcus suis и т.д. (табл. 2).
***
Развитие иммунологии и генной инженерии привело к разработке новых методов получения антител, в том числе к созданию технологии фагового дисплея [129, 130]. Данная методика является предпочтительным выбором для производства рекомбинантных антител в большинстве лабораторий, поскольку обеспечивает быструю и экономичную наработку антител с использованием нитевидного фага.
Рекомбинантные антитела используются в диагностике благодаря их специфичности и аффинности. На сегодняшний день на рынке доступно множество платформ, таких как иммунохроматографический анализ, ИФА и микроскопическая визуализация клеток, которые позволяют быстро и точно идентифицировать антигены-мишени, обнаруженные в образце. Большинство платформ используют либо анализ захвата антигена, либо анализ захвата антител для диагностики определенных заболеваний [131].
Следует отметить, что годовой объем продаж терапевтических антител превысил 98 млрд долларов США в 2017 г., а прогноз на 2028 г. составляет более 450 млрд [132]. По данным Fortune Business Insights в 2021 г. соответствующий объем рынка составил 178.5 млрд долларов (https://www.fortunebusinessinsights.com/monoclonal-antibody-therapy-market-102734). Но при этом отсутствуют точные сведения об объеме применения рекомбинантных антител. На данный момент использование подобных антител в терапии и диагностике весьма ограничено, и необходимо проводить дополнительные исследования в данном направлении.
Большой потенциал применения комбинаторных библиотек дает исследователям беспрецедентную возможность определения бактерий, игнорируя использование длительных диагностических процедур. Одним из важных моментов при развитии биосенсоров является подбор соответствующего сенсорного элемента. Технология фагового дисплея фрагментов антител является перспективным методом получения стабильных сенсорных элементов для их использования в датчиках.
Отметим основные преимущества использования фагового дисплея антител по сравнению с классическими методами получения антител:
– Производство рекомбинантных антител проводится in vitro и отсутствует необходимость проведения экспериментов с привлечением животных.
– Уменьшение времени, необходимого для продукции антител, поскольку классические методы требуют иммунизации, которая может занять несколько недель или месяцев, чтобы вызвать достаточный иммунный ответ для выработки антител.
– Фаговые антитела обладают высокой эффективностью в детекции необходимого аналита; имеют преимущества перед природными иммуноглобулинами и, в некоторых случаях, перед их растворимыми фрагментами.
– Технология получения фаговых антител нетрудоемкая, обладает низкой себестоимостью и достаточно быстрая, что позволяет за короткий срок посредством саморепликации фагов получать репертуар фрагментов антител, существующих в организме, и даже расширять этот репертуар посредством искусственного синтеза.
– Возможность создания гибридных молекул с маркерными белками (например, с tag-пептидом), что позволяет эффективно выявлять иммунохимическую реакцию.
– С появлением технологии фагового дисплея стало возможным получение антител к аутоантигенам, слабоиммуногенным соединениям (гаптенам) и токсинам.
Однако следует признать, что фаговые антитела имеют более низкую аффинность по сравнению с обычными иммуноглобулинами. Это связано с отсутствием созревания аффинности антител фагового происхождения, тогда как антитела животного происхождения продуцируются после процесса созревания. В связи с этим, было предложено ввести дополнительную стадию созревания аффинности для улучшения свойств фаговых антител [129].
Производство антител с помощью рекомбинантных методов сможет повысить скорость их наработки, избегая серьезных затрат. В силу своей “гибкости” в отношении модификаций рекомбинантные антитела возможно адаптировать с применением новых технологий и механизмов для последующих применений в диагностике. Оптимизация процедуры получения фаговых антител и варьирование их свойств позволит повысить эффективность использование данных антител в биосенсорных системах, которые незаменимы практически в любой отрасли медицины, биотехнологии, экологии, пищевой промышленности и др.
Таким образом, рекомбинантные антитела, полученные с помощью фагового дисплея, обеспечивают важную платформу для детекции бактерий, и могут быть задействованы в медицине и ветеринарии для быстрого и точного обнаружения патогенов.
Исследование выполнено при финансовой поддержке гранта Российского научного фонда № 22-24-00417.
Список литературы
Gascoyne P., Pethig R., Satayavivad J., Becker F.F., Ruchirawat M. // Biochim. Biophys. Acta. 1997. V. 1323. P. 240–252.
Uithoven K.A., Schmidt J.C., Ballman M.E. // Biosens. Bioelectron. 2000. V. 14. № 10–11. P. 761–770.
Vaughan P.S., Leszyk J.D., Vaughan K.T. // J. Biol. Chem. 2001. V. 276. № 28. P. 26171–26179.
Lesniewski A., Los M., Jonsson–Niedziółka M., Krajewska A., Szot K., Los J.M., Niedziolka–Jonsson J. // Bioconjug. Chem. 2014. V. 25. № 4. P. 644–648.
Spadiut O., Capone S., Krainer F., Glieder A., Herwig C. // Trends Biotechnol. 2014. V. 32. № 1. P. 54–60.
Ратнер Г.М. Поликлональные антитела как реагенты для иммуноанализа: получение, характеристика, применение. Aвтореф. дис. д-ра мед. наук. Томск, 1996. 47 с.
Альтшулер E.П., Серебряная Д.В., Катруха А.Г. // Успехи биологической химии. 2010. Т. 50. С. 203–258.
Flajnik M.F., Singh N.J., Holland S.M. Paul’s Fundamental Immunology / 8 Ed. Amsterdam: Wolters Kluwer Health, 2022. 1312 p.
Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Перевод с англ. М.: Мир, 2002. 589 с.
Петрова Е.Э., Комалева Р.Л., Лахтина О.Е., Самохвалова Л.В., Калинина Н.А., Шошина Н.С. et al. // Биоорганическая химия. 2009. Т. 35. № 3. С. 357–368.
Казачинская Е.И., Иванова А.В., Сорокин А.В., Качко А.В., Субботина Е.Л., Разумов И.А., Локтев В.Б. // Медицинская иммунология. 2010. Т. 12. № 3. С. 177–190.
Bradbury A.R., Marks J.D. // J. Immunol. Methods. 2004. V. 290. № 1–2. P. 29–49.
Bradbury A.R.M., Sidhu S., Dübel S., McCafferty J. // Nat. Biotechnol. 2011. V. 29. № 3. P. 245–254.
Деев С.М., Лебеденко Е.Н., Петровская Л.Е., Долгих Д.А., Габибов А.Г., Кирпичников М.П. // Успехи химии. 2015. Т. 84. № 1. С. 1–26.
Miller L.E., Stevens C.D. Clinical Immunology and Serology: A Laboratory Perspective. 5 Ed. Philadelphia: F.A. Davis, 2020. 624 p.
Abbas A.K., Lichtman A.H., Pillai S. Cellular and Molecular Immunology. 10 Ed. Amsterdam: Elsevier, 2021. 600 p.
Hendrickson O.D., Zherdev A.V., Kaplun A.P., Dzantiev B.B. //Mol. Immunol. 2002. V. 39. № 7–8. P. 413–422.
Schroeder H.W. Jr, Cavacini L. // J. Allergy Clin. Immunol. 2010. V. 125. № 2. Suppl 2. P. S41–52.
Duquesnoy R.J. // Hum. Immunol. 2006. V. 67. № 11. P. 847–862.
Chi S.W., Maeng C.Y., Kim S.J., Oh M.S., Ryu C.J., Kim S.J. et al. // Proc. Natl. Acad. Sci. USA. 2007. V. 104. № 22. P. 9230–9235.
Sundberg E.J. // Methods Mol. Biol. 2009. V. 524. P. 23–36.
McCafferty J., Griffiths A.D., Winter G., Chiswell D.J. // Nature. 1990. V. 348. № 6301. P. 552–554.
Sidhu S.S., Geyer C.R. Phage Display in Biotechnology and Drug Discovery / 2nd Edition. Boca Raton: CRC Press, 2015. 584 p.
Kehoe J.W., Kay B.K. // Chem. Rev. 2005. V. 105. № 11. P. 4056–4072.
Hammers C.M., Stanley J.R. // J. Invest. Dermatol. 2014. V. 134. № 2. P. 1–5.
Hoffman J.A., Giraudo E., Singh M., Zhang L., Inoue M., Porkka K., Hanahan D., Ruoslahti E. // Cancer Cell. 2003. V. 4. № 5. P. 383–391.
Joyce J.A., Laakkonen P., Bernasconi M., Bergers G., Ruoslahti E., Hanahan D. // Cancer Cell. 2003. V. 4. № 5. 393–403.
Zurita A.J., Arap W., Pasqualini R. // J. Control. Release. 2003. V. 91. № 1–2. P. 183–186.
Valadon P., Garnett J.D., Testa J.E., Bauerle M., Oh P., Schnitzer J.E. // Proc. Natl. Acad. Sci. USA. 2006. V. 103. № 2. P. 407–412.
Frank R., Hargreaves R. // Nat. Rev. Drug Discov. 2003. V. 2. № 7. P. 566–580.
Rudin M., Weissleder R. // Nat. Rev. Drug Discov. 2003. V. 2. № 2. P. 123–131.
Ladner R.C., Sato A.K., Gorzelany J., de Souza M. // Drug Discov. Today. 2004. V. 9. № 12. P. 525–529.
Perez J.M., Josephson L., O’Loughlin T., Högemann D., Weissleder R. // Nat. Biotechnol. 2002. V. 20. № 8. P. 816–820.
Akerman M.E., Chan W.C., Laakkonen P., Bhatia S.N., Ruoslahti E. // Proc. Natl. Acad. Sci. USA. 2002. V. 99. № 20. P. 12617–12621.
Mikawa M., Wang H., Guo L., Liu R., Marik J., Takada Y., Lam K., Lau D. // Mol. Cancer Ther. 2004. V. 3. № 10. P. 1329–1334.
Kelly K.A., Allport J.R., Tsourkas A., Shinde–Patil V.R., Josephson L., Weissleder R. // Circ. Res. 2005. V. 96. № 3. P. 327–336.
Zitzmann S., Mier W., Schad A., Kinscherf R., Askoxylakis V., Krämer S. et al. // Clin. Cancer Res. 2005. V. 11. № 1. P. 139–146.
Гулий О.И., Зайцев Б.Д., Бородина И.А., Фомин А.С., Староверов С.А., Дыкман Л.А., Шихабудинов А.М. // Биофизика. 2017. Т. 62. № 3. С. 472–484.
Guliy O.I., Zaitsev B.D., Borodina I.A., Shikhabudinov A.M., Teplykh A.A., Staroverov S.A., Fomin A.S. // Talanta. 2018. V. 178. P. 569–576.
Deantonio C., Cotella D., Macor P., Santoro C., Sblattero D. // Human Monoclonal Antibodies: Methods and Protocols. 2014. P. 277–295.
Lo B.K.C. Antibody Engineering. Methods and Protocols. V. 248. Totowa, N.J.: Humana Press, 2004. 562 p.
McConnell S.J., Dinh T., Le M.H., Spinella D.G. // Biotechniques. 1999. V. 26. P. 208–210.
Сумарока М.В., Дыкман Л.А., Богатырев В.А., Зайцева И.С., Соколов О.И., Щеголев С.Ю., Харрис У. // Аллергология и иммунология. 2000. Т. 1. № 2. С. 134–135.
Krebber A., Bornhauser S., Burmester J., Honegger A., Willuda J., Bosshard H.R., Plückthun A. // J. Immunol. Methods. 1997. V. 201. № 1. P. 35–55.
Hoogenboom H.R., Chames P. // Immunol. Today. 2000. V. 21. № 8. P. 371–378.
Staroverov S.A., Volkov A.A., Fomin A.S., Laskavuy V.N., Mezhennyy P.V., Kozlov S.V. et al. // J. Immunoassay Immunochem. 2015. V. 36. № 1. P. 100–110.
Тикунова Н.В., Морозова В.В. // Acta Naturae. 2009. Т. 1. № 3. С. 22–31.
Ahmad Z.A., Yeap S.K., Ali A.M., Ho W.Y., Alitheen N.B.M., Hamid M. // Clin. Dev. Immunol. 2012. V. 2012. Article 980250.https://doi.org/10.1155/2012/980250
Dormeshkin D.O., Brichko E.A., Gilep A.A., Usanov S.A. // Proceedings of the National Academy of Sciences of Belarus, Chemical Series. 2017. № 2. P. 93–110.
Anderson G.P., Liu J.L., Hale M.L., Bernstein R.D., Moore M., Swain M.D., Goldman E.R. // Anal. Chem. 2008. V. 80. № 24. P. 9604–9611.
Шаталова А.В., Якубова А.С., Палимпсестов В.В., Есмагамбетов И.Б. // Разработка и регистрация лекарственных средств. 2019. Т. 8. № 1. С. 14–22.
Goldman E.R., Liu J.L., Bernstein R.D., Swain M.D., Mitchell S.Q., Anderson G.P. // Sensors. 2009. V. 9. № 1. P. 542–555.
Тиллиб С.В. // Мол. биология. 2011. Т. 45. № 1. С. 77–85.
Charlton K.A., Moyle S., Porter A.J., Harris W.J. // J. Immunol. 2000. V. 164. № 12. P. 6221–6229.
Bashir S., Paeshuyse J. // Antibodies. 2020. V. 9. № 2. Article 21.https://doi.org/10.3390/antib9020021
Щелкунов С.Н. Генетическая инженерия: Учебно-справочное пособие. 2 Изд. Новосибирск: Сиб. унив. изд-во, 2004. 496 с.
Gavilondo J.V., Larrick J.W. // Biotechniques. 2000. V. 29. № 1. P. 128–132.
Roth K.D.R., Wenzel E.V., Ruschig M., Steinke S., Langreder N., Heine P.A. et al. // Front. Cell. Infect. Microbiol. 2021. V. 11. Article 697876.https://doi.org/10.3389/fcimb.2021.697876
de Kruif J., Boel E., Logtenberg T. // J. Mol. Biol. 1995. V. 248. № 1. P. 97–105.
Аникаев А.Ю., Ломоносов А.М. // Лабораторная служба. 2014. Т. 3. № 1. С. 32–36.
Collins F.S., Hamburg M.A. // N. Engl. J. Med. 2013. V. 369. № 25. P. 2369–2371.
Fantini M., Pandolfini L., Lisi S., Chirichella M., Arisi I., Terrigno M., Goracci M., Cremisi F., Cattaneo A. // PLoS One. 2017. V. 12. № 5. Article e0177574. https://doi.org/10.1371/journal.pone.0177574
Braun R., Schönberger N., Vinke S., Lederer F., Kalinowski J., Pollmann K. // Viruses. 2020. V. 12. № 12. Article 1360. https://doi.org/10.3390/v12121360
Peltomaa R., Benito–Peña E., Barderas R., Moreno–Bondi M.C. // ACS Omega. 2019. V. 4. № 7. P. 11569–11580.
Smith G.P. // Science. 1985. V. 228. № 4705. P. 1315–1317.
Smith G.P., Petrenko V.A. // Chem. Rev. 1997. V. 97. № 2. P. 391–410.
Chassagne S., Laffly E., Drouet E., Hérodin F., Lefranc M.P., Thullier P. // Mol. Immunol. 2004. V. 41. № 5. P. 539–546.
Jacobsson K., Rosander A., Bjerketorp J., Frykberg L. // Biol. Proced. Online. 2003. V. 5. P. 123–135.
Stich N., Gandhum A., Matyushin V., Raats J., Mayer C., Alguel Y., Schalkhammer T. // J. Nanosci. Nanotechnol. 2002. V. 2. № 3–4. P. 375–381.
Rudenko N., Fursova K., Banada P.P., Bhunia A.K. Antibodies and Immunoassays for Detection of Bacterial Pathogens. / Eds. M. Zourob, S. Elwary, A. Turner. N.Y.: Springer Science + Business Media, 2008. P. 567–602.
Byrne B., Stack E., Gilmartin N., O’Kennedy R. // Sensors. 2009. V. 9. № 6. P. 4407–4445.
Walper S.A., Lasarte Aragonés G., Sapsford K.E., Brown III C.W., Rowland C.E., Breger J.C., Medintz I.L. // ACS Sens. 2018. V. 3. № 10. P. 1894–2024.
Rudenko N., Fursova K., Shepelyakovskaya A., Karatovskaya A., Brovko F. // Sensors. 2021. V. 21. № 22. Article 7614. https://doi.org/10.3390/s21227614
Dykman L.A., Staroverov S.A., Guliy O.I., Ignatov O.V., Fomin A.S., Vidyasheva I.V. et al. // J. Immunoassay Immunochem. 2012. V. 33. № 2. P. 115–127.
Гулий О.И., Зайцев Б.Д., Кузнецова И.Е., Шиxабудинов А.М., Каpаваева О.А., Дыкман Л.А., Cтаpовеpов C.А., Игнатов О.В. // Биофизика. 2012. Т. 57. № 3. С. 460–467.
Huang S., Yang H., Lakshmanan R.S., Johnson M.L., Wan J., Chen I.-H. et al. // Biosens. Bioelectron. 2009. V. 24. № 6. P. 1730–1736.
Guliy O.I., Velichko N.S., Fedonenko Yu.P., Bunin V.D. // Talanta. 2019. V. 202. P. 362–368.
Гулий О.И., Величко Н.С., Федоненко Ю.П., Бунин В.Д. // Прикл. биохимия и микробиология. 2020. Т. 56. № 1. С. 96–104.
Kuhn P., Thiem S., Steinert M., Purvis D., Lugmayr V., Treutlein U. et al. // Hum. Antibodies. 2017. V. 26. № 1. P. 29–38.
Nanduri V., Bhunia A.K., Tu S.I., Paoli G.C., Brewster J.D. // Biosens. Bioelectron. 2007. V. 23. № 2. P. 248–252.
Liu P., Han L., Wang F., Petrenko V.A., Liu A. // Biosens. Bioelectron. 2016. V. 82. P. 195–203.
Wang X.-Y., Yang J.-Y., Wang Y.-T., Zhang H.-C., Chen M.-L., Yang T., Wang J.-H. // Talanta. 2021. V. 221. https://doi.org/10.1016/j.talanta.2020.121668
De Plano L.M., Fazio E., Rizzo M.G., Franco D., Carnazza S., Trusso S., Neri F., Guglielmino S.P.P. // J. Immunol. Methods. 2019. V. 465. P. 45–52.
Paoli G.C., Brewster J.D. // J. Rapid Methods Autom. Microbiol. 2007. V. 15. P. 77–91.
McIvor M.J., Karoonuthaisiri N., Charlermroj R., Stewart L.D., Elliott C.T., Grant I.R. // PLoS One. 2013. V. 8. № 9. Article e74312.https://doi.org/10.1371/journal.pone.0074312
Holst O., Ulmer, A.J., Brade H., Flad H.-D., Rietschel E.T. // FEMS Immunol. Med. Microbiol. 1996. V. 16. № 2. P. 83–104.
Saunders N.J., Peden J.F., Hood D.W., Moxon E.R. // Mol. Microbiol. 1998. V. 27. № 6. P. 1091–1098.
Kannenberg E.L., Carlson R.W. // Mol. Microbiol. 2001. V. 39. № 2. P. 379–391.
Mora L., Newton W.E. Isolation, Identification and localization of Diazotrophic Bacteria from C4-plant Miscanthus. / Ed. B. Eckert. Dordrecht: Kluwer academic publishers, 2008. 705 p.
Егоров А.М., Осипов А.П., Дзантиев Б.Б., Гаврилова Е.М. Теория и практика иммуноферментного анализа. М.: Изд-во “Высшая школа”, 1991. С. 3–42.
Meyer T., Schirrmann T., Frenzel A., Miethe S., Stratmann–Selke J., Gerlach G.F. et al. // BMC Biotechnol. 2012. V. 12. Article 29. https://doi.org/10.1186/1472-6750-12-29
Payandeh Z., Rasooli I., Mousavi Gargari S.L., Rajabi Bazl M., Ebrahimizadeh W. // Trans. R. Soc. Trop. Med. Hyg. 2014. V. 108. № 2. P. 92–98.
Ahn B.E., Bae H.W., Lee H.R., Woo S.J., Park O.K., Jeon J.H., Park J., Rhie G.E. // Biochem. Biophys. Res. Commun. 2019. V. 509. № 2. P. 611–616.
Hussein A.H., Davis E.M., Halperin S.A., Lee S.F. // Infect. Immun. 2007. V. 75. № 11. P. 5476–5482.
Hayhurst A., Happe S., Mabry R., Koch Z., Iverson B.L., Georgiou G. // J. Immunol. Methods. 2003. V. 276. № 1–2. P. 185–196.
Zou N., Newsome T., Li B., Tsai S., Lo S.-C. // Exp. Biol. Med. 2007. V. 232. № 4. P. 550–556.
Gerstenbruch S., Brooks C.L., Kosma P., Brade L., Mackenzie C.R., Evans S.V., Brade H., Müller–Loennies S. // Glycobiology. 2010. V. 20. № 4. P. 461–472.
Lindquist E.A., Marks J.D., Kleba B.J., Stephens R.S. // Microbiology. 2002. V. 148. № 2. P. 443–451.
Shirvan A.N., Aitken R. // Braz. J. Microbiol. 2016. V. 47. № 2. P. 394–402.
Alibeiki M., Golchin M., Tabatabaei M. // BMC Vet. Res. 2020. V. 16. № 1. Article 361. https://doi.org/10.1186/s12917-020-02572-4
Salhi I., Bessalah S., Snoun D., Khorchani T., Hammadi M. // Iran. J. Biotechnol. 2020. V. 18. № 1. Article e2247. https://doi.org/10.30498/IJB.2020.127753.2247
Mechaly A., Elia U., Alcalay R., Cohen H., Epstein E., Cohen O., Mazor O. // Sci. Rep. 2019. V. 9. № 1. Article 11418.https://doi.org/10.1038/s41598-019-47931-w
Wang Q., Chang C.S., Pennini M., Pelletier M., Rajan S., Zha J. et al. // J. Infect. Dis. 2016. V. 213. № 11. P. 1800–1808.
Reason D.C., Wagner T.C., Lucas A.H. // Infect. Immun. 1997. V. 65. № 1. P. 261–266.
Fouladi M., Sarhadi S., Tohidkia M., Fahimi F., Samadi N., Sadeghi J., Barar J., Omidi Y. // Appl. Microbiol. Biotechnol. 2019. V. 103. № 8. P. 3407–3420.
Fahimi F., Sarhaddi S., Fouladi M., Samadi N., Sadeghi J., Golchin A. et al. // Appl. Microbiol. Biotechnol. 2018. V. 102. № 16. P. 6899–6913.
Close D.W., Ferrara F., Dichosa A.E., Kumar S., Daughton A.R., Daligault H.E. et al. // BMC Microbiol. 2013. V. 13. Article 270. https://doi.org/10.1186/1471-2180-13-270
Mohd Ali M.R., Sum J.S., Aminuddin Baki N.N., Choong Y.S., Nor Amdan N.A., Amran F., Lim T.S. // Int. J. Biol. Macromol. 2021. V. 168. P. 289–300.
Moreira G.M.S.G., Köllner S.M.S, Helmsing S., Jänsch L., Meier A., Gronow S. et al. // Sci. Rep. 2020. V. 10. № 1. Article 15267. https://doi.org/10.1038/s41598-020-72159-4
Moreira G.M.S.G., Gronow S., Dübel S., Mendonça M., Moreira Â.N., Conceição F.R., Hust M. // Front. Public Health. 2022. V. 10. Article 712657. https://doi.org/10.3389/fpubh.2022.712657
Tu Z., Chen Q., Li Y., Xiong Y., Xu Y., Hu N., Tao Y. // Anal. Biochem. 2016. V. 493. P. 1–7.
Boel E., Bootsma H., de Kruif J., Jansze M., Klingman K.L., van Dijk H., Logtenberg T. // Infect. Immun. 1998. V. 66. № 1. P. 83–88.
Fuchs M., Kämpfer S., Helmsing S., Spallek R., Oehlmann W., Prilop W. et al. // BMC Biotechnol. 2014. V. 14. Article 68. https://doi.org/10.1186/1472-6750-14-68
Kawasaki M., Echiverri C., Raymond L., Cadena E., Reside E., Gler M.T. et al. // PLoS Med. 2019. V. 16. № 4. Article e1002780. https://doi.org/10.1371/journal.pmed.1002780
Yan Z.-H., Zhao B., Pang Y., Wang X.-J., Yi L., Wang H.-L., Yang B., Wie P.-J., Jia H.-Y., Li S.-P., Zhao Y.-L., Zhang H.-T. // J. Microbiol. Immunol. Infect. 2021. V. 54. № 3. P. 437–446.
Liu C.-Y., Weng C.-C., Lin C.-H., Yang C.-Y., Mong K.-K.T., Li Y.-K. // Biotechnol. Lett. 2017. V. 39. № 3. P. 407–413.
Kulkarni A., Mochnáčová E., Majerova P., Čurlík J., Bhide K., Mertinková P., Bhide M. // Front. Mol. Biosci. 2020. V. 7. Article 573281. https://doi.org/10.3389/fmolb.2020.573281
Skottrup P.D., Leonard P., Kaczmarek J.Z., Veillard F., Enghild J.J., O’Kennedy R. et al. // Anal. Biochem. 2011. V. 415. № 2. P. 158–167.
Tout N.L., Lam J.S. // Clin. Diagn. Lab. Immunol. 1997. V. 4. № 2. P. 147–155.
Postel S., Deredge D., Bonsor D.A., Yu X., Diederichs K., Helmsing S. et al. // Elife. 2016. V. 5. Article e18857. https://doi.org/10.7554/eLife.18857.001
Zhang Y., Sun X., Qian Y., Yi H., Song K., Zhu H. et al. // J. Mol. Biol. 2019. V. 431. № 24. P. 4882–4896.
Griep R.A., van Twisk C., van Beckhoven J.R., van der Wolf J.M., Schots A. // Phytopathology. 1998. V. 88. № 8. P. 795–803.
Nian S., Wu T., Ye Y., Wang X., Xu W., Yuan Q. // BMC Immunol. 2016. V. 17. № 1. Article 8. https://doi.org/10.1186/s12865-016-0146-z
Zanganeh S., Rouhani Nejad H., Mehrabadi J.F., Hosseini R., Shahi B., Tavassoli Z., Aramvash A. // Appl. Biochem. Biotechnol. 2019. V. 187. № 2. P. 493–505.
de Greeff A., van Alphen L., Smith H.E. // Infect. Immun. 2000. V. 68. № 7. P. 3949–3955.
Ebrahimizadeh W., Mousavi Gargari S., Rajabibazl M., Safaee Ardekani L., Zare H., Bakherad H. // Appl. Microbiol. Biotechnol. 2013. V. 97. № 10. P. 4457–4466.
Yu J., Sun Z., Sun X., Sun X., Wei H., Jia W. et al. // Microb. Pathog. 2020. V. 143. Article 104136. https://doi.org/10.1016/j.micpath.2020.104136
Lillo A.M., Ayriss J.E., Shou Y., Graves S.W., Bradbury A.R., Pavlik P. // PLoS One. 2011. V. 6. № 12. Article e27756. https://doi.org/10.1371/journal.pone.0027756
Hust M., Meyer T., Voedisch B., Rülker T., Thie H., El-Ghezal A. et al. // J. Biotechnol. 2011. V. 152. № 4. P. 159–170.
Ch’ng A.C.W., Choong Y.S., Lim T.S. Phage Display-Derived Antibodies: Application of Recombinant Antibodies for Diagnostics. / Ed. S.K. Saxena. London: IntechOpen Limited, 2016. P. 107–135.
Beadle C., Long G.W., Weiss W.R., McElroy P.D., Maret S.M., Oloo A.J., Hoffman S.L. // Lancet. 1994. V. 343. № 8897. P. 564–568.
Grilo A.L., Mantalaris A. // Trends Biotechnol. 2019. V. 37. P. 9–16.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология