Прикладная биохимия и микробиология, 2023, T. 59, № 2, стр. 208-216
Биопрепарат на основе иммобилизованных микроорганизмов как основа высокоэффективных органических удобрений нового поколения
Н. Ю. Юдина 1, Т. Н. Козлова 1, Т. Н. Абрамова 2, В. А. Арляпов 1, Л. Д. Асулян 1, В. А. Алферов 1, А. Н. Решетилов 2
1 Тульский государственный университет
300012 Тула, Россия
2 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина Российской академии наук –
обособленное подразделение ФИЦ ПНЦБИ РАН
142290 Пущино, Московская обл., Россия
Поступила в редакцию 05.09.2022
После доработки 30.10.2022
Принята к публикации 07.11.2022
- EDN: LVOQMF
- DOI: 10.31857/S0555109923020198
Аннотация
На основе бактерий Bacillus megaterium и Azotobacter сhroococcum, иммобилизованных в гидрогель модифицированного поливинилового спирта создано 2 биопрепарата. Показано, что при применении разработанных биопрепаратов происходит увеличение влажности почвы (в 2 раза), всхожести (до 100%), длины стебля и корня кресс-салата (на 15–30%). При применении биопрепарата на основе Azotobacter chroocоcсum происходило обогащение почвы азотом (в 2 раза). Жизнеспособность бактерий в гидрогеле на основе поливинилового спирта, модифицированного янтарной кислотой составляла более 30 сут, что позволило создать эффективные биоудобрения нового поколения на их основе.
В последние годы в сельском хозяйстве растет спрос на использование биоудобрений (препараты микробных культур), которые безопасны для окружающей среды. Они производятся в промышленных масштабах для различных растений, это такие известные препараты как “Нитрагин”, “Аzotobakterins”, “Ризоторфин”, “Азофит” и “Азолен” (Россия), свойства которых зависят от используемых штаммов бактерий [1, 2].
Применение синтетических удобрений на основе азота, по оценкам исследователей, обеспечивает примерно половину мировых запасов продовольствия, и прогнозируется, что уровень потребления азотных удобрений возрастет с 80 до 180 млн т к 2050 г. [3], однако до 50% применяемых синтетических удобрений подвержены потерям в почве и окружающей среде. В связи с этим используют различные азотофиксирующие бактерии родов Azotobacter, Azospirillum, Herbaspirillum, Gluconacetobacter, Clostridium, Methanosarcina, которые способны преобразовывать молекулярный азот в ионы аммония – форму пригодную для усвоения растениями. Количество свободноживущих азотофиксирующих бактерий в почве не велико (<104 КОЕ/г почвы) и они обеспечивают поступление от 0.3 до 15 кг/Га в год азота в почву [4]. Особого внимания заслуживают биопрепараты на основе бактерий рода Azotobacter, поскольку они улучшают азотное питание, усиливают витаминный обмен, увеличивают доступность дополнительных питательных веществ (P, K и Zn), продуцируют биологически активные вещества, например гормоны роста растений, что способствует развитию растений, снижают возможность заражения растений грибными и бактериальными заболеваниями, хотя точный механизм действия, с помощью которого Azotobacter может усиливать рост растений, еще полностью не изучен [5]. Еще одним преимуществом бактерий рода Azotobacter является образование цист, за счет которых они способны сохранять жизнеспособность в окружающей среде (в сухой почве более 10 лет), что позволит использовать их для создания уникальных биоудобрений. На настоящий момент биоудобрения на основе Azotobacter (более 30 коммерческих биопрепаратов, в России Азолен, Азофит, Азотовит, Ризо, Азотобактер и др.) представляют самый большой сегмент мирового рынка биоудобрений. В 2017 г. он составлял 212.2 млн долларов и ожидается, что среднегодовые темпы роста в течение 2020–2025 гг. составят 8.7% [1].
Помимо азотофиксирующих бактерий, в качестве биоудобрений в почву вносят фосфосолюбилизирующие, которые обеспечивают превращение нерастворимых фосфатов в растворимые, пригодные для использования растениями. Создано не менее 10 коммерческих биопрепаратов на основе бактерий рода Bacillus [2], в том числе в России, “Фосфобактерин” на основе спороносной палочки Bacillus megaterium var. phоsphaticum [6]. При этом биопрепараты для обработки семян перед посадкой чаще всего используют в виде водной суспензии. Очевидно, что такие препараты достаточно быстро вымываются из почвы. Решением этой проблемы может быть иммобилизация применяемых микроорганизмов в гидрогели, образованные слабосшитыми полимерами.
Поливиниловый спирт (ПВС) является одним из наиболее популярных полимеров, используемых как биологически совместимые материалы в качестве основы гидрогелей [7–10]. Гидрогели на основе ПВС нашли широкое применение во многих сферах деятельности: медицине [11, 12], промышленности [13], сельском хозяйстве [14], биосенсорике [7–9, 15] и т.д. Макромолекулы ПВС имеют линейное строение, поэтому его гидрогели постепенно растворяются в воде. Для предотвращения этого процесса синтезируют сетчатые полимеры, за счет введения различных сшивающих агентов в зависимости от целей (N-винилпирролидон [7], сульфоянтарная кислота [16], глутаровый альдегид, формальдегид [17], лимонная и янтарная кислоты [18] и т.д.). При применении гелей ПВС в сельском хозяйстве особое внимание следует уделить таким сшивающим агентам, как дикарбоновые кислоты, так как янтарная кислота сама является удобрением [19].
Иммобилизация микроорганизмов различных родов (Azоtоbacter, Bacillus, Streptomyces) в сшитый гидрогель модифицированного ПВС позволит создать инновационный увеличивающий плодородие почвы биопрепарат. Гидрогель к тому же позволяет удерживать большое количество влаги (частота полива может быть уменьшена до двух раз в месяц), а использование микроорганизмов позволит обеспечить растения необходимыми макроэлементами, стимулировать рост, развитие, цветение и созревание плодов.
Цель работы – разработка биопрепарата для удобрения почвы на основе гидрогеля модифицированного поливинилового спирта и почвенных бактерий Bacillus megaterium de Bary ВКМ В-847 и Azotobacter сhroococcum Beijerinck 1901 ВКМ B-1616.
МЕТОДИКА
Получения ПВС, модифицированного N-винилпирролидоном. Для получения поливинилового спирта, модифицированного N-винилпирролидоном использовали 5%-ный водной раствор ПВС марки № 16/1 (Россия), водный раствор аммоний-церий (IV) нитрата (NH4)2Ce(NO3)6 (ч. д. а., ТУ 6-09-4762-84, Россия) в качестве инициатора и N-винилпирролидон (99%, “Acrosorganics”, США) в качестве сшивающего агента. Модификацию проводили при постоянном перемешивании в атмосфере азота при температуре 40°С.
Получение поливинилового спирта, модифицированного дикарбоновыми кислотами. К 5%-ному раствору ПВС при температуре 60°С добавляли навеску кислоты (янтарной, щавелевой, фумаровой) из расчета, что на 0.04 моль ПВС приходится 7.5 × 10–4 моль дикарбоновой кислоты [20].
Регистрация ИК-спектров. Регистрацию ИК-спектров образцов модифицированного ПВС в виде тонких пленок проводили на инфракрасном Фурье-спектрометре ФМС 1201 (“Мониторинг”, Россия).
Определение доли сшитого ПВС. Определение доли сшитого полимера проводили методом экстракции. Для этого проводили взвешивание высушенного образца массой от 0.01 до 0.02 г, заливали водой и перемешивали в течение 2 ч при t = 60°C. После экстракции воду отделяли центрифугированием и сушили исследуемые образцы до постоянной массы при 60°C. Экстракцию повторяли несколько раз до получения постоянной массы образца после высушивания. Эксперимент проводился для 15 образцов каждой пленки со статистической обработкой полученных данных. Процент потери веса определяли по формуле:
где m1 – масса до экстракции, m2 – масса высушенного гидрогеля после экстракции.
Определение степени набухания модифицированного ПВС. Для определения степени набухания навеску высушенного геля (0.01–0.02 г) взвешивали на аналитических весах и опускали на 5 мин в микропробирку, в которой находилось 1.5 мл дистиллированной воды. После этого набухший гель отделяли центрифугированием и взвешивали. Влагосодержание определяли высушиванием образца геля при температуре 120°С до постоянной массы.
Культивирование клеток микроорганизмов. Штаммы Bacillus megaterium ВКМ В-847и Azotobacter сhroococcum ВКМ B-1616 были получены во Всероссийской коллекции микроорганизмов Института биохимии и физиологии микроорганизмов РАН.
Бактерии B. megaterium культивировали аэробно 36–38 ч на жидкой глюкозо-пептонной питательной среде следующего состава (г/л): мясной пептон – 10, мясной экстракт – 10, NaCl – 5 (“Диаэм”, Россия). Бактерии A. chroococcum культивировали аэробно 72–90 ч на жидкой питательной среде Эшби, следующего состава (г/л): K2HPO4 – 0.2, сахароза – 5.0, NaCl – 0.2, MgSO4 · · 7H2O – 0.2, K2SO4 – 0.2, CaCO3 – 5.0.
Клетки культивировали аэробно в качалочных колбах объемом 750 см3 при температуре 28°С. Полученную биомассу отделяли центрифугированием при 10 000 g при комнатной температуре 10 мин (центрифуга TG16WS, “Поликом”, Россия). Осадок промывали 20 мМ фосфатным буферным раствором, рН 6.8, ресуспендировали в буферном растворе и распределяли по микропробиркам типа Eppendorf, центрифугировали на центрифуге “Eppendorf” (Германия) 5 мин при 10000 g. Промытую биомассу хранили при температуре – 25°С в микропробирках.
Оценка дыхательной активности микроорганизмов. Для формирования рецепторного элемента на фрагмент целлюлозной диализной мембраны D9777 (“Sigma”, США) размером 1 × 1 см наносили 10 мкл суспензии бактерий, разбавленных в соотношении 1 : 1 соответствующим буферным раствором (титр бактерий B. megaterium B-847 в суспензии составлял 3 × 109 КОЕ/мл, а для бактерий A. сhroococcum B-1616 – 6 × 108 КОЕ/мл). Закрепление биочувствительного элемента на электроде Кларка проводили с помощью полимерного кольца.
Формирование рецепторной системы биосенсора на основе иммобилизованных микроорганизмов в гидрогели ПВС. Для получения биокатализатора к 200 мкл гидрогеля модифицированного поливинилового спирта добавляли 20 мг сырой биомассы бактерий B. megaterium B-847. Равномерного распределения клеток в гидрогеле добивались встряхиванием смеси на центрифуге Skyline Elmi Centrifuge&Vortex CM70M (“ELMI”, Латвия) в течение 5 мин. Полученную суспензию переносили в планшет (d = 5 мм) и оставляли при 18–22°С до полного высыхания.
Биорецепторный элемент фиксировали на кислородном электроде при помощи нейлоновой сетки. Данная методика универсальна для всех модифицирующих агентов.
Проведение биосенсорных измерений. Электрохимические измерения проводили с использованием анализатора “Эксперт-009” (“Эконикс-Эксперт”, Россия), сопряженного с персональным компьютером, работающим под управлением специализированного программного обеспечения EXP2PR (“Эконикс-Эксперт”, Россия). Измеряемым параметром (ответом биосенсора) являлась максимальная скорость изменения концентрации кислорода при добавлении субстратов (мг/дм3 ∙ с).
Преобразователями являлись кислородные электроды типа Кларка, содержащие иммобилизованные клетки микроорганизмов. Измерения выполнялись в кювете объемом 5 мл. Для измерений использовали натрий-калиевый фосфатный буферный раствор, рН – 6.8, суммарная концентрация солей в котором составляла 20 мМ. Раствор перемешивали магнитной мешалкой (150 об./мин).
Формирование биопрепарата на основе иммобилизованных микроорганизмов в гидрогели ПВС. Для получения биопрепарата к 1000 мкл гидрогеля модифицированного поливинилового спирта добавляли 100 мг сырой биомассы бактерий B. megaterium B-847 или A. сhroococcum B-1616. Равномерного распределения клеток в гидрогеле добивались встряхиванием смеси на центрифуге Skyline Elmi Centrifuge&Vortex CM70M (“ELMI”, Латвия) в течение 5 мин. Полученную суспензию переносили на предметное стекло и оставляли при 18–22°С до полного высыхания. Высушенный биопрепарат измельчали ножницами и вносили в почву.
Биотестирование. Было сформировано 3 серии образцов с применением коммерческого удобрения “Зеба” с использованием разработанного биопрепарата и контроля. В качестве коммерческого удобрения выбран почвоулучшитель-суперабсорбент “Зеба” (“Щелково Агрохим”, Россия), в состав которого входят гель крахмал-поли (2-акриламид-ко-2-акриловая кислота), калиевая соль – 88% и мел – 12%. В качестве влагоудерживающего компонента в данном продукте выступает полимер на основе крахмала. Производитель обещает улучшение прорастания семян и рост рассады, сокращение количества поливов и расхода воды, более активное развитие корневой системы.
В 60 г предварительно прокаленной в течение 3 ч при 140°С почвы вносили 50 семян кресс-салата. После чего производился полив 50 мл дистиллированной воды. Гидрогели (коммерческий и разработанный биопрепарат) вносили в толщу почвы. Масса коммерческого аналога рассчитывалась согласно рекомендации производителя (0.5 г/л почвы, 0.12% по массе). Биотестирование проводилось в течение 7 сут. Измеряемыми параметрами были влажность почвы, всхожесть семян, высота стебля кресс-салата и длина корня [21].
Измерение влажности почвы производилось в соответствии с ГОСТ 28268-89.
Капилярный электрофорез. Определение иона аммония в образцах почвы проводили в соответствии с ПНД Ф 16.1:2:2.2:2.3.74-2012. Анализ проводили с помощью системы капиллярного электрофореза “Капель-104Т” (Россия) и программного обеспечения “МультиХром 1.5х”
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Известно, что гидрогели ПВС применяются в качестве носителей для иммобилизации микроорганизмов и ферментов [7–9, 15]. Иммобилизация микроорганизмов в гидрогели ПВС модифицированные дикарбоновыми кислотами позволяет создавать биопрепараты для улучшения почвы. В настоящей работе были отобраны бактерии вида B. megaterium, так как они являются фосфосолюбилизирующими бактериями, обеспечивающими превращение нерастворимых фосфатов в растворимые, пригодные для использования растениями [22]. Бактерии вида A. chroococcum – азотофиксаторы, которые преобразуют молекулярный азот в ионы аммония – форму пригодную для усвоения растениями [1]. Таким образом, использование данных микроорганизмов обеспечит присутствие в почве таких важных макроэлементов, как фосфор и азот.
Модификация поливинилового спирта. Для получения сетчатого полимера в качестве модифицирующих агентов использовали N-винилпирролидон и дикарбоновые кислоты: янтарную, фумаровую и щавелевую. На примере янтарной кислоты показана схема сшивки ПВС и ИК-спектр (рис. 1).
В ИК-спектре наблюдалось исчезновение полосы поглощения карбоксильной группы при 1698 см–1 и появление полосы поглощения при 1731 см–1, характерной для сложных эфиров. При 1695 см–1 наблюдаются колебания ацетильной группы остаточного поливинилацетата. Для доказательства образования сетчатой структуры в синтезированных гидрогелях ПВС определяли долю сшитого полимера методом экстракции.
Как видно из табл. 1, при увеличении доли N-винилпирролидона и инициатора в 10 раз в сополимере происходило увеличение доли сшитого полимера на 20% (с 50 до 70%). При увеличении содержания N-винилпирролидона и инициатора происходит уменьшение степени набухания гидрогеля с 11 до 3 г/г. Структура ПВС, модифицированного N-винилпирролидоном, описана в ранее опубликованной статье [7].
Таблица 1.
Доля сшитого полимера и степень набухания модифицированных гидрогелей ПВС
| Гидрогель (мольные соотношения) | Степень набухания Q, г/г | Доля сшитого полимера Р, % |
|---|---|---|
| ПВС: янтарная кислота = 160 : 3 | 5 ± 1 | 50 ± 2 |
| ПВС : фумаровая кислота = 160 : 3 | 4 ± 2 | 34 ± 5 |
| ПВС : щавелевая кислота = 160 : 3 | 3 ± 1 | 33 ± 3 |
| ПВС : инициатор : N-ВП = 160 : 7 :1 | 11 ± 4 | 50 ± 3 |
| ПВС : инициатор : N-ВП = 160 : 35 : 5 | 5 ± 1 | 60 ± 3 |
| ПВС : инициатор : N-ВП = 160 : 70 : 10 | 3 ± 1 | 70 ± 10 |
Наибольшей степенью сшивки при использовании дикарбоновых кислот обладал образец ПВС, модифицированный янтарной кислотой (50%), по сравнению с фумаровой (34%) и щавелевой (33%). Этот факт можно объяснить тем, что янтарная кислота, содержащая одинарные С–С связи, обладает более гибкой конфигурацией и способна взаимодействовать с гидроксильными группами ПВС при любом пространственном расположении этих групп, в отличии от фумаровой, обладающей жестким углеродным скелетом за счет двойных связей С=С. Все образцы ПВС, модифицированные дикарбоновыми кислотами, обладали сопоставимой степенью набухания.
Так как гидрогель будет использоваться в качестве основы для создания биопрепарата и служить в почве источником дополнительной влаги для растения, то важным показателем является степень набухания. На основании данного факта для дальнейших исследований была выбрана матрица на основе ПВС : инициатор : N-винилпирролидон в мольном соотношении 160 : 7 : 1, так как она обладала наибольшим значением этого показателя среди всех предложенных. В качестве второго гидрогеля для исследований был выбран ПВС, модифицированный янтарной кислотой, так как он обладал достаточными степенью набухания и долей сшивки, а сама янтарная кислота применяется в качестве удобрений в сельском хозяйстве.
Определение характеристик жизнеспособности микроорганизмов с использованием биосенсорного подхода. Подбор наиболее перспективной матрицы на основе модифицированного ПВС проводился с использование бактерий B. megaterium. Для сравнения был выбран способ иммобилизации с применением диализной мембраны, так как он считается наиболее “мягким” и биоматериал не теряет своей активности. Предложенный подход к выбору биопрепарата основан на сравнительном анализе чувствительности микроорганизмов по отношению к окисляемым органическим субстратам как основной характеристике биокаталитической активности; стабильности в иммобилизованном состоянии как ключевой физиолого-биохимической характеристике и способности микроорганизмов окислять широкий круг веществ как ключевой метаболической характеристики. Таким образом, в качестве показателей жизнедеятельности микроорганизмов были приняты следующие параметры биосенсора: долговременная стабильность, спектр окисляемых субстратов, нижняя граница определяемых концентраций. Данные характеристики отражают надежность фиксации бактерий в порах гидрогелях, наличие токсичного эффекта на микроорганизмы со стороны матрицы и возможные препятствия диффузии субстрата со стороны матрицы. Для определения достоверности биосенсорных измерений был использован показатель операционной стабильности, показывающий устойчивость ответа сенсора на одну и ту же концентрацию субстрата при проведении большого числа последовательных измерений [23].
Для оценки спектра окисляемых субстратов бактериями B. megaterium В-847 регистрировали отклик биосенсора на введение в измерительную кювету одинакового объема растворов субстратов (которые могут находиться в почве) с концентрацией 1 моль/дм3. Для трудно растворимых веществ применяли насыщенные растворы. Каждое измерение проводилось по 3 раза. Данные по спектру окисляемых субстратов бактериями B. megaterium при разных способах иммобилизации представлены на одной диаграмме (рис. 2).
Рис. 2.
Спектр субстратов (1–21), окисляемых бактериями B. megaterium В-847, иммобилизованными в ПВС : N-ПВ (I), ПВС : янтарная кислота (II) и на диализной мембране (III): 1 – ксилоза, 2 – галактоза, 3 – глюкоза; 4 – манноза, 5 – фруктоза, 6 – сахароза, 7 – лактоза, 8 – этанол, 9 – глицерин, 10 – мочевина, 11 – глицин, 12 – серин, 13 – тирозин, 14 – аргинин, 15 – глутамин, 16 – аспаргиновая кислота, 17 – глутаминовая кислота, 18 – этановая кислота, 19 –пропандиовая кислота, 20 – бутандиовая кислота, 21 – аскорбиновая кислота.

Данные по спектру окисляемых субстратов представлены в процентах по отношению к максимальному отклику. При иммобилизации в диализную мембрану и гидрогель ПВС, модифицированный янтарной кислотой, максимальный ответ сенсора был получен на галактозу, а при использовании ПВС, модифицированного N-винилпирролидоном, – на ксилозу. Анализируя данную диаграмму, можно сказать, что бактерии B. megaterium могут метаболизировать широкий круг субстратов, включая моно- и дисахариды, одноатомные и многоатомные спирты, органические кислоты и аминокислоты во всех случаях иммобилизации (рис. 2). Полученные результаты вполне согласуются с природой данных микроорганизмов, которые являются сапрофитами. Вне зависимости от способа иммобилизации бактерии окисляют все исследуемые субстраты, а значит, включение в гель не влияет на ферментативные системы микроорганизмов.
На основании полученных данных (табл. 2 и рис. 2) можно сказать, что значительного отличия в параметрах жизнедеятельности бактерий B. megaterium при различных способах иммобилизации не обнаружено. Биосенсоры обладают высокой долговременной стабильностью (более 20 сут), сопоставимой операционной стабильностью (относительное отклонение не более 8%), широким спектром окисляемых субстратов (20 субстратов) и довольно низким значением нижней границы определяемых концентраций глюкозы (0.004 ммоль/дм3). На основании данных показателей можно сделать вывод, что поливиниловый спирт, модифицированный янтарной кислотой и N-винилпирролидоном надежно фиксирует бактерии B. megaterium, не оказывая на них токсичного влияния, не затрудняет диффузию субстрата и не оказывает влияние на ферментативные системы клеток, а значит может быть использован в качестве иммобилизующей матрицы для создания биопрепарата. Для дальнейших исследований был выбран биопрепарат на основе ПВС, модифицированного янтарной кислотой, так как данный гидрогель требует меньше временных и экономических затрат при синтезе, биокатализатор обладал наибольшей долговременной стабильностью, кроме того янтарная кислота может применяться в качестве удобрения. Проведена иммобилизация бактерий A. сhroocоcсum в выбранную матрицу и на основании биосенсорных измерений показана высокая жизнеспособность в ней микроорганизмов. Долговременная стабильность составила 26 сут, нижняя граница определяемых концентраций – 0.006 ммоль/дм3.
Таблица 2.
Характеристики биосенсоров на основе бактерий родов Bacillus и Azotobacter
| Характеристика биосенсора/способ иммобилизации | Бактерии B. megaterium | Бактерии Azotobacter ПВС : янтарная кислота |
||
|---|---|---|---|---|
| ПВС : N-ВП | ПВС : янтарная кислота | диализная мембрана | ||
| Операционная стабильность по 15 измерениям, % | 7.5 | 7.9 | 7.2 | 8.6 |
| Долговременная стабильность, сут | 26 | 35 | 23 | 26 |
| Нижняя граница определяемых концентраций глюкозы, моль/л | 0.002 | 0.002 | 0.004 | 0.006 |
Биотестирование созданных биопрепаратов. В качестве тест-объекта были использованы семена кресс-салата в соответствии с ПНД Ф Т 14.1:2:4.19-2013. В табл.3 представлены результаты биотестирования, проведенные на кресс-салате.
Таблица 3.
Биотестирование созданных биопрепаратов на основе бактерий B. megaterium и A. сhroocоcсum
| Вариант | Высота стебля, мм | Длина корня, мм | Всхожесть, % | Влажность через 7 сут, % | Начальное содержание ионов ${\text{NH}}_{4}^{ + }$, мг/кг | Содержание ионов ${\text{NH}}_{4}^{ + }$ через 7 сут, мг/кг |
|---|---|---|---|---|---|---|
| Контроль | 17 ± 1 | 12 ± 1 | 53 ± 7 | 5 ± 1 | 24 ± 2 | 14 ± 2 |
| Гидрогель “Зеба” (0.12%) | 24 ± 2 | 12 ± 2 | 79 ± 3 | 7 ± 1 | 25 ± 2 | 15 ± 2 |
| ПВС : янтарная кислота | Биопрепарат на основе бактерий B. megaterium | |||||
| 0.06% | 28 ± 6 | 12 ± 2 | 90 ± 6 | 14.1 ± 0.5 | – | – |
| 0.12% | 29 ± 5 | 26 ± 2 | 100 ± 0 | 18.7 ± 0.3 | – | – |
| 0.24% | 33 ± 6 | 29 ± 2 | 100 ± 0 | 22.7 ± 0.4 | – | – |
| ПВС : янтарная кислота | Биопрепарат на основе бактерий A. сhroocоcсum | |||||
| 0.06% | 25 ± 1 | 38 ± 2 | 89 ± 4 | 7 ± 2 | 23 ± 2 | 24 ± 2 |
| 0.12% | 25 ± 1 | 44 ± 3 | 89 ± 4 | 9 ± 1 | 24 ± 2 | 28 ± 3 |
| 0.24% | 25 ± 1 | 46 ± 3 | 89 ± 2 | 12 ± 2 | 24 ± 2 | 27 ± 2 |
Как видно из приведенных в табл.3 результатов, добавление 0.06% по массе биопрепарата на основе модифицированного ПВС и бактерий в почву дает результаты сравнимые с коммерческим гидрогелем. При увеличении дозы биопрепарата до 0.12 и 0.24% наблюдалось значительное увеличение корневой системы, высоты стебля и всхожести. Разработанный биопрепарат на основе гидрогеля ПВС способен удерживать влагу в почве лучше коммерческого образца.
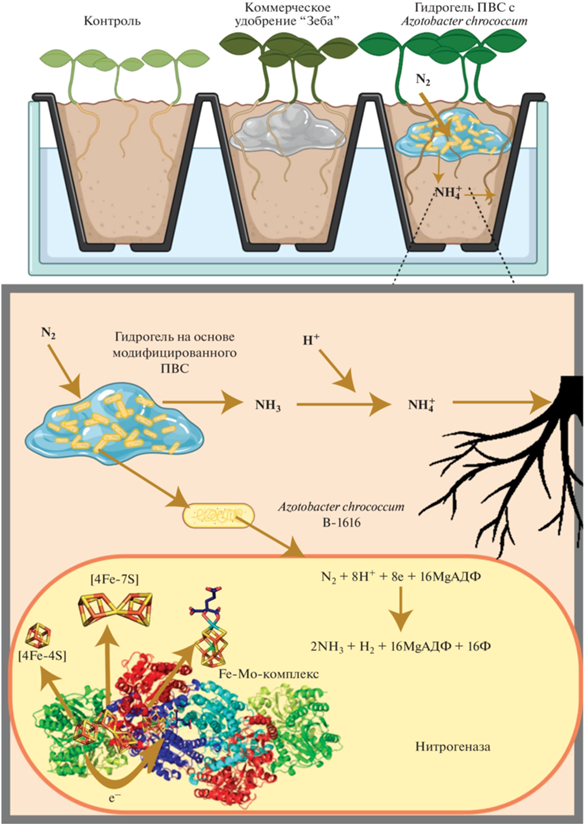
Для образцов на основе биопрепарата с A. chroococcum методом капиллярного электрофореза установлено присутствие ионов ${\text{NH}}_{4}^{ + },$ поскольку данные микроорганизмы фиксируют азот в виде ионов аммония [1]. На рис. 3 представлена схема действия разработанного биопрепарата на основе бактерий A. chroococcum, иммобилизованных в гидрогель ПВС, модифицированного янтарной кислотой.
В контрольном образце после 7 сут экспозиции наблюдалось снижение концентрации ионов аммония в почве на 42% (с 24 до 14 мг/г), при использовании коммерческого препарата “Зеба” так же происходило снижение их концентрации, так как эти образцы не содержали азотофиксирующих микроорганизмов. При использовании разработанного биопрепарата на основе бактерий A. chroococcum происходило незначительное увеличение содержания ионов аммония, что подтверждало жизнеспособность бактерий A. chroococcum, иммобилизованных в гидрогель ПВС, модифицированного янтарной кислотой. Фиксация атмосферного азота бактериями Azotobacter осуществлялась под действием фермента нитрогеназы, который необратимо окисляется под действием кислорода (но в клетке находится в защищенном виде) [24]. В соответствии со схемой, представленной на рис. 3, ферментный комплекс состоит из двух ферментов: собственно нитрогеназы (называемой также Mo-Fe-белком, в состав кофактора входит два атома молибдена) и гидрогеназы (Fe-белок или редуктаза нитрогеназы). Эти два компонента белка действуют вместе и катализируют восстановление азота до аммиака.
На основании проведенных исследований можно сделать вывод, что разработанный биопрепарат не уступает коммерческому аналогу, а по некоторым показателям превосходит его и может быть рекомендован в качестве влагоудерживающего и обогащающего почву макроэлементами биопрепарата.
Синтезированы матрицы на основе ПВС и различных сшивающих агентов (N-винилпирролидон и дикарбоновые кислоты) и определены доля сшитого полимера и степень набухания. Наиболее перспективным гидрогелем для создания биоудобрений является ПВС, модифицированный янтарной кислотой, доля сшитого полимера в котором составила 50 ± 2%, степень набухания – 5 ± 1 г/г. На основании биосенсорных измерений доказана жизнеспособность микроорганизмов B. megaterium и A. chroocоcсum в разработанных матрицах, что позволит использовать их для создания биоудобрений. Показано, что при использовании обоих биопрепаратов на основе бактерий происходило улучшение таких характеристик как всхожесть, влажность, длина стебля, длина корня, а биопрепарат на основе A. chroocоcсum значительно обогащал почву азотом (в 2 раза). Разработанные биоудобрения могут служить прототипом для создания высокоэффективного биоорганического коммерческого удобрения нового поколения.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования РФ в рамках государственного задания № FEWG-2021-0013 (Биокаталитические платформы на основе клеток микроорганизмов, субклеточных структур и ферментов в сочетании с наноматериалами).
Список литературы
Aasfar A., Bargaz A., Yaakoubi K., Hilali A., Bennis I., Zeroual Y., MeftahKadmiri I. // Front. Microbiol. 2021. V. 12. P. 354–372.
Saxena A.K., Kumar M., Chakdar H., Anuroopa N., Bagyaraj D.J. // J. Applied Microbiol. 2020. V. 128. № 6. P. 1583–1594.
Bindraban P.S., Dimkpa C., Nagarajan L., Roy A., Rabbinge R. // Biol. and Fertility of Soils. 2015. V. 51. № 8. P. 897–911.
Saha B., Saha S., Das A., Bhattacharyya P.K., Basak N., Sinha A.K., Poddar P. // In “Agriculturally Important Microbes for Sustainable Agriculture.” Singapore: Springer, 2017. P. 81–128.
Sumbul A., Ansari R.A., Rizvi R., Mahmood I. // Saudi J. Boil. Sciences. 2020. V. 27. № 12. P. 3634–3640.
Гинь Т.А., Соколова М.Т., Казаринова Т.Ф. // Изв. Вузов. Прикл. хим. и биотехнол. 2012. № 2. С. 68–73.
Arlyapov V.A., Yudina N.Y., Asulyan L.D., Kamanina O.A., Alferov S.V., Shumsky A.N., Reshetilov A.N. // 3 Biotech. 2020. V. 10. № 5. P. 1–11.
Arlyapov V.A., Yudina N.Yu., Asulyan L.D., Alferov S.V., Alferov V.A., Reshetilov A.N. // Enzyme and Microbial Technol. 2013. № 53. P. 257–262.
Yudina N.Yu., Arlyapov V.A., Chepurnova M.A., Alferov S.V., Reshetilov A.N. // Enzyme and Microbial Technol. 2015. № 78. P. 46–53.
Асулян Л.Д., Бояркина В.В., Агаева М.В. Гидрогели поливинилового спирта как влагоудерживающие сорбенты // Изв. Тул. ГУ Естеств. науки. 2021. № 1. С. 13–19.
Kamoun E.A., Loutfy S.A., Hussein Y., Kenawy E.R.S. // Intern. J. Biological Macromolecules. 2021. V. 187. P. 755–768.
Husain M.S.B., Gupta A., Alashwal B.Y., Sharma S. // Energy Sources. Part A: Recovery, Utilization, and Environmental Effects. 2018. V. 40. № 20. P. 2388–2393.
Alipoori S., Mazinani S., Aboutalebi S.H., Sharif F. // J. Energy Storage. 2020. V. 27. P. 101072.
Arefian M., Hojjati M., Tajzad I., Mokhtarzade A., Mazhar M., Jamavari A. // J. Composites and Compounds. 2020. V. 2. № 3. C. 69–76.
Wen N., Jiang B., Wang X., Shang Z., Jiang D., Zhang L., Guo Z. // The Chemical Record. 2020. V. 20. № 8. P. 773–792.
Rynkowska E., Fatyeyeva K., Marais S., Kujawa J., Kujawski W. // Polymers. 2019. V. 11. № 11. P. 1799.
Ahmad A.L., Yusuf N.M., Ooi B.S. // Desalination. 2012. V. 287. P. 35–40.
do Nascimento F.C., de Aguiar L.C.V., Costa L.A.T., Fernandes M.T., Marassi R.J., Gomes A.D.S., de Castro J.A. // Polymer Bulletin. 2021. V. 78. № 2. P. 917–929.
Нораев М.Г., Машенцева Н.Г. // Роль технических наук в развитии общества. 2017. С. 158–163.
Степин С.Г., Дикусар Е.А. // Достижения фундаментальной, клинической медицины и фармации. Витебск: УО “Витебский государственный медицинский университет”, 2015. С. 174–175.
Сидоренко О.Д. // Агрохимия. 2012. № 11. С. 48–51.
Saeid A., Prochownik E., Dobrowolska–Iwanek J. // Molecules. 2018. V. 23. № 11. P. 2897.
Харькова А.С., Арляпов В.А., Туровкая А.Д., Автух А.Н., Стародумова И.П., Решетилов А.Н. // Прикл. биохимия и микробиология. 2019. Т. 55. № 2. С. 199–209.
Hakeem K.R., Sabir M., Ozturk M., Akhtar M., Ibrahim F.H. // Reviews of Environmen. Contamination and Toxicology. 2016. V. 242. P. 183–217.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология