Радиационная биология. Радиоэкология, 2019, T. 59, № 1, стр. 68-74
Влияние ионизирующего излучения разной мощности экспозиционных доз природной радиации на физиологические и биохимические характеристики ряда видов растений Якутии
Е. С. Хлебный 1, *, И. В. Слепцов 1, А. Н. Журавская 1
1 Институт биологических проблем криолитозоны Сибирского отделения РАН
Якутск, Россия
* E-mail: chicloon@gmail.com
Поступила в редакцию 21.04.2017
Аннотация
Исследовано влияние разных мощностей экспозиционных доз (МЭД) хронического облучения природной радиации (20–3000 мкР/ч) на физиологические и биохимические характеристики семенного потомства однолетних травянистых растений: мятлика узколистного (Póa angustifólia), иван-чая узколистного (Chamérion angustifólium) и лапчатки норвежской (Potentílla norvégica), длительное время произрастающих в условиях разных мощностей экспозиционных доз природной радиации, при одинаковых почвенных условиях. Показано, что по мере увеличения МЭД повышенного естественного радиационного фона (ПЕРФ) физиологические характеристики проростков исследованных растений повышаются в 1.2–3.3 раза при всех МЭД произрастания материнских растений. Установлено, что у семенного потомства наблюдалось увеличение суммы низкомолекулярных антиоксидантов (ΣНМАО), на фоне повышения уровня перекисного окисления липидов в зависимости от МЭД природной радиации. Прослеживается видоспецифическая ответная реакция по содержанию жирных кислот (ΣFA) в зависимости от величины МЭД в проростках семенного потомства, произрастающих в условиях ПЕРФ.
Известно, что проблема малых доз ионизирующих излучений была и остается наиболее сложной и актуальной, имеющей не только радиобиологическое, но и социально-экономическое значение. Понятие “малые дозы” не имеет единого определения. Поэтому Научный комитет ООН по действию атомной радиации (НКДАР ООН) рекомендовал дозы в 200 мГр и ниже относить к малым дозам, а мощность дозы 0.1 мГр/мин и ниже – к малым мощностям доз, относительно человека [1]. В настоящее время имеются обширные данные о негативном и позитивном действии малых доз ионизирующей радиации на биоту [2]. С одной стороны – это стимулирующее действие на метаболические процессы растительных и животных организмов, за счет активации клеточных систем восстановления, приводящее к повышению радиоустойчивости к острому облучению (радиоадаптация). С другой – к значительному повышению радиочувствительности, за счет накопления в геноме организмов хромосомных перестроек, приводящих к образованию аберрантных клеток, отличающихся пониженной устойчивостью к вторичному воздействию γ-излучений в высоких дозах. В Южной Якутии находится Эльконский ураново-рудный район, расположенный в центральной части Алданского щита. Проведенная γ-сьемка показала, что мощность экспозиционной дозы (МЭД) горных пород по γ-компоненте варьирует от 20 до 3000 мкР/ч и более [3, 4].
Ранее установлено, что повышенный естественный радиационный фон (ПЕРФ) может выступать в качестве “мягкого, тренирующего” стресс-фактора по отношению к растительным и животным организмам, что выражается в изменении морфологических, физиологических и биохимических стандартов биоты [5–7]. Известно, что одним из механизмов адаптации к изменяющимся условиям обитания является активация антиоксидантных систем [8]. Ранее проведенные нами исследования позволили выявить ряд механизмов биохимических адаптаций ольховника кустарникового к разным МЭД ПЕРФ. Установлено, что при значениях МЭД от 50 до 500 мкР/ч увеличение жизнеспособности проростков обеспечивается за счет повышения суммарной антиоксидантной защиты, сформированной как адаптация к ПЕРФ [9].
Изучение жирных кислот в растительных клетках в адаптационном процессе представляет большой интерес вследствие их значительной роли в функционировании клеточных мембран и в биоэнергетических реакциях. Известно, что непредельные жирные кислоты регулируют вязкость липидного слоя клеточной мембраны, способствуя адаптации растений к низкотемпературному стрессу, за счет активации (или ингибирования) синтеза фермента десатуразы, который участвует в процессе образования ЖК [10–12]. В исследованиях ряда авторов было показано, что при адаптации организмов к холодному климату Якутии происходит повышение содержания полиненасыщенных ЖК, что способствует увеличению их резистентности к низкотемпературному стрессу [13, 14]. Вместе с тем крайне мало исследований, посвященных влиянию радиации на содержание жирных кислот, их взаимосвязи с низкомолекулярными антиоксидантами и продуктом перекисного окисления липидов – малоновым диальдегидом.
Целью исследования было изучение влияния мощности разных экспозиционных доз облучения в условиях повышенного естественного радиационного фона на ряд физиологических и биохимических характеристик проростков семенного потомства травянистых растений.
МАТЕРИАЛЫ И МЕТОДИКА
На территории уранового месторождения в Южной Якутии были собраны семена однолетних травянистых растений: мятлика узколистного (Póa angustifólia), иван-чая узколистного (Chamérion angustifólium) и лапчатки норвежской (Potentílla norvégica), длительное время произрастающих в условиях разных мощностей экспозиционных доз природной радиации (40, 50, 80, 100, 150, 350, 400, 700, 2000 и 3000 мкР/ч). Определение мощности экспозиционной дозы повышенного естественного радиационного фона проводили радиометром-дозиметром МКС-14ЭЦ (Россия), имеющего детекторы на определение γ-β-компонентов ионизирующего излучения. Контролем служили семена, собранные у растений, выросших в условиях 20 мкР/ч. В этих же точках сбора были взяты образцы почвы. В почвенных пробах с применением стандартных методик определили рН водной вытяжки, содержание гумуса, ионов K+ и Р2О5, а также 238U в грунте в расчете г/т [15, 16].
Проращивание семян и проростков проводили в условиях климатокамеры (“BINDER”, Германия) при t = 24°С, в чашках Петри, при длине светового дня – 18 ч. Критериями оценки физиологических признаков были: энергия прорастания семян на 7-й день (%), всхожесть семян – на 15-й день (%), появление настоящего листа у проростков – на 30-й день наблюдения (%). Антиоксидантный статус клеток проростков определяли по суммарному содержанию низкомолекулярных антиоксидантов (НМАО) и уровню перекисного окисления липидов (ПОЛ) [17, 18].
Определение ЖК в проростках проводили методом кислотного гидролиза на газовом хроматографе с масс-спектрометрическим детектором (ГХ-МС, Россия) [19]. Сумму ненасыщенных жирных кислот (ΣUSFA) вычисляли путем сложения всех идентифицированных ненасыщенных ЖК, сумму насыщенных жирных кислот (ΣSFA) суммированием всех насыщенных ЖК, сумму жирных кислот (ΣFA) – сложением ΣSFA и ΣUSFA.
Эксперименты выполняли в четырех биологических и аналитических повторностях. Результаты представлены в виде средней арифметической величины. Анализ и оценку достоверности результатов определяли согласно описанию [20]. При определении биохимических параметров статистический разброс вычисляли путем введения 5%-ной ошибки на метод, для физиологических параметров – 10%-ной ошибки на измерение.
Сравнение средних значений выборок проводили методом однократного дисперсионного анализа (ANOVA). Значимость отличий между средними значениями определяли, используя критерий Ньюмена–Кейлса для множественных сравнений при уровне p ≤ 0.05. Рассчитывали с помощью пакета AnalystSoft, StatPlus – программа статистического анализа, v. 2007.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В табл. 1 показаны агрохимические характеристики почвы в точках сбора семян растений, которые статистически значимо не отличались. Приведены также МЭД в точках сбора, которые напрямую зависят от содержания урана в почве (r = 0.99 при p ≤ 0.05). То есть растения произрастали в одинаковых почвенных условиях, но при разных мощностях γ-фона.
Таблица 1.
Мощность экспозиционной дозы, содержание 238U в грунте и агрохимическая характеристика почвы в точках сбора семян растений
| МЭД, мкР/ч | рН водной вытяжки | Гумус, % | Содержание в водной вытяжке | Содержание 238U в грунте, г/т (ПДК – до 10) | |
|---|---|---|---|---|---|
| K+ | Р2О5 | ||||
| 20 | 7.9 ± 0.8 | 6.7 ± 0.7 | 5.6 ± 0.6 | 0.2 ± 0.1 | 1.9 ± 0.2 |
| 50 | 7.7 ± 0.8 | 7.4 ± 0.7 | 5.9 ± 0.6 | 0.1 ± 0.1 | 27.0 ± 0.3* |
| 100 | 7.0 ± 0.7 | 8.4 ± 0.8 | 6.6 ± 0.6 | 0.2 ± 0.1 | 40.0 ± 0.4* |
| 150 | 7.3 ± 0.7 | 7.2 ± 0.7 | 7.2 ± 0.7 | 0.1 ± 0.1 | – |
| 250 | 7.1 ± 0.7 | 6.4 ± 0.6 | 3.8 ± 0.4 | 0.1 ± 0.1 | 128.0 ± 1.3* |
| 700 | 7.4 ± 0.7 | 7.1 ± 0.7 | 6.2 ± 0.6 | 0.1 ± 0.1 | 696.0 ± 7.0* |
| 2000 | 7.5 ± 0.7 | 6.4 ± 0.6 | 4.6 ± 0.5 | 0.2 ± 0.1 | 1800.0 ± 18.0* |
| 3000 | 7.0 ± 0.7 | 6.8 ± 0.7 | 5.6 ± 0.6 | 0.1 ± 0.1 | 3066.0 ± 30.0* |
Известно, что действие малых доз ионизирующего излучения способствует повышению энергии прорастания, всхожести семян, ускорению появления первых настоящих листьев, более раннему цветению и созреванию, повышению ветвления, увеличению урожайности [21, 22].
В табл. 2 показаны энергия прорастания и всхожесть семян, количество проростков с настоящими листьями, суммарное содержание НМАО, уровень ПОЛ в проростках, выросших из семян родительских форм, произраставших в условиях разных МЭД природного ПЕРФ.
Таблица 2.
Физиологические и биохимические характеристики проростков мятлика узколистного, иван-чая узколистного и лапчатки норвежской, выросших из семян растений, сформированных в условиях разных МЭД
| Критерии оценки | Мощность экспозиционной дозы произрастания, мкР/ч | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 20 | 40 | 50 | 80 | 100 | 150 | 200 | 350 | 400 | 700 | 2000 | 3000 | |
| Мятлик узколистный | ||||||||||||
| Энергия прорастания семян, % | 10.0 ± 1.0 | 18.0 ± 1.8* | 11.5 ± 1.5 | 30.0 ± 3.0* | 32.5 ± 3.2* | – | – | – | – | – | 23.0 ± 2.3* | 2.5 ± 0.2* |
| Всхожесть семян, % | 12.0 ± 1.2 | 25.5 ± 2.5* | 30.5 ± 3.0* | 40.0 ± 4.0* | 34.5 ± 3.4* | – | – | – | – | – | 31.0 ± 3.0* | 6.0 ± 0.6* |
| Настоящий лист, % | 3.0 ± 0.3 | 11.5 ± 1.1* | 12.0 ± 1.2* | 33.0 ± 3.3* | 25.0 ± 2.2* | – | – | – | – | – | 29.5 ± 0.3* | 2.0 ± 0.2* |
| НМАО, мкг-экв/гпр | 9.8 ± 0.01 | 9.4 ± 0.01 | 10.2 ± 0.02 | 10.5 ± 0.02* | 10.8 ± 0.02* | – | – | – | – | – | 10.8 ± 0.02* | 14.0 ± 0.2* |
| ПОЛ, ммоль/гсут | 0.7 ± 0.01 | 0.7 ± 0.01 | 0.8 ± 0.01* | 1.1 ± 0.01* | 0.9 ± 0.01* | – | – | – | – | – | 0.9 ± 0.1* | 1.1 ± 0.1* |
| Иван-чай узколистный | ||||||||||||
| Энергия прорастания семян, % | 40.0 ± 4.0 | – | – | 48.5 ± 4.8 | – | – | 32.0 ± 3.2* | 32.7 ± 3.3* | – | 43.5 ± 4.4 | – | – |
| Всхожесть семян, % | 54.5 ± 5.4 | – | – | 62.5 ± 6.2 | – | – | 65.8 ± 6.5 | 74.0 ± 7.4 | – | 66.8 ± 6.7 | – | – |
| Настоящий лист, % | 9.0 ± 0.9 | – | – | 62.0 ± 6.0* | – | – | 65.0 ± 6.5* | 56.3 ± 5.6* | – | 42.3 ± 4.2* | – | |
| НМАО, мкг-экв/гпр | 9.0 ± 0.01 | – | – | 8.8 ± 0.01 | – | – | 9.6 ± 0.01* | 9.8 ± 0.01* | – | 10.5 ± 0.02* | – | – |
| ПОЛ, ммоль/гсут | 0.8 ± 0.01 | – | – | 1.0 ± 0.01* | – | – | 0.9 ± 0.01* | 0.9 ± 0.01* | – | 1.3 ± 0.01* | – | – |
| Лапчатка норвежская | ||||||||||||
| Энергия прорастания семян, % | 57.7 ± 5.8 | – | – | 72.0 ± 7.2* | – | 77.8 ± 7.8* | – | – | 72.2 ± 7.2* | 80.0 ± 8.0* | – | – |
| Всхожесть семян, % | 64.5 ± 6.5 | – | – | 89.5 ± 8.9* | – | 82.0 ± 8.2* | – | – | 77.0 ± 7.7 | 86.5 ± 8.5* | – | – |
| Настоящий лист, % | 56.0 ± 5.6 | – | – | 82.0 ± 8.2* | – | 88.0 ± 8.8* | – | – | 69.0 ± 6.9* | 81.3 ± 8.1* | – | – |
| НМАО, мкг-экв/гпр | 7.1 ± 0.02 | – | – | 8.0 ± 0.01* | – | 8.0 ± 0.01* | – | – | 8.4 ± 0.01* | 9.0 ± 0.01* | – | – |
| ПОЛ, ммоль/гсут | 0.7 ± 0.01 | – | – | 0.8 ± 0.01* | – | 0.8 ± 0.01* | – | – | 0.9 ± 0.01* | 1.0 ± 0.01* | – | – |
Установлено, что энергия прорастания и всхожесть семян мятлика узколистного и лапчатки норвежской повысились в 1.2–3.3 раза при всех МЭД произрастания материнских растений относительно контроля. У иван-чая узколистного наблюдалось снижение этих показателей на 20% при МЭД 200 и 350 мкР/ч.
Наиболее информативен показатель – “образование настоящего листа” на 30-й день наблюдения, так как функционирование меристематической ткани является подтверждением дальнейшей жизнеспособности проростка и растения в целом. Следует отдельно выделить физиологические и биохимические характеристики проростков дочернего поколения мятлика узколистного, выросшего из семян материнских растений, произраставших в условиях МЭД ПЕРФ 3000 мкР/ч. При данных условиях произрастания, при равных микроклиматических и почвенных условиях сформировалось поколение семян, проростки которых имели исследованные нами показатели значительно ниже контрольных. Энергия прорастания и всхожесть семян были снижены на 75–50% соответственно. Количество проростков с настоящими листьями к концу срока наблюдения было на 30% меньше, чем в контроле, тогда как содержание НМАО и интенсивность ПОЛ повышены на 40 и 60% относительно контрольного значения.
При действии ионизирующего излучения на организм значительный вклад оказывают радиотоксины, которые образуются в результате радиолиза воды и окисления ненасыщенных жирных кислот [23]. Как следствие, наблюдается повышение в клетках облученных организмов содержания малонового диальдегида, являющегося продуктом перекисного окисления липидов.
Суммарное содержание НМАО в клетках проростков исследуемых растений также повысилось на 10–30% во всех точках отбора, а ПОЛ – на 10–60%. Интенсивность процессов ПОЛ (по содержанию МДА) в проростках мятлика узколистного, иван-чая узколистного и лапчатки норвежской, сформированных при МЭД произрастания родительских форм от 50 до 3000 мкР/ч, статистически достоверно увеличивалась, что может свидетельствовать о неспособности внутриклеточных систем элиминировать последствия оксидативного стресса [24].
Известно, что биологическая мембрана является очень чувствительной к окислению, в том числе и свободными радикалами, которые вызывают перекисное окисление липидов, что в свою очередь отражается на содержании жирных кислот в организме [17]. Выявлено, что при всех МЭД ПЕРФ сумма общих ЖК статистически значимо не отличалась от контрольного значения, за исключением МЭД 350 мкР/ч, где сумма общих ЖК была увеличена на 19% в клетках проростков иван-чая узколистного. При МЭД 350 мкР/ч сумма ненасыщенных жирных кислот также была повышена на 13%. Длительное произрастание материнских растений в условиях других вариантов МЭД статистически достоверного отличия у клеток проростков дочернего поколения от контроля не выявило. Сумма насыщенных ЖК повышалась на 18–31% при МЭД 200 и 350 мкР/ч, а в других вариантах исследованных мощностей доз статистически достоверного отличия не наблюдалось (рис. 1, А).
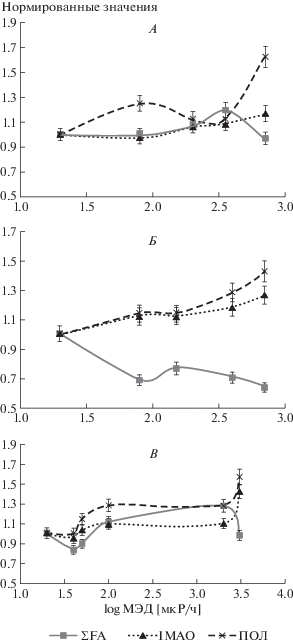
Рис. 1.
Изменение концентрации жирных кислот в проростках исследованных видов растений (А – иван-чай узколистный; Б – лапчатка норвежская; В – мятлик узколистный) в зависимости от мощности экспозиционной дозы.
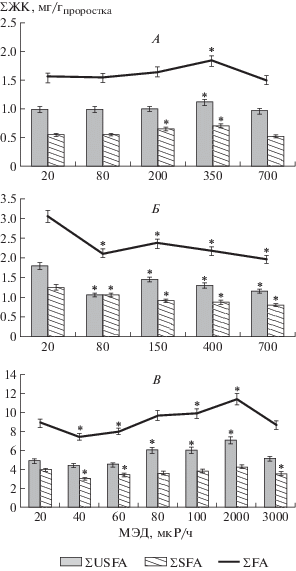
Произрастание материнских растений лапчатки норвежской в условиях разных МЭД ПЕРФ привело к снижению на 23–36% суммы общих ЖК, ΣUSFA – на 19–42%, ΣSFA – на 16–36% у проростков дочернего поколения во всем диапазоне мощностей исследованных доз относительно контроля (рис. 1, Б).
Показано, что сумма общих ЖК у проростков мятлика узколистного изменялась немонотонно (рис. 1, В): при МЭД 40 и 50 мкР/ч – уменьшалась на 10–16%, при МЭД 100 и 2000 мкР/ч – увеличивалась на 11–28%, а при МЭД 80 и 3000 мкР/ч – не отличалась от контрольного значения. Содержание ΣSFA при МЭД, близких к контрольному значению (40 и 50 мкР/ч), и при МЭД 3000 мкР/ч уменьшалось на 10–24%. В диапазоне МЭД от 80 до 2000 мкР/ч содержание статистически значимо не отличалось от контроля, но наблюдалось увеличение на 23–44% суммы ненасыщенных ЖК в диапазоне МЭД от 80 до 2000 мкР/ч, а при остальных мощностях экспозиционных доз не отличалась от контрольного значения.
Ингибирование процессов синтеза ЖК может быть вызвано повышением количества свободных радикалов, которые в свою очередь инициируют окисление жирных кислот, что, скорее всего, свидетельствует о неэффективной работе антиоксидантной защиты проростков. Рост содержания доли ненасыщенных ЖК в проростках на фоне повышения перекисного окисления липидов может быть связан с адаптацией растений к действию МЭД ПЕРФ и более активным синтезом ненасыщенных ЖК вследствие увеличения активности ферментов десатураз.
Сравнение изменения суммарного содержания НМАО, активности ПОЛ и ΣFA в проростках в зависимости от МЭД произрастания материнских растений позволило выявить статистически достоверную отрицательную корреляцию между ΣFA и активностью ПОЛ у проростков иван-чая узколистного и лапчатки норвежской (r = –0.43 и –0,83 при p ≤ 0.05 соответственно; рис. 2). Это может свидетельствовать об истощении пула ЖК при повышении уровня ПОЛ, которое создается за счет увеличения МЭД ПЕРФ. Эффект особенно заметен у иван-чая узколистного (рис. 2, А), где при МЭД 350 мкР/ч (lg 2.5) происходит снижение активности ПОЛ на фоне повышения ΣFА, а при МЭД 700 мкР/ч (lg 2.8) наблюдается обратный процесс. При этом увеличение суммарного содержания НМАО никак не повлияло на ΣFA. При хроническом действии различных МЭД ПЕРФ на материнские растения лапчатки норвежской (рис. 2, Б) у проростков семенного потомства отмечена не только отрицательная корреляция между ΣFA и активностью ПОЛ, но и между ΣFA и содержанием НМАО (r = –0,92 при p ≤ 0.05). Это свидетельствует о недостаточной эффективности НМАО в отношении снижения уровня ПОЛ и, как следствие, еще большего истощения пула ЖК в клетках проростков дочернего поколения. При действии различных МЭД ПЕРФ на мятлик узколистный наблюдается схожая закономерность. Различие заключается в том, что этот вид растения произрастает в условиях более высоких МЭД, необходимых для проявления эффекта снижения ΣFА и повышения активности ПОЛ, что может указывать на высокую радиоустойчивость данного вида.
ВЫВОДЫ
Установлено, что МЭД ПЕРФ по γ-компоненте зависит от содержания урана в почве. Показано, что изученные материнские растения произрастали в одинаковых почвенно-климатических условиях и физиологические и биохимические характеристики их семенного потомства зависели, в первую очередь, от мощности экспозиционной дозы природной радиации.
Малые дозы радиации оказали стимулирующее воздействие на энергию прорастания, всхожесть семян и образование настоящего листа у проростков дочернего поколения во всем диапазоне МЭД. Следует отметить, что МЭД более 2000 мкР/ч для мятлика узколистного была лимитирующей. То есть при равных микроклиматических и почвенных условиях сформировалось поколение семян, проростки которых имели исследованные нами показатели ниже контрольных.
Интенсивность процессов ПОЛ (по содержанию МДА) в проростках мятлика узколистного, иван-чая узколистного и лапчатки норвежской, сформированных при МЭД произрастания родительских форм от 40 до 3000 мкР/ч, увеличивалась, что может свидетельствовать о нестабильной работе внутриклеточных систем антиоксидантной защиты.
Установлено, что проростки семенного потомства мятлика узколистного, иван-чая узколистного и лапчатки норвежской, родительских форм, длительное время произрастающих в условиях действия МЭД ПЕРФ, проявляют видоспецифичную ответную реакцию по содержанию ЖК, что может быть обусловлено различной стратегией адаптации исследуемых растений к радиации.
Выявлена статистически достоверная отрицательная корреляция между ΣFA и активностью ПОЛ у проростков семян иван-чая узколистного и лапчатки норвежской (r = –0.43 и –0.83 при p ≤ ≤ 0.05), что указывает на истощение пула ЖК при повышении уровня ПОЛ, которое создается за счет увеличения МЭД ПЕРФ.
Список литературы
Научный комитет ООН по действию атомной радиации (НКДАР ООН). Ионизирующие излучения: источники и биологические эффекты: Доклад 1982 г. в Генеральной Ассамблее. Т. 1. Нью-Йорк: ООН, 1982. 882 с.
Бурлакова Е.Б., Конрадов А.А., Мальцева Е.Л. Действие сверхмалых доз биологически активных веществ и низкоинтенсиных физических факторов // Хим. физика. 2003. Т. 22. № 2. С. 21–40.
Наумов С.С., Шумилин М.В. Урановые месторождения Алдана // Отечественная геология. 1994. № 11/12. С. 20–23.
Основные санитарные правила обеспечения радиационной безопасности (ОСПОРБ-99): 2.6.1. Ионизирующее излучение, радиационная безопасность СП 2.6.1.799-99. М.: Минздрав России, 2000. 98 с.
Кузин А.М. Проблема малых доз и идеи гормезиса в радиобиологии // Радиобиология. 1991. Т. 31. Вып. 1. С. 16–21.
Лучник Н.В. Биофизика цитогенетических поражений и генетический код. Л.: Медицина, 1968. 295 с.
Позолотин А.А., Альшиц Л.К. К вопросу о влиянии предварительного гамма-облучения на последующую радиочувствительность семян гороха // Радиобиология. 1974. № 14. Вып. 1. С. 154–156.
Журавская А.Н., Филиппов Э.В., Кершенгольц Б.М. Влияние биохимических адаптаций ольхи кустарниковой (Duschecia fruticosa (Rupr) к повышенному естественному радиационному фону на выживаемость проростков и радиочувствительность ее семян // Радиац. биология. Радиоэкология. 2000. Т. 40. № 3. С. 254–260.
Журавская А.Н., Артамонова С.Ю. Повышенный естественный радиационный фон и растение. Новосибирск: Изд-во СО РАН, 2014. 153 с.
Ударева Л.В., Коненкина Т.А., Шмаков В.Н., Макаренко С.П. Жирнокислотный состав липидов каллусов двух видов лиственницы (Larix gmelinii и Larix sibirica) // Химия растит. сырья. 2014. №. 2. С. 121–127.
Новицкая Г.В., Суворова Т.А., Трунова Т.И. Липидный состав листьев в связи с холодостойкостью растений томатов // Физиол. растений. 2000. Т. 47. № 6. С. 829–835.
Los D.A., Murata N. Structure and expression of fatty acid desaturases // Biochem. Biophys. Acta. 1998. V. 1394. P. 3–15.
Нохсоров В.В., Дударева Л.В., Чепалов В.А. и др. Свободные жирные кислоты и адаптация организмов к холодному климату Якутии // Вестн. Бурятской гос. сельскохоз. акад. им. В.Р. Филиппова. 2015. Т. 38. № 1. С. 127–134.
Петров К.А., Перк А.А., Чепалов В.А., Охлопкова Ж.М. Особенности жирнокислотного состава некоторых растений Якутии в период формирования криорезистентности // Вестн. Северо-Восточного фед. ун-та им. М.К. Аммосова. 2011. Т. 8. № 2. С. 26–29.
Аринушкина Е.В. Руководство по химическому анализу почв. М.: МГУ, 1962. 488 с.
Бобров В.А., Гофман А.М. Лабораторный гамма-спектрометрический анализ естественных радиоактивных элементов (методические разработки). Новосибирск: Ин-т геологии и геофизики СО АН СССР, 1971. 67 с.
Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. М.: Наука, 1972. 252 с.
Ермаков А.И., Арасимович В.В., Н. П. Ярош Н.П. и др. Методы биохимического исследования растений. Л.: Агропромиздат, 1987. 430 с.
Слепцов И.В., Хлебный Е.С., Журавская А.Н. Динамика изменения жирнокислотного состава щирицы запрокинутой, ярутки полевой и лофанта тибетского // Наука и образование. 2015. № 4 (80). С. 100–105.
Лакин Г.Ф. Биометрия. М.: Высш. шк., 1980. 293 с.
Журавская А.Н. Адаптация к экстремальным условиям среды и радиочувствительность растений (радиоэкологические исследования) // Радиац. биология. Радиоэкология. 2012. Т. 52. №. 4. С. 381–387.
Кузин А.М. Стимулирующее действие ионизирующего излучения на биологические процессы: К проблеме биологического действия малых доз. М.: Атомиздат, 1977. 315 с.
Филиппов Э.В., Журавская А.Н., Прокопьев И.А. и др. Влияние радионуклидов урана и тория в системе “грунт–растение” на биохимические характеристики ольховника кустарникового (Duschekia fruticosa) // Радиац. биология. Радиоэкология. 2016. Т. 56. № 5. С. 535–541.
Гродзинский Д.М. Радиобиология растений. Киев: Наук. думка, 1989. 380 с.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология