Радиационная биология. Радиоэкология, 2019, T. 59, № 1, стр. 63-67
ИССЛЕДОВАНИЕ ПРОЦЕССОВ УФ-МОДИФИКАЦИИ СВОБОДНОЙ И ИММОБИЛИЗОВАННОЙ НА МАТРИЦЕ ХИТОЗАНА КОЛЛАГЕНАЗЫ
М. Г. Холявка 1, *, С. М. Панкова 1, Ю. М. Вышкворкина 2, А. Н. Лукин 1, В. Г. Артюхов 1
1 Воронежский государственный университет
Воронеж, Россия
2 Московский физико-технический институт
Москва, Россия
* E-mail: holyavka@rambler.ru
Поступила в редакцию 26.07.2018
Аннотация
Каталитическая активность молекул свободной коллагеназы из Clostridium histolyticum под воздействием УФ-света в дозах 151–6040 Дж/м2 подвергалась модуляции в большей степени, чем в иммобилизованном на матрице хитозана состоянии. После УФ-облучения раствора энзима в дозе 3020 Дж/м2 наблюдалось снижение его активности на ~9%, при иммобилизации коллагеназы на матрице кислоторастворимого среднемолекулярного и высокомолекулярного хитозанов изменение активности фермента не было выявлено во всем диапазоне применяемых нами доз. Адсорбция на хитозане приводит к повышению стабильности гетерогенных биокатализаторов по отношению к УФ-облучению по сравнению со свободной формой бактериальной коллагеназы. Образование связей между энзимом и матрицей как среднемолекулярного, так и высокомолекулярного хитозанов оказывает значительное влияние на устойчивость иммобилизованного препарата к УФ-излучению, вероятно, за счет повышения жесткости третичной структуры коллагеназы в ходе адсорбции.
Знание механизмов первичных стадий фотобиологических процессов необходимо для понимания трансформации энергии поглощенных квантов света в таких явлениях, как фотосинтез, зрение, повреждающее (фотолиз) и лечебное действие (фототерапия) ультрафиолетового (УФ) и лазерного излучений. Выяснение путей регуляции начальных этапов трансформации энергии электронного возбуждения и сопровождающих ее молекулярных превращений, включая изменения в хромофорных группах, их белковых носителях и окружающей мембране, представляет собой одну из основных задач фотобиофизики и радиационной биологии. Эта проблема связана с выяснением роли и механизмов участия электронно-возбужденных состояний в процессах, протекающих в жизненно важных биологических системах, в частности, белках-ферментах и их комплексах [1, 2].
Описан ряд возможностей для применения белка коллагена в качестве терапевтического агента. В последние годы интерес ученых направлен на разработку биоматериалов с множественными функциями, такими как коллагены и их пептидные фрагменты, поэтому коммерческое использование фермента коллагеназы находит широкое применение [3–6].
Коллагеназа (КФ 3.4.24.7) является уникальной протеазой, которая способна избирательно гидролизовать коллаген, входящий в состав соединительной ткани живого организма. Расщепляя крайне устойчивые к действию других ферментов коллагеновые волокна, коллагеназа выполняет в организме человека и животных важнейшие функции, участвует в превращениях соединительной ткани при росте и морфогенезе, а также в устранении некоторых патологических процессов. К настоящему времени разработаны препараты медицинского и ветеринарного назначения на основе коллагеназы [7–9], в том числе включающие коллагеназу из Clostridium histolyticum [10], Streptomyces lavendulae [11], сериновые коллагенолитические протеиназы [12]. Выявлено литическое действие подобных фармацевтических композиций на струп ожоговой раны. При гнойных ранах фермент способствует быстрому удалению нежизнеспособных тканей и экссудата, раннему появлению грануляционной ткани, эпителизации. Применение коллагеназы предупреждает развитие грубых рубцов, при этом сохраняется подвижность кожи и мягких тканей [13].
Экспериментальные данные показывают, что продукты расщепления коллагена после лечения бактериальной коллагеназой могут способствовать миграции и усилению активности макрофагов, фибробластов и кератиноцитов. Выявлено участие клеточных матричных взаимодействий в экспрессии коллагеназы в кератиноцитах и фибробластах. Локализация фермента в ожоговых ранах – как внутри клеток, так и внутри раневой области – предполагает, что фермент непосредственно участвует в механизмах заживления. Коллагеназы обладают уникальной способностью разрушать нативный коллаген, который полностью устойчив к действию других протеаз. Они играют важную роль во время заживления кожи, где происходят обширная деградация, ресинтез и ремоделирование коллагена [3, 5].
Основным недостатком растворимой формы ферментов является их быстрая инактивация за счет протеолиза. Подобные препараты лабильны и требуют постоянного их внесения в виде раствора [14, 15]. Одним из способов повышения стабильности энзимов является их иммобилизация на полимерных носителях. Этот подход позволяет увеличить время полужизни фермента, упрощает доставку препарата к пораженному органу или ткани и дает возможность быстро его удалить [16, 17]. Перспективными носителями для иммобилизации лекарственных средств белковой природы являются хитозаны и их производные, которые обладают антибактериальной активностью, низкой аллергенностью и относительно низкой стоимостью [18, 19].
Известен способ лечения ожоговых ран путем воздействия светом от источника УФ-излучения, прошедшим предварительно через полимерную пленку, расположенную на расстоянии 15–20 см от раневой поверхности. Данный метод обладает бактерицидным эффектом, способствует стимуляции репаративных процессов и ускорению эпителизации, что приводит к уменьшению сроков госпитализации больных [2, 4].
Облучение ожоговых ран УФ-светом коротковолнового спектра является эффективным способом их лечения, благодаря выраженному антибактериальному эффекту УФ-излучения, а также его поверхностному действию, которое приводит к отсутствию микроабсцессов у пациентов и клеточной инфильтрации [5, 6].
Комплексное использование действия УФ-излучения, бактериальной коллагеназы и производных хитозана, возможно, будет способствовать более быстрому восстановлению раны или ожога и сокращению сроков заживления кожных покровов, поэтому целью нашей работы было изучить особенности и закономерности воздействия УФ-излучения на процессы фотомодуляции свободной и иммобилизованной на матрице хитозана коллагеназы.
МАТЕРИАЛЫ И МЕТОДИКА
В качестве объекта исследования была выбрана коллагеназа из Clostridium histolyticum фирмы “Sigma-Aldrich”, субстратом для гидролиза служил бычий сывороточный альбумин (БСА) фирмы “Sigma-Aldrich”, носителями для иммобилизации – два вида хитозана, синтезированных ЗАО “Биопрогресс”: хитозан пищевой кислоторастворимый среднемолекулярный (Мr = 200 кДа, степень деацетилирования (СД) 82%), хитозан кислоторастворимый высокомолекулярный (Мr = = 350 кДа, СД = 94.85%).
Иммобилизацию коллагеназы на хитозане проводили адсорбционным методом [20, 21]. Определение количества белка в препаратах и каталитической активности фермента осуществляли модифицированным методом Лоури [22].
УФ-облучение растворов свободной и иммобилизованной коллагеназы проводили при их непрерывном перемешивании магнитной мешалкой в термостатируемой кювете (20 ± 1°С) с помощью ртутно-кварцевой лампы типа ДРТ-400 через светофильтр УФС-1 с полосой пропускания 240–390 нм в течение 1, 3, 5, 10, 20, 30, 40 мин. Доза облучения составила соответственно 151, 453, 755, 1510, 3020, 4530 и 6040 Дж/м2.
Регистрацию ИК-спектров анализируемых образцов осуществляли в Центре коллективного пользования научным оборудованием Воронежского государственного университета с помощью ИК-Фурье спектрометра Bruker Vertex-70 (Германия). Спектры снимались с неориентированных порошковых образцов.
Статистическую обработку полученных результатов проводили с использованием t-критерия Стьюдента, различия признавали значимыми при р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
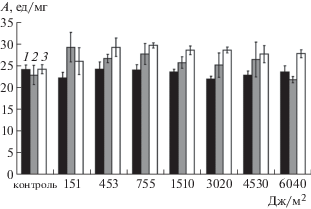
При УФ-облучении свободного фермента в дозах 151, 453, 755 и 1510 Дж/м2 изменение удельной активности коллагеназы не было зарегистрировано, фермент сохранял свои каталитические свойства на относительно постоянном (первоначальном) уровне, который был характерен для необлученных (контрольных) образцов. Снижение активности свободного препарата на ~9% происходило только при воздействии дозой 3020 Дж/м2.
После иммобилизации коллагеназы на матрице пищевого кислоторастворимого среднемолекулярного хитозана при УФ-облучении в дозе 151 Дж/м2 наблюдалось увеличение активности фермента на ~28%, возможно, это связано с перестройками в третичной структуре молекулы белка. При использовании доз 1510, 3020, 4530 и 6040 Дж/м2 каталитическая активность коллагеназы возвращалась на первоначальный уровень.
После иммобилизации коллагеназы на матрице кислоторастворимого высокомолекулярного хитозана при УФ-облучении в дозах 453 и 755 Дж/м2 зарегистрировано увеличение каталитической активности фермента на ~21 и 23% соответственно. При дальнейшем УФ-облучении с повышением дозы изменение активности коллагеназы не выявлено (рис. 1).
Рис. 1.
Влияние УФ-облучения на удельную каталитическую активность (ед/мг белка) свободной и иммобилизованной на матрице хитозана коллагеназы: 1 – свободный фермент, 2 – коллагеназа, иммобилизованная на матрице среднемолекулярного хитозана, 3 – коллагеназа, иммобилизованная на матрице высокомолекулярного хитозана.
Для более полного анализа наблюдаемых эффектов мы зарегистрировали ИК-спектры коллагеназы, иммобилизованной на матрице средне- и высокомолекулярного хитозанов, до и после облучения образцов УФ-светом в дозах 151, 453, 755, 1510, 3020, 4530 и 6040 Дж/м2 (рис. 2, 3). При воздействии УФ-излучения во всем диапазоне исследуемых нами доз на комплекс коллагеназы и кислоторастворимого среднемолекулярного хитозана происходит смещение пика 602 см–1 в сторону уменьшения значений волновых чисел, а при дозе 755 Дж/м2 и выше в спектре образца появляется пик 1257 см–1 (оба пика обусловлены взаимодействием νCN и νCO). Кроме того, полоса в области 1408 см–1 при воздействии УФ-света во всем диапазоне доз расщепляется на две – 1378–1382 и 1414–1418 см–1. Полосы в этой области соотносятся с угловой деформацией и осевым растяжением групп C–H [23].
Рис. 2.
ИК-спектры коллагеназы, иммобилизованной на матрице кислоторастворимого среднемолекулярного хитозана, до (контроль) и после воздействия УФ-света (дозы облучения указаны на спектрах).
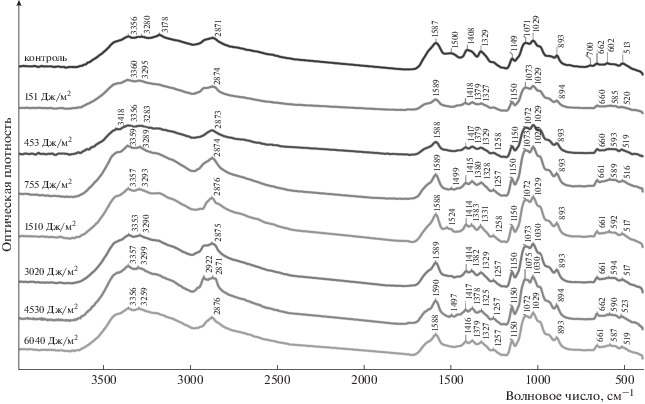
Рис. 3.
ИК-спектры коллагеназы, иммобилизованной на матрице кислоторастворимого высокомолекулярного хитозана, до (контроль) и после воздействия УФ-света (дозы облучения указаны на спектрах).
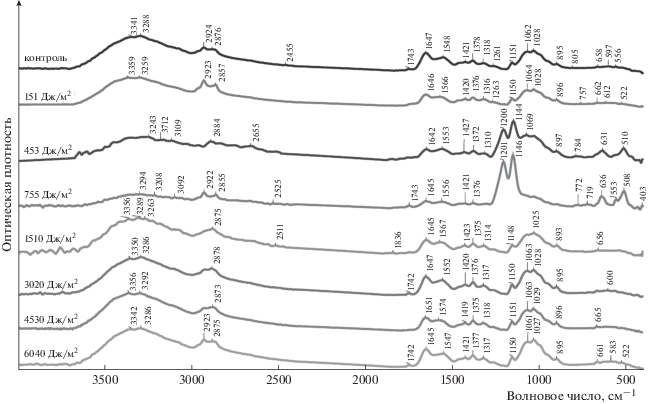
При облучении комплекса коллагеназы с матрицей кислоторастворимого высокомолекулярного хитозана в дозе 151 Дж/м2 возрастает интенсивность пиков 1027 и 1063 см–1, обусловленных взаимодействием νCN и νCO. При воздействии на образец доз 453, 755 и 1510 Дж/м2 (рис. 3) выявляется снижение интенсивности пиков 1025–1028, 1372–1375, 1552–1566, 1642–1646, 2875–2884, 2922–2960 см–1 (δNH + νCN, δO = C–N, δNH, νNH). Пик 1068 см–1 полностью исчезает при облучении образцов в дозах 755 и 1510 Дж/м2, но при 453 Дж/м2 появляются пики 2655 и 2827 см–1. Выше отмечалось, что при дозах 453 и 755 Дж/м2 происходит увеличение каталитической активности иммобилизованной коллагеназы на 21–23%. При увеличении дозы облучения до 3020 Дж/м2 и выше интенсивность пиков принимает значения, примерно равные значениям для необлученных образцов (как и каталитическая активность ферментного препарата).
ВЫВОДЫ
Каталитическая активность свободной коллагеназы в водном растворе под воздействием УФ-света модулируется в большей степени, чем в иммобилизованном состоянии. Иммобилизация приводит к увеличению стабильности гетерогенных биокатализаторов по отношению к УФ-облучению по сравнению со свободными энзимами. Образование связей между коллагеназой и матрицей как среднемолекулярного, так и высокомолекулярного хитозанов в значительной мере повышает фотоустойчивость иммобилизованного фермента, вероятно, за счет возрастания жесткости третичной структуры коллагеназы при адсорбции на хитозане. Эффекты совместного действия УФ-излучения и коллагеназы из Clostridium histolyticum, иммобилизованной на матрице средне- и высокомолекулярного хитозанов, следует учитывать при терапии гнойных ран и ожогов, осложненных бактериальной инфекцией, так как после образования комплекса с хитозаном фермент не снижает своей каталитической активности при воздействии УФ-света в дозах до 6040 Дж/м2. Подобное сочетание терапевтических агентов (УФ-излучение, хитозан и иммобилизованная на нем коллагеназа) может выступать в перспективе как эффективный метод вкупе с антибиотиками и химиопрепаратами при лечении ожогов, ран и раневых инфекций, в том числе устойчивых к действию антибиотиков.
Список литературы
Пиняскина Е.В. Реактивирующее и протекторное действие красного света на дрожжевые клетки, инактивированные УФ-излучением // Изв. Самарского науч. центра РАН. 2011. Т. 13. № 1 (5). С. 1137–1139.
Реброва Г.А., Василевский В.К., Ребров Л.Б. и др. Биохимическое и фотометрическое исследование модификации структуры коллагена при УФ-облучении // Биомед. химия. 2007. Т. 53. № 4. С. 442–453.
Jung W., Winter H. Considerations for the use of clostridial collagenase in clinical practice // Clin. Drug Invest. 1998. V. 15 (3). C. 245–252.
Peacock Jr. E.E. Collagenolysis: the other side of the equation world // J. Surg. 1980. V. 4. № 3. P. 297–302.
Watanabe K. Collagenolytic proteases from bacteria // Appl. Microbiol. Biotechnol. 2004. V. 63. P. 520–526.
Lebertz H., Andreesen J.R. Glycine fermentation by Clostridium histolyticum // Arch. Microbiol. 1988. V. 150. P. 11–14.
Патент RU 2129862, МПК A61K 9/06, A61K 47/36, опубл. 10.05.1999.
Патент RU 2139044, МПК A61K 9/06, A61K 38/48; опубл. 10.10.1999.
Патент RU 2127128, МПК A61L 15/32, опубл. 10.03.1999.
Патент RU 2174389, МПК A61K 9/06, A61K 38/43, A61P 17/02, опубл. 10.10.2001.
Патент RU 2166950, МПК A61K 35/74, C12Q 1/37, опубл. 20.05.2001.
Патент RU 2149644, МПК A61K 38/48, опубл. 27.05.2000.
Патент RU 2093166, МПК A61K 35/39, опубл. 20.10.1997.
Klasen H.J. A review on the non-operative removal of necrotic tissue from burn wounds // Burns. 2000. V. 26. P. 207–222.
Thallinger B., Prasetyo E.N., Nyanhongo G.S., Guebitz G.M. Antimicrobial enzymes: An emerging strategy to fight microbes and microbial biofilms // Biotechnol. 2013. V. 8. P. 97–109.
Mogosanua G.D., Grumezescub A.M. Natural and synthetic polymers for wounds and burns dressing // Int. J. Pharmaceutics. 2014. V. 463. P. 127–136.
Benucci I., Lombardelli C., Liburdi K. et al. Immobilised native plant cysteine proteases: packed-bed reactor for white wine protein stabilization // J. Food Sci. Technol. 2015. V. 23. P. 1–16.
Khalil A., Saurabha C.K., Adnan A.S. et al. A review on chitosan-cellulose blends and nanocellulose reinforced chitosan biocomposites: Properties and their applications // Carbohydr. Polym. 2016. V. 5. P. 216–226.
Logith Kumar R., Keshav Narayan A., Dhivya S. et al. A review of chitosan and its derivatives in bone tissue engineering // Carbohydr. Polym. 2016. V. 20. P. 172–188.
Логинова О.О., Холявка М.Г., Артюхов В.Г. Физико-химические и кинетические свойства гетерогенного биокатализатора на основе трипсина, иммобилизованного на матрице хитозана // Биофарм. журн. 2015. № 2. С. 13–16.
Логинова О.О., Холявка М.Г., Артюхов В.Г., Беленова А.С. Разработка методики получения гетерогенного биокатализатора на основе трипсина, иммобилизованного на матрице хитозана // Фундам. исследования. 2013. № 11 (часть 3). С. 484–487.
Логинова О.О., Холявка М.Г., Артюхов В.Г., Беленова А.С. Подбор методики количественного определения трипсина, иммобилизованного на матрице хитозана, и его каталитической активности // Вестн. ВГУ. Сер. “Химия. Биология. Фармация”. 2013. № 2. С. 116–119.
Pereira F.S., da Agostini D.L.S., Job A.E., Gonzalez E.R.P. Thermal studies of chitin-chitosan derivatives // J. Therm. Anal. Calorim. 2013. V. 114. P. 321–327.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


