Радиационная биология. Радиоэкология, 2019, T. 59, № 2, стр. 200-204
ИНГИБИТОРЫ NOS КАК СРЕДСТВА ПРОФИЛАКТИКИ И ТЕРАПИИ КОМБИНИРОВАННЫХ РАДИАЦИОННО-ТЕРМИЧЕСКИХ ПОРАЖЕНИЙ
Е. А. Чеснакова, М. В. Филимонова *, В. М. Макарчук, А. С. Самсонова, Т. С. Корнеева, Л. И. Шевченко, В. И. Суринова, А. С. Филимонов
Медицинский радиологический научный центр им. А.Ф. Цыба –
филиал Научного медицинского исследовательского центра радиологии Минздрава России
Обнинск, Россия
* E-mail: mari_fil@mail.ru
Поступила в редакцию 30.07.2018
Аннотация
Показана высокая эффективность ингибиторов NOS Т1004 и Т1023 при их использовании в малотоксичных дозах (составляющих 1/8–1/12 ЛД16) на модели комбинированного радиационно-термического поражения (КРТП) по критерию 30-суточной выживаемости животных. Для моделирования КРТП мышей подвергали воздействию γ-излучения 60Со (МД = 0.25 Гр/мин) на установке “Луч-2” в дозе 7 Гр, после чего наносили термический ожог степени IIIБ 10% общей площади поверхности тела. Применение Т1004 через 5 мин или через 4 ч после КРТП статистически значимо, по сравнению с контрольной группой, повышало выживаемость животных (до 90–100%), средняя продолжительность жизни (СПЖ) мышей контрольной группы составила 10.9 ± 5.6 сут. Кратное (через 4 ч, на 2-е, 5-е, 6-е сут) применение Т1004 или Т1023 после КРТП сопровождалось повышением выживаемости подопытных животных на 40%, тогда как в контроле выживаемость составляла 20%. СПЖ павших животных контрольной группы и группы с применением Т1004 статистически значимо не отличалась и составляла 12.5 ± 9.5 сут и 12.7 ± 7.4 сут соответственно, тогда как в группе применения Т1023 наблюдалась устойчивая тенденция к увеличению СПЖ (18.2 ± 6.9 сут) по сравнению с контрольной группой.
Наряду с новыми технологиями современного мира радиационная компонента стала неотъемлемой частью жизни человека. Так, результатами научных достижений ядерной физики стали новые виды топлива и оружия, а вместе с ними и новые угрозы: аварии на атомных электростанциях, хранилищах радиоактивных материалов, угроза ядерного и радиационного терроризма. Примерами таких событий стали атомная бомбардировка Хиросимы и Нагасаки, аварии на атомных подводных лодках, на Чернобыльской и других АЭС. В результате таких инцидентов и катастроф в большинстве случаев (свыше 65%) у пострадавших развивались не изолированные радиационные поражения, а комбинированные (КРП) – сочетание общего или локального облучения с механической и/или ожоговой травмой, а также с воздействием химических веществ [1–3]. Каждый из поражающих компонентов вносит свой вклад в патогенез и в результате взаимного патогенетического отягощения существенно усугубляет развитие поражения, повышая вероятность негативных исходов [4].
Эффективность существующих методов ранней терапии КРП, включающих хирургическое лечение и обработку ран и ожогов, антибактериальную и иммуностимулирующую терапию, инфузию кровезаменителей и электролитов, остается пока достаточно низкой [2, 5].
В этой связи очевидно, что разработка эффективных методов терапии многокомпонентных патологических состояний КРП требует детального изучения таких патологий и развития новых подходов, во многом отличных от лечения изолированных лучевых повреждений, ожогов и травм. Однако, к сожалению, большинство отечественных исследований по проблемам КРП и, в частности, комбинированного радиационно-термического поражения (КРТП), относятся к концу прошлого века и нередко ограничены частными аспектами.
Известна роль эндогенного NO во многих физиологических и патофизиологических процессах организма, в частности, при комбинированных радиационно-термических поражениях [5]. МРНЦ им. А.Ф. Цыба с 1980-х годов имеет обширный опыт в патогенетических исследованиях КРП и экспериментальной разработке средств терапии КРТП В частности, были начаты исследования возможности применения модификаторов оксида азота (NO) в профилактике и лечении КРТП [6–11].
Ранее нами была показана противошоковая и противолучевая эффективность ряда оригинальных N,S-замещенных изотиомочевин, обладающих свойствами ингибиторов синтаз оксида азота (NOS-ингибиторов) [12], что явилось основанием для изучения целесообразности их применения в лечении комбинированных радиационных, в частности, радиационно-термических поражений. Целью данной работы было изучение влияния ингибиторов NOS при однократном и кратном применении на выживаемость животных при КРТП.
МАТЕРИАЛЫ И МЕТОДИКА
Исследования проведены на самцах мышей F1 (CBA × C57BL6j) по 12–15 особей в группе. Для моделирования КРТП мышей подвергали воздействию γ-излучения 60Со при мощности дозы 0.25 Гр/мин на установке “Луч-2” в дозе 7 Гр, после чего наносили термический ожог степени IIIБ 10% общей площади поверхности тела. Шесть галогеновых ламп устанавливали параллельно обжигаемой поверхности кожи на расстоянии от нее 10 мм при мощности светового потока 550 кДж/м2, длительность световой вспышки составляла 2 с.
В качестве исследуемых соединений использованы производные изотиомочевины, обладающие свойствами ингибиторов NOS, под шифрами Т1004 и Т1023, синтезированные и охарактеризованные в лаборатории радиационной фармакологии МРНЦ им. А.Ф. Цыба. Проведено две серии экспериментов, в которых испытуемые соединения вводили по следующим схемам:
1) однократное, через 5 мин или через 4 ч после КРТП применение соединения Т1004 в дозе 46 мг/кг (1/8 ЛД16) внутрибрюшинно;
2) кратное, через 4 ч, на 2-е, 5-е, 6-е сут после КРТП применение Т1004 в дозе 30 мг/кг (1/12 ЛД16) внутрибрюшинно либо Т1023 в дозе 30 мг/кг (1/10 ЛД16) внутрижелудочно.
Эффективность терапии оценивали по 30-суточной выживаемости подопытных животных. Проверку значимости межгрупповых различий проводили, используя непараметрические критерии: точный критерий Фишера и U-критерий Вилкоксона–Манна–Уитни. Во всех случаях различия считали статистически значимыми при p < < 0.05, значения записывали в виде M ± S.D. Статистические расчеты проведены с использованием программных пакетов Origin 7.5 (OriginLab, США) и Statistica 7.0 (StatSoft Inc., США) [13].
РЕЗУЛЬТАТЫ
Для адекватной оценки роли каждого из поражающих факторов и вклада ингибиторов NOS в развитие патологического процесса нами была использована модель КРТП, которая включает ожоговую компоненту, не вызывающую на протяжении 30 сут гибели подопытных животных, и лучевую компоненту, при изолированном воздействии предполагающую гибель 40–60% животных. Сочетание обеих компонент значительно отягощает состояние животных в сравнении с изолированным воздействием ожога или тотального облучения и сопровождается гибелью 80–85% животных. Нами проведены предварительные пилотные исследования по тестированию модели и возможности применения ингибиторов NOS для терапии КРТП (собственные неопубликованные данные).
Результаты первого исследования, при однократном применении ингибитора NOS Т1004 в терапии КРТП, представлены на рис. 1. Видно, что соединение Т1004 при его введении через 5 мин или через 4 ч после КРТП статистически значимо (p < 0.025) повышало 30-суточную выживаемость животных до 90–100%, в то время как в контрольной группе выживаемость составляла 20%.
Рис. 1.
Влияние Т1004 (46 мг/кг внутрибрюшинно) на 30-суточную выживаемость самцов мышей F1 (CBA × C57BL6j) после комбинированного радиационно-термического поражения. * Статистически значимые различия (p < 0.05) по точному критерию Фишера.
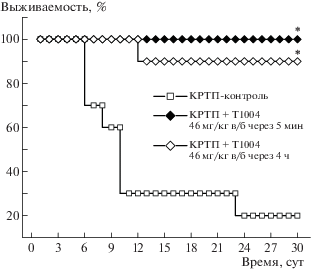
Динамика гибели контрольных животных показывает, что начало гибели в группе из 10 контрольных мышей наблюдалось на 7-е сут после КРТП, что свидетельствует о начале костномозговой формы острой лучевой болезни, при этом СПЖ павших животных составила 10.9 ± 5.6 сут. В группе из 10 мышей с применением Т1004 через 4 ч единственный случай гибели зарегистрирован на 13-е сут после КРТП. А в группе применения Т1004 через 5 мин гибели животных в течение 30 сут не наблюдалось.
Во второй серии экспериментов было установлено (рис. 2), что 4-кратное применение как Т1004, так и Т1023 после КРТП повышало выживаемость животных до 60%, тогда как в контрольной группе выживаемость также не превышала 20%. Средняя продолжительность жизни павших животных в контроле и в группе применения Т1004 статистически значимо не различалась. В группе применения Т1023 наблюдалась устойчивая тенденция к увеличению СПЖ по сравнению с контрольной группой (таблица 1).
Рис. 2.
Влияние 4-кратного применения Т1004 (30 мг/кг внутрибрюшинно) и Т1023 (30 мг/кг внутрижелудочно) на 30-суточную выживаемость самцов мышей F1 (CBA × C57BL6j) после комбинированного радиационно-термического поражения. Статистически значимых различий по точному критерию Фишера нет.
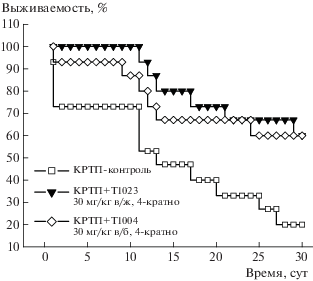
Таблица 1.
Влияние Т1023 при внутрижелудочном и Т1004 при внутрибрюшинном введении в дозе 30 мг/кг на показатели средней продолжительности жизни самцов мышей F1 (CBA × C57BL6j) на фоне КРТП (M ± S.D.)
| СПЖ, сут | ||
|---|---|---|
| Контроль (n = 15) | Т1004 через 4 ч (n = 15) | Т1023 через 4 ч (n = 15) |
| 12.5 ± 9.5 | 12.7 ± 7.4 | 18.2 ± 6.9 сут |
При анализе динамики гибели контрольных животных на этой модели КРТП видно, что 25–30% мышей погибает в первые 3 сут, что, скорее всего, обусловлено развитием болевого и ожогового шока, асептической эндотоксемии. В дальнейшем летальное действие КРТП в этой группе возобновлялось с 10–12-х сут и, вероятно, было уже обусловлено развитием костномозговой формы острой лучевой болезни и сепсиса (рис. 2).
Сопоставление динамики гибели контрольных животных и мышей, получавших Т1004 и Т1023, по нашему мнению, свидетельствует, что применение ингибиторов NOS после нанесения КРТП в данном исследовании предупреждало раннюю летальность, обусловленную ожоговой болезнью, – предотвращало развитие тяжелых форм шока на фоне выраженной эндотоксемии и гиповолемии.
ОБСУЖДЕНИЕ
Начальный период ожоговой болезни представляет собой асептическую эндотоксемию и воспалительную реакцию, что способствует активации индуцибельной синтазы (iNOS) и значительному повышению концентрации NO [14, 15]. Поздние стадии острой лучевой болезни также сопровождаются повышенной выработкой NO в организме [16, 17]. В условиях КРТП даже сравнительно легкие ожоги вносят существенный вклад в отягощение течения лучевой болезни и приводят к снижению доли выживших животных после радиационного воздействия [6, 18, 19]. Сочетание пострадиационной миелосупрессии и бактериальной эндотоксемии приводит к развитию генерализованного инфекционного процесса – сепсиса, сопровождающегося значительным и стойким повышением продукции NO в органах и тканях, что способствует формированию глубоких циркуляторных нарушений, таких, как вазодилятация, снижение периферического сосудистого сопротивления, повышение проницаемости сосудов, вплоть до эндотоксемического и септического шока [18–20]. Нередко такие нарушения приводят к развитию угрожающих осложнений: полиорганной дисфункции, дистресс-синдрома и рефрактерных вазоплегий – патологических состояний, слабо поддающихся терапии и приводящих к резкому возрастанию летальности [21, 22].
В мире активно ведутся работы по исследованию патогенеза КРП и поиску молекулярных маркеров таких патологических состояний [21–27], средств терапии и повышения качества жизни пациентов с комбинированными радиационно-механическими, радиационно-термическими и сочетанными радиационными повреждениями.
Одним из рациональных подходов к предотвращению развития эндотоксемии при терапии КРП является, на наш взгляд, модификация синтеза NO. Собственные опубликованные данные [28] показывают, что ингибиторы NOS из класса производных изотиомочевины эффективны при тяжелом эндотоксемическом шоке у крыс, что проявляется статистически значимым повышением артериального давления на протяжении не менее 2 ч.
Экспериментальные исследования возможностей использования ингибиторов NOS в терапии КРТП были начаты С.Я. Проскуряковым, Л.П. Ульяновой, Р.С. Будаговым. Было показано, что обработка мышей дифетуром приводит к практически полному ингибированию синтеза NO в печени как в контроле, так и у животных с КРТП, а также повышает выживаемость подопытных животных на 40–50% [9].
Результаты проведенных нами исследований демонстрируют эффективность ингибиторов NOS Т1004 и Т1023 при внутрибрюшинном и внутрижелудочном введении однократно и курсом на модели КРТП, что проявляется в повышении 30-суточной выживаемости животных (60%, 90–100%) в сравнении с контролем (20%). Это подтверждает перспективность ингибиторов NOS из класса производных изотиомочевины для разработки эффективных схем терапии КРТП как изолированно, так и, в частности, в сочетании со стимуляторами гемопоэза.
Дальнейшие исследования в этой области, несомненно, внесут вклад в понимание патогенеза КРП и КРТП и создадут новые возможности в разработке лекарственных средств, остро необходимых при чрезвычайных ситуациях мирного и военного времени.
Список литературы
Комбинированные радиационные поражения: патогенез, клиника, лечение / А.И. Бритун, Р.С. Будагов, Е.А. Вагнер и др.; под ред. А.Ф. Цыба, М.Н. Фаршатова. М.: Медицина 1992. 288 с.
Легеза В.И., Гребенюк А.Н., Бояринцев В.В. Комбинированные радиационные поражения и их компоненты. СПб.: Фолиант, 2015. 216 с.
DiCarlo A.L., Ramakrishnan N., Hatchett R.J. Radiation combined injury: overview of NIAID research // Health Phys. 2010. V. 98 (6). P. 863–867.
Заргарова Н.И., Гребенюк А.Н., Легеза В.И., Владимирова О.О. Об особенностях феномена взаимного отягощения при сочетанных радиационных поражениях // Вестн. Рос. воен.-мед. академии. 2013. № 2 (42). С. 91–95.
Forstermann U., Sessa W.C. Nitric oxide synthases: re-gulation and function // Eur. Heart J. 2012. V. 33. № 7. P. 829–837.
Ульянова Л.П., Кетлинский С.А., Будагов Р.С. Исследование эффективности интерлейкина-1β при лечении комбинированных радиационно-термических поражений // Радиац. биология. Радиоэкология. 1997. Т. 37. Вып 2. С. 175–181.
Будагов Р.С., Ульянова Л.П. Интерлейкин-6 в патогенезе комбинированных радиационно-термических поражений // Радиац. биология. Радиоэкология. 2004. Т. 44. № 4. С. 398–402.
Будагов Р.С., Ульянова Л.П. Влияние средств микробного происхождения на уровень цитокинов в сыворотке крови, гематологический статус и выживаемость мышей при комбинированных радиационных поражениях // Радиац. биология. Радиоэкология. 2001. Т. 41. № 1. С. 38–42.
Будагов Р.С., Ульянова Л.П. Эффекты модуляторов уровня цитокинов на выживаемость мышей и крыс при комбинированных радиационно-термических поражениях // Радиац. биология. Радиоэкология. 2004. Т. 44. № 4. С. 392–397.
Проскуряков С.Я., Ульянова Л.П., Скворцов В.Г., Будагов Р.С. Оценка роли оксида азота в отягощении исходов комбинированных радиационно-термических поражениях // Радиац. биология. Радиоэкология. 2005. Т. 45. № 3. С. 316–319.
Хлоповская Е.И., Будагов Р.С., Сморызанова О.А., Ротт Г.М. Участие металлотионеинов в регуляции активности макрофагов при комбинированном радиационно-термическом поражении // Биохимия. 1997. Т. 62. Вып. 3. С. 344–347.
Филимонова М.В., Шевченко Л.И., Макарчук В.М. и др. Радиозащитные свойства ингибитора NO-синтаз Т1023: I. Показатели противолучевой активности и взаимодействие с другими радиопротекторами // Радиац. биология. Радиоэкология. 2015. Т. 55. № 3. С. 250–259.
Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М.: МедиаСфера, 2002. 312 с.
Abo El-Noor M.M., Elgazzar F.M., Alshenawy H.A. Role of inducible nitric oxide synthase and interleukin-6 expression inestimation of skin burn age and vitality // J. Foren. Legal Med. 2017. V. 52. P. 148–153.
Rawlingson A. Nitric oxide, inflammation and acute burn injury // Burns. 2003. V. 29. I. 7. P. 631–640.
Ohta S., Matsuda S., Gunji M., Kamogawa A. The Role of Nitric Oxide in Radiation Damage // Biol. Pharm. Bull. 2007. V. 30. № 6. 1102–1107.
Leach J.K., Black S.M., Schmidt-Ullrich R.K, Mikkelsen R.B. Activation of Constitutive Nitric-oxide Synthase Activity Is an Early Signaling Event Induced by Ionizing Radiation // J. Biol. Chem. 2002. V. 277. № 18. P. 15400–15406.
Dudzinski D.M., Michel T. Life history of eNOS: Partners and pathway // Cardiovasc. Res. 2007. V. 75. № 2. P. 247–260.
Cauwels A. Nitric oxide in shock // Kidney Int. 2007. V. 72. № 5. P. 557–565.
Gkisioti S., Mentzelopoulos S.D. Vasogenic shock physi-ology // Open Acc. Emerg. Med. 2011. V. 3. doi: https://doi.org/10.2147/OAEM.S10388
Carter S.R., Zahs A., Palmer J.L. et al. Intestinal Barrier Disruption as a Cause of Mortality in Combined Radiation and Burn Injury // Shock. 2013. V. 40. № 4. P. 281–289.
Palmer J.L., Deburghgraeve C.R., Bird M.D. et al. Deve-lopment of a Combined Radiation and Burn Injury Model // J. Burn. Care Res. 2011. V. 32. № 2. P. 317–323.
Kiang J.G., Garrison B.R., Gorbunov N.V. Radiation Combined Injury: DNA Damage, Apoptosis, and Autophagy // Adaptive Med. 2010. V. 2. № 1. P. 1–10.
Kiang G., Jiao W., Cary L.H. et al. Wound Trauma Increases Radiation-Induced Mortality by Activation of iNOS Pathway and Elevation of Cytokine Concentrations and Bacterial Infection // Radiat. Res. 2010. V. 173. P. 319–332.
Kiang J.G., Garrison B.R., Gorbunov N.V. Radiation Combined Injury: DNA Damage, Apoptosis, and Autophagy // Adaptive Med. 2010. V. 2. № 1. P. 1–10.
Mendoza A.E., Neely C.J., Charles A.G. et al. Radiation Combined with Thermal Injury Induces Immature Myeloid Cells // Shock. 2012. V. 38. № 5. P 532–542.
Ran X., Cheng T., Shi C. et al. The effects of total-body irradiation on the survival and skin wound healing of rats with combined radiation-wound injury // J. Trauma. 2004. V. 57. P. 1087–1093.
Филимонова М.В., Шевченко Л.И., Суринова В.И. и др. Влияние N-припионил-S-изопропил-изотиомочевины на продукцию биогенного оксида азота (NO) и гемодинамические параметры животных при эндотоксимическом шоке // Вопр. биол., мед. и фарм. химии. 2011. № 9. С. 35–39.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


