Радиационная биология. Радиоэкология, 2019, T. 59, № 2, стр. 191-199
ВЛИЯНИЕ ПРЕПАРАТА “СЕМАКС” НА ЖИЗНЕННЫЙ СТАТУС И МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ В ГОЛОВНОМ МОЗГЕ МЫШЕЙ ПРИ ОБЛУЧЕНИИ ПРОТОНАМИ
К. Н. Ляхова 1, 2, *, И. А. Колесникова 1, 2, Н. Н. Буденная 1, 2, Ю. С. Северюхин 1, 2, Т. М. Бычкова 3, 4, О. В. Никитенко 3, 4, Д. М. Утина 1, 2, А. Г. Молоканов 1, А. А. Иванов 1
1 Объединенный институт ядерных исследований
Дубна, Россия
2 Государственный университет “Дубна”
Дубна, Россия
3 Институт медико-биологических проблем РАН
Москва, Россия
4 Федеральный медицинский биофизический центр им. А.И. Бурназяна ФМБА России
Москва, Россия
* E-mail: lyakhovakn@mail.ru
Поступила в редакцию 23.07.2018
Аннотация
Важными задачами космической радиобиологии являются изучение воздействия заряженных частиц на функции центральной нервной системы космонавтов при дальних космических полетах и поиск препаратов, способных купировать возможные нарушения при подобном воздействии. Целью работы стала оценка влияния препарата “Семакс” на поведенческие реакции, силу скелетной мускулатуры, состояние костномозгового кроветворения и морфологические изменения нейронов головного мозга мышей, облученных ускоренными протонами. Установлено, что “Семакс” при интраназальном введении нормализует показатель эмоционального статуса на 7-е сутки после облучения ускоренными протонами в дозах 2.3 и 3 Гр. Препарат восстанавливает уровень показателя силы скелетной мускулатуры облученных животных до контрольных значений. Морфологическая картина в сенсомоторной коре головного мозга облученных животных, которым вводили препарат “Семакс”, близка к нормальной.
К числу актуальных и слабо изученных проблем нейрорадиобиологии относятся вопросы модификации нарушений высших интегративных функций центральной нервной системы средствами фармакохимической защиты при действии ионизирующих излучений с разными физическими характеристиками. Прежде всего это касается эффектов, индуцированных ускоренными заряженными частицами. Значительные успехи радиационных фармакологов в области разработки средств купирования клинических проявлений первичной реакции организма при действии больших доз радиации [1] не решают проблем, возникающих в неврологическом статусе при хроническом облучении [2] и действии малых доз облучений [3]. В наибольшей степени это относится к нарушениям, вызванным излучениями с высокой линейной передачей энергии (ЛПЭ), что крайне актуально при решении проблем космической радиобиологии. При анализе радиобиологических эффектов космических излучений при пилотируемых полетах в дальний космос следует иметь в виду наличие в их составе не только протонов высоких энергий, но и тяжелых заряженных частиц, обладающих высокой биологической эффективностью. Характер передачи энергии тяжелыми ионами (“эффект пули”) при прохождении через ткани обусловливает совершенно иной тип их воздействия на организм в условиях полета в дальнем космосе. Это обстоятельство может определять развитие радиационных синдромов, принципиально отличных от наблюдаемых при действии редкоионизирующих космических излучений. С учетом этого необходимо иметь в виду возможное формирование нарушений со стороны центральной нервной системы (ЦНС) космонавтов, которые могут вызвать нарушения операторской деятельности экипажа уже во время полета [4, 5]. Такой вывод подтверждается в экспериментах по облучению лабораторных животных высокоэнергетичными ионами железа и водорода в дозах, соответствующих реальным потокам галактических ядер железа при полете к Марсу. В этих опытах выявляются различные нарушения со стороны ЦНС облученных животных [6–9]. Через 1.5–3.0 мес. после облучения они проявляются в выраженных нарушениях пространственной ориентации, угнетении когнитивных функций. Об этом же свидетельствуют данные о снижении уровня ряда нейромедиаторов (в частности, серотонина) и наличие поведенческих расстройств у грызунов и приматов (Macaca mulatta) возбудимого неуравновешенного типа высшей нервной деятельности [10–12] после облучения головного мозга высокоэнергетичными ионами углерода.
Осуществить защитные мероприятия от поражающего действия заряженных частиц, исходящих из глубин галактики, методами физической защиты к настоящему времени не представляется возможным. В связи с этим приобретают актуальность исследования, касающиеся поиска средств фармакохимической защиты, купирующих нарушения высших интегративных функций ЦНС при действии космических видов излучений. Одним из перспективных препаратов, способных специфически купировать радиационные нарушения в ЦНС, является препарат “Семакс”. Медицинский препарат – нейропептид с торговым названием “Семакс” имеет химическое название: метионил-глутамил-гистидил-фенилаланил-пролил-глицил-пролин. Препарат относится к фармацевтической группе ноотропных средств и выпускается в лекарственной форме: капли назальные 0.1% [13]. “Семакс” влияет на процессы, связанные с формированием памяти и обучением, усиливает внимание при обучении и анализе информации, улучшает консолидацию памятного следа у пациентов после нейрохирургических вмешательств, черепно-мозговой травмы, при цереброваскулярных заболеваниях, в том числе дисциркуляторной энцефалопатии, улучшает адаптацию организма к гипоксии, церебральной ишемии, наркозу и при других повреждающих воздействиях [14].
Целью настоящего исследования стала оценка влияния официнального препарата “Семакс” (капли назальные 0.1%) на поведенческие реакции, силу скелетной мускулатуры, проявления костномозгового синдрома и морфологические изменения нейронов сенсомоторной коры и клеток Пуркинье коры мозжечка мышей, облученных протонами с энергией 170 МэВ в дозах 2.3 и 3.0 Гр.
В доступной литературе, кроме нашего сообщения [15, 16], сведений о подобных исследованиях мы не встретили.
МАТЕРИАЛЫ И МЕТОДИКА
Животные. Исследования проводили на аутбредных половозрелых самках мышей ICR (CD-1), SPF категории, массой тела 21–29 г, в возрасте 7–8 нед, число животных в каждой группе 7–10 особей. В ходе всего эксперимента животные содержались в стандартных лабораторных условиях и имели свободный доступ к воде и корму. Эвтаназию животных осуществляли путем декапитации.
Облучение. Животные были подвергнуты облучению ускоренными протонами на медицинском пучке фазотрона Объединенного института ядерных исследований (г. Дубна). Мышей фиксировали и облучали в специальных индивидуальных контейнерах по четыре особи одновременно. Применялось краниокаудальное направление пучка частиц. Средняя энергия протонов на входе в кабину перед замедлителем составляла 170 МэВ. Энергия частиц в кабине была определена по пробегу пучка в воде (R = 200 мм воды). Измерения проводили полупроводниковым кремниевым детектором. Среднее значение ЛПЭ на входе пучка составляло 0.49 кэВ/мкм. Дозиметрическая калибровка пучка в каждой точке глубинного дозового распределения проводилась ионизационной камерой ТМ30013 клинического дозиметра PTW UNIDOS-E (“PTW-FREIBURG”, Германия). Облучение животных проводили в пике Брэгга при толщине дополнительного замедлителя, равной 190 мм. Мощность дозы на входе пучка (с убранным дополнительным замедлителем) составляла 0.62 Гр/мин, мощность дозы в точке облучения на тело мыши (90% от уровня дозы в пике Брэгга) составляла 1.42 Гр/мин. Отношение дозы в точке облучения к дозе на входе составляло 2.28. На входе пучка объекты облучали в дозах, равных 1.0 и 1.25 Гр, что составляло 2.3 и 3.0 Гр в тканях облучаемых животных. Для контроля облучения за контейнерами с животными размещалась радиохромная пленка. Контрольная группа животных (транспортный контроль), не подвергавшаяся облучению, также была помещена в контейнеры.
Введение препарата “Семакс”
После облучения животных распределяли на две рандомизированные по массе группы, одна из которых (основная) получала препарат “Семакс” 0.1% (по 1 капле интраназально, начиная со второго часа после облучения), трижды в сутки: утром, днем и вечером в течение 7 сут. Второй группе облученных животных вводили кипяченую охлажденную воду по аналогичной схеме.
Поведенческие реакции и сила скелетной мускулатуры
Влияние облучения протонами на поведенческие реакции животных оценивали на 7-е сут после облучения. Оценку проводили по уровню локомоторной активности в тестовой установке “Открытом поле” (ОП) [17] с круговой серой ареной диаметром 63 см. В течение 3 мин учитывали акты пересечения секторов, проходы через центр, подъем, норковый рефлекс. Сумма этих актов составила показатель ориентировочно-исследовательской реакции (ОИР), а акты груминг, замирание, движение на месте – показатель эмоционального статуса (ЭС). Силу скелетной мускулатуры мышей оценивали по показателю силы захвата (в граммах) передних лап животного на электронном динамометре. Делали три измерения на каждое животное. Анализ показателя силы захвата производили по лучшему из трех измерений.
Оценка влияния препарата “Семакс” на проявление костномозгового синдрома лучевой болезни у мышей
Оценку влияния препарата производили по большинству традиционных радиобиологических показателей: масса тимуса и селезенки, число кариоцитов в костном мозге и число лейкоцитов в периферической крови. Для оценки показателя числа кариоцитов в костном мозге бедренной кости и числа лейкоцитов в периферической крови в исследовании была использована общепринятая методика подсчета клеток в камере Горяева [18]. Массу тимуса и массу селезенки определяли на электронных весах Ohaus с точностью деления 1 мг.
Морфологические изменения в головном мозге мышей
После декапитации извлекали головной мозг и фиксировали в растворе Карнуа для дальнейшего гистологического исследования. Обработка головного мозга мышей и приготовление препаратов проходили в соответствии со стандартной гистологической техникой. Препараты окрашивали крезилвиолетом по методу Ниссля [19]. В зависимости от степени структурных нарушений выделяли три группы клеток: нейроны без видимых изменений; нейроны с обратимыми морфофункциональными и компенсаторно-приспособительными изменениями и нейроны с дистрофическими нарушениями (рис. 1). В группу нейронов с обратимыми морфофункциональными и компенсаторно-приспособительными изменениями входили клетки, подверженные умеренному хроматолизу, а также нейроны с небольшими изменениями величины и формы цитоплазмы, ядра и ядрышка, сближенные нейроны. Показателем тяжести дегенеративных процессов принято считать количество нейроцитов с дистрофическими изменениями [20]. К данным видам изменений относят пикноморфные нейроны, клетки тени, нейроны, подверженные сильной вакуолизации. Для количественной оценки данных определяли процентное соотношение нейронов без видимых изменений, нейронов с обратимыми морфофункциональными и компенсаторно-приспособительными признаками и нейронов с дистрофическими изменениями.
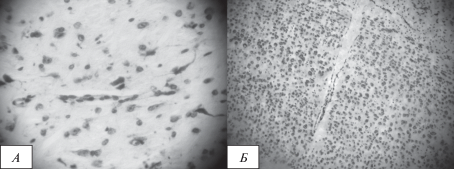
Рис. 1.
Фото сосудов коры головного мозга на 8-е сутки после облучения: А – сосуд без нарушений (ок. ×10, об. ×40), Б – сосуд с нарушением целостности (Ок. ×10, об. ×10). Окраска крезилвиолетом по методу Ниссля.
Для статистической обработки подсчета средней арифметической и ошибки средней использовали программный комплекс Origin Pro 2015, достоверность различий рассчитывали с помощью критерия Манна–Уитни. Результаты считали статистически значимыми при р ≤ 0.05.
Все эксперименты проводились в соответствии с “Правилами проведения работ с использованием экспериментальных животных” (Приказ МЗ СССР № 755 от 12.08.1977 г.) и “Международными рекомендациями по проведению биомедицинских исследований с использованием животных” (Совет международных медицинских научных организаций (CIOMS), Женева, 1995 г.).
РЕЗУЛЬТАТЫ
Препарат “Семакс” нормализует показатель ЭС на 7-е сутки после облучения
В табл. 1 представлены данные о поведенческой исследовательской реакции животных на 7-е сут после облучения протонами. При облучении в дозе 2.3 Гр показатель груминга и число выходов в центр ОП у облученных животных без использования препарата за 3 мин наблюдения составил в среднем 0.3 ± 0.2 и 2.1 ± 0.7 актов соответственно. Эти величины статистически значимо (р < 0.05 по критерию Манна–Уитни) ниже по сравнению с группой необлученных контрольных животных (0.9 ± 0.2 и 4.3 ± 0,7 актов соответственно). В то же время в группе облученных животных с использованием “Семакса” величины показателей возрастают до значений 0.8 ± 0.2 и 3.6 ± 0.7 актов соответственно и статистически не отличаются от соответствующих показателей, регистрируемых в группе необлученных контрольных животных.
Таблица 1.
Показатели неврологического статуса мышей самок ICR (CD-1) на 7-е сут после протонного облучения с энергией 170 МэВ на входе
| Доза облучения, Гр | № | Группа | Число животных (n) | Показатели: число реакций за 3 мин (M ± m) | ||||
|---|---|---|---|---|---|---|---|---|
| ОИР | ЭС | ОИР/ЭС | число выходов в центр ОП | груминг | ||||
| 2.3 | 1 | Необлученный контроль | 7 | 143 ± 4.2 | 3 ± 0.42 | 52.5 ± 5.1 | 4.3 ± 0.72 | 0.9 ± 0.22 |
| 2 | Облученный контроль без введения препарата | 7 | 156.5 ± 7 | 1.6 ± 0.2 | 101.0 ± 11.84 | 2.1 ± 0.9 | 0.3 ± 0.2 | |
| 3 | Облученные, с введением “Семакса” | 8 | 149.1 ± 7.5 | 4.4 ± 0.5 | 39.0 ± 6.02 | 3.6 ± 0.7 | 0.8 ± 0.2 | |
| 3.0 | 4 | Необлученный контроль | 10 | 127.2 ± 51 | 7.2 ± 0.43 | 18.1 ± 1.3 | 4.3 ± 0.61.3 | 0.8 ± 0.13 |
| 5 | Облученный контроль без введения препарата | 10 | 141.5 ± 7 | 4.7 ± 0.2 | 30.8 ± 2.75 | 2.1 ± 0.93 | 0.8 ± 0.13 | |
| 6 | Облученные, с введением “Семакса” | 10 | 136.3 ± 8 | 8.9 ± 1.6 | 20.9 ± 1.4 | 6.6 ± 0.7 | 1.3 ± 0.2 | |
Суммарный показатель ЭС составил в необлученной контрольной группе 3.0 ± 0.4 актов. Эта величина у животных, облученных в дозе 2.3 Гр без введения препарата, составляет 1.6 ± 0.2 актов, а у облученных особей при введении “Семакса” достигает 4.4 ± 0.5 актов. Различия между контрольной и основной группами облученных животных статистически значимы (р < 0.05).
Показатель ОИР составил в группе облученных животных в дозе 3.0 Гр без “Семакса” 141.5 ± ± 7.0 актов, а в группе облученных с введением “Семакса” –136.3 ± 14.2 актов. В группе необлученных контрольных животных этот показатель составил 127.2 ± 5.0 актов. Статистически значимые различия отмечены между основной и контрольной группами облученных животных.
Показатель ЭС в группе животных, облученных в дозе 3.0 Гр составил 4.7 ± 0.2 актов, что существенно ниже по сравнению с группой необлученного контроля, где регистрировали 7.2 ± ± 0.4 актов. Применение “Семакса” привело к полному восстановлению значения этого показателя до 8.9 ± 1.6 актов, что незначительно превышает показатели интактного контроля.
Применение препарата восстанавливает уровень показателя силы скелетной мускулатуры облученных животных до контрольных значений
Влияние облучения и препарата “Семакс” на силу скелетной мускулатуры у мышей табл. 2. Сила скелетной мускулатуры на 8-е сут после облучения в дозе 2.3 Гр составила у облученных животных 70.3 ± 2.6 г, а в группе облученных с введением “Семакса” отмечено сохранение показателя до уровня 87.9 ± 3.6 г. В группе необлученных контрольных животных эта величина достигала 94.4 ± 4 г. При этом отмечены статистически значимые различия между группами необлученного контроля и контрольных облученных животных (р < 0.05). Следует отметить, что показатели необлученного контроля и облученных животных с введением “Семакса” статистически значимо не различались.
Таблица 2.
Показатели силы скелетной мускулатуры мышей самок ICR (CD-1) на 8-е сутки после протонного облучения с энергией 170 МэВ (число животных в группе 7–10)
| Доза облу-чения, Гр | № | Группа | Сила захвата передних лап по отношению к биоконтролю, % |
|---|---|---|---|
| 2.3 | 1 | Необлученный контроль | 100 |
| 2 | Облученный контроль без введения препарата | 84.61 | |
| 3 | Облученные, с введением “Семакса” | 93.1 | |
| 3.0 | 4 | Необлученный контроль | 100 |
| 5 | Облученный контроль без введения препарата | 81.32 | |
| 6 | Облученные, с введением “Семакса” | 102.1 |
Сила скелетной мускулатуры на 8-е сут после облучения в дозе 3.0 Гр составила у облученных животных 96.1 ± 5.7 г, в группе облученных животных с введением препарата отмечено сохранение показателя со средними значениями 120.7 ± ± 8.3 г, в группе необлученного контроля – 118.2 ± 9.6 г. При этом отмечены статистически значимые различия между основной и контрольной группами облученных животных (р < 0.05).
Введение “Семакса” облученным животным не усугубляло проявления острой лучевой болезни
Данные, характеризующие иммуногематологический статус мышей на 8-е сут после облучения, указывают на наличие выраженного радиационного повреждения этих функциональных систем, более выраженного при дозе 3.0 Гр. (табл. 3). Это регистрируется по показателям массы тела, массы лимфоидных органов (тимуса и селезенки), числа кариоцитов в костном мозге и лейкоцитов в периферической крови. Статистически значимых различий по показателям иммуногематологического статуса между группами животных, с введением препарата “Семакс” и группой животных, которым не вводился препарат, в основном не отмечено. Это позволяет заключить, что негативного влияния на проявления лучевой болезни введение препарата не оказывает. Отмечена некоторая тенденция к понижению уровня показателей иммунитета и кроветворения животных групп облученного контроля и группы с введением “Семакса”, облученных в дозе 3.0 Гр и в меньшей степени при облучении в дозе 2.3 Гр.
Таблица 3.
Иммуногематологический статус мышей самок ICR (CD-1) на 8-е сутки после облучения протонами с энергией 170 МэВ на входе (число животных в группе 7–10)
| Доза облу-чения, Гр | № | Группа | Показатели (M ± m) | ||||
|---|---|---|---|---|---|---|---|
| масса тела, г | масса тимуса, мг | масса селезенки, мг | количество клеток костного мозга (109/бедро) | количество лейкоцитов в периферической крови (109/л) | |||
| 2.3 | 1 | Необлученный контроль | 23.7 ± 0.5 | 90.5 ± 4.11 | 90.8 ± 7.8 | 22.9 ± 0.62 | 3.3 ± 0.12 |
| 2 | Облученный контроль | 22.3 ± 0.5 | 78.8 ± 3.1 | 75.1 ± 3.5 | 17.4 ± 1.1 | 1.5 ± 0.1 | |
| 3 | Облученные, с введением “Семакса” | 22.5 ± 0.3 | 71.3 ± 2.5 | 74.5 ± 2.5 | 17.1 ± 0.6 | 1.7 ± 0.1 | |
| 3.0 | 4 | Необлученный контроль | 27.7 ± 2.3 | 78.5 ± 0.73 | 105 ± 0.54 | 20.5 ± 0.4 | 2.9 ± 0.1 |
| 5 | Облученный контроль | 26.5 ± 0.7 | 53.5 ± 4.4 | 90.1 ± 4.7 | 17.6 ± 0.7 | 1.13 ± 0.2 | |
| 6 | Облученные, с введением “Семакса” | 25.8 ± 0.8 | 54.6 ± 3.4 | 81.6 ± 3 | 17.0 ± 0.5 | 1.23 ± 0.2 | |
Морфологические изменения в головном мозге мышей
В ходе экспериментов установлено наличие структурно измененных клеток у животных всех экспериментальных групп на фоне морфологически сохранных нейронов. Были обнаружены нейроны с различной степенью тяжести структурных изменений: от обратимых морфофункциональных и компенсаторно-приспособительных до дистрофических необратимых изменений. Регистрировались клетки с признаками кариорексиса, цитолизиса, пикноморфные нейроны, ишемические нейроны, “клетки-тени”, окруженные глиоцитами.
На 8-е сут после облучения в ткани сенсомоторной коры мышей обеих экспериментальных групп наблюдались следующие виды изменений нейронов (рис. 2): гипохромные нейроны, нейроны с различными видами хроматолиза: сегментарного, апикального и центрального. В 3–5-м слоях коры встречались гиперхромные нейроны, с выраженной складчатостью ядерной мембраны. Кроме того, имело место увеличение количества сближенных нейронов в сенсомоторной коре, нейронов с двумя и тремя ядрышками – главным образом вблизи гиппокампа.
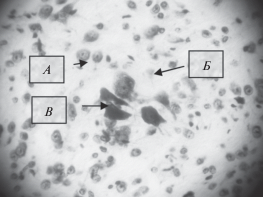
Рис. 2.
Морфологические изменения клеток коры головного мозга на 8-е сутки после облучения протонами в дозе 2.3 Гр. А – неизмененный нейрон; Б – нейроны с морфофункциональными и компенсаторно-приспособительными изменениями; В – нейроны с дистрофическими нарушениями. Окраска крезилвиолетом по методу Ниссля. Ок. ×10, об. ×40.
По результатам визуально-оптического анализа препаратов, полученных от животных экспериментальной группы 3, можно сделать вывод о том, что кровеносные сосуды сенсомоторной коры головного мозга имеют меньше признаков нарушений целостности структуры (не обладали признаками гомогенизации или разрыхления стенок), в отличие от группы 2. При этом и количество измененных нейронов у животных группы 3 было меньшим по сравнению с животными группы 2. Очевидно, что существует прямая зависимость степени тяжести изменений нейронов от состояния капилляров.
Анализ полученных данных свидетельствует о том, что относительное число измененных нейронов у облученных животных (группа 2) в коре головного мозга статистически значимо является большим по сравнению с необлученным контролем. У животных группы 3 при введении препарата “Семакс” количество измененных нейронов в сенсомоторной коре существенно меньшее, чем у облученных животных без введения препарата. Обнаружено, что количество дистрофически-измененных нейронов в группе 3 приближается к уровню необлученного контроля (табл. 4).
Таблица 4.
Количество нейронов сенсомоторной коры в различных группах животных на 8-е сутки после облучения протонами в дозе 2.3 Гр, (µ ± m)%
| Группа | № | Неизмененные нейроны, % | Обратимые морфофункциональные и компенсаторно-приспособительные нейроны, % | Дистрофические нейроны, % |
|---|---|---|---|---|
| Необлученный контроль | 1 | 84.5 ± 0.86 | 14.8 ± 0.81 | 0.76 ± 0.33 |
| Облученный контроль без введения препарата | 2 | 74.5 ± 0.78*, ** | 21.5 ± 0.75* | 3.87 ± 0.33*, ** |
| Облученные, с введением “Семакса” | 3 | 86.0 ± 1.31 | 11.9 ± 1.16 | 1.80 ± 0.41 |
Следует заметить, что количество нейронов без видимых нарушений в коре головного мозга животных в группах 1 и 3 больше, чем в группе 2. У животных группы 2 число нейронов с морфофункциональными и компенсаторно-приспособительными изменениями статистически значимо больше по сравнению с группой 1. При оценке количества дистрофических нейронов в коре было обнаружено статистически значимое отличие у облученных животных с введением кипяченой воды. В этой группе значительно выше показатель среднего числа нейронов с данным видом нарушений, чем в двух других группах. Необходимо отметить наблюдаемые изменения капиллярной сети коры головного мозга. Как правило, дистрофически-измененные нервные клетки располагались вблизи капилляров с периваскулярным отеком. Были обнаружены капилляры и мелкие сосуды с признаками гомогенизации или разрыхления их стенок, с набуханием ядер эндотелия. Иногда наблюдались резкое расширение мелких сосудов, стаз эритроцитов в них. В некоторых случаях просвет микрососудов был неравномерно расширен и переполнен форменными элементами крови, но выхода их за пределы сосудистой стенки выявлено не было. Такого рода патологические изменения капилляров и мелких сосудов отмечались лишь в первой группе животных – облученных протонами.
Наблюдавшиеся изменения в клетках Пуркинье мозжечка носили более выраженный характер: встречались гиперхромные нейроны с пикнотичным ядром, вокруг тел отдельных гипер-хромных клеток имелся перицеллюлярный отек. Результаты количественного анализа нейроморфологических изменений в коре мозжечка представлены в табл. 5. Следует отметить, что облучение протонами статистически значимо снизило количество неизмененных нейронов и увеличило число морфофункциональных и компенсаторно-приспособительных. Как видно на табл. 5, статистически значимых эффектов препарата “Семакс” в коре мозжечка нами не выявлено. В группе 1 количество нормальных нейронов Пуркинье статистически значимо больше по сравнению с группой 2. Значимые различия по суммарному числу нейронов с обратимыми морфофункциональными и компенсаторно-приспособительными признаками нарушений наблюдаются между группами 1 и 3.
Таблица 5.
Количество клеток Пуркинье мозжечка в различных группах на 8-е сутки после облучения протонами в дозе 2.3 Гр, (µ ± m)%
| Группа | № | Неизмененные нейроны, % | Обратимые морфофункциональные и компенсаторно-приспособительные нейроны, % | Дистрофические нейроны, % |
|---|---|---|---|---|
| Необлученный контроль | 1 | 85.8 ± 2.42 | 10.4 ± 0.92 | 3.80 ± 2.16 |
| Облученный контроль без введения препарата | 2 | 79.4 ± 1.23* | 18.4 ± 2.44 | 2.27 ± 0.87** |
| Облученные, с введением “Семакса” | 3 | 76.7 ± 6.40 | 17.2 ± 2.01* | 6.10 ± 0.77 |
Установлено [21], что в патогенезе лучевых поражений центральной нервной системы значительное место занимает состояние стенок микрососудов, их повреждение является причиной нарушения барьерной функции эндотелия, что приводит к последовательному развитию периваскулярного отека, формированию локальной гипоксии, что в значительной мере ухудшает трофику ткани, способствует развитию вторичных дефектов в стенке сосудов, формирует дистрофические изменения нейронов (рис. 1). Гипоксия и нарушения углеводного обмена быстро сказываются на функциях нейронов, энергетические процессы в которых зависят от этих веществ, при ограничении кровоснабжения более глубокие повреждения развиваются, прежде всего, в нейронах с высоким уровнем метаболизма. Наиболее чувствительна к таким нарушениям кора больших полушарий, а также мозжечок, что и подтверждается в полученном материале большим количеством измененных нейронов у животных, подвергавшихся облучению протонами. В этой связи отсутствие нарушений микроциркуляторного русла в коре большого головного мозга облученных животных, получавших “Семакс”, а также меньшее количество измененных нейронов указывает на эффективное положительное действие “Семакса” на гемодинамику головного мозга, на его противолучевой эффект.
ОБСУЖДЕНИЕ
Полученные данные свидетельствуют о положительном влиянии нейропептида “Семакс” на показатели поведенческой исследовательской реакции и силу скелетной мускулатуры у мышей при действии протонов высоких энергий. Следует заметить, что экспериментальных исследований о влиянии использованного препарата на неврологический статус животных при действии ионизирующей радиации мы не встретили. Однако на позитивное влияние препарата при радиационном воздействии указывают данные клинических исследований. Эти результаты свидетельствуют о положительном эффекте нейропептида при разных сценариях лучевого воздействия на организм. Использование “Семакса” в составе комплексной терапии пожилых пациентов, имевших в отдаленном анамнезе (нескольких лет) контакт с ионизирующим излучением, вызывало благоприятный нейрофизиологический эффект. На фоне проведения комплексной терапии и приема “Семакса” у группы лиц, спустя 7 лет после участия в ликвидации последствий аварии на Чернобыльской АЭС, отмечены исчезновение вялости, снижение психической и физической утомляемости, улучшение настроения, внимания, памяти, умственной работоспособности [14]. Положительное действие “Семакса” на гемодинамику головного мозга, работу сердца, умственную работоспособность и другие показатели психофизиологического статуса отмечено при реабилитации ветеранов подразделений особого риска через 20–40 лет после участия в ликвидации радиационных аварий [8]. В составе комплексной терапии “Семакс” оказал позитивный эффект в отношении психического здоровья представителей населения через 35 лет после облучения на р. Теча и Восточно-Уральском радиоактивном следе [22]. “Семакс” в составе различных фармакологических композиций повышает устойчивость к гипоксии, обладает нейропротекторной и антиамнестической активностью и повышает физическую работоспособность экспериментальных животных при однократном внутрибрюшинном введении [23].
Статистически значимых различий по показателям иммуногематологического статуса между группами животных, с введением препарата “Семакс” и группой животных, которым не вводился препарат, отмечено не было. Это позволяет сделать вывод о том, что применение препарата не отягощало тяжести лучевого поражения.
Анализируя полученные результаты по изучению морфологических изменений головного мозга животных, можно прийти к заключению о том, что действие препарата “Семакс” менее выражено в мозжечке, чем в коре головного мозга, и наблюдаемое снижение повреждающего действия радиации связано с положительным действием “Семакса” на стенки капилляров сосудов мозга, что отражается в наблюдаемых компенсаторно-приспособительных реакциях нервных клеток.
Таким образом, полученные данные в эксперименте позволяют сделать вывод о том, что использованный нейропептид оказывает благоприятное влияние на реализацию высших интегративных функций ЦНС у грызунов при действии ускоренных заряженных частиц – протонов высоких энергий. Это свойство было нами запатентовано [24]. Полученные результаты дают основания для дальнейшего изучения влияния данного препарата на поведенческие и когнитивные реакции животных при действии более тяжелых заряженных частиц, например, ионов углерода. Наряду с этим можно считать перспективными исследования других фармакохимических средств для купирования негативного влияния ускоренных тяжелых ионов на структуры и функции центральной нервной системы. Необходимость такого рода исследований обусловлена важными практическими задачами, стоящими перед космической радиобиологией, радиационной медициной, такие работы планируются нами в дальнейшем.
Список литературы
Мартиросов К.С., Зорин В. В. Средства профилактики и лечения диспептических проявлений первичной реакции на облучение // Радиационная медицина. В 4 т. Т 1. Теоретические основы радиационной медицины. М., 2004. С. 761–787.
Бушманов А. Ю., Торубаров Ф. С. Неврологические аспекты радиационных поражений // Радиационная медицина. В 4 т. Т. 2. М., 2004. С. 126–129.
Котеров А.Н. Малые дозы ионизирующей радиации: подходы к определению диапазона и основные радиобиологические эффекты // Радиационная медицина. В 4 т. Т 1. Теоретические основы радиационной медицины. М., 2004. С. 871–925.
Григорьев А.И., Красавин Е.А., Островский М.А. К вопросу о радиационном барьере при пилотируемых межпланетных полетах // Вестн. РАН. 2017. Т. 87. № 1. С. 65–69.
Григорьев Ю.Г., Шафиркин А.В., Ушаков И.Б. и др. Космическая радиобиология за 55 лет (к 50-летию ГНЦ PФ-ИМБП РАН) / РАН, Ин-т медико-биологических проблем и др. М.: Экономика, 2013. 303 с.
Rabin B.M., Joseph J.A., Shukitt-Hale B. Heavy particle irradiation, neurochemistry and behavior: threshold, dose-response curves and recovery function // Adv. Space Res. 2004. № 33. P. 1330–1333.
Britten R.A., Davis L.K., Johnson A.M. et al. Low (2 cGy) doses of 1 GeV/u 56Fe-particle radiation loads to a persistant reduction in the spatial learning ability of rats // Radiat. Res. 2012. № 177. P. 146–151.
Parihar V.K., Allen B., Tran K.K. et al. What happens to your brain on the way to Mars // Sci. Adv. 1 May 2015. V. 1. № 4. e1400256.
Kiffer F., Howe A.K., Carr H., Wang J. et al. Late effects of 1H irradiation on hippocampal physiology // Life Sci. Space Res. 2018. T. 17. P. 51–62.
Штемберг А.С., Базян А.С., Лебедева-Георгиевская К.Б. и др. Влияние облучения протонами высокой энергии на поведение крыс: нейрохимические механизмы // Авиакосм. и экол. медицина. 2013. Т. 47. № 6. С. 54-60.
Беляева А.Г., Штемберг А.С., Носовский А.М. и др. Воздействие высокоэнергетических протонов и ионов углерода 12С на когнитивные функции обезьян и содержание моноаминов и их метаболитов в периферической крови // Нейрохимия. 2017. Т. 34. № 1. С. 1–9.
Штемберг А.С., Кохан В.С., Кудрин В.С. и др. Воздействие высокоэнергетических протонов в пике Брэгга на поведение крыс и обмен моноаминов в некоторых структурах мозга // Нейрохимия. 2015. Т. 32. №. 1. С. 78–85.
Регистр лекарственных средств России 2000–2016. Семакс раствор 0,1%. Инструкция по применению, противопоказания и состав. URL. https://www.rlsnet.ru/tn_index_id_11684.htm (дата обращения 14.09.2018).
Андреева Л.А., Ашмарин И.П. Ноотропное средство и фармацевтическая композиция ноотропного действия: Патент РФ №2045958.
Ляхова К.Н., Иванов А.А., Молоканов А.Г. и др. Влияние нейропептида “Семакс” на показатели поведенческой исследовательской реакции и силу скелетной мускулатуры мышей, облученных протонами // Авиакосм. и экол. медицина. 2018. Т. 52. № 4. С. 71–76.
Ляхова К.Н., Колесникова И.А., Северюхин Ю.С. и др. Доклиническое изучение нейропептида “Семакс” при лучевой патологии // Проблемы химической защиты и репарации при радиационных воздействиях. М., 2018. С. 99–101.
Буреш Я., Бурешова О., Хьюстон Дж.П. Методики и основные эксперименты по изучению мозга и поведения. М.: Наука, 1992. С. 159–245.
Mantz J.M. Method for the quantitative examination of the bone marrow of white rats // C. R. Seances Soc. Biol. Fil. 1957. V. 151. № 11. P. 1957–1960.
Меркулов Г.А. Курс патологогистологической техники / Г.А. Меркулов. Л: Медгиз, 1961. С. 162–165.
Федоренко Б.С. Радиобиологические эффекты корпускулярных излучений // Радиационная безопасность космических полетов. 2006. С. 112–115.
Ильичева В.Н. Сравнительная характеристика влияния малых доз ионизирующего излучения на проницаемость микрососудов различных зон коры головного мозга // Вестн. новых мед. технологий. 2011. Т. 18. Вып. № 2. С. 251–253.
Пучкова Е.И., Алишев Н.В. Исследование лечебных свойств препарата “Семакс” при реабилитации ветеранов подразделений особого риска // Успехи геронтологии. 2012. Т. 25. № 3. С. 525–530.
Бухарин В.А., Цветков С.А., Таймазов А.В., Готовцев И.И. Повышение уровня умственной и физической работоспособности единоборцев путем корреспондирования методик коррекции // Ученые записки ун-та им. П.Ф. Лесгафта. 2012. № 2 (84). С. 154–159.
Иванов А.А., Красавин Е.А., Ляхова К.Н. и др. Способ профилактики нарушений психоневрологического статуса при острой лучевой болезни в эксперименте: Патент РФ № 2638270.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


