Радиационная биология. Радиоэкология, 2019, T. 59, № 2, стр. 183-190
ЭТАНОЛ КАК ВОЗМОЖНЫЙ МОДИФИКАТОР ОСТРОГО РАДИАЦИОННОГО ПОРАЖЕНИЯ МОЗГА
В. П. Фёдоров 1, *, И. Б. Ушаков 1, 2, Г. А. Шальнова 1
1 Государственный научный центр – Федеральный медицинский биофизический центр им. А.И. Бурназяна ФМБА России
Москва, Россия
2 Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России
Санкт-Петербург, Россия
* E-mail: fedor.vp@mail.ru
Поступила в редакцию 07.07.2018
Аннотация
В экспериментах на крысах, подвергшихся γ-облучению головы в церебральных дозах с предшествующим или последующим введением различных доз этанола, изучены церебральные эффекты. Показано, что оба фактора вызывают сходные изменения неврологической симптоматики и нейроморфологических эффектов. Этанол до облучения существенно не модифицировал состояние нейронов, но вызывал появление синапсов, дегенерирующих по филаментарному типу. После облучения этанол в пороговой дозе не изменял, а в транквилизирующей дозе несколько усиливал радиационные изменения нейронов и синапсов. Эффекты модификации радиационного поражения головного мозга зависели от дозы этанола и времени его введения.
В научной и художественной литературе активно поддерживается мнение о радиозащитном действии алкоголя [1, 2]. Данный факт не вызвал сомнений и у профессионалов-радиобиологов (многие из них принимали непосредственное участие в ликвидации последствий аварии на Чернобыльской АЭС) на пленуме Научного совета РАН по радиобиологии в 2016 г., посвященном 30-летию аварии на Чернобыльской АЭС – “30 лет аварии на Чернобыльской АЭС – итоги и прогнозы”. Предполагается, что кроме радиационного фактора, на здоровье ликвидаторов влияли и другие, среди которых не последнее место занимал алкоголь. Так, 93% опрошенных ликвидаторов последствий аварии на ЧАЭС употребляют спиртные напитки и 20% ликвидаторов за последние 2–3 года стали делать это чаще [2, 3]. Cреди ликвидаторов возросло количество наркологических заболеваний, превышая на 20% аналогичный показатель в контрольной группе [4]. Анализ дозовой зависимости этого подкласса психических расстройств с использованием статистических моделей показал, что риск развития наркологических заболеваний, рассчитанный для всей когорты ликвидаторов, статистически значим. Вместе с тем у ликвидаторов 1986-го года, составляющих группу с более высокой дозой облучения, не отмечено достоверного различия в величине радиационного риска по этому классу заболеваний по сравнению со всей изученной когортой. К тому же противники использования алкоголя при радиационных воздействиях, к сожалению, не приводят серьезных научных обоснований [5, 6].
Несмотря на принятие различных запретительных мер, алкоголь издавна является непременным спутником военных конфликтов [7]. Осведомленность о фармакологической активности этанола в плане “коррекции” психоэмоционального статуса, а также доступность препарата позволяют предположить, что частота его применения при чрезвычайных ситуациях будет только возрастать. Ведь “пошло это еще с первых лет ядерного штурма, когда никаких других протекторов медицина не знала. Да так и вошло в привычку” [1]. Не стали исключением в этом плане и радиационные аварии (Красное Сормово, 1970; бухта Чажма, 1985; Чернобыльская АЭС, 1986 и др.) [9]. В то же время А.К. Гуськова [3] cчитает, что при анализе радиационных эффектов надо оценивать вклад обычных факторов риска развития патологии нервной системы и особенно злоупотребления ликвидаторами алкоголем, ухода в болезнь, низкой социальной активности и распространенности ложных рентных притязаний. Подробно проблема радиации и алкоголя обсуждена в одноименной монографии [1].
Довольно интересные данные встречаются и в зарубежной литературе. Так, установлено, что применение алкоголя или пива перед рентгеновским облучением увеличивает продолжительность жизни облученных самцов комаров [9]. Полиэтиленгликоль с молекулярной массой 400 обладает радиопротекторным свойством по показателям ректальной температуры и тремору мышей при облучении в дозе ЛД50/30 головы и шеи с коэффициентом от 1.14 до 1.24, а при общем облучении – 1.12 [10]. Приводятся также данные о защите этанолом кожи от ультрафиолетового В-индуцированного фотостарения [11]. Показано, что этиловый экстракт арахиса является эффективным цитопротекторным агентом против B-индуцированного окислительного стресса из-за активации антиоксидантной системы и детоксикации ферментов в коже [12]. В экспериментах на мышах установлено, что лечение УФ-излучением в сочетании с двумя химическими веществами алкоголем и алоэ, не считающимися канцерогенными, приводит к более широкому распределению мутаций в критическом гене-супрессоре опухоли кожи [13]. В то же время отмечен эффект синергизма при использовании этанола и УФ-излучения для снижения уровня отдельных патогенных бактерий пищевого происхождения [14] и при стерилизации аллотрансплантантов сухожилий [15]. Более того, у онкологических больных алкоголь способствовал возникновению радиационных осложнений [16]. При этом риск рака печени у собак, получавших этанол, был в 3 раза выше, чем у неалкогольных когорт животных, хотя время удержания радионуклидов в ткани печени уменьшалось [17].
На основании вышеизложенного и с учетом практически полного отсутствия сведений о нейроморфологическом эквиваленте влияния этанола и ионизирующего излучения (как при изолированном, так и комбинированном действии) на поведение и работоспособность человека и животных сформулирована цель данного исследования – анализ модифицирующего влияния алкоголя на нейроморфологические показатели облученного головного мозга.
МАТЕРИАЛЫ И МЕТОДИКА
Эксперимент проведен на 120 белых крысах-самцах линии Вистар массой 250–270 г, которых облучали в направлении голова–хвост γ-квантами от источника 60Со в дозах 50, 87.5 и 200 Гр при мощности дозы облучения 6.7 сГр/с. За 2 и 15 мин до или после облучения крысам внутрибрюшинно вводили 15%-ный раствор этанола из расчета 0.28, 0.56 и 2.25 г/кг массы. Дозы были выбраны как “крайние” (пороговая и транквилизирующая) по механизму действия на ЦНС [18], а также по примерной эквивалентности алкогольных и лучевых изменений поведенческих реакций (1.5 г/кг) и неврологического статуса (2.25 г/кг). Экстраполяция с “выходом” на данные величины доз проведена на основании предварительных экспериментов на крысах, а также результатов совместной аппроксимации данных по выполнению компенсаторного слежения операторами-добровольцами и приматами соответственно при дозах этанола 0.5–2 г/кг и облучения 25–100 Гр [1].
Объектом исследования служили лобная кора (поле FPa), гиппокамп (поле А4) и хвостатое ядро. Материал забирали через 1.7 ч после воздействия. Гидратационный профиль мозга оценивали путем определения содержания воды методом высушивания. Кусочки головного мозга фиксировали в растворе Бекера и пропаноле, обезвоживали и заливали в парафин. Обзорные срезы окрашивали по Нисслю и гематоксилин-эозином. При исследовании оценивали структурно-функциональную перестройку нейронов по морфометрическим и тинкториальным показателям. Среди нейронов подсчитывали процент клеток с функциональными (нормо-, гипо- и гиперхромные) и деструктивными (клеточные тени и пикноморфные нейроны) изменениями. Морфометрию нервных клеток (площадь сечения цитоплазмы, ядра, ядрышка) проводили при помощи компьютерного комплекса анализаторов изображений с использованием программы “Image J” 36 b Wayne Rosband (National Institutes of Health, США). Анализу подлежали нейроны, срез которых прошел через их ядро и ядрышко. Вычисляли ядерно-цитоплазматический и ядрышко-ядерные индексы (ЯЦ индекс, ЯЯ индекс). Количество нейронов у одного животного (n = 6), необходимых для определения нейроморфологических показателей, определяемое методом аккумулированных средних, составило от 250 до 500. В итоге рассматриваемые параметры имеют распределения, близкие к нормальным, так как среднее арифметическое, геометрическое и гармоническое значения незначительно отличаются друг от друга, а также от моды и медианы; минимальные и максимальные значения примерно равноудалены от среднего значения и стандартизированные коэффициенты асимметрии и эксцесса по абсолютной величине меньше 2. При незначительном коэффициенте вариации показателей в данном случае возможно использование параметрических методов обработки результатов. Полученные данные сопоставляли с данными проверки гипотезы о различии средних для двух выборок по t-критерию Вилкоксона. В итоге данные непараметрического анализа подтвердили целесообразность использования параметрического метода. При этом стандартное отклонение позволило более точно определять различия средних значений. Описательную статистику с вычислением средних значений и доверительные интервалы осуществляли с помощью пакетов программ Statistica 6.1.
Для ультраструктурных исследований материал фиксировали методом инфильтрации в 2.5%-ном растворе глутаральдегида на 0.2 моль/л коллидиновом буфере, обеспечивающем быстрое проникновение фиксатора в вещество мозга, постфиксировали в 1%-ном растворе осмиевой кислоты на том же буфере, обезвоживали в этаноле и заливали в эпон-812. Ультратонкие срезы получали на ультратоме LKB-III (Швеция), контрастировали цитратом свинца и исследовали в электронном микроскопе IEM-100 CX-II (Япония). Подсчитывали общее количество синапсов, расположенных на шипиках дендритов, и среди них определяли процент неизмененных, с функциональными и деструктивными изменениями.
Каждой группе соответствовал адекватный возрастной контроль. Протокол эксперимента в разделах выбора, содержания животных и выведения их из опыта был составлен в соответствии с принципами биоэтики и правилами лабораторной практики (Приказ МЗ РФ № 267 от 19.06.2003 г. “Об утверждении правил лабораторной практики”).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее установлено, что оба фактора (облучение и этанол) вызывают при изолированном действии сходные по выраженности и временнóй динамике неврологические изменения и полное их симптоматическое подобие [1, 19]. Неврологической симптоматике соответствует комплекс типовых неспецифических структурно-функциональных изменений, заключающихся в изменении соотношения различных типов нейронов (нормо-, гипо- и гиперхромные, а также пикноморфные и клеточные тени) у экспериментальных животных, отражающих их различное функциональное состояние (покой, возбуждение, торможение, гибель), а также выраженность функциональных и деструктивных проявлений с изменениями объемов тела, ядра, ядрышка нейронов и их соотношений (табл. 1).
Таблица 1.
Взаимосвязь между действием этанола (2.25 г/кг) и γ-облучением в дозе 87.5 Гр на нейроны сенсомоторной коры (линейные коэффициенты корреляции Пирсона r ± m)
| Показатели состояния нейронов | Типы нейронов | ||||
|---|---|---|---|---|---|
| нормохромные | гипохромные | гиперхромные | пикноморфные | клеточные тени | |
| Линейные коэффициенты корреляции Пирсона (r ± m) | |||||
| Нейронов на площади | 0.99 ± 0.001* | 0.67 ± 0.19* | 0.98 ± 0.013* | 0.97 ± 0.018* | 0.90 ± 0.065* |
| Объем нейронов | 0.99 ± 0.006* | 0.92 ± 0.056* | 0.34 ± 0.031 | 0.31 ± 0.032 | 0.40 ± 0.298 |
| Объем ядер | 0.99 ± 0.0048* | 0.97 ± 0.02* | 0.81 ± 0.119* | ||
| Объем ядрышек | 0.99 ± 0.004* | 0.99 ± 0.0002* | 0.24 ± 0.0332 | ||
| Ядерно-клеточный индекс | 0.08 ± 0.035 | 0.78 ± 0.137* | 0.34 ± 0.031 | ||
| Ядерно-цитоплазматический индекс | 0.04 ± 0.354 | 0.97 ± 0.024* | 0.16 ± 0.034 | ||
| Ядрышко-ядерный индекс | 0.27 ± 0.033 | 0.19 ± 0.034 | 0.74 ± 0.158* | ||
Из данных таблицы следует, что влияние из-учаемых факторов на количество нейронов и их распределение по типам имеют положительные корреляционные связи высокой степени и только для нейронов с повышенной функциональной активностью (гипохромные) средней степени (r = = 0.67). Положительная зависимость высокой силы установлена и для размеров нормо- и гипохромных нейронов (коэффициенты корреляции равны 0.99 и 0.92). Для размеров гиперхромных и пикноморфных нейронов, а также клеточных теней связь положительная, но средней степени. Действие этанола и γ-облучения на размеры ядра и ядрышка имело высокое сходство для всех нейронов, находящихся в состоянии функциональной нормы (нормо-, гипо- и гиперхромные), только у гиперхромных клеток связь для ядрышек была слабо положительной (r = 0.24). Корреляционная зависимость между значениями ядерно-клеточного индекса у всех типов нейронов положительная, но высокая степень связи наблюдалась только у гипохромных нейронов (r = 0.78). Гиперхромные нейроны показали среднюю степень сходства изучаемых факторов (r = 0.34), а у нормохромных нейронов выявлено крайне слабое сходство динамики показателя (r = 0.08). Что касается сходства изменений ядерно-цитоплазматического индекса при действии изучаемых факторов, то для нормо- и гиперхромных нейронов связь была слабо положительной (r = 0.04 и r = 0.16 соответственно) и только для гипохромных нейронов значение коэффициента корреляции соответствовало максимальному (r = 0.97). Показатели ядрышко-ядерного индекса имели высокое сходство только у гиперхромных нейронов (r = 0.74), а для нормо- и гипохромных нервных клеток связь была слабо положительной и коэффициенты корреляции составляли 0.27 и 0.19 соответственно.
Учитывая, что исследованные показатели состояния нейронов лобной коры при воздействии этанола и γ-облучения имеют положительные связи, причем большинство высокой и средней степени, можно говорить о достаточно выраженном сходстве действия этанола и ионизирующего излучения в изученных дозах на нейроны коры головного мозга. При этом ультраструктурная картина состояния органоидов и мембранных структур цитоплазмы нейронов свидетельствует о том, что в основе действия изучаемых факторов лежит гипоксия как типовой нейропатологический процесс. Наибольшая схожесть нейроморфологических эффектов действия алкоголя и радиации получена по динамике изменений синапсов, когда синхронно проявляются их изменения по светлому, темному и очаговому типу (табл. 2).
Таблица 2.
Изменения аксошипиковых синапсов лобной коры (в % от общего количества) при раздельном и комбинированном действии алкоголя и γ-облучения
| Группа животных | Реактивные изменения синапсов | Деструктивные изменения синапсов | Типы деструктивных изменений | |||
|---|---|---|---|---|---|---|
| очаговый | светлый | темный | филаментар-ный | |||
| 1. Контроль | 15(10–21) | 5(3–9) | 22(3–53) | 67(35–92) | 11(0–38) | – |
| 2. Этанол (0.28 г/кг) | 30(23–37) [1] | 22(16–28) [1] | 19(8–34) | 59(42–74) | 22(10–37) | – |
| 3. Этанол (2.25 г/кг) | 32(24–39) [1] | 31(24–38) [1] | 21(11–34) | 58(43–71) | 21(11–34) | – |
| 4. Облучение головы (50 Гр) | 36(29–44) [1] | 24(17–31) [1] | 40(26–56) | 41(26–56) | 19(9–32) | – |
| 5. Этанол (0.28 г/кг) + + облучение головы | 34(26–42) [1] | 29(22–36) [1] | 50(35–65) | 25(13–39) [1] | 25(13–39) | – |
| 6. Этанол (2.25 г/кг + облучение головы) | 35(28–43) [1] | 28(21–35) [1] | 41(27–56) | 50(35–65) | 9(2–19)* [1] | |
| 7. Облучение головы + + этанол (0.28 г/кг) | 37(26–49) [1] | 25(15–36) [1] | 31(12–55) | 50(26–74) | 19(4–41) | – |
| 8. Облучение головы + + этанол (2.25 г/кг) | 43(35–51) [1–3] | 26(20–33) | 34(21–49) | 49(34–64) | 17(7–30) | – |
Из приведенных в таблице данных видно, что у животных контрольной группы почти 15% межнейрональных контактов имеют различные функциональные изменения в виде набухания аксональной части синапсов, изменения количества, формы, осмиофилии и расположения везикул. По современным представлениям, такие изменения синапсов носят характер функционального напряжения и могут быть обратимыми [20]. Наряду с этим около 6% контактов аксонных терминалей с шипиками дендритов имеют изменения деструктивного характера. В основном, дегенерация происходит по светлому типу: аксональная часть синапса набухшая, просветлена, с уменьшенным количеством везикул, а оставшиеся везикулы располагаются неравномерно и могут “склеиваться” вблизи пресинаптической мембраны или в центре терминали. Наблюдаются изменения и в постсинаптическом отделе в виде набухания шипикового аппарата и появления здесь осмиофильных включений. Вокруг таких синапсов заметна гипертрофия астроцитарных отростков. Наличие измененных синапсов у интактных животных свидетельствует о широкой вариабельности их функциональной нормы. Высокая лабильность присуща в основном синапсам, локализованным на шипиках дендритов, в то время как аксосоматические синапсы имеют более постоянную ультраструктурную организацию, что надо учитывать при анализе результатов экспериментальных воздействий.
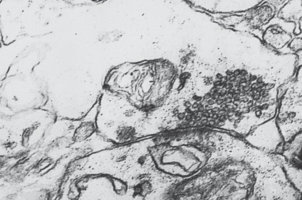
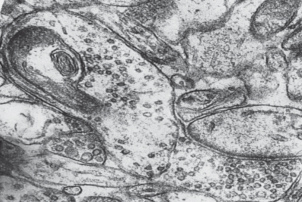
При γ-облучении крыс в дозах от 50 до 200 Гр состояние синапсов без значимой дозовой зависимости можно охарактеризовать как крайнюю степень функционального напряжения. При этом 39.8% межнейрональных контактов лобной коры не изменено. В то же время выявляются разнообразные изменения как аксодендритическпх, так и аксосоматичееких синапсов, а самой лабильной структурой является пресинаптическая терминаль. На втором месте по частоте изменений стоят синаптические пузырьки. Наблюдается изменение не только количества везикул, но и их размеров, формы, осмиофилии и расположения. Нередко можно наблюдать “склеивание” везикул на пресинаптической мембране или в центре терминали. Количество везикул в синапсах колеблется от единичных до массового заполнения пресинаптического отдела. В последнем случае наблюдается полоса просветления между везикулами и активными участками пресинаптической мембраны, что свидетельствует о блокаде синаптической передачи [20]. Весьма лабильной структурой является шипиковый аппарат. Нередко он набухает и распадается, а на его месте появляются осмиофильные включения в виде гранул или хлопьевидного материала. Постоянно встречаются синапсы с деструктивными изменениями (см. табл. 2). При этом аксональная терминаль просветлена, имеет небольшое количество везикул, а пресинаптическая мембрана утрачивает четкие контуры (рис. 1).
Встречается также очаговая дегенерация и в более редких случаях – дегенерация синапсов по темному типу. Из всего многообразия межнейрональных контактов наиболее лабильными являются синапсы, расположенные на шипиках дендритов. Аналогичные изменения межнейрональных связей в головном мозге при действии ионизирующего излучения представлены и в работе [21]. Изменения синапсов при введении этанола являются однотипными с их изменениями при облучении (см. табл. 2). Все изменения неспецифичны, так как встречаются и при других воздействиях, а также в процессе адаптивных перестроек нейронов [13–15]. Выраженность изменений синапсов под влиянием этанола (2.25 г/кг) примерно такая же, как и при облучении головы в дозе 50 Гр, но больше поражается шипиковый аппарат (рис. 2).
Рис. 2.
Блокада синаптической щели осмиофильным материалом, дезорганизация и распад шипикового аппарата после введения этанола в дозе 2.25 г/кг. ×80 000.
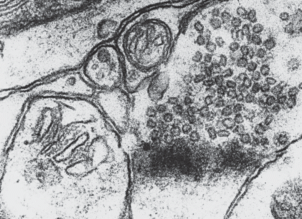
Изменения синапсов при введении этанола являются однотипными с их изменениями при облучении (см. табл. 2). Все изменения неспецифичны, так как встречаются и при других воздействиях, а также в процессе адаптивных перестроек нейронов [13–15]. Выраженность изменений синапсов под влиянием этанола (2.25 г/кг) примерно такая же, как и при облучении головы в дозе 50 Гр, но больше поражается шипиковый аппарат (см. рис. 2). Подобное явление весьма неблагоприятно, так как шипиковому аппарату, наряду с синаптическими мембранами, придается важное значение в процессах восприятия, формирования временных связей и энграммы памяти.
В связи с изменениями в шипиковом аппарате появляются структурно-функциональные предпосылки девиантного поведения индивидуума.
Довольно типичной для действия изучаемых факторов является реакция везикул. Наблюдается изменение не только их количества, но и расположения, размеров, формы и осмиофилии (рис. 3).
Рис. 3.
Полиморфное состояние синаптических везикул в пресинаптическом отделе аксошипикового синапса сенсомоторной коры. ×80 000.
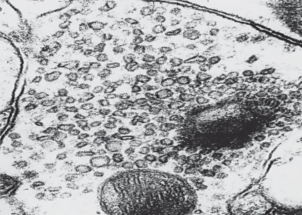
Подобное явление имеет принципиальное значение, так как ряд авторов связывают эти критерии везикул с функцией синапсов и наличием определенного медиатора [20]. Эффекты комбинированного действия изучаемых факторов зависели от последовательности их воздействия, дозы и времени введения этанола. Так, применение этанола до γ-облучения головы существенно не модифицировало радиационные изменения синапсов, но вызывало появление синапсов, дегенерирующих по филаментарному типу (рис. 4). Подобное явление в других экспериментальных группах не встречалось. Этанол в дозе 0.28 г/кг после облучения не оказывал влияния на радиационные изменения синапсов.
Рис. 4.
Дегенерация синапса сенсомоторной коры по филаментарному типу при введении этанола в дозе 2.25 г/кг перед облучением в дозе 50 Гр. ×100 000.
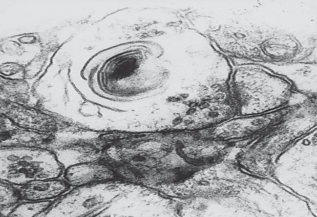
При действии больших доз алкоголя (2.25 г/кг) наблюдалось некоторое усиление эффектов ионизирующего излучения: при сохранении числа измененных синапсов в них отмечаются более выраженные изменения. При анализе суммарной частоты функциональных и деструктивных изменений установлено, что этот показатель достоверно выше, чем в группе облучения (по методу φ). В 67% случаев наблюдался распад митохондрий в пресинаптичеких отделах, а в других группах не более чем в 11%. Деструкция митохондрий происходит, видимо, быстро, так как один их полюс выглядит набухшим, а второй сохраняет плотно упакованные кристы. Типичным является изменение внутренней мембраны митохондрий, которая закручивается в миелиноподобные мембранные комплексы (рис. 5). Такое состояние митохондрий может привести к существенному нарушению процесса выработки энергии и затруднению функции синапсов.
Рис. 5.
Распад митохондрии в пресинаптическом отделе синапса сенсомоторной коры при введении этанола в дозе 2.25 г/кг после облучения в дозе 50 Гр. ×64 000.
Интересно отметить, что этанол вызывает и определенный “провоцирующий” эффект отека-набухания (табл. 3).
Таблица 3.
Изменения гидратационного профиля мозга крыс при раздельном и комбинированном действии этанола и облучения в дозе 50 Гр
| Группы животных | Гидратация различных структур мозга, % | ||
|---|---|---|---|
| лобные доли | ствол мозга | мозжечок | |
| Контроль | 79.57 ± 0.19 | 73.28 ± 0.25 | 77.91 ± 0.32 |
| Этанол (0.28 г/кг) | 79.43 ± 0.50' | 73.71 ± 0.50 | 77.98 ± 0.32 |
| Этанол (2.25 г/кг) | 79.67 ± 0.32 | 74.37 ± 0.50* | 78.50 ± 0.23 |
| Облучение головы | 79.15 ± 0.12 | 73.41 ± 0.58 | 77.75 ± 0.28 |
| Этанол (0.28 г/кг) + облучение головы | 79.56 ± 0.20 | 73.88 ± 0.56 | 77.70 ± 0.28 |
| Этанол (2.25 г/кг) + облучение головы | 79.56 ± 0.33 | 73.07 ± 0.48 | 77.90 ± 0.43 |
| Облучение головы + этанол (0.28 г/кг) | 79.35 ± 0.25 | 73.92 ± 0.30* | 78.28 ± 0.32 |
| Облучение головы + этанол (2.25 г/кг) | 80.66 ± 0.60* | 74.73 ± 0.31* | 79.28 ± 0.88* |
Очевидно, что минимальная концентрация этанола сама не вызывает сдвигов в гидратационном профиле, но при действии после облучения обусловливает отек ствола мозга. Концентрация этанола 2.25 г/кг уже сама по себе приводила к гипергидратации ствола, а после облучения отек выявляется во всех изученных отделах мозга. Увеличение содержания воды в мозге хорошо коррелирует с выявляющимся при ультраструктурном исследовании мозга набуханием синапсов и нейропиля.
Таким образом, в действии этанола и γ-облучения на структурно-функциональное состояние нейронов головного мозга крыс наблюдается определенное сходство, а при комбинированном последовательном действии этих факторов отмечается как синергизм, так и по некоторым показателям антагонизм. В целом этанол усиливает частоту и выраженность неврологической симптоматики при остром радиационном поражении головного мозга и вызывает большие структурные изменения синапсов, связанные, по-видимому, с нарушением энергообеспечения и гипергидратацией, особенно при его введении после облучения. В связи с этим этанол по его механизму действия, ближайшим и отдаленным последствиям не может служить надежным профилактическим или лечебным противорадиационным средством. Особенно это относится к операторам, находящимся на дежурстве с риском радиационного воздействия.
Список литературы
Ушаков И.Б., Лапаев В.Э., Воронцова З.А., Должанов А.Я. Алкоголь и радиация (очерки радиационной наркологии или алкогольный Чернобыль). Воронеж: Изд-во “Истоки”, 1998. 248 с.
Федоров В.П., Ушаков И.Б., Федоров Н.В. Церебральные эффекты у ликвидаторов Чернобыльской аварии. Саарбрюккен: LAP LAMBERT Academic Publishing, 2016. 390 с.
Гуськова А.К. Радиация и мозг человека // Мед. радиология и радиац. безопасность. 2001. Т. 46. № 5. С. 47–55.
Ляско Л.И., Артамонова Ю.З. Ликвидаторы чернобыльской катастрофы: патофизиология медицинских последствий // Медицинские радиологические последствия Чернобыля: прогноз и фактические данные спустя 30 лет // Тез. Междунар. науч.-практ. конф. Обнинск: МРНЦ им. А.Ф. Цыба, 2016. С. 82.
Пострелко В., Черный А. Чернобыльская катастрофа и алкоголь: клиника, эпидемиология и лечение. Саарбрюккен: LAP LAMBERT Academic Publi-shing, 2013. 75 с.
Енуков М.В. Выведение радиации из организма: последние исследования // Мат. междунар. науч.-практ. Конф. “Чернобыль – 30 лет”, посвященной 30-летию со дня катастрофы на Чернобыльской АЭС. М.: Академия ГПС МЧС России, 2016. С. 95–100.
Сидоров П.И., Лукманов М.Ф. Особенности пограничных психических расстройств у ветеранов войны в Афганистане // Журн. неврологии и психиатрии им. С.С. Корсакова. 1997. Т. 97. № 3. С. 20–25.
Мастрюков А.А., Федоров В.П. Ядерная катастрофа века. Воронеж: Науч. книга, 2016. 404 с.
Rodriguez S.D., Brar R.K., Drake L.L., Drumm H.E. The effect of the radio-protective agents’ ethanol. trimethylglycine. and beer on survival of X-ray-steri-lized male Aedes aegypti // Parasit Vectors. 2013. V. 18. № 6. P. 211–216.
Shaeffer J., Schellenberg K.A., Seymore C.H. et al. Radioprotective effect of polyethylene glycol // Radiat. Res. 1986. V. 107. № 1. P. 125–135.
Ham S.A., Hwang J.S., Kang E.S., Yoo T. Ethanol extract of Dalbergia odorifera protects skin keratinocytes against ultraviolet B-induced photoaging by suppres-sing production of reactive oxygen species // Biosci. Biotechnol. Biochem. 2015. V. 79. № 5. P. 760–770.
Choi J.Y., Choi D.I., Lee J.B., Yun S.J. Ethanol extract of peanut sprout induces Nrf2 activation and expression of antioxidant and detoxifying enzymes in human dermal fibroblasts: implication for its protection against UVB-irradiated oxidative stress // Photochem. Photobiol. 2013. V. 89. № 2. P. 453–460.
Badgwell D.B., Walker C.M., Baker W.T., Strickland F.M. Ethanol and aloe emodin alter the p53 mutational spectrum in ultraviolet radiation-induced murine skin tumors // Mol. Carcinog. 2004. V. 39. № 3. P. 127–138.
Ha J.H., Ha S.D. Synergistic effects of ethanol and UV radiation to reduce levels of selected foodborne pathogenic bacteria // J. Food Prot. 2010. V. 73. № 3. P. 556–561.
Zhou M., Zhang N., Liu X. et al. Tendon allograft sterilized by peracetic acid/ethanol combined with gamma irradiation // J. Orthop. Sci. 2014. V. 19. № 4. P. 627–636.
Matthews R.H., Kadoch C., Ercal N. Alcohol as a potential contributing factor in radiation complications // Clin. Adv. Hematol. Oncol. 2009. V. 7. № 4. P. 257–262.
Shiina S., Teratani T., Obi S., Hamamura K. Nonsurgical treatment of hepatocellular carcinoma: from percutaneous ethanol injection therapy and percutaneous microwave coagulation therapy to radiofrequency ablation // Oncology. 2002. V. 62. № l. P. 64–68.
Буров Ю.В., Ведерников Н.Н. Нейрохимия и фармакология алкоголизма. М.: Медицина, 1985. 240 с.
Ушаков И.Б., Федоров В.П. Ранние изменения интегративных систем головного мозга крыс при сочетанном действии этанола. и гамма-облучения // Мед. радиология. 1988. Т. 33. № 10. С. 50–56.
Ушаков И.Б., Федоров В.П., Саурина О.С. Радиационные морфофункциональные эффекты мозга. Воронеж: Науч. книга, 2010. 287 с.
Parihar V.K., Allen B., Tran K.K. et al. What happens to your brain on the way to Mars. Sci. Adv. 2015. V. 1. P. e1400256.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология