Радиационная биология. Радиоэкология, 2019, T. 59, № 2, стр. 177-182
РОЛЬ ПРОЦЕССОВ ПОСТЛУЧЕВОГО ВОССТАНОВЛЕНИЯ В РЕАЛИЗАЦИИ ПРОТИВОЛУЧЕВЫХ ЭФФЕКТОВ РАДИОПРОТЕКТОРОВ НА КЛЕТОЧНОМ И ОРГАНИЗМЕННОМ УРОВНЕ
М. В. Филимонова, Е. С. Евстратова, В. М. Макарчук, Л. И. Шевченко, А. С. Филимонов, В. Г. Петин *
Медицинский радиологический научный центр им. А.Ф. Цыба – филиал ФГБУ “Национальный медицинский исследовательский центр радиологии” Минздрава России
Обнинск, Россия
* E-mail: vgpetin@yahoo.com
Поступила в редакцию 30.07.2018
Аннотация
Для диплоидных дрожжевых клеток S. cerevisiae продемонстрирована корреляция эффективности радиозащитного действия цистеамина с радиочувствительностью клеток и их способностью к пост-радиационному восстановлению. Для демонстрации участия процессов восстановления в механизме радиозащитного действия соединения Т1023 на животных приводятся данные по выживаемости клоногенных клеток костного мозга мышей при воздействии γ-излучения. Показано, что радиозащитное действие этого соединения реализуется не только на физико-химическом этапе формирования радиационного повреждения за счет уменьшения содержания кислорода в тканях, но и вследствие пострадиационного восстановления на биохимическом этапе, что отражается наличием сигмоидной части на кривой доза–эффект в области малых доз ионизирующего излучения.
Значимость процессов восстановления в механизме действия радиопротекторов была доказана для бактериальных клеток [1, 2]. В этих работах при исследовании молекулярных процессов радиозащитного действия различных соединений на выживаемость бактерий Escherichia coli было показано, что радиопротекторы не изменяют общего количества повреждений ДНК, индуцированных γ-излучением, а уменьшают скорость ферментативной инцизии. На этом основании сделан вывод, что в результате взаимодействия радиопротекторов с поврежденными участками ДНК последние становятся частично экранированными от действия эндонуклеазы, а уменьшение скорости инцизии приводит к понижению ферментативной индукции двойных разрывов ДНК, что может быть важным только для клеток дикого типа и тех мутантов, которые были способны восстанавливаться от радиационных повреждений. Конечно, результаты, полученные на бактериях, не могут быть перенесены непосредственно на эукариоты. Необходимы дальнейшие исследования, чтобы установить молекулярный механизм участия процессов восстановления в радиозащитном действии химических соединений на эукариотические клетки.
Участие процессов восстановления в механизме действия радиопротекторов достаточно широко обсуждалось в работах [3–6]. В этих работах анализируются схемы развития процессов радиационного повреждения на молекулярном и клеточном уровнях, учитывающие процессы восстановления как на химической стадии формирования повреждения, так и в пострадиационный период, например, при выдерживании облученных дрожжевых клеток в непитательной среде [7]. При изучении зависимости радиозащитного действия цистеамина от состояния репарационных ферментов в клетках дикого типа и трех мутантных диплоидных штаммах дрожжей Saccharomyces cerevisiae (гомозиготные по локусам rad2, xrs4, rad54) не было обнаружено значительных различий в радиозащитном действии цистеамина на клетки дикого типа и радиочувствительные штаммы, дефектные по эксцизионной и рекомбинационной системам репарации [8]. Однако в дрожжах S. cerevisiae имеются, по крайней мере, восемь отдельных локусов, которые контролируют чувствительность клеток к ионизирующему излучению. Поэтому в данной работе приводятся результаты изучения радиозащитного действия цистеамина (класс аминотиолов) на дрожжевые клетки S. cerevisiae дикого типа и с различными дефектами в генетических локусах, контролирующих чувствительность клеток к ионизирующему излучению. Кроме того, для демонстрации участия процессов восстановления в механизме радиозащитного действия соединения Т1023, вызывающего у животных транзиторную гипоксию вследствие ингибирования синтаз оксида азота, приведены данные о выживаемости клоногенных клеток костного мозга мышей при воздействии γ-излучения.
МАТЕРИАЛЫ И МЕТОДИКА
Эксперименты выполнены на гаплоидных и диплоидных дрожжевых штаммах дикого типа и радиочувствительных мутантах различного генотипа: S288C (RAD), g218/6b (rad50), g218/7a (rad51), g160/2b (rad52), g151/12c (rad53), g218/7c (rad54), X1687/101b (rad55), 30-57-rs31 (rad56), g246/6b (rad57); XS800 (RAD/RAD), XS1806 (rad50/rad50), XS806 (rad51/rad51), XS1898 (rad52/rad52), XS1889 (rad53/rad53), T3 (rad54/rad54), XS1935 (rad55/rad55), XS1943 (rad56/rad56), XS1988 (rad57/rad57). В качестве радиопротектора использован 0.01 моль/л водный раствор цисте-амина, не оказывающий при такой концентрации токсического действия. Клетки помещали в водный раствор радиопротектора за 30 мин до облучения. Суспензию дрожжевых клеток концентрацией 106 кл/мл, при которой не наблюдаются эффекты, обусловленные гипоксией клеток, облучали γ-квантами 60Co на установке “Исследователь” при мощности дозы 20 Гр/мин. Продолжительности облучения варьировали в диапазоне от 0 до 40 мин. Суспензию клеток облучали в стационарной стадии роста, для этого использовали 4–6-суточные культуры диплоидных клеток и 12–14-суточные культуры гаплоидных, выращенные на стандартной агаризованной питательной среде при 30°С. Протяженность предрадиационного культивирования определяли по прекращению почкования клеток. Доля почкующихся клеток составляла около 2%. Такая клеточная популяция состояла из отдельных клеток примерно одинакового размера. Выживаемость клеток определяли по способности образовывать видимые глазом макроколонии, сформированные на 3–5-е сутки на стандартной питательной среде. Каждый опыт повторяли 2–5 раз. Результаты представлены в виде среднего значения и его стандартной ошибки.
Эффективность действия цистеамина для гаплоидных дрожжей количественно оценивали фактором изменения дозы (ФИД), определяемым отношением значений среднелетальных доз ${{D}_{0}}$ (доза, снижающая выживаемость в e раз, где e – основание натуральных логарифмов) для кривых выживаемости, полученных с цистеамином (${{D}_{0}}$(II)) и без него (${{D}_{0}}$(I)) – ФИД = ${{D}_{0}}$(II)/${{D}_{0}}$(I). Это же отношение использовали и для диплоидных дрожжевых клеток, при этом ${{D}_{0}}$ рассчитывали на экспоненциальной части кривых выживаемости.
Изучено влияние синтезированного в лаборатории радиационной фармакологии МРНЦ им. А.Ф. Цыба соединения Т1023 (75 мг/кг), являющегося ингибитором синтаз оксида азота, на выживаемость клоногенных клеток костного мозга мышей (CBA × C57BL6j), облученных γ-квантами 60Co на установке “Луч-1” при мощности дозы 0.4–0.8 Гр/мин. Животных облучали в группах по 15 особей. Радиопротектор вводили животным внутрибрюшинно за 15–20 мин до облучения. Выживаемость гемопоэтических клоногенных клеток костного мозга мышей оценивали по тесту экзогенных селезеночных колоний, детально описанному в работе [9]. Параметры ФИД для Т1023 оценивали отношением изоэффективных доз на кривых выживаемости клоногенных клеток костного мозга, полученных с протектором и без него.
РЕЗУЛЬТАТЫ
На рис. 1 приведены кривые выживаемости гаплоидных rad-мутантов и их родительского штамма дикого типа, облученных без радиопротектора и в 0.01 моль/л растворе цистеамина. Эффективность защиты гаплоидных дрожжей суммирована в табл. 1 для этих и некоторых других штаммов, результаты с которыми не представлены на рис. 1.
Рис. 1.
Кривые выживаемости гаплоидных дрожжевых клеток S. cerevisiae различного генотипа: A – S288C (RAD), Б – g218/4d (rad50), В – g218/7a (rad51), Г – gl60/2b (rad52); клетки были облучены γ-квантами 60Co в отсутствие (светлые значки) и присутствии (темные значки) 0.01 моль/л цистеамина.
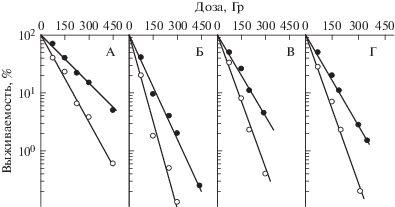
Таблица 1.
Эффективность защиты гаплоидных дрожжей S. cerevisiae различного генотипа цистеамином (0.01 моль/л)
| Штамм | Мутантный локус | ${{D}_{0}}$(I), Гр без цистеамина | ${{D}_{0}}$(II), Гр с цистеамином | ФИД |
|---|---|---|---|---|
| S288C | RAD | 85.0 | 154.0 | 1.81 ± 0.2 |
| g218/6b | rad50 | 37.0 | 72.0 | 1.95 ± 0.3 |
| g218/7a | rad51 | 60.0 | 101.0 | 1.69 ± 0.1 |
| g160/2b | rad52 | 57.0 | 91.0 | 1.59 ± 0.1 |
| g151/12c | rad53 | 79.0 | 137.0 | 1.73 ± 0.2 |
| g218/7c | rad54 | 58.0 | 83.0 | 1.42 ± 0.3 |
| X1687/101b | rad55 | 57.0 | 126.0 | 2.20 ± 0.4 |
| 30-57-rs31 | rad56 | 62.0 | 98.0 | 1.58 ± 0.1 |
| g246/6b | rad57 | 70.0 | 123.0 | 1.78 ± 0.2 |
Видно, что эффективность защиты цистеамином была почти одинаковой для гаплоидных клеток дикого типа и большинства мутантных клеток, она была несколько повышена для rad55 мутанта, но понижена для rad54 мутанта. Эффективность защитного действия цистеамина варьировала случайным образом вокруг среднего значения ФИД = 1.75 ± 0.16. Никакой корреляции между ${{D}_{0}}$ и ФИД для этих гаплоидных штаммов не обнаружено. Известно, что способность гаплоидных клеток восстанавливаться от радиационных повреждений значительно ниже по сравнению с диплоидными [7]. Поэтому для уточнения роли восстановления в механизме действия радиопротекторов были выполнены эксперименты с диплоидными дрожжевыми клетками. На рис. 2 приведены кривые выживаемости разных штаммов S. cerevisiae дикого типа и радиочувствительных штаммов, гомозиготных по мутантному локусу. В табл. 2 суммированы радиобиологические параметры кривых выживаемости этих и некоторых других штаммов, результаты экспериментов с которыми не отражены на рис. 2. Отметим, что значения ФИД, представленные в табл. 2, оценивали по отношению соответствующих ${{D}_{0}}$. Мы не оценивали этот параметр для разных уровней эффекта, поскольку он незначительно изменялся в зависимости от дозы облучения и составлял в среднем 2.2 ± 0.2 (рис. 2, А), 1.6 ± 0.1 (рис. 2, Б), 1.4 ± 0.1 (рис. 2, В), 1.3 ± 0.1 (рис. 2, Г).
Рис. 2.
Выживаемость диплоидных дрожжей S. cerevisiae, облученных γ-квантами 60Co без радиопротектора (светлые значки), и в присутствии 0.01 моль/л цистеамина (темные значки): А – XS800 (RAD/RAD); Б – XS1806 (rad50/rad50); В – XS806 (rad51/rad51); Г– XS1898 (rad52/rad52).
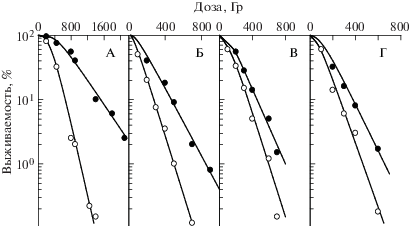
Таблица 2.
Эффективность защиты диплоидных дрожжей S. cerevisiae различного генотипа цистеамином (0.01 моль/л)
| Штамм | Мутантный локус | ${{D}_{0}}$(I), Гр без цистеамина | ${{D}_{0}}$,(II) Гр с цистеамином | ФИД |
|---|---|---|---|---|
| XS800 | RAD/RAD | 178.0 | 495.0 | 2.78 ± 0.4 |
| XS1806 | rad50/rad50 | 89.0 | 178.0 | 2.00 ± 0.3 |
| XS806 | rad51/rad51 | 34.0 | 47.0 | 1.38 ± 0.1 |
| XS1898 | rad52/rad52 | 32.0 | 48.0 | 1.40 ± 0.2 |
| XS1889 | rad53/rad53 | 72.0 | 137.0 | 1.90 ± 0.2 |
| T3 | rad54/rad54 | 23.9 | 30.4 | 1.27 ± 0.1 |
| XS1935 | rad55/rad55 | 80.0 | 169.0 | 2.11 ± 0.2 |
| XS1943 | rad56/rad56 | 137.0 | 300.0 | 2.19 ± 0.3 |
| XS1988 | rad57/rad57 | 134.0 | 268.0 | 2.00 ± 0.2 |
Из этих данных видно, что среди исследованных штаммов мутанты с локусами rad51, 52, 54 в диплоидном состоянии показывали наибольшую чувствительность к действию ионизирующего излучения. Радиочувствительность диплоидных клеток, гомозиготных по отношению к локусам rad56, 57, незначительно отличалась от радиочувствительности диплоидных клеток дикого типа; радиочувствительность диплоидных дрожжевых клеток, гомозиготных по отношению к локусам rad50, 53, 55, была промежуточной. Известно, что диплоидные клетки дикого типа, а также некоторые rad-мутанты (rad53, 55, 56, 57), хотя и были более радиочувствительными по сравнению с клетками исходного родительского штамма, сохраняли способность к восстановлению в пострадиационный период в непитательной среде при 30°С, а другие штаммы, гомозиготные в отношении rad-мутаций (rad50, 51, 52, 54), не обладали такой способностью [10]. Из представленных в табл. 2 данных видно, что эффективность радиационной защиты цистеамином была больше для клеток дикого типа и некоторых мутантов, сохранивших способность к восстановлению. Расчеты для большой совокупности диплоидных дрожжевых клеток различного генотипа, включая результаты, приведенные в табл. 2, показывают, что параметры ${{D}_{0}}$ с цистеамином и ${{D}_{0}}$ без протектора коррелируют друг с другом (коэффициент корреляции r = 0.98). Этот факт является дополнительным подтверждением точки зрения, что эффективность действия радиопротекторов связана и со способностью клеток к восстановлению, тем самым подтверждают обсуждаемую гипотезу об участии систем пострадиационного восстановления в реализации противолучевого действия радиопротекторов.
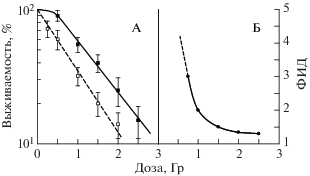
Рис. 3 демонстрирует зависимость выживаемости клоногенных клеток костного мозга мышей (рис. 3, А) и эффективности радиозащитного действия (ФИД) соединения Т1023 (рис. 3, Б) от дозы γ-излучения. В этом случае значение ФИД оценивали отношением изоэффективных доз кривых с протектором и без него. Видно, что экспоненциальная кривая выживаемости клеток костного мозга при облучении мышей без радиопротектора превращается в сигмоидную после облучения мышей в присутствии радиопротектора. Вследствие этого ФИД составляет порядка 1.4 в области больших доз и более 4.0 в области сигмоидного плеча при малых дозах ионизирующей радиации. Пунктирная линия до дозы 0.5 Гр показывает экстраполяцию в область малых доз. В соответствии с классическими представлениями радиобиологии [11, 12], эти данные указывают на восстановление клеток от сублетальных повреждений в области малых доз ионизирующего излучения только в присутствии радиопротектора. Тем самым демонстрируется роль восстановления клеток от радиационных повреждений в реализации радиозащитного действия соединения Т1023.
ОБСУЖДЕНИЕ
Участие систем пострадиационного восстановления в противолучевом действии многих радиопротекторов хорошо известно и широко обсуждалось в литературе [1–6, 10], несмотря на то, что защитный эффект реализуется на радиационно-химическом этапе формирования радиационного повреждения. Однако остается неясным вклад репарационных процессов в противолучевые эффекты аминотиолов и гипоксических радиопротекторов [3, 5].
Данные о зависимости эффективности радиопротекторов от генотипа клеток, контролирующего процессы восстановления у бактериальных и дрожжевых клеток, послужили основой для разработки кинетических схем развития радиационного поражения, в которых значительное внимание уделяется механизму участия пострадиационного восстановления в радиосенсибилизирующем и радиозащитном действии химических агентов [3–6, 13]. Эти схемы включают процессы ферментативной репарации в механизме модификации радиочувствительности, суть которых сводится к следующему. В результате прямого или косвенного действия ионизирующего излучения первичные радиационные повреждения могут взаимодействовать с кислородом или донорами электронов. В первом случае формируется необратимое летальное повреждение, во втором случае с некоторой вероятностью образуется состояние, которое само по себе летально, но поддается ферментативной репарации. Приведенные в данной работе результаты исследований на дрожжевых клетках качественно объясняются этими механизмами. Присутствие радиопротектора в момент облучения в равной степени снижает на физико-химическом этапе лучевую альтерацию клеток различного генотипа. Различие же в эффективности защиты клеток, способных к восстановлению, и клеток, не обладающих такой способностью, об-условлено пострадиационным восстановлением клеток на биохимическом этапе формирования повреждений. Следует отметить, что действие многих радиопротекторов объясняется индукцией тканевой гипоксии, т.е. кислородным эффектом, реализация которого тесно связана со способностью клеток восстанавливаться от радиационных повреждений [4–6].
В настоящее время для человека известна редкая мутация, приводящая к дефектности всех соматических клеток по глутатионсинтетазе. В экспериментах, проведенных на клетках, полученных от таких пациентов, было показано, что уменьшение содержания глутатиона приводило к замедлению и неполному восстановлению одиночных разрывов, т.е. такие клетки можно рассматривать в определенной мере дефектными по восстановлению. В соответствии с показанной ролью репарационных процессов в противолучевых эффектах радиопротекторов эффективность действия противолучевых средств для таких клеток должна быть пониженной. Такие результаты и наблюдали в радиобиологических экспериментах с клетками, дефектными по глутатионсинтетазе [14].
Логично предположить, что для повышения эффективности действия радиопротекторов следует рассматривать возможности модификации способности клеток к восстановлению. В недавней публикации было показано, что после рентгеновского облучения восстановление клеток S. cerevisiae, обогащенных магнитным изотопом магния (25Mg), происходит вдвое быстрее, чем восстановление клеток, обогащенных немагнитным изотопом (24Mg) [15]. При этом доля необратимых повреждений в клетках, обогащенных 25Mg, на 60% меньше по сравнению с клетками, обогащенными 24Mg. Поскольку процессы восстановления принимают участие в механизме реализации радиопротекторов, в работе [15] авторы допускают принципиальную возможность создания новых радиопротекторов на основе стабильных магнитных изотопов.
Совокупность приведенных данных показывает, что эффективность действия радиопротекторов определяется не только снижением вероятности формирования летальных и потенциально летальных повреждений на физико-химическом этапе, но и уменьшением вероятности реализации уже сформированных потенциально летальных повреждений вследствие пострадиационного восстановления. Вклад клеточной репарации в противолучевой эффект радиопротекторов в большей степени проявляется у диплоидных клеток и, судя по всему, носит универсальный характер как для аминотиолов, так и для гипоксических противолучевых средств.
БЛАГОДАРНОСТИ
Публикация подготовлена при поддержке гранта Президента РФ МК-872.2018.4 (Соглашение № 075-02-2018-570), а также в рамках научного проекта Российского фонда фундаментальных исследований и Правительства Калужской области № 18-413-400004а(р).
Список литературы
Bresler S.E., Noskin L.A., Stepanova I.M. et al. Mechanisms of the radioprotecting action of chemical compounds of Escherichia coli cells // Molec. Gen. Genet. 1978. V. 163. № 1. P. 75–85.
Носкин Л.А. Молекулярные механизмы репарационного баланса в клетках про- и эукариотов: Дис. … д-ра биол. наук. Гатчина, 1984.
Рождественский Л.М. Кислородный эффект и процессы репарации // Механизмы лучевой патологии. Сборник / Под ред. Ю.Б. Кудряшова. М.: Изд-во Моск. ун-та, 1984. С. 119–127.
Рождественский Л.М. Механизм радиозащитного эффекта и индикация эффективности радиопротекторов. М.: Энергоатмоиздат, 1985. 128 с.
Эйдус Л.Х. Общая схема модификации лучевого поражения клеток // Механизмы лучевой патологии. Сборник / Под ред. Ю.Б. Кудряшова. М.: Изд-во Моск. ун-та, 1984. С. 128–135.
Эйдус Л.Х., Корыстов Ю.Н. Кислород в радиобиологии. М.: Энергоатомиздат, 1984. 176 с.
Корогодин В.И. Проблемы пострадиационного восстановления. М.: Атомиздат, 1966. 391 с.
Гильяно Н.Я., Малиновский О.В., Харламов А.Д. Радиозащитный эффект цистеамина на дрожжевых клетках штаммов дикого типа и мутантных по репарации // Радиобиология. 1981. Т. 21. № 3. С. 379–383.
Филимонова М.В., Шевченко Л.И., Макарчук В.М. и др. Радиозащитные свойства ингибитора NO-синтаз Т1023: I. Показатели противолучевой активности и взаимодействие с другими радиопротекторами // Радиац. биология. Радиоэкология. 2015. Т. 55. № 3. С. 250–259.
Petin V.G., Kim J.K. Synergistic interaction and cell responses to environmental factors. New York: Nova Science Publishers, 2016. 337 p.
Ярмоненко С.П., Коноплянников А.Г., Вайнсон А.А. Клиническая радиобиология. М.: Медицина, 1992. 320 с.
Hall E.J. Radiobiology for the Radiologist. Philadelphia: Lippincott Williams and Wilkins, 2000. 490 p.
Неклюдов А.Г., Комаров В.П., Петин В.Г. Количественное описание модификации радиочувствительности // Радиобиология. 1987. Т. 27. № 1. С. 46–51.
Revesz L., Edgren M., Nishida T. Mechanisms of inherent radioprotection in mammalian cells // Modification and Radiosensitivity in Cancer Treatment / Ed. T. Sugahara. Tokyo: Academic Press, 1984. P. 13–29.
Авдеева Л.В., Евстюхина Т.А., Кольтовер В.К. и др. Магнитные изотопы: новый подход к созданию новых противолучевых средств // Мат. Междунар. конф.“Проблемы химической защиты и репарации при радиационных воздействиях” (Дубна, 30–31 мая 2018 г.). Дубна, 2018. С. 78–80.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология