Радиационная биология. Радиоэкология, 2019, T. 59, № 3, стр. 243-254
ОСОБЕННОСТИ ДЕЙСТВИЯ γ-ИЗЛУЧЕНИЯ НА МЕЗЕНХИМАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ ЖИРОВОЙ ТКАНИ ПОСЛЕ ДЛИТЕЛЬНОГО КУЛЬТИВИРОВАНИЯ
А. В. Родина *, Ю. П. Сёмочкина, О. В. Высоцкая, А. И. Глухов, Е. Ю. Москалёва
НИЦ “Курчатовский институт”, Курчатовский комплекс НБИКС-технологий
Москва, Россия
* E-mail: Rodina_AV@nrcki.ru
Поступила в редакцию 04.06.2018
Аннотация
Важную роль в процессах пострадиационной регенерации играют тканевые стволовые клетки, а также резидентные и привлеченные в область повреждения мезенхимальные стволовые клетки (МСК), функциональная активность которых может изменяться под действием ионизирующего излучения. Целью работы было изучение ответа МСК жировой ткани (МСК ЖТ) мыши на действие γ-излучения в широком диапазоне доз после кратковременного и длительного культивирования, а также характеристика способности к репарации двунитевых разрывов (ДР) ДНК и функциональной активности длительно культивируемых МСК ЖТ. При сравнении необлученных культур МСК ЖТ на 6-м и 30-м пассажах значительные различия обнаружены в активности теломеразы в этих клетках: она была высокой на 6-м и крайне низкой на 30-м пассаже. Время удвоения клеток к 30-му пассажу снизилось на 7 ч. Через 7 сут после радиационного воздействия обнаружены статистически значимые отличия между МСК ЖТ, облученными на раннем и позднем пассажах, по количеству клеток, которое снижалось при дозах 0.1 и 1 Гр только при облучении клеток на 30-м пассаже. Однако через 14 сут культивирования после воздействия γ-изучения количество МСК ЖТ, облученных на 6-м и 30-м пассажах, не различалось. Не выявлено отличий в эффективности клонирования и клоногенной активности МСК ЖТ, облученных на 6-м и 30-м пассажах. Обнаружен блок клеточного цикла в фазе G0/G1 через 24 ч после воздействия радиации в дозе 6 Гр на МСК 6-го и 30-го пассажей, а через 7 сут после облучения в этой же дозе наблюдался блок цикла в фазе G2/M. МСК ЖТ на 30-м пассаже обладали способностью к активной репарации ДР ДНК после действия γ-излучения. Даже клетки, облученные в дозе 6 Гр на 30-м пассаже, сохраняли способность к секреции факторов роста и цитокинов и способность к дифференцировке. Совокупность представленных данных свидетельствует о резистентности МСК ЖТ к сублетальным дозам γ-излучения (до 6 Гр) и сохранении их функций в зонах, расположенных вблизи от облучаемой в процессе лучевой терапии области.
При лучевой терапии – наиболее эффективном методе лечения многих видов рака – возможно развитие побочных эффектов и осложнений, вызванных повреждением клеток здоровых тканей в зоне облучения. Возможность и эффективность пострадиационной регенерации нормальных тканей в значительной мере определяются сохранностью тканевых стволовых клеток. Кроме того, важную роль в стимуляции и регуляции процессов регенерации играют резидентные и привлеченные в область повреждения мезенхимальные стволовые клетки (мультипотентные стромальные стволовые клетки, МСК), функциональная активность которых может изменяться под действием ионизирующего излучения [1]. Регенеративный потенциал МСК определяется не только их способностью к пролиферации и мультилинейной дифференцировке, но и высокой противовоспалительной, иммуномодулирующей и регуляторной активностью, обусловленной секрецией ряда цитокинов и факторов роста [2]. Нормальные органы и ткани в процессе лучевой терапии получают различные по величине дозы, способные оказывать негативное воздействие в результате повреждения ДНК клеток, что может приводить к апоптозу, накоплению мутаций и злокачественной трансформации [3]. Чувствительность клеток к ионизирующему излучению зависит как от типа и уровня повреждений ДНК, так и от эффективности процессов репарации [4]. Радиочувствительность МСК жировой ткани (ЖТ) изучена недостаточно, хотя эта ткань широко представлена в организме. Свойства МСК могут изменяться после длительного культивирования, которое используется для получения необходимого количества клеток. В ряде исследований показано, что длительное культивирование МСК in vitro для увеличения их количества может приводить к накоплению спонтанных повреждений ДНК, репликативному старению, снижению теломеразной активности, и, как следствие, к изменению функциональной активности клеток, к уменьшению скорости пролиферации или снижению способности к дифференцировке [5, 6]. Поэтому целью работы стало изучение ответа МСК ЖТ мыши на действие γ-излучения в диапазоне малых и сублетальных доз после кратковременного и длительного культивирования, а также характеристика способности к репарации двунитевых разрывов (ДР) ДНК и функциональной активности длительно культивируемых МСК-ЖТ.
МАТЕРИАЛЫ И МЕТОДЫ
Выделение и культивирование МСК. Животных умерщвляли путем цервикальной дислокации. МСК выделяли из жировой ткани мышей линии C57BL/6 в возрасте 2 мес., как описано ранее [7]. Фрагменты жировой ткани измельчали ножницами, затем гомогенизировали в среде DMEM/F12 (“Gibco”, США) без сыворотки. К суспензии фрагментов жировой ткани в среде добавляли раствор коллагеназы (“Sigma”, США) (конечная концентрация 0.08%) и инкубировали суспензию при перемешивании 1 ч при 37°С. Собирали клетки с помощью центрифугирования (1200 об/мин, 10 мин.). Осадок клеток ресуспендировали в среде DMEM/F12 с 10% фетальной бычьей сыворотки (ФБС) (“HyClone”, США) для нейтрализации коллагеназы. После центрифугирования (1200 об/мин, 10 мин) собранные клетки ресуспендировали в среде DMEM/F12 с 10% ФБС и 50 мкг/мл гентамицина (“Gibco”, США) и переносили в культуральный флакон с площадью 75 см2 (“Corning”, США). После прикрепления (через 24 ч) клетки промывали фосфатно-солевым буфером (ФСБ) (“Sigma”, США), вносили культуральную среду и культивировали до достижения субконфлуентного состояния при 37°С, 5% СО2 в увлажненной атмосфере. По достижении 80–85% конфлюентности клетки рассевали, используя раствор трипсин-ЭДТА (“Gibco”, США), содержащий 0.05% трипсина и 0.02% ЭДТА. Было получено 10 культур МСК ЖТ от разных мышей. В исследовании использовали три линии МСК ЖТ, которые культивировались до 6 и 30 пассажей.
Фенотипирование МСК ЖТ с помощью проточной цитометрии. Клетки снимали с подложки с помощью раствора трипсин-ЭДТА, промывали ФСБ и фиксировали в растворе 2%-ного параформальдегида 20 мин при комнатной температуре. После фиксации клетки дважды промывали ФСБ, осадок ресуспендировали в ФСБ, содержащем 0.1% бычьего сывороточного альбумина (“ICN”, США) в концентрации 3 × 105 клеток/100 мкл. Суспензию клеток инкубировали 30 мин при комнатной температуре с антителами, конъюгированными с Alexa Fluor 488 или фикоэритрином (“Biolegend”, США), к антигенам мыши Sca-1, CD9, CD45 и CD11b. В качестве изотипического контроля использовали соответствующие IgG, конъюгированные с Alexa Fluor 488 или фикоэритрином (“Biolegend”, США). Анализ проводили на проточном цитометре FacsCalibur (“BD Bioscience”, США, ресурсный центр молекулярной и клеточной биологии). В каждом образце анализировали 104 клеток.
Облучение клеток. Клетки в культуральной среде подвергали действию γ-излучения от источника 60Cо на установке “ГУТ-200М” при комнатной температуре в дозах до 0.1 Гр при мощности дозы 0.01 Гр/мин; а в дозах 1–8 Гр – при мощности дозы 0.75 Гр/мин.
Исследование выживаемости клеток. МСК ЖТ снимали с подложки с использованием раствора трипсин-ЭДТА 0.05% и облучали в полной культуральной среде в суспензии. Сразу после радиационного воздействия клетки высаживали в 6-луночные планшеты (“Corning”, США). Количество МСК в контроле и после облучения анализировали путем подсчета в камере Горяева с использованием трипанового синего для выявления погибших клеток. Выживаемость клеток оценивали в процентах от их количества в контрольных пробах. Значения времени удвоения клеток за 72 ч культивирования рассчитывали по формуле TD = tplog2/log(N2/N1), где tp – время культивирования, N1 – начальное количество клеток, N2 – конечное количество клеток.
Определение клоногенной активности МСК ЖТ. МСК ЖТ снимали с подложки с использованием раствора трипсин-ЭДТА 0.05% и облучали в полной культуральной среде в суспензии. Сразу после радиационного воздействия клетки высаживали в 6-луночные планшеты (“Corning”, США). Необлученные и облученные в дозах 0.03, 0.05, 0.1, 1 и 2 Гр клетки высевали в количестве 100 на лунку, после воздействия в дозе 4 Гр – 200 клеток на лунку, в дозе 6 и 8 Гр – 400 клеток на лунку в среде DMEM/F12, содержащей 10% ФБС, и культивировали 14 сут. Для окрашивания колоний культуральную среду удаляли, клетки промывали ФСБ, окрашивали колонии 0.5%-ным раствором кристаллвиолета в метаноле в течение 10 мин, промывали ФСБ, высушивали на воздухе, сканировали и подсчитывали количество колоний.
Определение активности теломеразы (АТ). Осадки МСК ЖТ после 6 и 30 пассажей и клеток миелолейкоза человека линии К562 замораживали и хранили при –70°С. Для определения АТ готовили экстракты клеток в лизирующем буфере CHAPS, который добавляли из расчета 1 мкл на 10 000 клеток. Определение АТ в экстрактах клеток проводили с помощью метода TRAP с модификациями для неизотопной детекции АТ [8]. Элонгацию олигонуклеотидного субстрата (TS-праймер) и последующую амплификацию проводили в 50 мкл реакционной смеси, содержащей 67 ммоль/л Трис-HCl (рН 8,8), 16.6 ммоль/л (NH4)2SO4, 0.01% Tween-20, 1.5 ммоль/л MgCl2, 1 ммоль/л EGTA, 50 ммоль/л каждого dNTP, 0.1 мкг TS-праймера (5'-ATTCCGTCGAGCAGAGTT-3'), 1–10 мкл экстрактов клеток. Экстракты клеток МСК-ЖТ добавляли так, чтобы в реакционной смеси содержалось 5 мкг белка, активность в которых сравнивали с активностью теломеразы в 0.4 мкг белка экстракта контрольной теломеразопозитивной линии К562. На стадии ПЦР в реакционную смесь добавляли 0.1 мкг CX-праймера (5'-CCCTTACCCTTACCCTTACCCTAA-3') и 2.5 ед. акт. SmarTaq ДНК-полимеразы (“Диалат”, Москва). Реакционную смесь амплифицировали в течение 28 циклов ПЦР. Разделение амплифицированных TRAP-продуктов осуществляли методом электрофореза в 10%-ном неденатурирующем ПААГ в трис-боратном-ЭДТА буфере. Визуализацию разделенных TRAP-продуктов проводили на УФ-трансиллюминаторе (λ 300 нм) после окрашивания геля в темноте в течение 30 мин в растворе красителя SYBR Gold (“Molecular Probes”, США). Для визуализации результатов использовали систему гель-документирования Syngene G:BOX Chemi XT4 (Великобритания) с встроенной программой обработки полученного изображения GeneTools, которая рассчитывает интенсивность свечения пиков (в условных единицах), соответствующих дискретным фрагментам TRAP-продуктов. Суммарная площадь пиков принималась за величину АТ в конкретном образце. Далее рассчитывали относительную АТ, сравнивая АТ с положительным контрольным образцом.
Исследование клеточного цикла и уровня апоптоза с помощью проточной цитофлуориметрии. Клетки собирали, 2 раза промывали ФСБ и фиксировали 70%-ным этанолом (1 × 106 клеток/мл этанола) при +4°С в течение 1 ч. Фиксированные клетки осаждали центрифугированием при 1500 об/мин, промывали ФСБ. Осадок при концентрации 1 × 106 клеток/мл раствора ресуспендировали в ДНК окрашивающем растворе (ФСБ рН 7.4, содержащий 0.1%-ный Тритон Х-100, 0.1 ммоль/л ЭДТА, 0.05 мг/мл Рибонуклеазы А (“Sigma”, США), 50 мкг/мл йодистого пропидия (“Sigma”, США)) и инкубировали 1 ч при комнатной температуре. Исходный раствор Рибонуклеазы А предварительно кипятили на водяной бане в течение 10 мин. Анализ проводили с помощью проточного цитофлуориметра BD FACSCalibur (“BD Biosciences”, США) при возбуждении 488 нм и эмиссии 585–600 нм. Анализ клеточного цикла проводили в соответствии с рекомендациями фирмы “BD Biosciences” с использованием программы CellQuestPro (“BD Biosciences”, США). Долю клеток в состоянии апоптоза оценивали как фракцию гиподиплоидных клеток.
Анализ содержания гистона γН2АХ c помощью флуоресцентной микроскопии и проточной цитофлуориметрии. Анализ проводили, как описано в [9, 10], с некоторыми модификациями [11]. Для определения содержания гистона γН2АХ с помощью микроскопии МСК предварительно высаживали на покровные стекла в 24-луночных планшетах (“Corning”, США) в количестве 40 тыс. на лунку и культивировали в полной культуральной среде (DMEM/F12, 10% ФБС, “Gibco”, США) в стандартных условиях. Желательно, чтобы перед облучением клетки находились в субконфлуентном состоянии, так как логарифмическая фаза роста характеризуется более высоким уровнем спонтанных повреждений ДНК. Контрольные и облученные клетки инкубировали в полной питательной среде при 37°С в течение 1 ч после радиационного воздействия для анализа уровня повреждений ДНК и в течение 24 ч для оценки полноты репарации двунитевых разрывов ДНК. По окончании инкубации среду удаляли, клетки промывали ФСБ c 3% ФБС и фиксировали на стеклах в абсолютном метаноле 10 мин на льду при +4°С. Образцы хранили в абсолютном метаноле при –20°С до проведения исследования. При проведении исследования образцы для микроскопии инкубировали в течение 10 мин при комнатной температуре в растворе для блокировки: ФСБ, содержащем 3% ФБС и 0.05% Твин-20, pH 7,4, затем в блокирующем растворе с первичными моноклональными мышиными антителами к гистону γH2AX (“Merck Millipore”, Германия) в концентрации 1 мкг/мл (разведение 1:1000) при +4°С в течение ночи. По окончании инкубации с первичными антителами образцы промывали ФСБ c 3% ФБС и инкубировали со вторичными поликлональными козьими антителами, мечеными Alexa Fluor 488 (“Biolegend”, США) в концентрации 0.25 мкг/мл (разведение 1 : 2000) при комнатной температуре в течение 1 ч. Затем пробы промывали ФСБ, инкубировали в растворе DAPI (0.3 мкмоль/л) 10 мин при комнатной температуре для окрашивания ядер и заключали стекла в мовиол. Визуализацию и обработку изображений осуществляли с помощью флуоресцентного микроскопа AXIO IMAGER (“Carl Zeiss”, Германия), оснащенного цифровой камерой.
Клетки для проточной цитометрии снимали с подложки, используя раствор трипсин-ЭДТА, промывали ФСБ c 3% ФБС и также фиксировали в абсолютном метаноле при +4°С в течение 20 мин, образцы хранили в метаноле при –20°С до проведения измерений. Перед исследованием клетки отмывали от метанола в растворе для блокировки и инкубировали в блокирующем растворе с прямыми мышиными моноклональными антителами к гистону γH2AX, мечеными Alexa Fluor 488 (“BD Pharmingen”, США; разведение 1 : 20). Для измерения использовали не менее 300 тыс. клеток на пробу в виде суспензии в ФСБ. Анализ проводили на проточном цитофлуориметре FacsCalibur (“BD Bioscience”, США, ресурсный центр молекулярной и клеточной биологии).
Определение уровня супероксидного аниона. Определение уровня супероксидного аниона с MitoSOX проводили в соответствии с рекомендациями фирмы-производителя. Сток-раствор MitoSOX Red (“Thermo Fischer”, США) для определения митохондриального супероксид-аниона в концентрации 5 ммоль/л готовили путем растворения содержимого одной ампулы (50 мкг) в 13 мкл стерильного DMSO (“Sigma-Aldrich”, США) и хранили не более 1 мес. при –20°С. Рабочий раствор MitoSOX Red в ФСБ (5 мкмоль/л) готовили непосредственно перед использованием. Клетки дважды промывали ФСБ и инкубировали в рабочем растворе в течение 10 мин в стандартных условиях. По окончании инкубации клетки снимали с подложки раствором 0.05%-ного трипсина в растворе Версена (“Gibco”, США), помещали в полную культуральную среду и подвергали воздействию γ-излучения. После облучения клетки дважды промывали ФСБ с 2% БСА и анализировали на проточном цитометре BD FACSCalibur (“BD Bioscience”, США, ресурсный центр молекулярной и клеточной биологии).
Приготовление кондиционированной среды МСК и анализ секреции цитокинов. МСК высаживали в пластиковые чашки Петри диаметром 6 см (“Corning Costar”, США) в количестве 0.5 млн на чашку в полной культуральной среде и культивировали в стандартных условиях (5%-ный СО2, 37°С). Через 24 ч, когда плотность клеток составляла около 80% от монослоя, культуральную среду удаляли, клетки дважды промывали раствором ФСБ. В чашки Петри добавляли по 3 мл среды DMEM/F12 с 5% ФБС и инкубировали клетки в стандартных условиях 24 ч, затем инкубировали еще 48 ч в среде DMEM/F12 без ФБС. По окончании инкубации среду отбирали и центрифугировали 10 мин при 1500 g при +4°С. Супернатант аликвотировали по 1.4 мл и хранили при –80°С до проведения исследования. Клетки снимали с использованием раствора 0.25%-ного трипсина в растворе Версена и в каждом образце подсчитывали количество клеток в камере Горяева. В кондиционированной среде анализировали уровень факторов роста и цитокинов VEGF, IL6, HGF и TGFβ с помощью ИФА в соответствии с прописью фирмы производителя (“R&D Systems”, США).
Статистическая обработка. Статистическую обработку результатов проводили с использованием компьютерной программы OriginPro 2016. Для проведения статистического анализа результатов каждого эксперимента использовали данные 4–5 независимых испытаний. Анализ статистических различий оценивали с помощью теста One-Way ANOVA. Результаты представлены в виде средних значений ± стандартная ошибка среднего. Статистически значимыми считали различия при р < 0.05.
РЕЗУЛЬТАТЫ
МСК ЖТ, выделенные из жировой ткани мышей линии С57BL/6, после шестого пассажа имели типичный фенотип МСК: клетки характеризовались высоким уровнем экспрессии Sca-1 и CD9 при отсутствии таких маркеров лейкоцитов, как CD45 и CD11b (рис. 1, А).
Рис. 1.
Характеристика МСК ЖТ мыши. А – уровень экспрессии поверхностных антигенов на 6-м пассаже. По оси абсцисс – средняя интенсивность флуоресценции, MFI, усл. ед.; по оси ординат – количество клеток, отн. ед. Левый пик – флуоресценция клеток после окрашивания изотипическими антителами, правый – после окрашивания антигенспецифическими антителами. Б – TRAP-анализ активности теломеразы: в МСК ЖТ на 6-м (1) и 30-м пассажах (2), в теломеразопозитивной линии клеток миелолейкоза челова К562 (3), и отрицательный контрольный образец – TRAP в отсутствие белкового экстракта (4). В – уровень секреции цитокинов МСК ЖТ на 6-м (темные столбцы) и 30-м (светлые столбцы) пассажах. * Статистически значимые отличия (р ≤ 0.05).
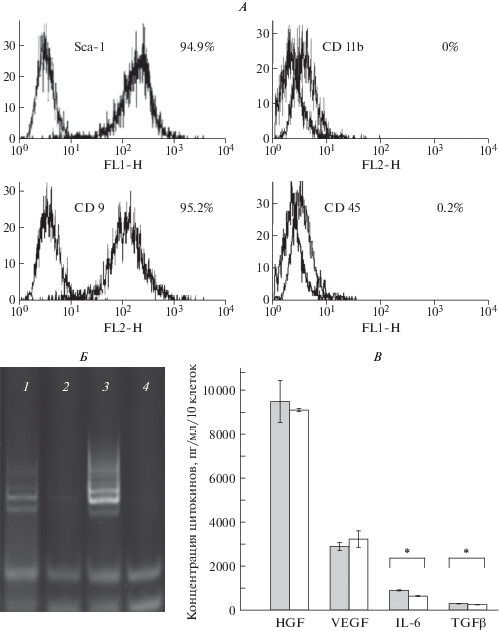
При исследовании активности теломеразы (АТ) методом TRAP было показано, что в МСК ЖТ мыши на раннем пассаже (6-й пассаж) рассчитанная АТ составила 0.4 отн. ед., а на 30-м пассаже – 0.07 отн. ед. (рис. 1, Б). МСК ЖТ после 6-го и 30-го пассажей различались также по уровню секреции некоторых факторов роста и цитокинов (рис. 1, В). Концентрацию VEGF, НGF, IL6 и TGFβ определяли в среде культивирования МСК на 6-м и 30-м пассажах. Обнаружено, что уровень секреции НGF МСК на раннем и позднем пассажах значимо не различался (9486 ± 960 и 9095 ± ± 68 пг/мл/106 клеток соответственно), так же как VEGF (2900 ± 186 и 3230 ± 375 пг/мл/106 клеток соответственно). В то же время наблюдалось значимое снижение уровней IL6 (893 ± 20.3 и 637 ± ± 6.5 пг/мл/106 для клеток 6-го и 30-го пассажей соответственно, р = 0.007) и TGFβ (289.3 ± 6.5 и 246.5 ± 4.7 пг/мл/106 для клеток 6-го и 30-го пассажей соответственно, р = 0.03) после длительного культивирования МСК-ЖТ, хотя, как видно из приведенных значений, уровень секреции этих цитокинов оставался достаточно высоким.
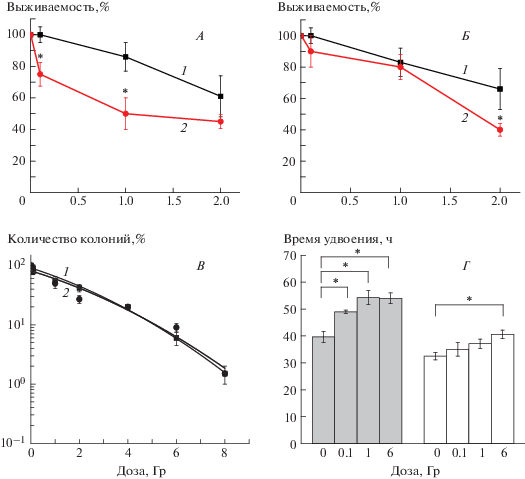
Чувствительность МСК ЖТ к облучению, определяемая на 6-м пассаже и после культивирования до 30-го пассажа по таким критериям, как выживаемость и способность к колониеобразованию, представлена на рис. 2. МСК ЖТ на 6-м пассаже оказались устойчивы к воздействию γ-излучения в дозах 0.1 и 1 Гр: и через 7, и через 14 сут после облучения рассматриваемый показатель не отличался от такового в необлученном контроле (рис. 2, А, Б). В то же время через 7 сут после воздействия в этих же дозах на МСК 30-го пассажа их количество было значимо снижено (р ≤ 0.05) (рис. 2, А). Однако к 14-м суткам анализируемый показатель достигал уровня, характерного для облученных на 6-м пассаже в дозах 0.1 и 1 Гр клеток (рис. 2, Б). В то же время после облучения МСК ЖТ на 6-м и 30-м пассажах в дозе 2 Гр их количество снижалось и статистически значимо отличалось от контроля через 7 и 14 суток после воздействия. Причем выживаемость облученных на 30-м пассаже клеток была ниже таковой для клеток, подвергшихся воздействию на 6-м пассаже. Клоногенная активность МСК ЖТ после облучения на 6-м и 30-м пассажах не различалась во всем диапазоне исследуемых доз (рис. 2, В). Не выявлено значимых различий в эффективности клонирования клеток 6-го и 30-го пассажей, которая составила 21.6 ± 6.2 и 32.0 ± 8.7% соответственно. Время удвоения популяции МСК ЖТ после 6-го и 30-го пассажей различалось и для необлученных клеток составило 39.7 ± 2.0 и 32.5 ± ± 1.4 ч соответственно, р = 0.04 (рис. 2, Г). После облучения МСК ЖТ на 6-м пассаже этот показатель значимо повышался во всем диапазоне исследуемых доз, а после воздействия на МСК ЖТ 30-го пассажа – только при дозе 6 Гр.
Рис. 2.
Чувствительность МСК ЖТ мыши на 6-м (1) и 30-м (2) пассажах к действию γ-излучения. А – количество МСК ЖТ через 7 сут после облучения; Б – количество МСК ЖТ через 14 сут после облучения; В – клоногенная активность МСК ЖТ (эффективность клонирования на 6-м и 30-м пассажах составила 21.6 ± 6.2 и 32.0 ± 8.7% соответственно); Г – время удвоения МСК ЖТ мыши на 6-м (темный столбец) и 30-м (светлый столбец) пассажах. * Статистически значимые отличия (р ≤ 0.05).
При исследовании влияния облучения на клеточный цикл было показано, что половина необлученных МСК ЖТ 6-го пассажа находились в фазе G0/G1 (~50%), а остальные распределились поровну между S и G2/M-фазами (S = 25% и G2/M = = 25%). Через 24 ч после облучения не наблюдалось статистически значимых отличий от контроля в распределении клеток по фазам клеточного цикла при всех дозах (рис. 3, А). Значимое повышение, по сравнению с контролем, доли клеток в фазе G2/M через 7 сут после радиационного воздействия наблюдалось только при дозе 6 Гр (24.8 ± 2.0 и 37.0 ± 1.3%, р = 0.007 соответственно; рис. 3, Б).
Рис. 3.
Влияние γ-излучения на клеточный цикл МСК ЖТ мыши. Распределение клеток по фазам клеточного цикла на 6-м (А, Б) и 30-м (В, Г) пассажах через 24 ч (А, В) и 7 сут (Б, Г) после действия γ-излучения в различных дозах. * Статистически значимые отличия (р ≤ 0.05).
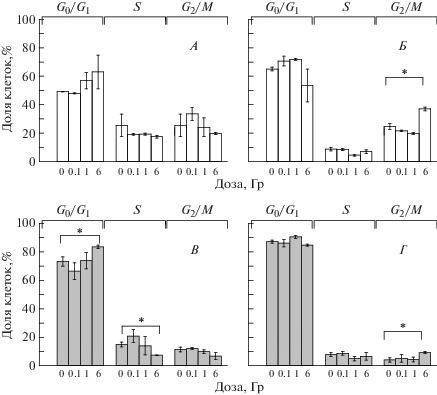
Необлученные МСК ЖТ 30-го пассажа преимущественно находились в фазе G0/G1 (~73%). Через 24 ч после облучения в дозе 6 Гр отмечалось значительное снижение доли клеток в S-фазе (с 15.0 ± 1.7 до 7.4 ± 0.1%, р = 0.04 соответственно) и блок клеточного цикла в фазе G0/G1 (повышение с 73.3 ± 3.3 до 83.5 ± 1.3%, р = 0.04; рис. 3, В). Через 7 сут после воздействия радиации в этой же дозе также наблюдалось значимое повышение доли клеток в фазе G2/M (с 4.1 ± 1.6 до 9.2 ± 1.0%, р = = 0.04 соответственно; рис. 3, Г). Статистически значимых отличий в распределении клеток по фазам клеточного цикла после облучения в дозах 0.1 и 1 Гр не наблюдалось ни на 6-м, ни на 30-м пассажах.
Для изучения степени повреждения и эффективности репарации ДР ДНК в МСК ЖТ 30-го пассажа, подвергшихся действию γ-излучения в дозах 0.1 и 1 Гр, использовали иммуноцитохимический метод с целью определения количества фокусов фосфорилированного гистона γН2АХ. Количественное определение этого белка в ядрах клеток используется в качестве суррогатного маркера ДР ДНК при визуализации фокусов гистона γН2АХ с помощью флуоресцентной микроскопии. Полученные результаты представлены на рис. 4.
Рис. 4.
Определение уровня гистона γH2AX в МСК ЖТ в контрольных (0 Гр) и облученных на 30-м пассаже МСК ЖТ мыши. А – микрофотографии фокусов γН2АХ в клетках МСК ЖТ. Данные флуоресцентной микроскопии. Ядра клеток окрашены флуоресцентным красителем DAPI. Цифрами указано количество фокусов на клетку. Б – содержание гистона γH2AX в МСК ЖТ через 1 и 24 ч после действия γ-излучения. MFI МСК ЖТ составила 4.9 ± 1.2 усл. ед.
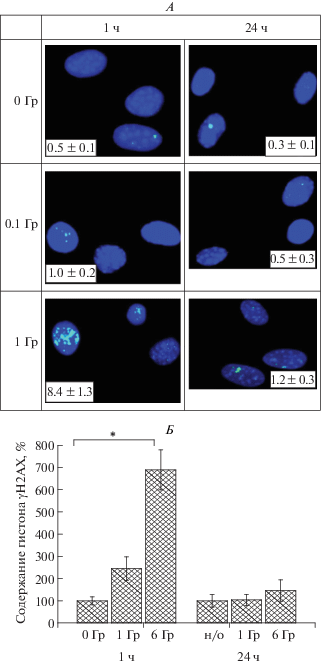
Количество фокусов гистона γН2АХ в необлученных клетках составило 0.5 ± 0.1 фокуса на клетку, через 1 ч после облучения в дозе 0.1 Гр обнаружено повышение этого показателя до 1.0 ± ± 0.2 фокуса на клетку, что свидетельствует о появлении повреждений ДНК в виде ДР в части МСК ЖТ, но эти различия не были статистически значимыми (рис. 4, А). Эффективность репарации ДР ДНК оценивали по уровню гистона γН2АХ в МСК через 24 ч после облучения. В это время количество фокусов гистона γН2АХ в МСК ЖТ, облученных в дозе 0.1 Гр, снизилось и составило 0.5 ± 0.3 фокусов на клетку (рис. 4, А). Это свидетельствует о том, что после облучения МСК ЖТ в дозе 0.1 Гр увеличивается количество ДР в отдельных клетках, но через 24 ч оно возвращается к уровню нормы.
Уровень γН2АХ в МСК ЖТ через 1 ч после облучения в дозе 1 Гр был значимо повышен и составил 8.4 ± 1.3 (р = 0.00002) фокусов на клетку. Через 24 ч этот показатель оставался выше уровня контроля и составлял 1.2 ± 0.3 фокусов на клетку (р = 0.03) (рис. 4, А).
С учетом того, что уровень γН2АХ в МСК-ЖТ через 1 ч после облучения в дозах 1 Гр и выше возрастает значительно, его количественное определение после воздействия в дозах 1 и 6 Гр проводили с помощью проточной цитофлуориметрии. Из представленных данных следует, что через 1 ч после облучения в дозах 1 и 6 Гр имеет место пропорциональное дозе увеличение уровня γН2АХ в клетках, оцениваемое по величине средней интенсивности флуоресценции (MFI) (рис. 4, Б). Однако значимое повышение содержания γН2АХ наблюдали только через 1 ч после облучения клеток в дозе 6 Гр. Через 24 ч после радиационного воздействия в этих дозах уровень гистона γН2АХ в МСК снижался и не отличался от контроля. Как следует из представленных данных, после облучения МСК-ЖТ в дозе 1 и 6 Гр имеет место полная репарация ДР в ДНК. Полученные данные свидетельствуют о более высокой чувствительности метода, использующего прямой подсчет фокусов с помощью микроскопии, при котором через 24 ч после облучения МСК 30-го пассажа даже в дозе 1 Гр еще сохранялось повышенное по сравнению с контролем количество ДР ДНК.
Поскольку важный вклад в повреждения ДНК при действии γ-излучения вносят активные метаболиты кислорода, был исследован уровень митохондриального супероксидного аниона в МСК-ЖТ после облучения. Через 1 ч после радиационного воздействия наблюдалось значимое увеличение доли клеток с повышенным содержанием красителя MitoSOX только в дозе 6 Гр (рис. 5).
Рис. 5.
Уровень продукции активных метаболитов кислорода (АМК) в необлученных (0 Гр) и облученных в дозах 0.1; 1 и 6 Гр (через 1 ч после облучения) МСК ЖТ 30-го пассажа. А – гистограммы накопления красителя MitoSOX. Левый пик – аутофлуоресценция; правый пик – флуоресценция после инкубации с MitoSOX. По оси абсцисс – средняя интенсивность флуоресценции, MFI, усл. ед.; по оси ординат – количество клеток, отн. ед. Б – количество клеток с высоким уровнем накопления MitoSOX (с MFI > > 40 усл. ед.) в МСК ЖТ.

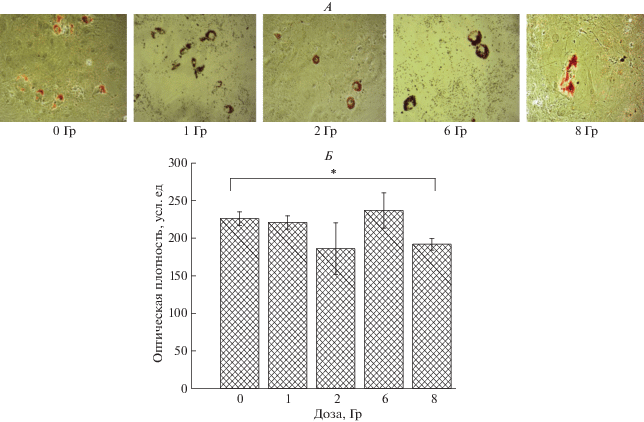
Повреждение ДНК МСК могло привести к изменению их функциональной активности, изменению уровня секреции факторов роста и цитокинов и способности МСК к дифференцировке. Облучение МСК на 30-м пассаже в дозе 0.1 Гр привело к значительному повышению секреции НGF, IL6 и TGFβ, в то время как уровень VEGF не отличался от такового в необлученном контроле (рис. 6). Действие γ-излучения в дозах 1 и 6 Гр существенно не влияло на секрецию VEGF, TGF-β и IL6 (рис. 6, Б–Г), но привело к повышению уровня НGF. При исследовании влияния γ-излучения на способность облученных МСК ЖТ к адипогенной дифференцировке под действием индукторов показано (рис. 7), что значимое уменьшение количества дифференцированных клеток, определяемое по оптической плотности после экстракции красителя Oil Red O, наблюдается только при радиационном воздействии на МСК ЖТ в высокой дозе – 8 Гр.
Рис. 6.
Содержание факторов роста и цитокинов в кондиционированной среде МСК ЖТ мыши через 10 пассажей после облучения клеток на 30-м пассаже в дозах 0.1; 1 и 6 Гр: А – HGF, Б – VEGF, В – TGFβ, Г – IL-6.
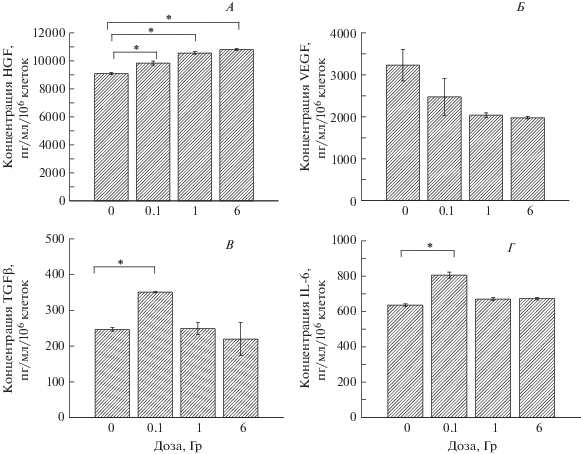
Рис. 7.
Адипогенная дифференцировка МСК ЖТ после облучения клеток на 30-м пассаже. А – микрофотографии МСК ЖТ после двухнедельной индукции дифференцировки через 5 сут после облучения. Окрашивание Oil Red O. Световая микроскопия, ув. ×20. Б – количество дифференцированных клеток по отношению к контролю, оцененное по оптической плотности после экстракции Oil Red O.
ОБСУЖДЕНИЕ
Анализ фенотипа выделенных из ЖТ клеток подтверждает их принадлежность к МСК ЖТ (рис. 1, А). При сравнении необлученных культур МСК ЖТ на 6 и 30 пассажах значительные различия обнаружены нами в АТ в этих клетках: она была высокой на 6-м пассаже и крайне низкой на 30-м (рис. 1, Б). АТ, наряду с другими факторами, может повышать устойчивость клеток к облучению [12, 13].
На 6-м пассаже обнаружена более низкая скорость пролиферации клеток, которую оценивали по времени их удвоения. Оно составило 39.7 ч по сравнению с 32.5 ч для МСК 30-го пассажа (р < < 0.05) (рис. 2, Г). В то же время по уровню секреции цитокинов клетки на этих пассажах практически не различались (рис. 1, В).
Через 7 сут после воздействия γ-излучения обнаружены статистически значимые отличия между МСК ЖТ, облученными на раннем и позднем пассажах, по количеству выживших клеток, которое значимо снижалось при дозах 0.1 и 1 Гр при облучении клеток только на 30-м пассаже. Однако не выявлено различий рассматриваемого показателя между МСК ЖТ, подвергшихся воздействию γ-излучения на 6-м и 30-м пассажах, через 14 сут их культивирования. Как отмечено выше, нами показано, что время удвоения МСК ЖТ на 6-м пассаже было на 7 ч выше, чем на 30-м пассаже, что свидетельствует об ускорении пролиферации МСК ЖТ мыши при длительном культивировании. При этом облучение этих клеток на 30-м пассаже в дозах 0.1 и 1 Гр не влияло на время их удвоения, в то время как при воздействии на 6-м пассаже оно увеличивалось (рис. 2, Г). Это и способствовало “выравниванию” количества клеток к 14-м суткам при облучении культур МСК на 6-м и 30-м пассажах. Возможно также, что эти различия в какой-то степени связаны с низкой АТ и включением альтернативных механизмов сохранения длины теломер.
Следует подчеркнуть, что и эффективность клонирования, и клоногенная активность МСК ЖТ после облучения клеток на 6-м и 30-м пассажах не различались (рис. 2, В). Эти данные позволяют заключить, что количество собственно стволовых клеток в препаратах МСК – тех клеток, которые определяют эффективность клонирования, оцениваемую по образованию колоний, – одинаково на 6-м и 30-м пассажах. Однако после 30 пассажей в культуре увеличивается скорость пролиферации прогениторных клеток, что приводит к повышению их радиочувствительности и определяет снижение их количества после облучения в дозах 0.1 и 1 Гр по сравнению с клетками, подвергшимися воздействию на 6-м пассаже (рис. 2, А, Б).
При сравнении изменений клеточного цикла МСК ЖТ, облученных на 6-м и 30-м пассажах, показано, что действие γ-излучения в малой дозе – 0.1 Гр – и в высоких дозах 1 и 6 Гр на клетки 6-го пассажа не приводило к нарушениям клеточного цикла через 1 сут после воздействия, но вызывало блок клеточного цикла на 7-е сутки в фазе G2/M (рис. 3, А, Б). В то же время при облучении МСК ЖТ на 30-м пассаже в дозе 6 Гр блок клеточного цикла обнаружен в фазе G0/G1, который сопровождается снижением доли клеток в S-фазе уже через 24 ч. Через 7 сут после облучения МСК ЖТ в дозе 6 Гр на 30-м пассаже, так же как и на 6-м, наблюдался блок цикла в фазе G2/M (рис. 3, В, Г). Эти результаты свидетельствуют о длительном, по крайней мере до 7 сут после облучения в дозе 6 Гр, сохранении части повреждений ДНК, которые клетки идентифицируют и репарируют в точке контроля в фазе G2/M. Основными путями репарации ДР являются негомологичное соединение концов (НГСК) и гомологичная рекомбинация (ГР). Наибольший вклад в быструю репарацию вносит процесс НГСК, ответственный за репарацию основного количества ДР, образованных в результате действия редкоионизирующего излучения [14]. Репарация путем НГСК идет в любой фазе клеточного цикла, в то время как ГР, для которой необходима сестринская хроматида, использующаяся в качестве матрицы для репарации поврежденной хроматиды, содержащей ДР, идет только в S- и G2-фазах клеточного цикла. Именно в этих фазах цикла клетки используют ГР для репарации двунитевых разрывов [15]. Аналогичные данные в отношении блока клеточного цикла через 24 ч в МСК ЖТ у мышей лини BALB/c после облучения в дозе 6 Гр получены O.M. Maria и соавт. [16]. Блок клеточного цикла в фазе G2/M и репарацию ДР ДНК в результате ГР в МСК после облучения авторы рассматривают как один из механизмов, определяющих радиорезистентность МСК ЖТ.
Изучение способности МСК ЖТ на 30-м пассаже к репарации ДР ДНК проводили путем анализа образования и элиминации количества фокусов или уровня γН2АХ.
При определении количества ДР, регистрируемого по числу фокусов γН2АХ через 1 ч после воздействия γ-излучения в дозе 0.1 Гр на МСК 30-го пассажа, показано, что оно значимо не отличалось от необлученного контроля, а через 24 ч соответствовало уровню спонтанных повреждений ДНК. Значительное повышение содержания фокусов γН2АХ наблюдалось через 1 ч после облучения клеток в дозе 1 Гр. После облучения в этой дозе через 24 ч количество фокусов оставалось повышенным по сравнению с контролем (рис. 4, А), что свидетельствует о неполной репарации ДР ДНК к этому времени. В то же время по данным проточной цитофлуориметрии через 24 ч после облучения МСК ЖТ в дозах 1 и даже 6 Гр имела место полная репарация ДР в ДНК (рис. 4, Б), что свидетельствует о недостаточной чувствительности этого метода для выявления низких уровней ДР ДНК. Сравнивая уровень образования γН2АХ в МСК ЖТ и в МСК из костного и головного мозга мыши следует отметить, что через 1 ч после облучения в дозе 1 Гр он возрастал в 2.5; 2.2 и 2.2 раза, а при дозе 6 Гр – в 6.8; 3.8 и 4.4 раза соответственно. При этом через 24 ч после воздействия в дозе 6 Гр остаточный уровень γН2АХ оставался повышенным в этих клетках на 40% (р > 0.05), 70% (р < 0.05) и 40% (р < 0.05) соответственно [11], что свидетельствует о более эффективной репарации ДР ДНК в МСК ЖТ и головного мозга, чем в МСК из костного мозга.
Облучение МСК ЖТ в дозе 6 Гр приводило к увеличению доли клеток с высоким уровнем митохондриального супероксидного радикала (рис. 5), что может быть дополнительным фактором повреждения клеток.
Показана сохранность функциональной активности МСК ЖТ после их облучения на 30-м пассаже, что определялось по уровню секреции цитокинов VEGF, HGF, IL-6 и TGF-β (рис. 6). При этом после действия γ-излучения на МСК ЖТ в дозе 0.1 Гр уровень секреции белков HGF, IL-6 и TGF-β значимо повышался, уровень VEGF соответствовал необлученному контролю, и даже после облучения в дозах 1 и 6 Гр секреция этих факторов не снижалась. Эффективность дифференцировки в адипоциты под влиянием γ-излучения уменьшалась только после облучения МСК ЖТ в самой большой дозе – 8 Гр (рис.7, Б).
Таким образом, при длительном культивировании МСК ЖТ – до 30-го пассажа, несмотря на значительное снижение АТ, наблюдается низкий уровень спонтанных фокусов γН2АХ, сохранение способности клеток к активной репарации ДР ДНК и восстановлению пролиферативной активности после действия γ-излучения. Контрольные и облученные в сублетальных дозах МСК ЖТ сохраняли способность к секреции факторов роста и цитокинов и способность к дифференцировке. Совокупность представленных данных свидетельствует о резистентности МСК ЖТ к сублетальным дозам γ-излучения (до 6 Гр) и сохранении их функций в зонах, расположенных вблизи от облучаемой в процессе лучевой терапии области.
Список литературы
Akita S., Akino K., Hirano A. et al. Mesenchymal stem cell therapy for cutaneous radiation syndrome // Health Phys. 2010. V. 98. № 6. P. 858–862.
Tolar J., Le Blanc K., Keating A., Blazar B. R. Concise review: hitting the right spot with mesenchymal stromal cells // Stem Cells. 2010. V. 28. P. 1446–1455.
Stem cell biology with respect to carcinogenesis aspects of radiological protection. ICRP Publication 131 // Ann. ICRP. 2015. V. 44. № 3/4. P. 7–357.
Lynam-Lennon N., Reynolds J.V., Pidgeon G.P. et al. Alterations in DNA repair efficiency are involved in the radioresistance of esophageal adenocarcinoma // Radiat. Res. 2010. V. 174. P. 703–711.
Wang Y., Zhang Z., Chi Y. et al. Long-term cultured mesenchymal stem cells frequently develop genomic mutations but do not undergo malignant transformation // Cell Death. Dis. 2013. V. 5. № 4. P. e950.
Baxter M.A., Wynn R.F., Jowitt S.N. et al. Study of telomere length reveals rapid aging of human marrow stromal cells following in vitro expansion // Stem Cells. 2004. V. 22. № 5. P. 675–682.
Zuk P.A., Zhu M., Mizuno H. et al. Multilineage cells from human adipose tissue: implications for cell-based therapies // Tissue Eng. 2001. V. 7. № 2. P. 211–228.
Glukhov A.I., Zimnik O.V., Gordeev S.A., Severin S.E. Inhibition of telomerase activity of melanoma cells in vitro by antisense oligonucleotides // Biochem. Biophys. Res. Commun. 1998. V. 248. P. 368–371.
Macphail S.H., Banath J.P., Yu T.Y. et al. Expression of phosphorylated histone H2AX in cultured cell lines following exposure to X-rays // Int. J. Radiat. Biol. 2003. V. 79. № 5. P. 351–358.
Krutzik P., Nolan G. Intracellular phospho-protein staining techniques for flow cytometry: monitoring single cell signaling events // Cytometry Part A. 2003. V. 55A. P. 61–70.
Москалёва Е.Ю., Сёмочкина Ю.П., Родина А.В. И др. Влияние облучения на мезенхимальные стволовые клетки костного и головного мозга мыши и их способность индуцировать опухоли // Радиац. биология. Радиоэкология. 2017. Т. 57. № 3. С. 245–256.
Wong K.K., Chang S., Weiler S.R. et al. Telomere dysfunction impairs DNA repair and enhances sensitivity to ioni-zing radiation // Nat. Genet. 2000. V. 26. P. 85–88.
Sishc B.J, Nelson C.B., McKenna M.J. et al. Telomeres and Telomerase in the Radiation Response: Implications for Instability, Reprograming, and Carcinogenesis // Front Oncol. 2015. V. 24. № 5. P. 257.
Kakarougkas A., Jeggo P.A. DNA DSB repair pathway choice: an orchestrated handover mechanism // Br. J. Radiol. 2014. V. 87. № 1035. P. 20130685
Shrivastav M., De Haro L.P., Nickoloff J.A. Regulation of DNA double-strand break repair pathway choice // Cell Res. 2008. V. 18. № 1. P. 134–147.
Maria O.M., Kumala S., Heravi M. et al. Adipose me-senchymal stromal cells response to ionizing radiation // Cytotherapy. 2016. V. 18. № 3. P. 384–401.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


