Радиационная биология. Радиоэкология, 2019, T. 59, № 3, стр. 255-260
ИЗМЕНЕНИЕ СОСТАВА И ФЛУОРЕСЦЕНТНЫХ СВОЙСТВ БИСРЕТИНОИДОВ В СЕТЧАТКЕ И РЕТИНАЛЬНОМ ПИГМЕНТНОМ ЭПИТЕЛИИ ГЛАЗА МЫШИ ПРИ ДЕЙСТВИИ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ
М. А. Яковлева 1, *, К. Н. Ляхова 2, Д. М. Утина 2, Ю. В. Виноградова 2, И. А. Колесникова 2, Т. Б. Фельдман 1, 3, М. А. Островский 1, 2, 3
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Лаборатория радиационной биологии Объединенного института ядерных исследований
Дубна, Россия
3 Биологический факультет Московского государственного университета им. М.В. Ломоносова
Москва, Россия
* E-mail: lina.invers@gmail.com
Поступила в редакцию 20.07.2018
Аннотация
Проведен флуоресцентный и хроматографический анализ бисретиноидов из сетчатки и ретинального пигментного эпителия глаз мышей до и после воздействия на них ускоренными протонами в пике Брэгга. Показано, что в результате воздействия ионизирующего излучения в дозах 1–4 Гр происходит сдвиг в коротковолновую область максимума спектра флуоресценции хлороформного экстракта, полученного как из ретинального пигментного эпителия, так и из сетчаток. Хроматографический анализ этих экстрактов показал изменение относительного содержания отдельных бисретиноидов. Полученные спектральные и хроматографические данные свидетельствуют о том, что воздействие на мышей ускоренными протонами в пике Брэгга в дозах 1–4 Гр приводит в тканях глаза к радиационному окислению бисретиноидов.
Моделирование биологического действия космических видов радиации на структуры мозга и глаза, и оценка риска их повреждающего действия [1], а также моделирование побочного эффекта радиационной терапии опухолей мозга и глаза [2, 3] являются важнейшими направлениями современной радиобиологии. В этой связи исследование радиационного воздействия на сетчатку и ретинальный пигментный эпителий (РПЭ) глаза представляет существенный интерес для оценки рисков от космического излучения и лучевой терапии на зрительную систему. Одновременно сетчатка и РПЭ глаза могут рассматриваться в качестве удобной модели для изучения последствий воздействия различных видов радиации на организм в целом.
Весьма вероятно, что при радиационном воздействии (ускоренные протоны, γ-излучение, тяжелые заряженные частицы) инициируется ускоренное старение структур глаза, а также вероятен риск развития дегенеративных заболеваний сетчатки. Ярким примером повреждающего действия тяжелых заряженных частиц на глаз служит ускоренное развитие катаракты при исключительно малых дозах [4].
Характерным процессом и маркером старения сетчатки и РПЭ глаза является накопление в клетках РПЭ так называемого “пигмента старости” – липофусциновых гранул (ЛГ) [5]. Эти гранулы образуются в клетках РПЭ в результате неполной лизосомальной деградации фагосом – “обломков” наружных сегментов фоторецепторных клеток [6]. Особенно интенсивно накопление ЛГ происходит при развитии дегенеративных заболеваний сетчатки и РПЭ [7, 8].
ЛГ обладают двумя важными свойствами: во-первых, они способствуют образованию при действии света активных форм кислорода (АФК) [9, 10], что объясняет их фототоксичность, и, во-вторых, ЛГ обладают выраженными флуоресцентными свойствами, на которых основан современный неинвазивный метод диагностики дегенеративных заболеваний – метод аутофлуоресценции глазного дна [11].
Фототоксичность и флуоресцентные свойства ЛГ обусловлены наличием в них конъюгатов полностью-транс ретиналя, так называемых бисретиноидов – бис-ретинилиденэтаноламина (А2Е) и его производных [12, 13]. В течение жизни бисретиноиды в составе ЛГ постоянно подвергаются воздействию света, что приводит к их фотоокислению и фотодеградации, и они, как известно, могут инициировать деструктивные процессы в клетках РПЭ и сетчатки [14].
Как нами недавно было показано, относительное содержание продуктов фотоокисления и фотодеградации бисретиноидов в составе ЛГ повышается с возрастом и при патологии; при этом в случае патологии наблюдается смещение максимума спектра флуоресценции ЛГ в коротковолновую область [12, 15]. Можно думать, что и после радиационного воздействия максимум спектра флуоресценции ЛГ сместится. Такое предположение основано на известных в литературе экспериментальных данных о том, что при действии различных видов ионизирующего излучения в клетках организма образуются АФК и развивается окислительный стресс, который может привести к гибели клетки [16–18]. Не исключено, что АФК могут инициировать окисление бисретиноидов как в фоторецепторных клетках, так и в клетках РПЭ и в отсутствие света. Таким образом, повышенное содержание продуктов окисления бисретиноидов ЛГ может стать диагностическим показателем окислительного стресса в клетках РПЭ и сетчатки в результате воздействия ионизирующего излучения. Поэтому исследование качественного и количественного состава бисретиноидов ЛГ в клетках РПЭ и сетчатке глаза экспериментальных животных, подвергшихся радиационному воздействию, может стать основой как для понимания механизмов повреждающего действия радиации на структуры глаза и диагностики такого повреждающего действия, так и для оценки уровня оксидативного стресса организма в целом при действии на него космического излучения и вследствие радиационной терапии опухолей. Иными словами, ЛГ могут стать универсальными маркерами оксидативного стресса в организме, подвергшемся воздействию ионизирующего излучения.
Целью данной работы было проведение флуоресцентного и хроматографического анализа бис-ретиноидов, выделенных из клеток РПЭ и сетчатки глаза мыши до и после воздействия на нее ионизирующего излучения.
МАТЕРИАЛЫ И МЕТОДИКА
Для эксперимента были использованы самцы мышей, гибриды первого поколения от скрещивания C57BL и CBA, возраст 6 мес, средняя масса 31 г.
Мыши были подвергнуты облучению ускоренных протонов на медицинском пучке фазотрона Объединенного института ядерных исследований (г. Дубна). Средняя энергия протонов на входе в кабину перед замедлителем составляла 170 МэВ. Энергия частиц в кабине была определена по пробегу пучка в воде (R = 200 мм воды). Измерения проводили полупроводниковым кремниевым детектором. Среднее значение ЛПЭ на входе пучка составляло 0.49 кэВ/мкм. Дозиметрическая калибровка пучка в каждой точке глубинного дозового распределения проводилась ионизационной камерой ТМ30013 клинического дозиметра PTW UNIDOS-E. Облучение животных проводили в пике Брэгга в дозах 1, 2, 3 и 4 Гр при толщине дополнительного замедлителя, равной 190 мм. Мощность дозы на входе пучка без дополнительного замедлителя составляла 1 Гр/мин, мощность дозы в точке облучения на тело мыши (90% от уровня дозы в пике Брэгга) составляла 1.42 Гр/мин.
Животных облучали в специальных индивидуальных фиксаторах для удерживания мышей в неподвижном состоянии (по четыре особи одновременно). Фиксаторы имели цилиндрическую форму с двумя подвижными ограничителями с обеих сторон. Фиксаторы были изготовлены из прозрачного акрилового пластика (оргстекло), размером 90 × 30 × 26 (мм).
Через сутки после облучения был произведен забой животных методом цервикальной дислокации, с последующим изъятием глаз, из которых затем извлекали отдельно сетчатку и РПЭ. Экстракт флуорофоров из сетчатки и клеток РПЭ получали по методу Фолча смесью хлороформ–метанол (1 : 1) [19]. Спектры флуоресценции суспензии РПЭ регистрировали на спектрофлуориметре Shimadzu RF-5301PC (“Shimadzu”, Япония). Анализ флуорофоров (бисретиноидов) в хлороформных экстрактах РПЭ и сетчаток из глаз мышей проводили методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на хроматографе фирмы “Knauer” (Германия) с колонкой “Диасфер 120 С18” (4 × 250 мм, размер сорбента 5 мкм). Разделение проводили путем линейного градиентного элюирования [12]. В качестве контроля использовали А2Е, синтезированный согласно методу, описанному в работе [20], а также стандарт полностью-транс ретиналя (ПТР) фирмы Sigma-Aldrich. Значения достоверности различия между группами (р) были посчитаны с использованием критерия Стьюдента.
Все эксперименты проводились в соответствии с “Правилами проведения работ с использованием экспериментальных животных” (Приказ МЗ СССР № 755 от 12.08.1977 г.) и “Международными рекомендациями по проведению биомедицинских исследований с использованием животных” Советом международных медицинских научных организаций (CIOMS), Женева, 1995 г.
РЕЗУЛЬТАТЫ
Флуоресцентный анализ хлороформных экстрактов РПЭ и сетчаток из глаз мышей
На рис. 1 представлены спектры флуоресценции хлороформных экстрактов РПЭ (А) и сетчаток из глаз мышей (Б), полученных на следующий день после воздействия на животных ионизирующим излучением в дозах 1–4 Гр.
Рис. 1.
Спектры флуоресценции хлороформных экстрактов РПЭ (А) и сетчаток (Б) из глаз мышей до и после воздействия ускоренными протонами в пике Брэгга в дозах 1–4 Гр: 1 – контроль, 2 – 1 Гр, 3 – 2 Гр, 4 – 3 Гр, 5 – 4 Гр. Возбуждение флуоресценции длиной волны – 488 нм.
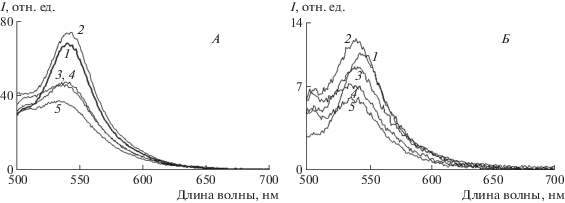
Из рис. 1, А видно, что при увеличении дозы ионизирующего облучения максимумы спектров флуоресценции хлороформного экстракта из РПЭ постепенно сдвигаются в коротковолновую область на ~10 нм. Аналогичная картина наблюдается и в случае флуоресцентного анализа хлороформного экстракта сетчаток из глаз мышей (рис. 1, Б). Этот сдвиг также составил примерно 10 нм. Следует отметить, что при дозе в 1 Гр в обоих случаях наблюдается небольшое увеличение интенсивности флуоресценции, а при дальнейшем увеличении дозы можно отметить заметное уменьшение интенсивности флуоресценции. Эти изменения флуоресцентных свойств экстрактов РПЭ и сетчаток указывают на то, что воздействие ионизирующего излучения на мышей приводит, по всей видимости, как к качественному, так и количественному изменению состава флуорофоров в клетках РПЭ и сетчатки глаза мыши.
Результаты флуоресцентного анализа хлороформных экстрактов РПЭ и сетчатки из глаз мышей, подвергшихся действию ускоренных протонов, позволяют проводить аналогию с результатами флуоресцентного анализа хлороформных экстрактов ЛГ из клеток РПЭ человека [12, 21]. Ранее нами было показано, что при облучении видимым светом этих экстрактов происходит фотоокисление и фотодеградация бисретиноидов, что в свою очередь приводит к коротковолновому сдвигу спектра флуоресценции. В этом эксперименте сами бисретиноиды ЛГ являются источником АФК [9, 10]. Можно предположить, что и в случае ионизирующего излучения АФК также могут окислять бисретиноиды, но уже в отсутствие света. Известно, что ионизирующее излучение повышает внутриклеточный уровень АФК за счет дисфункции митохондрий [16–18].
ВЭЖХ-анализ хлороформных экстрактов РПЭ и сетчаток из глаз мышей
На рис. 2 представлены примеры ВЭЖХ-анализа хлороформных экстрактов из РПЭ (А) и сетчаток из глаз мышей (Б) до и после воздействия ускоренными протонами. Вещества на хроматограмме: пики 1, 2 – окисленные формы А2Е [12]; пик 3 – полностью-транс ретиналь; пик 4 – А2Е [20]; пик 5 – продукты модификации А2Е [13, 22, 23].
Рис. 2.
Характерные хроматограммы хлороформного экстракта из клеток РПЭ (А) и сетчаток (Б) глаз мышей до и после воздействия ускоренными протонами. Контроль – верхняя часть рисунка; воздействие ускоренными протонами в пике Брэгга в дозе 2 (для сетчатки) и 4 (для РПЭ) Гр – нижняя часть рисунка. Детектирование на длине волны – 430 нм.
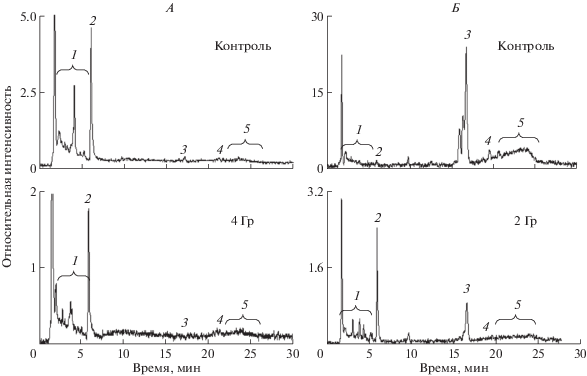
В образцах хлороформных экстрактов РПЭ (рис. 2, А, контроль) изначально присутствует А2Е, как и у человека, но в гораздо меньших количествах, что согласуется с литературными данными [24]. При воздействии ионизирующего излучения с увеличением дозы происходит снижение содержания А2Е и ПТР. Также наблюдается снижение относительного содержания веществ из группы пиков 1. Относительное содержание веществ, определяющихся пиком 2, а также группой пиков 5, увеличивается (таблица 1). Другими словами, по-видимому, ионизирующее излучение приводит к окислению и/или модификации АТР, А2Е и других бисретиноидов.
Таблица 1.
Относительное содержание различных бисретиноидов и их производных в хлороформном экстракте РПЭ и сетчаток из глаз мышей до и после воздействия на них ускоренными протонами в пике Брэгга (ВЭЖХ анализ)
| № пика* | Контроль | 1 Гр | 2 Гр | 3 Гр | 4 Гр |
|---|---|---|---|---|---|
| % | |||||
| Хлороформный экстракт РПЭ | |||||
| 1 | 33.4 ± 2.7 | 33.7 ± 2.6 | 23.1 ± 1.9 | 27.4 ± 1.5 | 24.4 ± 2.5 |
| 2 | 28.1 ± 2.1 | 50.7 ± 3.7 | 52.1 ± 4.3 | 48.1 ± 2.9 | 40.1 ± 3.1 |
| 3-ПТР | 14.6 ± 1.7 | 2.3 ± 0.9 | 1.4 ± 0.3 | 1.5 ± 0.5 | 5.5 ± 1.2 |
| 4-А2Е | 13.0 ± 1.9 | 4.1 ± 0.8 | 4.3 ± 0.5 | 3.1 ± 0.7 | 4.1 ± 1.0 |
| 5 | 10.9 ± 0.9 | 9.2 ± 1.3 | 19.1 ± 2.1 | 19.9 ± 1.6 | 25.9 ± 2.6 |
| Хлороформный экстракт сетчаток | |||||
| 1 | 23.9 ± 5.1 | 25.0 ± 1.5 | 46.2 ± 4.2 | 36.4 ± 1.5 | 38.9 ± 2.3 |
| 2 | 10.4 ± 1.2 | 10.1 ± 0.2 | 10.9 ± 1.5 | 12.2 ± 1.0 | 13.2 ± 1.4 |
| 3-ПТР | 33.5 ± 3.2 | 31.2 ± 2.5 | 23.3 ± 3.2 | 20.1 ± 2.1 | 19.3 ± 1.8 |
| 4-А2Е | 4.3 ± 0.8 | 7.4 ± 0.7 | 6.1 ± 1.1 | 13.2 ± 0.9 | 9.3 ± 1.1 |
| 5 | 27.9 ± 2.4 | 26.3 ± 1.2 | 13.5 ± 1.7 | 18.1 ± 1.1 | 19.3 ± 2.0 |
* Номер пика соответствует номеру пика на хроматограммах рис. 2. р ≤ 0.01. M ± m, n = 3.
В образцах хлороформных экстрактов сетчаток (рис. 2, Б) можно отметить высокий уровень изначального содержания ПТР (в отличие от РПЭ), а также присутствует А2Е, что согласуется с литературными данными [24]. При действии ионизирующего излучения относительное содержание ПТР в сетчатке, как и в РПЭ, падает (таблица 1). Но есть и отличия. В сетчатке, в отличие от РПЭ, нарастает относительное содержание А2Е и веществ группы пиков 1 и 2. А содержание веществ группы пиков 5, наоборот, уменьшается. Можно предположить, что высвобождающийся в больших количествах ПТР, являющийся хромофором родопсина, активно взаимодействует с фосфатидилэтаноламином, входящим в состав фоторецепторной мембраны, а затем модифицируется в форму А2Е [25].
Таким образом, ВЭЖХ-анализ хлороформных экстрактов РПЭ и сетчаток из глаз мышей выявил изменения в количественном и качественном составе бисретиноидов и их производных в результате воздействия ускоренных протонов на животных.
ОБСУЖДЕНИЕ
Флуоресцентный и ВЭЖХ анализ показал, что воздействие ионизирующего излучения на РПЭ и сетчатку глаза мыши приводит к изменению количественного и качественного содержания бис-ретиноидов и их производных в ЛГ РПЭ и фоторецепторных клетках сетчатки. Эти изменения аналогичны процессам фотоокисления и фотодеградации бисретиноидов и их производных, наблюдаемых в РПЭ глаза человека [12, 21]. Можно предположить, что происходит окисление бисретиноидов и их производных в результате действия излучения как на сами ЛГ гранулы и фоторецепторные клетки сетчатки, так и на митохондрии [16–18] и другие органеллы в клетках РПЭ и сетчатки.
Таким образом, радиационно-индуцированные изменения флуоресцентных свойств ЛГ могут стать маркером оксидативного стресса как в структурах глаза, так и организма в целом. Для обнаружения таких радиационно-индуцированных изменений можно использовать современный неинвазивный метод диагностики в офтальмологии – метод аутофлуоресценции глазного дна, поскольку основной вклад в такую аутофлуоресценцию вносят ЛГ. Для регистрации и количественной оценки повышенного содержания окисленных форм бисретиноидов и их производных нами предложена модификация метода и самого прибора, измеряющего такую аутофлуоресценцию глазного дна [15, 26, 27].
Список литературы
Григорьев А.И., Красавин Е.А., Островский М.А. К оценке риска биологического действия галактических тяжелых ионов в условиях межпланетного полета // Рос. физиол. журн. им. И.М. Сеченова. 2013. Т. 99. № 3. С. 273–280.
Tommasino F., Durante M. Proton radiobiology // Proton Radiobiol. Cancers. 2015. V. 7. № 1. P. 353–381.
Liu C.Y., Francis J.H., Brodie S.E., et al. Retinal toxicities of cancer therapy drugs // Retina. 2014. V. 34. № 7. P. 1261–1280.
Worgul B.V. Accelerated heavy particles and the lens // Ophthal. Res. 1988. V. 20. №3. P. 143–148.
Jung T., Bader N., Grune T. Lipofuscin: formation, distribution, and metabolic consequences // Ann. NY Acad. Sci. 2007. V. 1119. P. 97–111.
Geng L., Wihlmark U., Algvere P.V. Lipofuscin accumulation in iris pigment epithelial cells exposed to photoreceptor outer segments // Exp. Eye Res. 1999. V. 69. P. 539–546.
Sparrow J.R., Boulton M.E. RPE lipofuscin and its role in retinal photobiology // Exp. Eye Res. 2005. V. 80. P. 595–606.
Holz F.G., Pauleikhoff D., Klein R., Bird A.C. Pathoge-nesis of lesions in late age-related macular disease // Am. J. Ophthalmol. 2004. V. 137. P. 504–510.
Островский М.А., Донцов А.Е., Сакина Н.Л., Боултон М., Джарвис-Эванс Дж. Способность липофусциновых гранул из липидов при действии видимого света // Сенсорные cистемы. 1992. Т. 6. № 3. С. 51–54.
Boulton M., Dontsov A., Jarvis-Evans J., Ostrovsky M., Svistunenko D. Lipofuscin is a photoinducible free ra-dical generator // J. Photochem. Photobiol. B: Biol. 1993. V. 19. P. 201–204.
Von Ruckmann A, Fitzke F.W., Bird A.C. In vivo fundus autofluorescence in macular dystrophies // Arch. Ophthalmol. 1997. V. 115. P. 609–615.
Feldman T.B., Yakovleva MA., Arbukhanova P.M. et al. Changes in spectral properties and composition of lipofuscin fluorophores from human-retinal-pigment epithelium with age and pathology // Analyt. Bioanalyt. Chemy. 2015. V. 407. № 4. P. 1075–1088.
Wu Y., Fishkin N.E., Pande A. et al. Novel lipofuscin bis-retinoids prominent in human retina and in a model of recessive Stargardt disease // J. Biol. Chem. 2009. V. 284. P. 20155–20166.
Sparrow J.R., Zhou J., Cai B. DNA Is a Target of the Photodynamic Effects Elicited in A2E-Laden RPE by Blue-Light Illumination // Invest. Ophthalmol. Visual Scie. 2003. V. 44. P. 2245–2251.
Feldman T.B., Yakovleva M.A., Larichev A.V. et al. Spectral analysis of fundus autofluorescence pattern as a tool to detect early stages of degeneration in the retina and retinal pigment epithelium // EYE. 2018. V. 32. № 9. P. 1440–1448. https://doi.org/https://doi.org/10.1038/s41433-018-0109-0
Chien T., Tseng T.L., Wang J.Y. et al. albicans DBF4 gene inducibly duplicated by the mini-Ura-blaster is involved in hypha-suppression // Mutat. Res. 2015. V. 779. P. 78–85.
Saha A.K., Kappes F., Mundade A. et al. Intercellular trafficking of the nuclear oncoprotein DEK // Proc. Natl. Acad. Sci. U.S.A. 2013. V. 110. № 17. P. 6847–52.
Kobashigawa S., Suzuki K., Yamashita S. Ionizing radiation accelerates Drp1-dependent mitochondrial fission, which involves delayed mitochondrial reactive oxygen species production in normal human fibroblast-like cells // Biochem. Biophys. Res. Commun. 2011. V. 414. № 4. P. 795–800.
Folch J., Lees M., Stanley G.H.S. A simple method for the isolation and purification of total lipides from animal tissues // J. Biol. Chem. 1957. V. 226. P. 497–509.
Parish C.A., Hashimoto M., Nakanishi K. et al. Isolation and one-step preparation of A2E and iso-A2E, fluorophores from human retinal pigment epithelium // Proc. Natl. Acad. Sci. USA. 1998. V. 95. № 25. P. 14609-13.
Фельдман Т.Б., Яковлева М.А., Донцов А.Е., Островский М.А. Спектры флуоресценции и возбуждения флуорофоров липофусциновых гранул, полученных из ретинального пигментного эпителия кадаверных глаз человека // Изв. Акад. наук. Сер. xим. 2010. № 1. С. 269–276.
Kim S.R., Jang Y.P., Jockusch S. et al. The all-trans-re-tinal dimer series of lipofuscin pigments in retinal pigment epithelial cells in a recessive Stargardt disease model // Proc. Natl. Acad. Sci. USA. 2007. V. 104. P. 19273–19278.
Sparrow J.R., Wu Y., Nagasaki T. et al. Fundus autofluorescence and the bisretinoids of retina // Photochem. Photobiol. Sci. 2010. V. 9. P. 1480–1489.
Radu R.A., Mata N.L., Bagla A., Travis G.H. Light exposure stimulates formation of A2E oxiranes in a mouse model of Stargardt’s macular degeneration // PNAS. 2004. V. 101. № 16. P. 5928–5933.
Sparrow J.R., Wu Y., Kim C.Y., Zhou J. Phospholipid meets all-trans-retinal: the making of RPE bisretinoids // J. Lipid. Res. 2010. V. 51. P. 247–261.
Фельдман Т.Б., Островский М.А., Яковлева М.А. и др. Способ раннего выявления возрастной макулярной дистрофии сетчатки: Патент РФ на изобретение № 2651126, апрель, 2018.
Ларичев А.В., Панченко В.Я., Островский М.А., Фельдман Т.Б. Оптическое устройство для исследования глазного дна с целью выявления возрастной макулярной дистрофии сетчатки: Патент на полезную модель № 176795, январь, 2018.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


