Радиационная биология. Радиоэкология, 2019, T. 59, № 3, стр. 279-285
Влияние индралина на иммуно-гематологические показатели и поврежденность ДНК облученных аутбредных мышей ICR (CD-1)
А. Ю. Бушманов 1, Н. Ю. Воробьёва 1, 2, Т. М. Блохина 1, 2, И. Е. Андрианова 1, Н. М. Ставракова 1, Т. М. Бычкова 1, 3, О. В. Никитенко 1, 3, Е. И. Яшкина 1, А. В. Гордеев 1, Т. А. Караулова 1, М. Д. Воронцова 1, М. А. Игнатов 1, А. Н. Осипов 1, 2, А. А. Иванов 1, 3, 4, *
1 Государственный научный центр Российской Федерации –
Федеральный медицинский биофизический центр им. А.И. Бурназяна ФМБА России
Москва, Россия
2 Институт химической физики им. Н.Н. Семенова РАН
Москва, Россия
3 Государственный научный центр Российской Федерации –
Институт медико-биологических проблем РАН
Москва, Россия
4 Объединенный институт ядерных исследований
Дубна, Россия
* E-mail: a1931192@mail.ru
Поступила в редакцию 04.06.2018
Аннотация
Радиопротектор индралин (препарат Б-190) при внутрижелудочном введении за 15 мин до облучения аутбредных мышей ICR (CD-1) SPF-категории рентгеновским излучением в дозах 6 Гр (СД-10/30), 6.5 и 7 Гр (СД-100/30) повышает 30-суточную выживаемость животных, благоприятно влияет на состояние центральных органов иммунитета и гемопоэза, а также содержание лейкоцитов периферической крови. Кроме того, отмечено позитивное влияние на поведенческие реакции облученных животных и силу поперечнополосатой мускулатуры. Помимо перечисленных вторичных признаков благоприятного действия индралина, отмечено существенное снижение в клетках селезенки количества радиационно-индуцированных повреждений ДНК, регистрируемых проточно-цитометрическим анализом фосфорилированного гистона Н2АХ (γН2АХ) (1 ч и 8 сут после облучения) и методом ДНК-комет (8 сут после облучения). Указанные тесты рекомендуются для использования в экспериментах по изучению влияния противолучевых средств на процессы образования и репарации повреждений ДНК в облученном организме, а также в первичном отборе потенциальных радиопротекторов и оценке уровня их эффективности в клинике и эксперименте.
Расшифровка механизмов противолучевого действия радиопротекторов различных классов является одной из главных задач радиационной фармакологии, так как на этой основе возможно как развитие наших представлений о фундаментальных основах радиационных поражений, так и решение прикладной задачи по оптимизации медицинского применения радиопротекторов. В качестве модельного радиопротектора нами выбран индралин – α1-адреномиметик прямого действия [1–3] – наиболее эффективный и наиболее изученный препарат, разрешенный для применения у человека. Наш выбор обоснован также тем, что имеются данные о некоторых молекулярных механизмах реализации противолучевого действия этого препарата. В частности, установлено, что под воздействием индралина в органах кроветворения – костном мозге и селезенке – происходит активация рибонуклеотид-редуктазы, катализирующей включение рибонуклеозид-5-дифосфата в молекулу ДНК через синтез дезоксирибонуклеозидтрифосфата [4–6]. Однако до сих пор не ясно, как влияет индралин на процессы репарации повреждений ДНК после облучения. Особый интерес представляет репарация таких критических повреждений ДНК как двунитевые разрывы (ДР ДНК). Известно, что ДР ДНК являются основным триггером, запускающим процессы клеточного отклика на воздействие ионизирующего излучения [7–9]. В последние годы начали стремительно развиваться высокочувствительные методы косвенной оценки изменений количества ДР в живых клетках, основанные на иммунофлуоресцентном анализе белков, участвующих в репарации ДР в ДНК. Наибольшее развитие получил иммунофлуоресцентный анализ фокусов фосфорилированного корового гистона Н2АХ (γН2АХ), который считается самым чувствительным методом анализа ДР ДНК [10–13]. В настоящее время имеются примеры использования анализа γН2АХ в качестве патогенетического критерия при оценке противолучевых препаратов [14–17].
Цель нашей работы – изучение влияния индралина (препарата Б-190) на эффективность репарации радиационно-индуцированных повреждений ДНК in vivo в сопоставлении с традиционными радиобиологическими методами регистрации повреждающего действия радиации.
МАТЕРИАЛЫ И МЕТОДИКА
Исследования проведены на 110 аутбредных мышах самцах и самках ICR (CD-1) SPF-категории, с исходной массой тела у самок 20–27 г, у самцов 27–33 г. Животные находились в условиях конвенционального вивария в вентилируемом помещении с автоматизированной системой регулирования светового режима: 12 ч день и 12 ч ночь, при температуре 22–24°С. В зависимости от вида эксперимента мышей содержали по шесть, семь или 10 особей в стандартных клетках, в которых мыши имели свободный доступ к брикетированному корму и деионизированной воде. Для опытов отбирали только клинически здоровые особи. Группы формировали случайным выбором из равнозначных по массе животных.
Облучение. Однократное кратковременное одностороннее тотальное облучение мышей осуществляли на рентгеновской биологической установке РУБ РУСТ-М1 при напряжении 200 кВ, ток пучка 2 × 2.5 мА, фильтр алюминиевый 1.5 мм. Мощность дозы в контейнере с мышами 0.85 Гр/мин ±10%. Дозы облучения 6.0 (СД-10/30), 6.5 и 7 Гр (СД-100/30). С целью достижения максимально одинакового лучевого воздействия животных облучали по шесть особей в центре поля.
В качестве радиопротектора использовали препарат Б-190 (индралин) в лекарственной форме – таблетки по 150 мг. Предварительно таблетку растирали в ступке и растворяли в кипяченой воде. Препарат вводили внутрижелудочно в дозе 150 мг/кг в объеме 0.5 мл за 15 мин до облучения. Контрольные животные получали кипяченую воду в том же объеме.
Для оценки радиобиологического эффекта использовали ряд показателей.
Выживаемость животных за 30 суток наблюдения
Динамику биомассы группы животных определяли путем взвешивания группы животных на электронных весах с ценой деления 1 г.
Поведенческий статус. Изменения в поведении животных определяли с помощью теста “Открытое поле”, который позволяет оценить исследовательские реакции в новой среде, общую двигательную активность и тревожность у грызунов. Использовали установку “Открытое поле” (“Open Space“) белого фона с диаметром арены 63 см, разделенную на 18 секторов, центральную зону и 13 круглых отверстий в полу. Мышь помещали в центр установки. Наблюдение проводили в течение 3 мин. Ориентировочно-исследовательские реакции (ОИР) оценивали по показателям количества заходов в сектора, центр, заглядывание в норки (круглое отверстие пола камеры диметром 1.0 см), стойки с упором и без упора. К эмоциональному статусу (ЭС) животных относятся груминг, замирания и движения на месте.
Силу захвата передних конечностей, характеризующую состояние поперечнополосатой мускулатуры, определяли с помощью методики оценки физической работоспособности статического вида [18].
Иммуногематологические показатели
Массу тимуса и селезенки определяли на аналитических весах с ценой деления 0.1 мг. Подсчет числа лейкоцитов в периферической крови и уровень ядросодержащих клеток в костном мозге бедренной кости проводили общепринятыми методами [19] в камере Горяева.
Суспензию клеток селезенки в фосфатно-солевом буфере, содержащем 10 ммоль/л фосфатный буфер, pH 7.4, 0.14 моль/л NaCl, 2.7 ммоль/л KCl с 3 ммоль/л NaN3, и охлажденном до 4°С, фильтровали через нейлоновую сетку. Концентрацию клеток подсчитывали в камере Горяева.
Определение уровня радиационно-индуцированных повреждений ДНК в клетках селезенки проводили методом ДНК-комет в щелочных условиях [20–22], а также путем проточно-цитометрического анализа гистона γН2АХ [11, 16, 17].
Для окраски ДНК-комет использовали йодистый пропидий (Invitrogen). Визуализацию ДНК-комет осуществляли на люминесцентном микроскопе Nikon Eclipse Ni-U (NIKON, Япония) с использованием системы визуализации микрофотоизображений “ProgRes MFcool/CapturePro 2.8.8” (Jenoptik AG, Германия). На каждом слайде регистрировали по 100 комет. Обрабатывали по три слайда от каждого животного. Для анализа и обработки микрофотоизображений ДНК-комет использовали программу СASP 1.2.2 (СASPlab). В качестве критерия поврежденности ДНК использовали процент ДНК в хвосте кометы.
Для проточно-цитометрического определения γH2AX позитивных клеток использовали набор “anti-phospho-Histone H2AX” (Millipore Corp.). Все манипуляции выполняли согласно прилагающемуся к набору протоколу. Анализ проводили на проточном цитометре BD FACSCalibur (CША) со скоростью 200 кл./с. В каждом образце анализировали не менее 100 тыс. клеток.
Статистический анализ полученных результатов проведен с помощью общепринятых методов вариационной статистики (критерия Стьюдента) и критерия χ2 (для оценки выживаемости и биомассы) с использованием пакета Statistica7.0 (StatSoft).
Эксперименты выполнены в соответствии с “Правилами проведения работ с использованием экспериментальных животных” (приказ МЗ СССР № 755 от 12.08.1977 г.) и “Международными рекомендациями по проведению биомедицинских исследований с использованием животных” Совета международных медицинских научных организаций (CIOMS), Женева, 1985 г.
РЕЗУЛЬТАТЫ
Данные о радиозащитном действии препарата Б-190 в конкретных экспериментах, полученные с использованием традиционных методов, представлены в табл. 1 и 2. Необходимо отметить, что в опытных группах животных, облученных в дозе 6.5 Гр, погибло по одному животному из 10. При этом одно животное пало сразу после введения препарата, а другое в течение первых суток. Эти животные были в дальнейшем исключены из статистической обработки. Как видно в табл. 1, в эксперименте на мышах, облученных в абсолютно летальной дозе 7 Гр, препарат Б-190 обеспечил в трех опытах из четырех стабильный, хотя и невысокий, радиозащитный эффект на уровне 22–30% при полной гибели контрольных облученных животных за 30 сут наблюдения. По сумме всех опытов противолучевой эффект Б-190 оказался статистически значим. Б-190 способствовал также увеличению на 1.7–3.4 сут средней продолжительности жизни павших животных по сравнению с контролем. Эти результаты подкрепляет и другой показатель – уровень биомассы группы мышей, выживших к 7-м сут после облучения (самцы) и к 5-м сут после облучения (самки). Во всех четырех экспериментах биомасса групп животных, защищенных Б-190, существенно превышала таковую у контрольных облученных животных, по ряду позиций статистически значимо. Показатель средней массы оказался менее информативен.
Таблица 1.
Интегральные показатели радиозащитного действия препарата Б-190 в опытах на мышах ICR (CD-1)
| Пол | Доза облучения, Гр | Опыт/контроль | Число животных в группе | Выживаемость за 30 с, % (абс.) | До облучения | Время после облучения, сут | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| биомасса групповая, г | средняя в группе M ± m, г | 5 | 7 | |||||||
| биомасса групповая, г | средняя в группе M ± m, г | биомасса групповая, г | средняя в группе M ± m, г | |||||||
| Самцы | 6.5 | опыт | 9 | 22 (2) | 290 (9)** | 32.2 ± 1.9 | 232(8)***, ** | 29 ± 2.3 | ||
| контроль | 10 | 0 (0) | 328 (10)** | 32.8 ± 2.1 | 125(5)** | 25 ± 1.8 | ||||
| 7.0 | опыт | 10 | 30 (3) | 313 (10)** | 31.3 ± 1.7 | 228(8)***, ** | 28.5 ± 1.3 | |||
| контроль | 10 | 0 (0) | 326 (10)** | 32.6 ± 1.8 | 114(4)** | 28.5 ± 1.9 | ||||
| Самки | 6.5 | опыт | 9 | 22 (2) | 229 (9)** | 25.4 ± 1.6 | 222 (9)** | 24.7 ± 2.4 | ||
| контроль | 10 | 0 (0) | 233 (10)** | 23.3 ± 1.4 | 187 (9)** | 20.8 ± 1.9 | ||||
| 7.0 | опыт | 10 | 0 (0) | 265 (10)** | 26.5 ± 1.8 | 238 (10)**, *** | 23.8 ± 1.8 | |||
| контроль | 10 | 0 (0) | 256 (10)** | 25.6 ± 1.5 | 195 (9)** | 21.7 ± 1.9 | ||||
| Итого | 6.5–7.0 | опыт | 38 | 18 (7)*** | ||||||
| контроль | 40 | 0 (0) | ||||||||
Таблица 2.
Показатели жизненного статуса мышей ICR (CD-1) на 8-е сутки после рентгеновского облучения в дозе 6 Гр (M ± m)
| Группа № | Масса тела, г | Масса тимуса, мг | Масса селезенки, мг | Количество кариоцитов в костном мозге (n × 106/бедро) | Количество лейкоцитов в периферической крови (n × 109/л) | Сила захвата, г | ОИР, число актов | ЭС, число актов |
|---|---|---|---|---|---|---|---|---|
| Самцы | ||||||||
| 1. Мыши, защищенные Б-190 | 39.4 ± 1.2 | 39.2 ± 2.7 | 40.8 ± 3.7 | 9 ± 0.6 | 0.5 ± 0.08 | 178 ± 26.7 | 111.4 ± 29.3 | 3 ± 1.1 |
| 2. Контроль облучения | 37 ± 1.7 | 30.7 ± 5.2 | 39.8 ± 1.9 | 7.7 ± 0.8 | 0.4 ± 0.05 | 138 ± 16.4 | 89 ± 14.9 | 3 ± 0.6 |
| 3. Необлученный биоконтроль | 42.3 ± 1 | 51.3 ± 4 | 128.3 ± 8 | 27.5 ± 0.7 | 4 ± 0.4 | 164.2 ± 5.8 | 128 ± 21.6 | 2.7 ± 0.7 |
| Самки | ||||||||
| 1. Мыши, защищенные Б-190 | 31.5 ± 1.1 | 35.5 ± 3.5 | 70.5 ± 20.5* | 7.7 ± 0.3 | 0.5 ± 0.04 | 123.2 ± 12.1 | 118.2 ± 25.7 | 2.8 ± 1.2 |
| 2. Контроль облучения | 31.2 ± 1 | 37 ± 2.8 | 31.5 ± 2.2 | 7.9 ± 0.5 | 0.4 ± 0.02 | 125 ± 15.6 | 106.7 ± 21.5 | 5 ± 1 |
| 3. Необлученный биоконтроль | 37.3 ± 2.4 | 55.3 ± 13.8 | 162 ± 17.2 | 25.2 ± 3.4 | 2.4 ± 0.3 | 183.7 ± 22.3 | 139.3 ± 23.8 | 0.3 ± 0.3 |
Данные о физиологическом статусе мышей, облученных в дозе 6 Гр, суммированы в табл. 2. Наиболее демонстративными оказались результаты, полученные в опытах на мышах-самцах. Как видно в табл. 2, по семи из восьми использованных показателей жизненный статус мышей самцов, защищенных препаратом Б-190, оказался лучше, чем у контрольных облученных животных. У защищенных животных отмечена лучшая сохранность массы тела, массы тимуса и селезенки, числа клеток в костном мозге и лейкоцитов в периферической крови, силы поперечнополосатой мускулатуры и показателей деятельности ЦНС, включая ОИР. Однако в силу малого числа животных в группе (по шесть мышей) эти традиционные показатели в большинстве случаев не достигли статистической значимости.
Менее выразительный результат получен в опыте на мышах-самках. Позитивный эффект препарата Б-190 отмечен только по четырем показателям из восьми использованных, при этом зарегистрирован статистически значимый эффект по массе селезенки.
Таким образом, следует отметить, что в опытах на мышах, облученных в летальных дозах, использование препарата Б-190 путем внутрижелудочного введения в дозе 150 мг/кг за 15 мин до облучения обеспечивает отчетливый противолучевой эффект, регистрируемый традиционными радиобиологическими методами, рекомендованными в большинстве руководств по доклиническому изучению противолучевых средств, включая тесты на выживаемость, массу тела, состояние центральных органов иммунитета и кроветворения, уровень лейкоцитов в периферической крови и показатели состояния ЦНС. Опыты на мышах самцах дали более однозначный результат в сравнении с экспериментами на самках.
Результаты изучения влияния препарата Б-190 на поврежденность ДНК облученных мышей приведены на рис. 1, 2 и 3.
Рис. 1.
Влияние препарата Б-190 на долю γН2АХ позитивных клеток селезенки самок (А) и самцов (Б) мышей СD-1 через 1 ч после облучения в дозе 6 Гр. *** p < 0.001 – статистически значимое различие по отношению к группе необлученного контроля по t-критерию Стьюдента.
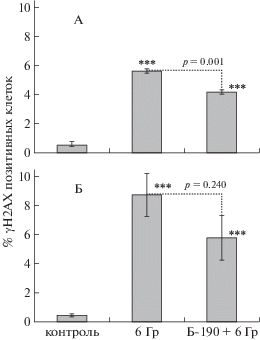
Рис. 2.
Влияние препарата Б-190 на долю γН2АХ позитивных клеток селезенки самок (А) и самцов (Б) мышей СD-1 через 8 сут после облучения в дозе 6 Гр. * p < 0.05 и ** p < 0.01 – статистически значимые различия по отношению к группе необлученного контроля по t-критерию Стьюдента.
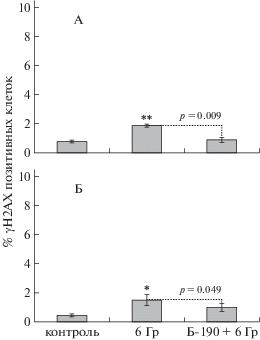
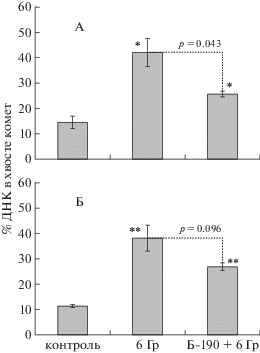
Рис. 3.
Влияние препарата Б-190 на относительное количество однонитевых разрывов и щелочно-лабильных сайтов ДНК (% ДНК в хвосте комет) в клетках селезенки самок (А) и самцов (Б) мышей СD-1 через 8 сут после облучения в дозе 6 Гр. * p < 0.05 и ** p < 0.01 – статистически значимые различия по отношению к группе необлученного контроля по t-критерию Стьюдента.
На рис. 1, А видно, что через 1 ч после облучения у облученных самок отмечалось статистически значимое (р < 0.001) увеличение доли γН2АХ позитивных клеток селезенки. При этом введение препарата Б-190 значимо уменьшало генотоксический эффект облучения. Сходные результаты были получены и для самцов (рис. 1, Б). Однако в этом случае статистически значимой защиты от генотоксического действия рентгеновского излучения не было отмечено. По всей видимости, это обусловлено существенной индивидуальной вариабельностью радиочувствительности у самцов мышей линии ICR (CD-1), что хорошо видно по довольно большим ошибкам среднего арифметического доли γН2АХ позитивных клеток в группах облученных мышей (рис. 1, Б).
На втором этапе работы был исследован тот же показатель, но через 8 сут после облучения в дозе 6 Гр. В этом случае доля γН2АХ позитивных клеток отражает вторичные пострадиационные процессы: гибель клеток по механизму апоптоза и компенсаторную пролиферацию. Образование ДР ДНК происходит преимущественно во время апоптотической межнуклеосомной деградации ДНК [23] и при коллапсе репликативных вилок [24]. В разгар лучевого поражения – через 8 сут после облучения как у самок (рис. 2, А), так и у самцов (рис. 2, Б) мышей СD-1 в дозе 6 Гр в группах, защищенных препаратом Б-190, по показателям γН2АХ позитивных клеток в селезенке отмечался статистически значимый на малом числе животных противолучевой эффект препарата. Следует отметить, что при использовании традиционных иммунологических показателей радиобиологического эффекта (табл. 2) статистически значимый результат отмечен только в опыте на самках по массе селезенки.
Дополнительно через 8 сут после облучения в дозе 6 Гр была исследована индукция однонитевых разрывов и щелочно-лабильных сайтов (ОР и ЩЛС) в спленоцитах мышей с помощью метода ДНК-комет в щелочных условиях. В пострадиационный период эти повреждения ДНК образуются преимущественно в результате атак свободных радикалов на ДНК (оксидативный стресс), напряжения пролиферативных процессов и клеточной гибели [20].
Результаты, полученные с помощью метода ДНК-комет, в целом подтверждают данные анализа γН2АХ позитивных клеток. Статистически значимое радиозащитное действие отмечалось в группе самок мышей, получивших препарат Б-190 (рис. 3, А).
Таким образом, с помощью молекулярных методов, таких как анализ γН2АХ позитивных клеток и метод ДНК комет как в ближайший к облучению срок (1 ч), так и в острый период развития лучевого поражения (на 8-е сут после облучения), на статистически малом экспериментальном материале (по шесть мышей в группе) получен статистически значимый результат, демонстрирующий противолучевое действие индралина (препарата Б-190), использованного в лекарственной форме при внутрижелудочном введении.
ОБСУЖДЕНИЕ
При обсуждении полученных данных, на наш взгляд, необходимо затронуть несколько вопросов, в числе которых запуск репарации радиационно-индуцированных повреждений ДНК в условиях использования радиопротектора индралина и место молекулярных методов оценки эффективности репарации ДР ДНК в решении прикладных вопросов радиобиологии.
По первому вопросу следует отметить, что в эксперименте использован индралин – препарат, являющийся мощным прессорным средством вазотонического механизма действия. В основе фармакологического эффекта индралина в облученном организме лежит ограничение регионального кровотока [25]. По мнению разработчиков препарата [4], индралин повышает в клетках синтез ДНК, белков, активирует регулируемую экстраклеточными сигналами киназу (ERKS), стимулирует пролиферацию и дифференцировку клеток. Активация этих процессов под действием индралина [4–6] отмечается через 30 мин после введения препарата и остается повышенной в течение 3 сут. Активация рибонуклеотидредуктазы под действием индралина может играть важную роль в реализации противолучевых свойств радиопротектора [5, 6].
По второму вопросу следует отметить, что использованные в работе методы оценки уровня ДР ДНК в облученном организме позволяют в ранний срок, уже через 1 ч после воздействия радиации, оценить степень повреждения ДНК и способность радиопротектора снизить выход ДР ДНК. Таким образом, можно сделать предварительное заключение о наличии радиозащитного эффекта у исследуемого препарата. В дальнейшем эти данные в развернутом эксперименте позволят оценить уровень фактора изменения дозы (ФИД). ДР ДНК в облученном организме сохраняются и в период разгара лучевой болезни – след позитивного действия радиопротектора сохраняется, что может быть полезным для клинициста при составлении прогноза исхода лучевого поражения.
На наш взгляд, практический интерес представляет исследование потенциальных противолучевых фармакологических препаратов на предмет их влияния на выход ДР ДНК, в системе доклинического изучения биологически активных веществ.
Безусловно, следует рассмотреть возможность использования тестов на ДР ДНК при скрининге радиопротекторов, поскольку опыты на животных ограничиваются по биоэтическим нормам, а как нами показано в данной работе, для получения статистически значимого результата традиционными радиобиологическими методиками требуется большее число животных, чем в случае применения молекулярных методов регистрации ДР ДНК.
Вполне вероятным представляется польза молекулярных методов при оценке не только радиопротекторов, но и других противолучевых средств, включая лечебные препараты различных классов – от цитокинов до витаминов и биологически активных добавок.
Требуют своего изучения и такие вопросы как оценка состояния репарационных процессов в ходе лучевой терапии онкологических заболеваний, как в системе иммунитета и кроветворения, так и в опухолевых клетках, включая лимфопролиферативные заболевания.
Список литературы
Васин М.В. Поиск и исследование новых эффективных средств фармакохимической защиты организма от поражающего действия ионизирующего излучения в ряду индолилалкиламинов: Дис. … д-ра мед. наук. М., 1977. 510 с.
Васин М.В., Антипов В.В., Чернов Г.А. и др. Роль вазоконстрикторного эффекта в реализации противолучевых свойств индралина в опытах на собаках // Радиац. биология. Радиоэкология. 1997. Т. 37. № 1. С. 46–55.
Васин М.В., Ушаков И.Б., Семенова Л.А., Ковтун В.Ю. К фармакологическому анализу противолучевого действия индралина // Радиац. биология. Радиоэкология. 2001. Т. 41. № 3. С. 307–309.
Пулатова М.К., Шарыгин В.Л., Шлякова Т.Г. Реакция синтеза дезоксирибонуклеотидов на облучение и их модификация радиопротекторами // Радиац. биология. Радиоэкология. 2003. Т. 43. № 1. С. 29–43.
Чернов Г.А., Шлякова Т.Г., Шарыгин В.Л. и др. Молекулярные аспекты действия радиопротектора индралина // Изв. РАН. Сер. биол. 1994. № 1. С. 20–37.
Чернов Г.А., Шарыгин В.Л., Пулатова Л.К. и др. Молекулярные механизмы действия радиопротектора индометофена. Биосинтетические и биоэнергетические аспекты // Изв. РАН. Сер. биол. 1996. № 3. С. 281–291.
Mladenov E., Magin S., Soni A., Iliakis G. DNA double-strand-break repair in higher eukaryotes and its role in genomic instability and cancer: Cell cycle and proliferation-dependent regulation // Seminars in Cancer Biol. 2016. V. 37–38. P. 51–64.
Osipov A.N., Buleeva G., Arkhangelskaya E., Klokov D. In vivo gamma-irradiation low dose threshold for suppression of DNA double strand breaks below the spontaneous level in mouse blood and spleen cells // Mutat. Res. 2013. V. 756. № 1–2. P. 141–145.
Osipov A.N., Grekhova A., Pustovalova M. et al. Activation of homologous recombination DNA repair in human skin fibroblasts continuously exposed to X-ray radiation // Oncotarget. 2015. V. 6. № 29. P. 26876–26885.
Goodarzi A.A., Jeggo P.A. Irradiation induced foci (IRIF) as a biomarker for radiosensitivity // Mutat. Res. 2012. V. 736. № 1–2. P. 39–47.
Wang Z., Hu H., Hu M. et al. Ratio of γ-H2AX level in lymphocytes to that in granulocytes detected using flow cytometry as a potential biodosimeter for radiation exposure // Radiat. Environ. Biophys. 2014. V. 53. № 2. P. 283–290.
Грехова А.К., Еремин П.С., Осипов А.Н. и др. Замедленные процессы образования и деградации фокусов γН2AX в фибробластах кожи человека, облученных рентгеновским излучением в малых дозах // Радиац. биология. Радиоэкология. 2015. Т. 55. № 4. С. 395–401.
Tsvetkova A., Ozerov I.V., Pustovalova M. et al. γH2AX, 53BP1 and Rad51 protein foci changes in mesenchymal stem cells during prolonged X-ray irradiation // Oncotarget. 2017. V. 8. № 38. P. 64317–64329.
Kumar A., Choudhary S., Adhikari J.S., Chaudhury N.K. Sesamol ameliorates radiation induced DNA damage in hematopoietic system of whole body γ-irradiated mice // Environ. Mol. Mutagen. 2018. V. 59. № 1. P. 79–90.
Raghuraman M., Verma P., Kunwar A. et al. Cellular evaluation of diselenonicotinamide (DSNA) as a radioprotector against cell death and DNA damage // Metallomics. 2017. Jun 1. V. 9. № 6. P. 715–725.
Воробьева Н.Ю., Грехова А.К., Трубицина К.Ю. и др. Интерлейкин-1b способен снижать проявления отдаленных последствий пролонгированного воздействия низкоинтенсивного гамма-излучения // Бюл. эксперим. биологии и медицины. 2015. Т. 160. № 10. С. 474–477.
Рождественский Л.М., Шлякова Т.Г., Трубицина К.Ю. и др. Профилактическое применение противолучевых средств у мышей при низкоинтенсивном γ-облучении // Радиац. биология. Радиоэкология. 2017. Т. 57. № 6. С. 608–620.
Иванов И.В. Методы оценки работоспособности лабораторных животных при экспериментальном воздействии патогенных и экстремальных факторов // Воен.-мед. журн. 2012. Т. 333. № 2. С. 42–47.
Иванов А.А., Андрианова И.Е., Булынина Т.М. и др. Фармакологические эффекты меланина у облученных мышей // Мед. радиология и радиац. безопасность. 2015. Т. 60. № 5. С. 5–11.
Мязин A.E., Осипов А.Н., Елаков А.Л. и др. Оценка методом ДНК-комет однонитевых разрывов ДНК лимфоцитов селезенки в отдаленные сроки после острого облучения мышей в сублетальных и среднелетальных дозах // Радиац. биология. Радиоэкология. 2002. Т. 42. № 6. С. 731–734.
Osipov A., Arkhangelskaya E., Vinokurov A. et al. DNA Comet Giemsa Staining for Conventional Bright-Field Microscopy // Int. J. Molec. Sci. 2014. V. 15. № 4. P. 6086–6095.
Воробьева Н.Ю., Архангельская Е.Ю., Бушманов А.Ю., Осипов А.Н. Влияние инкубации в гипертонических растворах хлорида натрия на повреждаемость ДНК лимфоцитов периферической крови человека γ-излучением и перекисью водорода // Саратов. науч.-мед. журн. 2014. Т. 10. № 4. С. 735–739.
Ding D., Zhang Y., Wang J. et al. Induction and inhibition of the pan-nuclear gamma-H2AX response in resting human peripheral blood lymphocytes after X-ray irradiation // Cell Death. Discov. 2016. Mar 21. V. 2. P. 16011.
Pustovalova M., Astrelina T.A., Grekhova A. et al. Residual γH2AX foci induced by low dose x-ray radiation in bone marrow mesenchymal stem cells do not cause accelerated senescence in the progeny of irradiated cells // Aging (Albany NY). 2017. Nov 21. V. 9. № 11. P. 2397–2410.
Ильин Л.А., Рудный Н.М., Суворов Н.Н. и др. Индралин – радиопротектор экстренного действия. Противолучевые свойства, фармакология, механизм действия, клиника. М.: МЗ РФ, 1994. 435 с.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


