Радиационная биология. Радиоэкология, 2019, T. 59, № 3, стр. 274-278
ПРОТИВОЛУЧЕВАЯ ЭФФЕКТИВНОСТЬ ФЛАГЕЛЛИНА В ОПЫТАХ НА МЫШАХ
Н. И. Лисина 1, *, Р. А. Щеголева 1, Т. Г. Шлякова 1, В. В. Зорин 1, А. Э. Шкаев 2, Л. М. Рождественский 1
1 Федеральный медицинский биофизический центр им. А.И. Бурназяна ФМБА России
Москва, Россия
2 ВНИИ ветеринарной вирусологии и микробиологии
Покров, Россия
* E-mail: ni-lisina@mail.ru
Поступила в редакцию 13.04.2018
Аннотация
В опытах на мышах СПФ категории изучена радиозащитная эффективность рекомбинантного препарата флагеллин, разработанного в ГосНИИ особо чистых биопрепаратов (Санкт-Петербург), при введении в широком интервале доз (0.004–2 мг/кг) за 30 мин до рентгеновского облучения в диапазоне доз 7–10 Гр. Оценена радиозащитная эффективность препарата по показателю 30-суточной выживаемости мышей и по критерию ФИД при костномозговой форме гибели. Значения ФИД составили величины 1.24–1.23–1.22 на уровне ЛД16, ЛД50 и ЛД84. ЕД50 составила приблизительно 25 мкг/кг. Выход на плато зависимости эффекта от дозы препарата определен дозой 0.2 мг/кг.
Препарат флагеллин (позднее – его производное CBLB502, получившее название энтолимод) был разработан в США на базе жгутикового белка одной из разновидностей сальмонелл [1, 2]. Авторами он был представлен как эффективное противолучевое средство профилактической и лечебной направленности, иммуномодулятор с известным механизмом действия через Толл-подобный рецептор TLR-5, но, главное, как препарат, лишенный выраженных побочных эффектов, свойственных другим высокомолекулярным соединениям (липополисахариды, ИЛ-1, ТНФ).
Как возможное перспективное средство для использования при различных сценариях лучевого воздействия на человека флагеллин привлек внимание и отечественных разработчиков противолучевых средств. Отечественный образец флагеллина, как рекомбинантный препарат, был разработан сотрудниками ГосНИИ особо чистых биопрепаратов ФМБА РФ (Санкт-Петербург) в виде полноразмерного белка, а также в виде варианта с делетированным центральным доменом [3]. Изучение протекторных и лечебных свойств флагеллина проводилось в Военно-медицинской академии им. С.М. Кирова и в Институте экспериментальной медицины (Санкт-Петербург), где в экспериментах на белых беспородных мышах были получены результаты, свидетельствующие о перспективности дальнейшего изучения противолучевой эффективности рекомбинантного флагеллина [4–6].
В Федеральном медицинском биофизическом центре им. А.И. Бурназяна также проводятся исследования отечественного препарата флагеллин. Этот препарат представляет интерес как близкий аналог беталейкина, в разработку которого, как медицинского препарата экстренной терапии лучевых поражений человека, Центр внес существенный вклад [7]. Кроме того, флагеллин представляет интерес в аспекте поиска средства ослабления отдаленных последствий радиационного поражения.
В настоящей работе представлены материалы по оценке радиозащитной эффективности делетированной формы флагеллина по тесту выживаемости в опытах на мышах СПФ категории в более широком диапазоне как доз облучения, так и доз препарата по сравнению с исследованиями, отраженными в литературе.
МАТЕРИАЛЫ И МЕТОДИКА
Работа выполнена на 140 мышах самцах СПФ категории сток СД1 массой 20–22 г, полученных из питомника лабораторных животных “Пущино”. При работе с экспериментальными животными соблюдали требования и условия, изложенные в нормативных и правовых документах о порядке проведения экспериментальных работ на животных [8].
Мышей содержали в поликарбонатных клетках на установке ИВК (индивидуальная вентиляция клеток) с подачей стерильного воздуха (Фармбиолайн, Финляндия). Животные содержались на стандартном рационе вивария при свободном доступе к воде и пище. Случайным отбором формировали опытные и контрольные группы по 8–10 животных.
В работе была использована делетированная форма рекомбинантного флагеллина, полученного из ГосНИИ ОЧБ. Лиофилизат флагеллина растворяли в фосфатно-альбуминовом буфере. Препарат в интервале доз 0.004–2 мг/кг вводили мышам опытных групп внутрибрюшинно за 30 мин до начала облучения. Животным контрольных групп за то же время и в тех же объемах вводили растворитель. Острое рентгеновское облучение осуществляли на установке РУСТ М1 при напряжении 200 кВ, токе на трубке 2.5 мА, алюминиевом фильтре 1.5 мм. Мощность дозы облучения составляла 1.1 Гр/мин. Примененные дозы облучения находились в интервале 7–10 Гр.
Радиозащитную эффективность флагеллина оценивали по 30-суточной выживаемости подопытных животных и по средней продолжительности жизни (СПЖ) павших мышей в сравнении с контрольными группами.
Результаты опытов подвергали статистической обработке по программе Statistica for Windows, версия 6, Пакеты программ: IBM SPSS, Statsoft Statistics.
РЕЗУЛЬТАТЫ
Прежде всего следует отметить, что мыши не проявляли какой-то выраженной реакции на введение максимальной дозы препарата (2 мг/кг).
Данные о выживаемости мышей контрольных и защищенных флагеллином групп представлены в табл. 1 и на рис. 1.
Таблица 1.
Выживаемость облученных мышей в контрольных и защищенных флагеллином группах
| Доза, Гр | Экспериментальные группы | |||||
|---|---|---|---|---|---|---|
| контроль | флагеллин 0.2 мг/кг | флагеллин 2 мг/кг | ||||
| выживаемость, % | СПЖ, сут | выживаемость, % | СПЖ, сут | выживаемость, % | СПЖ, сут | |
| 7 | 87 | 14 | ||||
| 7.1 | 75 | 15.5 | 100 | 100 | ||
| 7.5 | 25 | 15.8 | ||||
| 7.8 | 87 | 10 | 100 | 40 | 11 | |
| 8.2 | 37 | 14.6 | ||||
| 8.4 | 12 | 12 | 89 | 10 | 87 | 14 |
| 8.5 | 25 | 13.9 | ||||
| 9.06 | 0 | 11.4 | 80 | 10.5 | 75 | 12 |
| 9.5 | 62 | 15 | ||||
| 10 | 12 | 13.1 | ||||
Рис. 1.
Данные по выживаемости мышей при разных дозах облучения и разных дозах препарата флагеллин (1 – контроль, 2 – флагеллин).
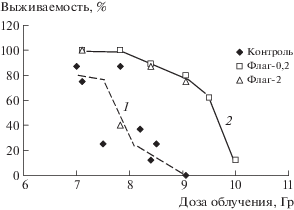
Как видно в табл. 1 и на рис. 1, гибель мышей регистрировали практически во всем диапазоне эффектов от 0 до 100%, а дозовые кривые имеют S-образный характер. Для доз флагеллина 0.2 и 2 мг/кг была отмечена одинаковая эффективность на уровне разных доз облучения, за исключением выброса для дозы препарата 2 мг/кг при дозе 7.8 Гр.
Как видно из представленных данных, противолучевая эффективность флагеллина сохраняется и при воздействии доз излучения, превышающих в наших условиях минимальную абсолютно летальную дозу ЛД95/30 (9 Гр). Данные по показателю СПЖ показывают, что почти все мыши, и опытные и контрольные, погибали в период от 10 до 16 сут, т.е. в период костномозгового синдрома острой лучевой болезни.
Для количественного анализа эффективности флагеллина по критерию ФИД были построены кривые выживаемости в координатах: доза облучения (Гр) – выживаемость (пробиты) (рис. 2).
Рис. 2.
Кривые выживаемости облученных мышей контрольной (1) и защищенной флагеллином в дозе 0.2 мг/кг (2) групп в координатах: доза (Гр) – выживаемость (пробиты).
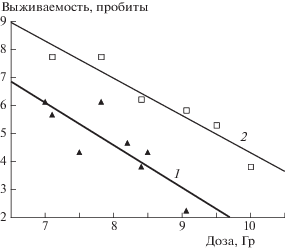
Для представленных на рис. 2 кривых доза–эффект были рассчитаны их аналитические выражения. Они составили:
Для рассчитанных кривых “доза–эффект” в контроле и опыте можно отметить высокую степень корреляции с вероятностью ошибки их линейной аппроксимации, не превышающей 1%.
Как видно из представленных на рис. 2 данных, все значения эффекта для обеих кривых лежат в пределах пробитов 6–4, что позволяет оценить значения ФИД на уровне принятых оценок по ЛД16 , ЛД50 и ЛД84 (табл. 2).
Таблица 2.
Значения ФИД для флагеллина в дозе 0.2 мг/кг на разных уровнях эффекта
| Уровень выживаемости, пробит | Контроль | Флагеллин 0.2 мг/кг | ФИД |
|---|---|---|---|
| Доза, Гр | |||
| 6 | 7.04 | 8.72 | 1.24 |
| 5 | 7.7 ± 0.17 | 9.47 ± 0.22 | 1.23 ± 0.04 |
| 4 | 8.35 | 10.2 | 1.22 |
Далее нами была определена средняя эффективная доза препарата, ЕД50. С этой целью был оценен эффект флагеллина в интервале доз от 0.004 до 2 мг/кг при дозах облучения 9.06 и 9.5 Гр (табл. 3). Данные на рис. 3 позволяют графически ориентировочно оценить ЕД50 на уровне 25 мкг/кг.
Таблица 3.
Радиозащитный эффект флагеллина по тесту выживаемости при разных дозах препарата и облучения
| Доза флагеллина, мг/кг | Доза, Гр | |||
|---|---|---|---|---|
| 9.06 | 9.5 | |||
| выживаемость, % | СПЖ, сут | выживаемость, % | СПЖ, сут | |
| 2 | 75 | 12 | ||
| 0.2 | 80 | 10.5 | 62 | 14.3 |
| 0.04 | 37 | 11.6 | ||
| 0.02 | 25 | 15.2 | ||
| 0.004 | 0 | 0 | ||
Рис. 3.
Зависимости выживаемости мышей от дозы препарата при дозах облучения 9.06 (1) и 9.5 (2) Гр; 3 – линия, обозначающая значение ЕД50 для обоих вариантов.
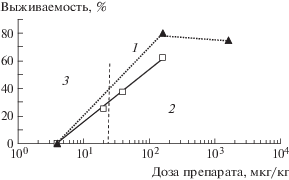
Данные по СПЖ показывают, что и при снижении доз препарата гибель мышей наблюдается в период 11–15 сут после облучения, т.е. происходит по костномозговому синдрому.
ОБСУЖДЕНИЕ
Способность флагеллина защищать подопытных животных при введении его в относительно малых дозах за короткое время до облучения в летальных дозах была отмечена ранее рядом авторов [1, 2, 4–6]. Хорошая переносимость мышами флагеллина, синтезированного отечественными специалистами, без выраженного побочного действия и ухудшения общего состояния животных была отмечена в работах при применении максимальных из использованных доз 1 и 2 мг/кг [4, 6].
В наших экспериментах дозовые границы применения флагеллина были расширены: препарат вводили в интервале доз 0.004–2 мг/кг. Кроме того, исследования проводились в более широких границах доз облучения. Это обстоятельство позволило оценить более полно характеристики противолучевого эффекта флагеллина. В частности, нами были определены значения ФИД не только для уровня ЛД50, но и для уровней 16 и 84% выживаемости, т.е. для высоких и низких доз облучения (табл. 2). Анализ этих данных показал, что флагеллин оказывает примерно одинаковое защитное действие на уровне низких, средних и высоких летальных доз облучения, обусловливающих кроветворную форму гибели.
Эффекты по выживаемости, полученные при использовании двух доз флагеллина 0.2 и 2 мг/кг, оказались практически одинаковыми. Было сделано предположение о наличии квазиплато после дозы 0.2 мг/кг. Основным параметром зависимости “доза–эффект” для определенных исследований является величина средней эффективной дозы (ЕД50), при действии которой на экспериментальных животных развивается эффект, равный 50% от максимально возможного [9]. Величина ЕД50 в данных условиях опытов была определена приближенно на уровне 25 мкг/кг.
Флагеллин является препаратом, действующим при применении в довольно малых дозах – на мышах оптимальные эффективные дозы не превышают сотен мкг/кг. В близких дозах он применялся и при переходе на другие виды животных и даже на человека [2].
Представляет интерес сопоставление полученных в данном исследовании результатов с данными других авторов, исследовавших делетированную форму флагеллина. Прежде всего это касается, конечно, оригинального препарата CBLB502 (энтолимода), разработанного в США и исследовавщегося в диапазоне доз 0.6–200 мкг/кг. Исследователи из США не оценивали ФИД для энтолимода, но их оценки эффективности препарата по выживаемости мышей (83–92% против 8% в контроле при дозе облучения 10 Гр) близки к нашим: 89–80% против 12–0% при дозах облучения 8.4–9.06 Гр соответственно [2]. Это свидетельствует о том, что делетированная форма отечественного флагеллина практически идентична энтолимоду. То обстоятельство, что флагеллин фактически является дженериком энтолимода, не умаляет достоинств первого: в мировой практике дженерики вообще преобладают над оригинальными препаратами.
При сравнении результатов наших исследований препарата флагеллин с данными других авторов в целом отмечается сходство в оценке его как перспективного противолучевого средства, но некоторые различия имеются. Хотя оценка эффективности флагеллина по критерию ФИД для ЛД50 была одинаковой, она существенно различалась для более высоких доз облучения: выживаемость защищенных животных в наших исследованиях снижалась существенно меньше (в диапазоне 7.8–9.06 Гр от 100 к 80%), чем в работах других авторов (в диапазоне 7.5–8.5 Гр от 70–80 к 29–40%) [4, 6]. Возможно, это было связано с более высоким качеством мышей СПФ категории, использованными в наших опытах, по сравнению с белыми беспородными мышами в опытах указанных авторов.
Не меньший интерес представляет сравнение результатов по эффективности энтолимода/флагеллина и беталейкина. Хорошо известно, что энтолимод/флагеллин очень близки к беталейкину по механизму внутриклеточной передачи сигнала, реализующего их противолучевое действие [10]. Известно, что эффективность беталейкина/ИЛ-1 при профилактическом введении мышам разных линий за 18–24 ч до облучения оценивалась разными авторами по критерию ФИД в районе 1.18–1.25, т.е. практически теми же значениями, что и для флагеллина [11, 12].
Возникает вопрос, не является ли в таком случае энтолимод/флагеллин практически близкой копией беталейкина и зачем он тогда нужен. При всем сходстве противолучевых эффектов двух препаратов в опытах на мышах есть основания предполагать наличие у флагеллина важного преимущества в меньшей выраженности побочных эффектов в виде температурной реакции и дискомфортных симптомов. Основывается это предположение на том, что, в отличие от ИЛ-1, флагеллин не активирует экспрессию ряда генов, особенно сильно активизирующих воспалительную реакцию [5, 10].
Итак, на основании результатов, полученных нами в опытах на мышах СПФ категории, можно заключить, что использованный нами отечественный препарат флагеллин в делетированной форме оказал достаточно выраженное противолучевое действие во всем диапазоне летальных доз и даже при дозах, превышающих минимальную абсолютно летальную дозу. Таким образом, полученные результаты свидетельствуют о перспективности продвижения отечественного флагеллина в практику радиационной медицины.
Список литературы
Burdelya L.G., Krivokrysenko V.I., Tallant T.C. et al. An agonist of toll-lair receptor 5 has radioprotective activity in mouse and primate models // Science. 2008. V. 320. № 5873. P. 226–230.
Krivokrysenko V.N., Shakhov A.N., Gudkov A.V., Feinstein E. Identification of G-CSF and IL-6 as candidate biomarkers of GBLB502 efficacy as a medical radiation countermeasure // JPET Fast Forward. 2012. P. 1–46.https://doi.org/0.1124/jpet.112.196071
Аль-Шехадат Р.И., Матюнина Е.А., Шарафутдинова Т.А. и др. Получение и изучение свойств рекомбинантного бактериального флагеллина // Хим. и радиац. безопасность. 2012. Спец. вып. С. 109–116.
Гребенюк А.Н., Аксенова Н.В., Петров А.В. и др. Получение различных вариантов рекомбинантного флагеллина и оценка их радиозащитной эффективности // Вестн. Рос. воен.-мед. акад. 2013. Т. 43. № 3. С. 75–80.
Софронов Г.А., Мурзина Е.В., Болехан В.Н. и др. Перспективные направления использования препаратов на основе рекомбинантного флагеллина // Мед. акад. журн. 2017. № 2. С. 7–20.
Мурзина Е.В., Софронов Г.А., Аксенова Н.В. и др. Противолучевые свойства бактериального флагеллина // Изв. Рос. воен.-мед. акад. 2017. Т. 36. № 2. Прил. 1. С. 242.
Рождественский Л.М., Кончаловский М.В., Баранов А.Е. и др. Возможность применения препарата Беталейкин (интерлейкин-1β) для экстренной терапевтической помощи при остром аварийном облучении человека // V Рос. нац. Конгр. “Человек и лекарство”, Москва, 21–25 апреля 1998. М., 1998. С. 454.
Директива 2010/63/EU Европейского парламента и Совета европейского союза по охране животных, используемых в научных целях. СПб.: Rus-Lasa “НП объединение специалистов по работе с лабораторными животными”, 2012. 48 с.
Попова Е.Б. Планирование исследований и анализ зависимостей “доза–эффект” токсичных и лекарственных веществ: Дис. … д-ра мед. наук. СПб., 2010.
O’Neill L., Green C. Signal transduction pathways activated by the IL-1 receptor family: ancient signaling machinery in mammls, insects, and plants // J. Leukoc. Biol. 1998. V. 63. P. 650–657.
Neta R. Cytokines in radioprotection and therapy of radiation injury // Biotherapy. 1988. № 1. P. 41–45.
Гребенюк А.Н., Легеза В.И. Противолучевые свойства интерлейкина-1. СПб.: ООО “Изд-во Фолиант”, 2012. 216 с.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


