Радиационная биология. Радиоэкология, 2019, T. 59, № 4, стр. 377-387
ОСОБЕННОСТИ ВЛИЯНИЯ ОБЛУЧЕННЫХ КОСТНОМОЗГОВЫХ МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК НА ПРОДУКЦИЮ МАКРОФАГАМИ ЦИТОКИНОВ И АКТИВНЫХ ФОРМ КИСЛОРОДА
Е. В. Агаева 1, *, В. Н. Петров 1, А.Г. Коноплянников 1, Л. А. Лепехина 1, Е. В. Саяпина 1, О. Е. Поповкина 1
1 MРНЦ им. А.Ф. Цыба – филиал НМИЦ радиологии Минздрава России
Обнинск, Россия
* E-mail: ekagaeva@yandex.ru
Поступила в редакцию 09.12.2017
Аннотация
В интересах повышения эффективности клеточной терапии при острых радиационных поражениях организма проведены сравнительные исследования иммуномодулирующих эффектов интактных и предварительно подвергнутых воздействию γ-излучения в дозах 50–500 мГр и 1–10 Гр костномозговых мезенхимных стромальных/стволовых клеток (МСК) пациентов-доноров на функциональную активность макрофагов в аллогенных (мононуклеары крови/МСК человека) и ксеногенных (перитонеальные макрофаги мышей/МСК человека) in vitro системах. В качестве критериев использованы тесты зимозан-индуцированной хемилюминесценции (ХЛ-активность) и липополисахарид-индуцированной продукции цитокинов TNF-α, IFN-γ, IL-1α и IL-10 макрофагами. Установлено, что для интактных и подвергнутых воздействию γ-излучения МСК, а также их кондиционированных сред (КС) характерно ингибирование продукции активных форм кислорода (АФК), которое может играть существенную роль в формировании иммуносупрессивного микроокружения при трансплантации МСК. Воздействие малых доз γ-излучения (50–100 мГр) МСК характеризовалось стимулирующим их эффектом, а больших доз γ-излучения – угнетающим воздействием на оцениваемые показатели функциональной активности макрофагов по сравнению с интактными МСК. Предполагается, что γ-излучение в малых дозах может служить в качестве одного из подходов прекондиционирования иммуномодулирующей и пролиферативной активности МСК.
В ранние сроки после воздействия ионизирующего излучения в тканях и органах развиваются острые воспалительные реакции, а затем – хронические воспалительные процессы, завершающиеся фиброзом. Важным фактором развития функциональных эффектов облучения является повышенная и длительная продукция в зоне воспаления активных форм кислорода (АФК). Установлена непосредственная связь между оксидативным стрессом, дисфункцией митохондрий и радиационным повреждением [1–3]. В основе развития полиорганной недостаточности и ранней смерти при острых лучевых поражениях лежат изменения четырех основных систем организма: кроветворной, желудочно-кишечной, кожной и нервной [4–6]. Исходы радиационных поражений организма, помимо физических параметров излучения, зависят от основных физиологических особенностей клеточных популяций кроветворной системы, эндотелия кишечника, эпителия альвеол легких и кожного покрова, нервных клеток и т.д., а также радиочувствительности клеток, величины пула стволовых клеток, их способности к восстановлению и пролиферации, длительности функционирования дифференцированных клеток в составе органов и тканей. В последнее время в качестве перспективного многофункционального средства для лечения последствий воздействия радиации на организм рассматриваются мультипотентные мезенхимные стромальные клетки (МСК). Накоплено достаточное количество доказательств в пользу терапевтического действия МСК при острых лучевых поражениях, результаты которых систематизированы и обобщены в обзорах [5–8]. Результаты экспериментального и клинического использования самих МСК или их субклеточных элементов (цитокины, везикулы), представленные в этих обзорах, свидетельствуют о плейотропных терапевтических эффектах на радиационно-поврежденные органы и ткани. Предполагается, что МСК или продукты их секреции могут служить одним из средств ранней неотложной терапии наряду с радиопротекторами, радиомитигаторами. В основе общих эффектов МСК-терапии при радиационных поражениях лежат следующие основные механизмы: антиапоптотическое, антиоксидантное, противовоспалительное действие МСК; стимуляция ими ангиогенеза, активация пролиферации тканеспецифических стволовых клеток, модулирование микроокружения и т.д. Эти возможности МСК открывают широкие перспективы использования данного вида клеток для лечения лучевой болезни и осложнений при лучевой терапии онкологических больных. МСК-терапия способствует восстановлению различных систем организма после радиационного воздействия, в том числе восстановлению кроветворения после тотального облучения перед последующей аллогенной трансплантацией костного мозга [8], купированию радиационно-индуцированного гастроинтестинального синдрома [9, 10], лечения пострадиационных ожогов [11] и радиационно-индуцированного поражения легких [12, 13]. Терапевтические эффекты после введения МСК выявлены вне зависимости от источника получения стволовых клеток: костный мозг, пуповинная кровь, жировая ткань, плацента и т.д. В случае полной аплазии костного мозга при дозах излучения 7–8 Гр и выше трансплантация костного мозга и МСК остается единственным способом восстановления кроветворения и сохранения жизни. Основной эффект, описанный в большинстве исследований после системного введения МСК, заключается в повышении выживаемости облученных животных, в том числе при воздействии летальных доз γ-излучения. При этом показатели выживаемости варьировали в пределах 16–80% на фоне 100%-ной смертности у контрольных животных [14]. В большинстве случаев авторы связывают терапевтические эффекты МСК, в первую очередь, с воздействием на систему гемопоэза: МСК при совместной трансплантации с гемопоэтическими стволовыми клетками (ГСК) способствуют приживлению последних. Эта идея получила широкое развитие в экспериментах на животных и в ряде клинических исследований [5–8].
Анализу иммуносупрессивной и противовоспалительной активности МСК в контексте взаимодействия с Т- и В-лимфоцитами, дендритными клетками, естественными киллерами посвящены многочисленные клинико-экспериментальные исследования и они довольно подробно освещены в многочисленных обзорах [15–18]. Вместе с тем механизмы взаимодействия трансплантируемых МСК с моно- и полиморфнонуклеарными фагоцитами практически не исследованы. Нами было показано, что МСК костного мозга человека и их кондиционированные среды (КС) дозо-зависимо ингибируют in vitro зимозан-индуцированную продукцию АФК макрофагами в аллогенных (МСК человека/макрофаги человека), сингенных (МСК мышей/перитонеальные макрофаги мышей) и ксеногенных (МСК человека/макрофаги мышей) сокультурах [19].
Установлено, что воздействие in vitro малых доз γ-излучения (50–100 мГр) [20] и гипоксии [21] (содержание кислорода 1–8% в тканях или в атмосфере инкубационной среды) стимулирует пролиферацию МСК за счет существенной активации ERK1/2 (внеклеточной сигнал-регулируемой киназы) и p38MAPK (митоген-активированной протеинкиназы).
Цель настоящей работы – оценка влияния облучения in vitro костномозговых МСК человека в малых (50–1000 мГр) и высоких (5 и 10 Гр) дозах на уровень индуцируемой продукции цитокинов и активных форм кислорода (АФК) мононуклеарами крови пациентов-доноров и перитонеальными макрофагами мышей при кратковременном их сокультивировании.
МАТЕРИАЛЫ И МЕТОДИКА
Выделение и экспансия МСК. В работе использованы МСК, выделенные из костного мозга практически здоровых пациентов-доноров (КМ-МСКч). В исследование включены пять здоровых доноров, у которых было получено информированное письменное добровольное согласие на участие в заборе костного мозга. Забор клеточного материала при пункции подвздошной кости человека под местной анестезией 0.5%-ным раствором новокаина проводили в строго стерильных условиях в объеме 0.5–1.0 мл и помещали в пробирки с гепарином (100 ЕД/мл пунктата). После отстаивания эритроцитов в течение 1–2 ч при комнатной температуре супернатант отсасывали пастеровской пипеткой, клетки отмывали в среде RPMI-1640 (“ПанЭко”, Россия), осадок после центрифугирования при 1200 об/мин в течение 10 мин ресуспендировали в полной ростовой среде RPMI-1640 (100 Ед/мл пенициллина, 100 нг/мл амфотерицина, 2 мМL-глутамина и 20% эмбриональной телячьей сыворотки (“ПанЭко”). МСК культивировали в СО2-инкубаторе при 37°С (в газовой среде: 5% углекислого газа и 95% воздуха) в пластиковых флаконах Карреля (“NUNC”) с площадью дна 25 см2 в полной ростовой среде RPMI-1640, содержащей 5 × 106 – 5 × 107 клеток костного мозга в 8 мл ростовой среды. Инкубационную среду меняли через 3–4 сут по мере ее закисления или пересеве клеток при достижении сливного (конфлюентного) монослоя с использованием 0.25% трипсина (“Sigma”, Германия) в новые культуральные флаконы с площадью дна 175 см2. Данный метод позволил к концу 5–6-й недели культивирования добиться получения популяции КМ-МСК человека в количестве 100 × 106 и более.
Культуры МСК пациентов-доноров удовлетворяют минимальным критериям Международного общества по клеточной терапии (International Society for Cellular Therapy) [17, 18, 22, 23]: 1) адгезия клеток к пластиковой поверхности и их пролиферация ex vivo; 2) экспрессия поверхностных маркеров CD73+, CD90+, CD105+ и отсутствие маркеров гемопоэтических клеток CD34-, CD45-, CD11b-, CD14-; 3) способность к in vitro дифференциации по остеогенному, хондрогенному и адипогенному путям. Эти доказательства были получены нами в исследованиях при оформлении документов на получение лицензии Минздрава РФ для клинических испытаний МСК.
In vitro воздействие γ-излучения на культуру МСК. Мезенхимные стромальные/стволовые клетки человека (МСКч) 4-го пассажа в количестве 5 × 106 вносили в культуральные флаконы Карреля с площадью дна 75 см2 в 20 мл полной ростовой среды (по 2–3 флакона на каждую предполагаемую дозу облучения), культивировали в течение 24 или 48 ч при температуре 37°С до образования конфлюэнтного монослоя. Флаконы с монослоем МСКч подвергали воздействию γ-излучения на аппарате “Рокус-АМ” (γ-лучи Со60, при мощности 0.58 Гр/мин) в дозах: 50, 100, 200, 500, 1000 мГр. Облучение монослоя МСКч в дозах 1, 5 и 10 Гр проводили на установке “Луч 1” (γ-лучи Со60, при мощности 0.31 Гр/мин). Монослой клеток МСКч после облучения выдерживали в СО2-инкубаторе при 37°С в течение 24 или 48 ч. Кондиционированные среды (КС) из-под культур МСКч собирали в пластиковые стерильные пробирки и до анализов выдерживали при –80°С. Прикрепившийся к пластиковой поверхности пул МСКч снимали 0.25%-ным раствором трипсина (“Sigma”) и сразу использовали для проведения анализов.
Выделение и анализ ХЛ-активности макрофагов. Мононуклеары (МН) крови практически здоровых пациентов-доноров отделения трансфузиологии МРНЦ им. А.Ф. Цыба выделяли центрифугированием на градиенте плотности Histopaque 1077/1119 (“Sigma”). На границе плазма крови/Histopaque 1077 получали кольцо взвеси мононуклеаров (моноцитов и лимфоцитов). Зимозан-привлеченные перитонеальные макрофаги (ПМ) мышей F1(СВА × С57BL/6) выделяли путем перитонеального лаважа на следующий день после внутрибрюшинного введения 0.5 мл взвеси зимозана (75 мкг/мышь; “Serva”). ПМ суспендировали в охлажденной (4°С) среде Хэнкса (без фенолового красного). Выделенные мононуклеары (МН) и перитонеальные макрофаги (ПМ) использовали в первые 2 ч (выдерживая при температуре тающего льда). Для измерения уровня продукции активных форм кислорода (АФК) в пластиковые кюветы люминометра вносили по 1 × 106 выделенных макрофагов в 750 мкл среды Хэнкса, содержащей люминол (конечная концентрация – 1 мМ5-Amino-2,3-dihydro-1,4 phthalazinedione; “Serva”). К взвеси эффекторных клеток добавляли по 1 × 106 облученных в дозах: 50; 100; 200; 500 и 1000 мГр, а также 5 и 10 Гр МСКч (соотношение макрофаги/МСКч 1 : 1). Затем кюветы со взвесью клеток инкубировали в кюветодержателе люминометра при 37°С в течение 15 мин при постоянном перемешивании. Для индуцирования метаболического взрыва автоматически добавлялась суспензия опсонизированного зимозана (1.25 мг/мл Zymosan; “Serva”). Этап анализа зимозан-индуцированной хемилюминесценции (ХЛ-активности) макрофагов продолжали в течение последующих 40 мин (величину пика индуцированной ХЛ измеряли в мВ/1 × 106 макрофагов при 37°С автоматически на люминометре по специальной программе LKB-Wallac 1251-124 Phagocytosys Program). Кроме того, оценивали модифицирующие эффекты кондиционированных сред (КС), полученных из-под культур, подвергнутых воздействию γ-излучения в дозах: 50; 100; 200; 500 и 1000 мГр МСКч, на ХЛ-активность макрофагов крови человека и ПМ мышей. В этом случае в пластиковые кюветы люминометра вносили по 1 × 106 макрофагов в минимальном объеме среды Хэнкса, конечную концентрацию кондиционированной среды (КС) доводили до 12, 25 или 100% соответственно. В этих пробах измеряли уровень зимозан-индуцированной ХЛ-активности макрофагов в условиях модифицирующего воздействия указанных выше концентраций КС из-под культур МСК, подвергнутых воздействию γ-излучения.
Данные представляли как средние величины пика индуцированной ХЛ-активности (мВ/1 × 106 макрофагов в 10–15 параллельных измерениях в трех независимых опытах) или в относительных значениях: соотношение ХЛ-активности макрофагов в условиях in vitro модифицирующего воздействия подвергнутых воздействию γ-излучения МСКч или КС к таковым значениям ХЛ-активности клеток без модулирующего воздействия МСКч или КС.
Измерение концентрации цитокинов в кондиционированных средах. В кондиционированных средах (КС) смешанных культур МН крови с контрольными или подвергнутыми воздействию γ-излучения МСКч в дозах: 50, 100, 200, 500 и 1000 мГр измеряли in vitro LPS-индуцированную концентрацию цитокинов TNF-α, IFN-γ, IL-1α, IL-10, используя иммуноферментативные наборы фирмы “tech@eBioscience”, Nort America. Для этого 5 × 106 контрольных или в соответствующей дозе облученных МСКч вносили в стерильные флаконы “Карреля” (“Nunc”, площадью дна 25 см2) в 5 мл полной ростовой среды RPMI-1640. Кроме того, в содержимое флаконов вносили дополнительно по 5 × 106 мононуклеаров (МН), выделенных из крови пациентов-доноров, а также раствор липополисахарида до 100 мкг/мл конечной концентрации (LPSE. Сoli 055:B5 “Sigma-Aldrich”). Флаконы с МСКч и МН в соотошении 1 : 1 помещали в СО2-инкубатор при 37°С на 24 или 48 ч. Кондиционированные среды до измерения уровня цитокинов хранили при –80°С. Затем в кондиционированных средах измеряли концентрацию перечисленных выше цитокинов. Интенсивность световой иммуноферментативной реакции измеряли на многоканальном фотометре (“MaltiskanAscent” “ThermoElectronCorp”) при длине волны 450 nm.
Статистическую значимость различий ХЛ-активности в сравниваемых выборках оценивали по t-критерию Стьюдента для множественных сравнений с введением поправки Бонферрони [24].
РЕЗУЛЬТАТЫ
На рис. 1 представлены кривые изменений in vitro зимозан-индуцированной люминол-зависимой хемилюминесценции (ХЛ-активность) мононуклеаров (МН) крови пациентов-доноров после кратковременного (15–20 мин) сокультивирования во взвеси с аллогенными интактными (необлученными) или подвергнутыми воздействия γ-излучения в дозах 50–500 мГр и 1–10 Гр костномозговыми МСК человека (МСКч) при их количественном соотношении 1 : 1 (1 × 106 МН/1 × × 106 МСКч). ХЛ-активность изолированного пула МН крови, т.е. без сокультивирования с МСКч, составила 153 ± 18 мВ/1 × 106 макрофагов (на рис. 1 – крайняя точка слева), значения которой нами были приняты за 1.0 ± 0.12 относительных единиц ХЛ-активности (М ± 95% доверительный интервал при n = 30). Инкубация МН крови с интактными (необлученными) МСКч (МН + МСКч, 0 мГр) приводила к достоверному угнетению (р ≤ 0.01) ХЛ-активности фагоцитов крови пациентов-доноров, когда значения показателя составили 0.77 ± 0.10 отн. ед. по отношению к ХЛ-активности изолированного (контрольного) пула МН крови. ХЛ-активность МН крови, соинкубированных с подвергнутыми воздействию γ-излучения в дозах 50 и 100 мГр МСКч, достоверно не отличалась от значений показателя контрольного пула МН крови (р ≥ 0.05), но была достоверно выше (р ≤ 0.05) по сравнению с ХЛ-активностью МН крови после кратковременного сокультивирования с пулом интактных (необлученных) МСКч (МН + МСКч, 0 мГр). ХЛ-активность МН крови при их сокультивировании с МСКч, подвергнутыми воздействию γ-излучения в дозах 200 и 500 мГр, была на уровне значений показателя МН крови несокультивированных с МСКч (р ≥ 0.05). Вместе с тем ХЛ-активность МН крови в сокультуре с подвергнутыми γ-излучению в дозе 500 мГр МСКч была достоверна выше значений показателя МН крови при их инкубации с необлученными МСКч (МН + МСКч 0 мГр) (р ≤ 0.05). В целом можно заключить, что воздействие γ-излучения на МСКч в малых дозах 50, 100 и 500 мГр приводит к стимулирующему эффекту на ХЛ-активность МН крови при их кратковременной соинкубации по сравнению с эффектами интактных МСКч, когда выявляется достоверное ингибирование зимозан-индуцированной ХЛ-активности МН крови. Дальнейшее повышение дозы γ-излучения в диапазоне 1–10 Гр приводило к противоположным эффектам: ХЛ-активность МН крови, соинкубированных с подвергнутыми воздействия γ-излучения в дозах 1, 5 и 10 Гр МСКч, была значимо ниже (р ≤ 0.05) по сравнению с контрольным пулом МН крови. Максимально ингибирующие эффекты были выявлены при соинкубации МН + МСКч, подвергшихся воздействию γ-излучению в дозе 10 Гр, когда ХЛ-активность была статистически значимо ниже не только по отношению к контрольному пулу МН, но также и по отношению к ХЛ-активности МН крови при кратковременном сокультивировании с необлученными МСКч (МН + + МСКч 0 Гр; р ≤ 0.05). Напоминаем, что монослой МСКч был подвергнут воздействию γ-излучения в диапазоне 50–1000 мГр на аппарате “Рокус-АМ” при мощности 0.58 Гр/мин, а в диапазоне 1–10 Гр (на рис. 1 – вторая половина кривой справа) – на аппарате “Луч-1” при мощности 0.31 Гр/мин. Несмотря на существенные различия в мощности γ-излучения, не было выявлено достоверных различий (р ≥ 0.05) в степени модифицирующего воздействия облученных в дозах 1 Гр МСКч (на рис. 1 две точки кривых доза–эффект) на in vitro зимозан-индуцированную ХЛ-активность МН крови при их кратковременном сокультивировании. Эти данные касаются модифицирующего воздействия МСКч после 24 ч воздействия γ-излучения в указанных выше дозах. Практически такие же результаты были получены при исследовании модифицирующего воздействия МСКч через 48 ч после воздействия γ-излучения в малых и больших дозах на ХЛ-активность МН крови в in vitro системе (результаты не приведены).
Рис. 1.
Влияние дозы γ-излучения монослоя МСК на их модифицирующие in vitro эффекты на ХЛ-активностьмононуклеаров крови (МН) пациентов-доноров. Примечание. По оси ординат – относительные значения пика хемилюминесцентной активности мононуклеаров крови (т.е. соотношение ХЛ-активности МН крови в условиях их кратковременного соинкубирования с контрольными (интактными) или подвергнутыми воздействию γ-излучения в соответствующих дозах МСКч при их соотношении 1 : 1 (1 × 106 МН/1 × × 106 МСКч) к таковым значениям ХЛ-активности изолированного пула МН); по оси абсцисс – исследованные группы: изолированный пул МН или пул кратковременно соинкубированных МН + МСКч (последние в монослойной культуре были подвергнуты предварительному (за 24 ч) воздействию γ-излучения в соответствующих дозах). Представлены средние данные из двух-трех независимых опытов по 5–10 повторностей на каждый срок наблюдения; средние значения ХЛ-активности изолированного (контрольного) пула МН (крайняя точка слева без соинкубирования МН с контрольными или подвергнутыми воздействию γ-излучения в соответствующих дозах МСКч) приняты за 1.0 ± 95%-ный доверительный интервал.
Достоверность различий: (*p ≤ 0.05 или **p ≤ 0.01) ХЛ-активности МН крови, соинкубированных с необлученными или облученными в соответствующих дозах МСК, по отношению к значениям показателя ХЛ-активности изолированного пула МН; (+p ≤ 0.05) – ХЛ-активности МН крови в условиях модифицирующего воздействия подвергнутых гамма-излучению в соответствующих дозах МСКч по отношению к таковым значениям ХЛ-активности МН, соинкубированных с интактными (необлученными) МСК (группа МН + МСК 0 мГр).
Fig. 1. The effect of γ-irradiation dose of the MSC monolayer on their in vitro modifying effects on CL- activity of blood mononuclear cells (MN) of donor patients.

На рис. 2 представлены результаты исследований модифицирующего воздействия кондиционированных сред (КС), полученных через 24 ч инкубации монослоя c подвергнутыми воздействию γ-излучения МСКч в дозах 50–1000 мГр и необлученных (0 мГр) МСКч на in vitro зимозан-индуцированную ХЛ-активность перитонеальных макрофагов (ПМ) мышей F1. Выбор перитонеальных макрофагов (ПМ) в качестве эффекторных клеток при анализе модифицирующих воздействий кондиционированных сред (КС) МСКч был обусловлен тем, что требуется большое количество клеток (1 × 106 в кювету люминометра) для одного повтора анализа ХЛ-активности. У нас не было возможности обеспечить необходимым количеством мононуклеаров крови (МН) пациентов-доноров в качестве эффекторных клеток в хемилюминесцентном тесте для каждой дозы γ-излучения МСКч и трех проанализированных концентраций КС. Кондиционированные среды (КС) интактных и подвергшихся воздействию γ-излучения в дозах 50–1000 мГр МСКч приводили к достоверному (p ≤ 0.001) дозозависимому (конечная концентрация КС 12,5, 25 и 100%) ингибированию ХЛ-активности перитонеальных макрофагов (ПМ) мышей при их инкубации в соответствующих кондиционированных средах по сравнению с показателями ХЛ-активности ПМ мышей без модифицирующего in vitro воздействия КС. Инкубация ПМ мышей в 100% кондиционированной среде (нижняя кривая на рис. 2) приводила к почти 10-кратному ингибированию ХЛ-активности макрофагов. Инкубация ПМ мышей в 25% КС независимо от дозы γ-излучения вызывала почти 5-кратное угнетение ХЛ-активности макрофагов. Инкубация ПМ мышей в среде с 12.5% концентрацией КС (верхняя кривая) вызывала двукратное ингибирование ХЛ-активности макрофагов по отношению к показателям ХЛ-активности интактных ПМ мышей. Исключение составляли показатели ХЛ-активности ПМ мышей при их инкубации в средах (с конечной концентрацией КС от 12.5 до 100%), полученных после инкубации подвергнутых воздействию γ-излучения в дозе 50 мГр МСКч, когда их уровень был достоверно выше (р ≤ 0.001) значений ХЛ-активности ПМ мышей, инкубированных как с кондиционированной средой (КС) интактных (необлученных), так и с КС подвергнутых воздействию γ-излучения МСКч в дозах 100–1000 мГр. Аналогичная картина зависимости изменений ХЛ-активности ПМ мышей (от концентрации КС и дозы гамма-излучения монослоя МСКч) была выявлена нами при воздействии кондиционированных сред (КС), полученных через 48 ч инкубации после воздействия γ-излучения МСКч (результаты не приведены).
Рис. 2.
Модифицирующее воздействие кондиционированных сред (КС) МСК, подвергнутых воздействию γ-излучения в дозах 50–1000 мГр на ХЛ-активность перитонеальных макрофагов (ПМ) мышей. Примечание. По оси ординат – ХЛ-активность в мВ/1 × 106 ПМ мышей; по оси абсцисс – исследованные группы: изолированный пул ПМ мышей (крайняя точка слева); пул кратковременно соинкубированных ПМ мышей в кондиционированных средах из-под культур контрольных (МСКч 0 мГр) или предварительно за 24 ч подвергнутых воздействию γ-излучения в дозах 50–1000 мГр МСКч. Представлены средние значения ХЛ-активности изолированного пула ПМ мышей или показатели ХЛ-активности ПМ в условиях воздействия соответствующих кондиционированных сред МСКч из двух-трех независимых опытов по 5–10 повторностей.
Fig. 2. The modifying effect of conditioned media (CM) of MSCs, exposed to γ-irradiation in doses of 50–1000 mGy, on CL-activity of mouse peritoneal macrophages (PM).

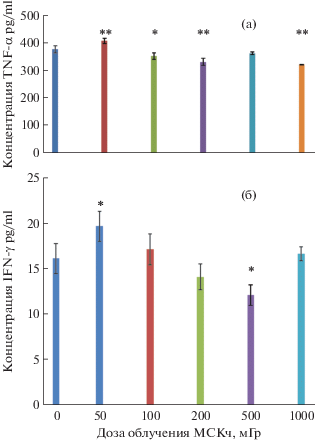
Нами проведена оценка уровня in vitro LPS-индуцированных цитокинов TNF-α, IFN-γ, IL-1α и IL-10 в кондиционированных средах смешанных культур (МН + МСКч при их соотношении 5 × 106/5 × 106 в 5 мл среды). На рис. 3, А и 3, В представлены результаты иммуноферментативного тестирования LPS-индуцированного уровня TNF-α и IFN-γ соответственно в кондиционированных средах смешанных культур МН крови с МСКч интактных (контрольных) или подвергнутых воздействию γ-излучения в дозах 100–1000 мГр. Установлено, что воздействие γ-излучения в дозах 100, 200 и 1000 мГр на МСКч приводит к достоверному снижению TNF-α – продуцирующей активности МН крови при их соинкубировании в соотношении 1 : 1 по сравнению с биоконтролем (МН + МСКч интактные). Следует отметить, что изменения концентрации IFN-γ в кондиционированных средах (МН + МСКч, подвергнутых воздействию γ-излучения) носили разнонаправленный характер в зависимости от дозы γ-излучения. При соинкубировании МН крови с МСКч, подвергнутых воздействию γ-излучения в дозе 50 мГр, выявлено достоверное повышение концентрации (р ≤ 0.05) IFN-γ в кондиционированных средах по сравнению с его уровнем в биоконтроле (МН + интактные МСКч). Концентрация IFN-γ в кондиционированных средах смешанных культур МН + МСКч после воздействия γ-излучения в дозах 200 и 500 мГр была статистически значимо ниже (р ≤ 0.05) по сравнению с уровнем в биоконтроле (МН+интактные МСКч). При дозах 100 и 1000 мГр в монослое МСКч значения IFN-γ в культуральных средах были на уровне биоконтроля (р ≥ 0.05). Здесь нами не представлены результаты измерений концентраций IL-1α и IL-10 в культуральных средах, поскольку независимо от дозы γ-излучения монослоя МСКч указанные показатели варьировали в пределах нижней чувствительности использованных иммуноферментативных тестов. Признаки усиления продукции АФК, TNF-α и IFN-γ на фоне почти полного отсутствия в культуральных средах IL-1α и IL-10 при сокультивировании МН+МСКч, подвергнутых воздействию γ-излучения в малых дозах 50–500 мГр, свидетельствуют о превалировании в исследованных пулах М1-фенотипа макрофагов (классически активированного типа). Сроки 24–48 ч соинкубации МН + МСКч (после воздействия γ-излучения), по-видимому, оказались недостаточными для М2-поляризации макрофагов [23], для которых характерны высокий уровень продукции IL-10 и повышенный прорегенераторный потенциал.
Рис. 3.
Модифицирующее влияние подвергшихся в дозах 50–1000 мГр воздействию γ-излучения мезенхимальных стромальных клеток (МСК) на in vitro липополисахарид-индуцированную продукцию TNF-α (А) и IFN-γ (В) мононуклеарами (МН) крови пациентов-доноров. Примечания. По оси ординат – концентрация (pg/ml) липополисахарид-индуцированной (LPS E. сoli 055:B5 100 µg/ml “Sigma-Aldrich”) TNF-α (А) или IFN-γ (В) в инкубационной среде совместных культур (МСКч 5 × 106/ МН 5 × 106 в 5 мл полной ростовой среды RPMI-1640 после 24 ч инкубации при 37°С); оси абсцисс – дозы 50–1000 мГр γ-излучения, которым подвергнуты культуры МСК костного мозга человека. Представлены средние данные от двух-трех независимых опытов.
Fig. 3. The modifying effect of exposed to γ-irradiation in doses of 50–1000 mGy mesenchymal stem cells (MSCs) on in vitro lipopolysaccharide-induced production of TNF-α (A) and IFN-γ (B) by blood mononuclear cells (MN) of donor patients.
ОБСУЖДЕНИЕ
В последние годы благодаря интенсивным исследованиям функций МСК доказана их потенциальная роль в репаративных процессах поврежденных тканей, в том числе радиационно-индуцированных поражений костного мозга, кишечника, кожного покрова и т.д. [5, 6]. S. Francois и соавт. [25] на диабетических мышах с тяжелым комбинированным иммунодефицитом (NOD/SCID) с воздействием сублетального (3.5 Гр; источник Сs137) общего γ-излучения в сочетании с локальным воздействием гамма-излучения на брюшную полость в дозе 4.5 Гр или правую заднюю конечность в дозе 26.5 Гр исследовали количественное и пространственное (по органам) распределение внутривенно введенных в дозе 5 × 106 человеческих МСК с помощью иммуногистологического и ПЦР-анализа. Авторами было установлено, что хоуминг введенных в общий кровоток ксеногенных МСК имеет тропный характер распределения и преимущественную локализацию в радиационно-поврежденных зонах органов и тканей. По мнению авторов, использованные ими модели радиационного поражения на фоне МСК-терапии могут иметь отношение к нескольким клиническим ситуациям: тотальное общее облучение как предтрансплантационный режим кондиционирования, лучевая терапия при лечении опухолей разных локализаций, а также случаи возможного аварийного облучения. Само по себе у NOD/SCID – иммунодефицитных мышей значительно повышалось приживление (графтинг) ксеногенных МСК в радиационно-поврежденные ткани после воздействия общего γ-излучения в сочетании с локальным воздействием. Таким образом, тропный характер распределения ex vivo экспансированных МСК при их инфузии в системный кровоток может служить в качестве перспективного терапевтического подхода в лечении постлучевых повреждений тканей и органов. В настоящее время проходят клинические испытания методики МСК-терапии в ремоделировании тканей при инфарктах, кардиомиопатиях, повреждениях спинного мозга и костей, фиброза легких и т.д. [26; http.// www.clinicaltrials.gov.]. Активная миграция МСК в поврежденные ткани опосредована различными факторами: хемокинами, протеолитическими ферментами, адгезивными молекулами, цитокинами и т.д. [27]. Показано, что в качестве одного из механизмов МСК противовоспалительного и стимулирующего регенеративные процессы воздействия в поврежденных тканях является секреция МСК молекул-антиоксидантов, в частности, супероксиддисмутазы (SOD3) [28]. SOD3, как секретируемая форма супероксиддисмутазы в кондиционированной среде MSC, была идентифицирована путем гель-электрофореза SDS-PAGE и иммуноблоттинга с использованием специфических моноклональных антител. Как было установлено, уровень MSC-секреции SOD3 в кондиционированную среду составлял около 0.046 пг/клетку (±0.012 станд. отклонение при n = 3).
По мнению K. Kemp и соавт. [28], SOD3 содействует повышению выживаемости мозжечковых нейрональных клеток и специфических клеток Пуркинье, следовательно, способствует нейропротекции при возникновении повреждений тканей в ЦНС. Аналогично описанные подходы могут оказаться эффективными при лечении постлучевых поражений тканей, при которых окислительные повреждения считаются одними из центральных. В частности, повышенная секреция SOD генномодифицированными МСК усиливала эффекты МСК-терапии на модели облученных животных [29]. Инфузия МСК при тотальном облучении тела у мышей индуцирует повышение экспрессии генов, редуцирующих продукцию активных форм кислорода (АФК), в частности, транскрипционного фактора Nrf 2 и SOD и противовоспалительного IL-10 [30]. МСК при in vitro сокультивировании ингибируют продукцию АФК макрофагами [19, 31, 32].
Моноциты и макрофаги являются одними из эффекторных клеток на патоген-ассоциированные молекулярные паттерны в очаге лучевых поражений органов и тканей и инициируют воспалительный процесс для локальной защиты от повреждений и инфекции. Основным источником клеточных АФК являются митохондрии, в которых за счет НАДФН-оксидаз формируется супероксидный радикал $({\text{О }}_{2}^{ - })$. Продуцируемая МСК супероксиддисмутаза 3 во внеклеточном пространстве катализирует переход супероксида в перекись водорода (Н2О2), который, в конечном итоге, распадается на водород и кислород за счет действия каталаз и пероксидаз. Таким образом, SOD3 предотвращает вступление в реакцию супероксида с оксидом азота, исключая формирование пероксинитрита – одного из наиболее сильных окислителей. SOD3, по-видимому, является одним из начальных факторов антиоксидантной защиты радиационно-индуцированных повреждений тканей от потенцирующего дополнительного аддитивного воздействия макрофагальных АФК.
Дополнительно, во избежание повреждения клеток, АФК-генерирующие митохондрии постоянно подвергаются митофагии, специализированному процессу аутофагии [33]. МСК являются мощными модуляторами врожденного и адаптивного иммунного ответа, в том числе, через модификацию функциональных свойств моноцитов/макрофагов. Инфламмасомы являются цитозольным и мультипротеиновыми комплексами, которые присутствуют в макрофагах и дендритных клетках [32]. Инфламмасома в макрофагах активируется в ответ на сигналы “клеточных повреждений” и инициирует воспалительные реакции путем продукции и секреции провоспалительных цитокинов, таких как IL-1β. Установлено, что человеческие МСК в негативном направлении регулируют активацию NLRP3 инфламмасомы человеческих и мышиных макрофагов, стимулированных ЛПС и АТФ [32, 33]. Активация каспазы-1 и последующее высвобождение IL-1β были снижены при прямом или transwell сокультивировании МСК с ЛПС-премированными макрофагами. МСК ингибируют активацию NLRP3 инфламмасомы и производство митохондриальных АФК в макрофагах, в первую очередь, за счет секреции антиапоптотического белка Stanniocalcin (STC-1) [32]. Добавление рекомбинантного белка STC-1 к ЛПС/АТФ-предстимулированным макрофагам приводило к воспроизведению эффекта МСК-ингибирования активации NLRP3 инфламмасомы и производства митохондриальных АФК. Таким образом, МСК ингибируют активизацию NLRP3 инфламмасомы и производство АФК в макрофагах, прежде всего, за счет секреции белка STC-1. Установлено, что роль STC-1 у млекопитающих заключается в защите от ишемии, подавлении воспалительных реакций и снижении АФК и апоптоза. По мнению авторов, учитывая важную роль митохондриальных АФК в активации NLRP3 инфламмасомы, роль МСК может заключаться в негативной регуляции инфламмасомных реакций в макрофагах, тем самым предотвращая развитие чрезмерных воспалительных реакций, в том числе в очагах пострадиационных поражений тканей и органов. В качестве клеточных регуляторов инфламмасомы эффекторные и СD4+ Т-клетки памяти ингибируют инфламмасома-медиируемую активацию каспазы-1 и продукцию IL-1β через лиганды ТNF-α или IFN-γ-сигнализации. Эти данные свидетельствуют, что МСК-модулирующая активность обеспечивается не только за счет межклеточных контактов, но также за счет продукции различных медиаторов (факторов) в микроокружении.
Полученные нами данные определенно свидетельствуют, что ex vivo экспансированные костно-мозговые МСК человека, а также их кондиционированные среды (КС) характеризуются дозозависимым in vitro ингибирующим действием на зимозан-индуцируемую люминол-зависимую хемилюминесценцию (ХЛ-активность) мононуклеаров (МН) крови пациентов-доноров. Поскольку интенсивность люминол-зависимой хемилюминесценции определяется суммарным эффектом всех продуцируемых макрофагами форм АФК (включая гипохлорит, пероксид водорода, синглетный анион-радикал, гидроксильный радикал, синглетный кислород, оксид азота и т.д.), выявленное угнетение ХЛ-ответа на опсонизированный зимозан в результате кратковременного сокультивирования во взвеси МСК/макрофагов обусловлено снижением продукции АФК в микроокружении. Аналогичные эффекты были выявлены при инкубации макрофагов в кондиционированных средах разных концентраций (от 12.5 до 100%), полученных при культивировании интактных и подвергнутых воздействию γ-излучения в широком диапазоне доз (50–500 мГр) МСКч. Возможные механизмы ингибирующего воздействия МСК на продукцию АФК и ТNF-α мы попытались обсудить на основе имеющихся литературных данных, собственных данных по этому поводу у нас нет. Иммуномодулирующие свойства МСК сохранялись при воздействии γ-излучения в малых и больших дозах на монослойные культуры МСК костного мозга человека. Максимальный ингибирующий эффект был выявлен при летальных дозах γ-излучения (10 Гр). В то же время воздействие γ-излучения на монослойную культуру МСКч в малых дозах (50–100 мГр) сопровождалось определенным стимулирующим эффектом на оцениваемые показатели функциональной активности МН по сравнению с эффектами воздействия интактных МСКч. В целом эти результаты согласуются с имеющимися в литературе данными о стимулирующем воздействии γ-излучения в малых дозах (20–75 мГр) на пролиферативную активность костномозговых МСК крыс [20]. Стимуляция пролиферации МСК крыс, по мнению авторов, связана с активизацией MAPK/ERK сигнальных путей, а также повышением доли клеток в S-фазе и снижением количества МСК в G1-фазе клеточного цикла. Таким образом, воздействие γ-излучения в малых дозах может служить в качестве одного из подходов прекондиционирования иммуномодулирующих свойств МСК. Можно предположить, что механизм МСК-ингибирования продукции АФК и провоспалительных цитокинов (TNF-α) тканевыми макрофагами может являться одним из ранних звеньев модуляции супрессивного микроокружения. По-видимому, мультипотентные МСК эволюционно выработали разнообразные механизмы (пути) избегания или минимизации нежелательных эффектов со стороны клеток-эффекторов естественного иммунитета организма, включая выработку SOD3, ингибирования продукции АФК и провоспалительных цитокинов тканевыми макрофагами. Причем, по данным литературы, МСК могут сохранять иммуномодулирующие свойства после их хоуминга и графтинга (локального приживления) после трансплантации, создавая в итоге иммуносупрессивную и прорегенеративную среду в локальном микроокружении в организме. Предполагается, что иммуномодулирующие свойства МСК не являются конституитивными, а индуцируются различными медиаторами воспалительного микроокружения [34]. В целях повышения эффективности и всеобъемлющего лечения радиационных поражений нам представляются перспективными следующие направления исследований по клеточной терапии:
– во-первых, подходы по использованию генномодифицированных или прекондиционированных разными стимулами МСК;
– во-вторых, комбинирование эффектов МСК-терапии в сочетании с Tregs- или DC-клетками с более детальной стандартизацией используемых для терапии клеток [34];
– наконец, возможное использование бесклеточных трофических факторов МСК в составе экзосом (везикул) [35], а также преимлантационного фактора (PIF) [36]. PIF изначально идентифицирован и охарактеризован E.R. Barnea и соавт. [37] как эмбрио-секретируемый пептид, состоящий из 9–15 аминокислот, тесно связанный с функцией человеческих эндометриальных стромальных клеток (Humanendometrialstromalcells – HESC) и первичных триместр децидуальных клеток (firsttrimesterdecidualcells – FTDC). Примечательно, что использование синтетического аналога PIF (в дозах 0.75–1.25 мг/кг) в течение первых двух часов после воздействия летального γ-излучения (8 Гр) мышей С57BL/6 или F1(С57BL/6xBalb/c) повышало выживаемость до 100% в течение 29 дней при 100%-ной летальности в течение 23 дней в контрольной группе [36]. При сублетальном γ-излучении (6 Гр) внутривенное введение 8 × 106 сингенных мононуклеарных клеток костного мозга, предварительно (до трансплантации) прединкубированных с PIF, способствовало сохранению структуры крипт и базальной мембраны кишечника мышей, восстановлению клеточности костного мозга и периферической крови без какой-либо дополнительной терапии. Таким образом, применение PIF в сочетании с трансплантацией костного мозга и мезенхимных стромальных клеток (МСК) может быть перспективным для эффективного лечения радиационных поражений.
Список литературы
Martindale J.L., Holbrook N.J. Cellular Response to Oxidative Stress: Signaling for Suicide and Survival // J. Cell Physiol. 2002. V. 192. P. 1–15.
Hill S., Van Remmen H. Mitochondrial stress signaling in longevity: A new role for mitochondrial function in aging // Redox Biol. 2014. V. 2. P. 936–944.
Almeida A.S., Fiqueiredo-Pereira C., Vieira H.L. Carbone monoxide and mitochondria-modulation of cell metabolism, redox response and cell death // Front Physiol. 2015. V. 6. Art. 33. P. 1–6.
Ярмоненко С.П., Вайнсон А.А. Радиобиология человека и животных. М.: Высш. шк., 2004. 549 с. [Yarmonenko S.P., Vainson A.A. Radiobiology of humans and animals // Radiobiologiya cheloveka i zhivotnykh. Moscow: Vysshaya Shkola, 2004. 549 p. (in Russian)]
Nicolay N.H., Perez R.L., Debus J., Huber P.E. Radio-resistant mesenchymal stem cells: mechanisms of resistance and potential implications for the clinic // Cancer Lett. 2015. V. 366. P. 133–140.
Nicolay N.H., Perez R.L., Saffrich R., Huber P.E. Radio-resistant mesenchymal stem cells: mechanisms of resistance and potential implications for the clinic // Oncotarget. 2015. V. 6. № 23. P. 19366–19380.
Калмыкова Н.В., Александрова С.А. Терапевтическое действие мультипотентных мезенхимальных стромальных клеток после радиационного воздействия // Радиац. биология. Радиоэкология. 2016. Т. 56. № 2. С. 117–137. [Kalmykova N.V., Alexandrova S.A. Therapeutic effects of multipotent mesenchymal stromal cells after irradiation // Radiation Biology. Radioecology. Terapevticheskoe deistvie mul’tipotentnykh mezenkhimal’nykh stromal’nykh kletok posle radiatsionnogo vozdeistviya // Radiatsionnaya Biologiya. Radioecologiya. 2016. V. 56. № 2. P. 117–137. (in Russian)]
Sugrue T., Lowndes N.F., Ceredig Rh. Mesenchymal stromal cells: radio-resistant members of the bone marrow // Immunol. Cell Biol. 2013. V. 91. P. 5–11.
Chao Y., Wei Min D., Hai Xu C., Ben Yan W. Application of human bone marrow-derived mesenchymal stem cells in the treatment of radiation-induced gastrointestinal syndrome. // Sci. China Life Sci. 2014. V. 57. № 12. P. 1177–1182.
Chang .-Y., Qu Y.-Q., Wang J., Dong L.-H. The potential of mesenchymal stem cells in the management of radiation enteropathy // Cell Death and Disease. 2015. V. 6. P. e1840; doi: 10. 1038/cdds. 2015. 189; publ. online 6 Aug. 2015.
Котенко К.В., Еремин И.И., Мороз Б.Б. и др. Клеточные технологии в лечении радиационных ожогов: Oпыт ФМБЦ им. А.И. Бурназяна // Клеточная технология и тканевая инженерия. 2012. Т. 7. № 2. С. 97–102. [Kotenko K.V., Eremin I.I., Moroz B.B. Kletochnye tekhnologii v lechenii radiatsionnykh ozhogov: opyt FMBTs im. A.I. Burnazyana // Kletochnaya tekhnologiya i tkanevaya inzheneriya. 2012. V. 7. № 2. P. 97–102. (in Russian)]
Iwata M., Madtes D.K., Abrams K. et al. Late Infusion of Cloned Marrow Fibroblasts Stimulates Endogenous Recovery from Radiation-Induced Lung Injury // PLoS ONE. 2013. V. 8. № 3. P. e57179.
Shim S., Lee S.B., Lee J.G. et al. Mitigating effects of hUCB-MSCs on the hematopoietic syndrome resulting from total body irradiation // Exp. Hematol. 2013. V. 41. № 4. P. 346–353.
Lange C., Brunswid-Spickenheier B., Cappallo-Ottemann H. et al. Radiation rescue: mesenchymal stromal cells protect from lethal irradiation // PLoS ONE. 2011. V. 6. № 1. P. e14486.
Андреева Е.Р., Буравкова Л.Б. Взаимодействие мультипотентных мезенхимальных стромальных и иммунных клеток: двунаправленные эффекты // Рос. физиол. журн. 2012. Т. 98. № 12. С.1441–1459. [Andreeva E.R., Buravkova L.B. Vzaimodeistvie mul’tipotentnykh mezenkhimal’nykh stromal’nykh i immunnykh kletok: dvunapravlennye effekty // Ros. Fiziol. Zhurn. 2012. V. 98. № 12. P. 1441–1459. (in Russian)]
Маянская И.В., Гоганова А.Ю., Толкачева Н.И. и др. Иммуносупрессивное действие мезенхимальных стволовых (стромальных) клеток // Иммунология. 2013. № 2. С. 122–128. [Mayanskaya I.V., Goganova A.Yu., Tolkacheva N.I., Ashkinazi V.I., Mayanskii A.N. Immunosupressivnoe deistvie mezenkhimal’nykh stvolovykh (stromal’nykh) kletok // Immunologiya. 2013. № 2. P. 122–128. (in Russian)]
Glenn J.D., Whartenby K.A. Mesenchymal stem cells: Emerging mechanisms of immunomodulation and therapy // World J. Stem Cells. 2014. V. 6. № 5. P. 526–539.
Molina E.R., Smith B.T., Shan S. et al. Immunomodulatory properties of stem cells and bioactive molecules for tissue engineering // J. Control. Release. 2015; http: //dx.doi.org/.https://doi.org/10.1016/ jcontel.2015.08.038
Цыб А.Ф., Петров В.Н., Коноплянников А.Г. и др. Ингибирующее действие in vitro мезенхимальных стволовых клеток на зимозан-индуцируемую продукцию активных форм кислорода макрофагами. // Клеточные технологии в биологии и медицине. 2008. № 3. С. 171–178. [Tsyb A.F., Petrov V.N., Konoplyannikov A.G., Sayapina E.V., Lepekhina L.A., Kal’sina S.Sh., Semenkova I.V., Agaeva E.V. Ingibiruyushchee deistvie in vitro mezenkhimal’nykh stvolovykh kletok na zimozan-indutsiruemuyu produktsiyu aktivnykh form kisloroda makrofagami // Kletochnye tekhnologii v biologii i meditsine.2008. № 3. P. 171–178. (in Russian)]
Liang X., So Y.H., Cui J. et al. The Low-dose Ionizing Radiation Stimulates Cell Proliferation via Activation of the MAPK/ERK Pathway in Rat Cultured Mesenchymal Stem Cells // J. Radiat. Res. 2011. V. 52. P. 380–386. https://doi.org/10.1269/jrr.10121
Sugrue T., Lowndes NF., Ceredig R. Local Irradiation Not Only Induces Homing of Human Mesenchymal Stem Cells at Exposed Sites but Promote Their Widespread Engraftment to Multiple Organs: A Study of Their Quantitative Distribution After Irradiation Damage // Stem Cells. 2014. V. 32. P. 2188–2200.
Dominici M., Le Blanc K., Mueller I. et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement // Cytotherapy. 2006. V. 8. P. 315–317.
Zheng G., Ge M., Qiu G., Shu Q., Xu J. Local Irradiation Not Only Induces Homing of Human Mesenchymal Stem Cells at Exposed Sites but Promote Their Widespread Engraftment to Multiple Organs: A Study of Their Quantitative Distribution After Irradiation Damage // Stem Cells Int. 2015. ArticleID 989473. 11 pages; https://doi.org/10.1155/2015/989473
Гланц С. Медико-биологическая статистика: Пер. с англ. М.: Практика, 1999. С. 104–121. [Glants S. Mediko-biologicheskaya statistika. Moscow: Praktika, 1999. P. 104–121. (in Russian)]
Francois S., Bensidhoum M., Mouiseddine M. et al. Local Irradiation Not Only Induces Homing of Human Mesenchymal Stem Cells at Exposed Sites but Promote Their Widespread Engraftment to Multiple Organs: A Study of Their Quantitative Distribution After Irradiation Damage // Stem Cells. 2006. V. 24. P. 1020–1029.
Barry F.P., Murphy J.M. Mesenchymal stem cells: Clinical applications and biological characterization // Int. J. Biochem. Cell Biol. 2004. V. 36. P. 568–584.
Lapidot T., Petit I. Current understanding of stem cell mobilization: The roles of chemokines, proteolytic enzymes, adhesion molecules, cytokines and stromal cells // Exp. Hematol. 2002. V. 30. P. 973–981.
Kemp K., Hares K., Mallam E. et al. Intravenous administration of mesenchymal stem cells genetically modified with extracellular superoxide dismutase improves survival in irradiated mice // J. Neurochem. 2010. V. 114. № 6. P. 1569–1580.
Abdel-Mageed A.S., Senagore A.J., Pietryga D.W. et al. Intravenous administration of mesenchymal stem cells genetically modified with extracellular superoxide dismutase improves survival in irradiated mice // Blood. 2009. V. 113. P. 1201–1203.
Francois S., Mouiseddine M., Allenet-Lepage B. Human mesenchymal stem cells provide protect against radiation induced liver injury by antioxid process, vasculature protection, hepatocyte differentiation and trophic effects // Biomed. Res. Int. 2013; 2013: Art ID 151679; https://doi.org/10.1155/2013/151679
Raffaghello L.Ph.D., Bianchi G., Bertolotto et al. Human Mesenchymal Stem Cells Inhibit Neutropil Apoptosis: A Model for Neutrophil Preservation in the Bone Marrow Niche // Stem Cells. 2008. V. 26. Issue 1. P. 151–162.
Oh J.I., Ko J.H., Lee H.J. et al. Mesenchymal stem/stromal cells inhibit the NLPP3 inflammasome by decreasing mitochondrial reactive oxigene species // Stem Cells. 2014. V. 32. P. 1553–1563.
Zhou R., Yazdi A.S., Menu Ph. & Tschopp J. A role for mitochondria in NLRP3 inflamasome activation // Nature. 2011. V. 469. P. 221–226.
Kim N., Cho S.-G. Overcoming immunoregulatory plasticity of mesenchymal stem cells for accelerated clinical applications // Int. J. Hematol. 2016. V. 103. P. 129–137.
Konala V.B., Mamidi M.K., Bhonde R. et al. The current landscape of the mesenchymal stromal cell secretome: A new paradigm for cell-free regeneration // Cytothe-rapy. 2016. V. 18. № 1. P. 13–24.
Shainer R., Almogi-Hazan O., Berger A. et al. PreImplantation factor (PIF) therapy provides comprehensive protection against radiation induced pathologies // www.impactjournals.com/oncotarget. 2016. V. 7. № 37. P. 58975–58994.
Barnea E.R., Almogi-Hazan O., Or R. et al. Immune regulatory and neuroprotective of preimplantation factor: From newborn to adult // Pharmacology& Therapeutics. 2015. V. 156. P. 10–25.
Каприн А.Д., Галкин В.Н., Жаворонков Л.П. и др. Синтез фундаментальных и прикладных исследований – основа обеспечения высокого уровня научных результатов и внедрение их в медицинскую практику // Радиация и риск. 2017. Т. 26. № 2. С. 26–40. [Kaprin A.D., Galkin V.N., Zhavoronkov L.P., Ivanov V.K., Ivanov S.A., Romanko Yu.S. Sintez fundamental’nykh i prikladnykh issledovanii – osnova obespecheniya vysokogo urovnya nauchnykh rezul’tatov i vnedrenie ikh v meditsinskuyu praktiku // Radiatsiya i risk. 2017. V. 26. № 2. P. 26–40. (in Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


