Радиационная биология. Радиоэкология, 2019, T. 59, № 6, стр. 592-598
АНТИАПОПТОТИЧЕСКИЕ ЭФФЕКТЫ КОФЕИНА, ГЕНИСТЕИНА И ВЕРАПАМИЛА ПО ОТНОШЕНИЮ К УФ-ОБЛУЧЕННЫМ ЛИМФОЦИТАРНЫМ КЛЕТКАМ
М. А. Наквасина 1, *, Е. В. Токмакова 1, И. А. Колтаков 1, В. Г. Артюхов 1
1 Воронежский государственный университет
Воронеж, Россия
* E-mail: nakvasina_ma@mail.ru
Поступила в редакцию 01.10.2018
Аннотация
Апоптоз лимфоцитов человека, индуцированный воздействием УФ-света (240–390 нм) в дозе 1510 Дж/м2, сопровождается значительным ростом внутриклеточного уровня активных форм кислорода в течение 1–2 ч после облучения. Добавление кофеина (10–4 моль/л) и генистеина (10–6 моль/л) к УФ-облученным лимфоцитам индуцирует снижение на 11 и 23% соответственно по сравнению с контролем количества клеток, находящихся на ранней стадии апоптоза. Антиапоптотические эффекты кофеина и генистеина по отношению к фотомодифицированным лимфоцитам связаны с их способностью снижать уровень активных форм кислорода в интактных и УФ-облученных клетках и инактивировать пероксид водорода. Верапамил (10–4 моль/л), в отличие от действия кофеина и генистеина, не уменьшает количество лимфоцитов, находящихся на ранней стадии апоптоза, по сравнению с таковым для фотомодифицированных свободных клеток, но проявляет эффекты снижения уровня активных форм кислорода в иммуноцитах.
Выявление механизмов, путей реализации и способов регулирования программированной клеточной смерти (ПКС) – одна из ключевых проблем биофизики и биохимии клетки.
Апоптоз – энергозависимый, эволюционно-консервативный процесс клеточной гибели, инициируемый внешними и внутренними факторами (сигналами), сопровождающийся активацией специфических протеаз и нуклеаз, расщеплением белков и фрагментацией ядерной ДНК, образованием мембранных апоптозных телец, содержащих фрагменты ядра и цитоплазмы [1, 2].
Нами установлено [3], что УФ-свет (240–390 нм) в дозах 151 и 1510 Дж/м2 индуцирует запуск рецепторного (Fas-зависимого) каспазного и р53-зависимого путей апоптоза лимфоцитов периферической крови доноров. На основании исследования уровня цитохрома с, изменений структурного состояния, величин мембранного потенциала митохондриальных мембран и активности сукцинатдегидрогеназы высказано предположение о возможности реализации апоптотической гибели лимфоцитов по митохондриальному механизму [4]. По-видимому, одними из медиаторов ПКС лимфоцитов в условиях УФ-облучения являются активные формы кислорода (АФК) и ионы кальция.
Соединения, способные изменять в клетках уровень АФК, свободного ионизированного кальция и влиять на функционирование отдельных компонентов сигналтрансдукторных систем, взаимодействующих с собственными сигнальными путями апоптоза, могут быть использованы в качестве регуляторов ПКС.
Верапамил – блокатор потенциалзависимых кальциевых каналов, модулятор фосфоинозитидного пути передачи информации в клетку [5, 6]. Кофеин – блокатор фосфодиэстеразы, разрушающей цАМФ, способный влиять на клеточный цикл и активность ключевых регуляторных белков, выступать в роли антиоксиданта или индуцировать апоптоз – соответственно в низких и высоких концентрациях [7–9]. Изофлавоноид генистеин – ингибитор протеинтирозинкиназы и топоизомеразы II, проявляющий антиоксидантную, антиангиогенную, противоопухолевую и иммуносупрессивную активность [10, 11].
С целью уточнения и детализации представлений о механизмах УФ-индуцированного апоптоза иммуноцитов, а также возможности его регулирования нами были исследованы структурно-функциональные модификации лимфоцитов человека после их УФ-облучения (240–390 нм) в дозе 1510 Дж/м2 и добавления верапамила, кофеина и генистеина.
МАТЕРИАЛЫ И МЕТОДИКА
Объектом исследования стали лимфоцитарные клетки, выделенные из гепаринизированной крови доноров. Лимфоциты получали центрифугированием донорской крови в градиенте плотности фиколл-урографина (ρ = 1.077 г/см3) [12]. Рабочая концентрация лимфоцитов – 2 × 106 кл/мл.
УФ-облучение лимфоцитов, суспендированных в растворе Хенкса (рН 7.4), проводили при их непрерывном перемешивании в термостатируемой открытой стеклянной кювете при температуре 20 ± 1°С с помощью ртутно-кварцевой лампы типа ДРТ-400. Расстояние от оси лампы до кюветы с образцом составляло 0.23 м. УФ-облучение клеток проводили через светофильтр УФС-1 с полосой пропускания 240–390 нм (со спектральными линиями: 253.7, 265.2, 280, 296.7, 302.2, 312.6, 365 нм). Интенсивность излучения лампы – 151 Дж/м2 за 1 мин. Доза облучения лимфоцитов составляла 1510 Дж/м2. Объем вносимого в кювету образца – 1 мл.
Суспензии интактных и УФ-модифицированных лимфоцитов в растворе Хенкса инкубировали в микропробирках при 37°С в течение 1–2 ч в присутствии СО2.
Для определения количества апоптотических клеток в суспензии лимфоцитов использовали тест-систему для детекции апоптоза FITC Annexin V/Dead Cell Apoptosis Kit (“Invitrogen”, США) [13]. Исследования проводили на проточном цитометре Guavaeasy Cyte (Merk Millipore, США). Полученные данные обрабатывали при помощи программы In Cyte.
Уровень экспрессии CD95 на поверхности лимфоцитов определяли методом проточной цитофлуориметрии на цитометре Guavaeasy Cyte (Merk Millipore, США) при помощи набора FITC Mouse Anti–Human CD95 (“BD PharmigenTM”, США).
Внутриклеточный уровень АФК исследовали флуоресцентным методом при помощи 2',7'-дихлорфлуоресцеин диацетата (DCFH-DA) на спектрофлуориметре Shimadzu RF-1501 (длина волны возбуждения – 480 нм, диапазон длин волн эмиссии образовавшегося в ходе реакции 2',7'-дихлорфлуоресцеина (DCF) – 524–525 нм) [14].
Уровень каталитической активности каталазы и глутатионредуктазы лимфоцитов определяли спектрофотометрическим методом при длинах волн соответственно 410 и 340 нм.
Число жизнеспособных лимфоцитов в пробах определяли методом эксклюзии трипанового синего [12].
Предварительно был проведен выбор концентраций используемых модификаторов таким образом, чтобы они не оказывали влияния на жизнеспособность нативных лимфоцитарных клеток. Для дальнейших экспериментов использовали растворы модификаторов в конечных концентрациях: верапамил (10–4 моль/л); кофеин (10–4 моль/л); генистеин (10–6 моль/л).
Растворы модификаторов добавляли к облученным суспензиям лимфоцитов через 1 мин после завершения процесса облучения.
Антирадикальную активность исследуемых модификаторов (верапамила, кофеина и генистеина) регистрировали по изменению интенсивности хемилюминесценции люминола на биохемилюминометре БХЛ-07. Инициация хемилюминесценции люминола происходит вследствие его окисления Н2О2, ОН-радикалами, супероксидным анион-радикалом. Среда для определения антирадикальной активности модификаторов по отношению к пероксиду водорода содержала: 0.4 мл натрий-фосфатного буфера (pH 7.4 при 20°С); 0.1 мл раствора люминола (10–3 моль/л); 0.1 мл модификатора (раствор Хенкса – в случае контроля); 0.1 мл H2O2 в концентрации 10–4 моль/л (вносимого перед измерением). Для изучения антирадикальной активности верапамила, кофеина и генистеина по отношению к ОН-радикалам использовали систему генерации гидроксильных радикалов по механизму Фентона [15]. В кювету хемилюминометра вносили 0.1 мл исследуемого модификатора (раствор Хенкса – в случае контроля); 0.4 мл натрий-фосфатного буфера (pH 7.4 при 20°С); 0.4 мл раствора FeSO4 (0.05 моль/л; готовится непосредственно перед работой) и 0.1 мл раствора люминола (10–3 моль/л). Затем быстро вносили 0.1 мл раствора пероксида водорода (10–4 моль/л) и измеряли интенсивность хемилюминесценции в данной системе. Кинетическую кривую биохемилюминесценции регистрировали в течение 1 мин на БХЛ-07, определяли интенсивность вспышки Imax. Конечные концентрации модификаторов в этих системах: верапамил (10–4 моль/л); кофеин (10–4 моль/л); генистеин (10–6 моль/л).
Статистическую обработку результатов экспериментов осуществляли с помощью набора электронных таблиц “Statgraphics”. Достоверность отличий контрольных и опытных значений долей лимфоцитов, находящихся на ранней стадии апоптоза и поздней стадии апоптоза или некроза, определяли с применением критерия согласия частот χ2 (хи-квадрат); уровня АФК в лимфоцитах в присутствии верапамила, кофеина, генистеина и их антирадикальной активности – при помощи t-критерия Стьюдента [16].
РЕЗУЛЬТАТЫ
На рис. 1 представлены результаты определения уровня активных форм кислорода в лимфоцитах сразу после УФ-облучения (1510 Дж/м2) и через 1 и 2 ч после фотомодификации клеток. Зарегистрировано статистически значимое повышение содержания активных форм кислорода в облученных лимфоцитах по сравнению с таковым нативных клеток.
Рис. 1.
Изменения уровня АФК после УФ-облучения лимфоцитов: 1 – уровень АФК в лимфоцитах сразу после облучения; 2 – уровень АФК в лимфоцитах через 1 ч после облучения; 3 – уровень АФК в лимфоцитах через 2 ч после облучения. А – интактные лимфоциты; Б – УФ-облученные лимфоциты.
Fig. 1. Changes in the level of ROS after UV-lymphocyte irradiation. Legend: 1 – ROS level in lymphocytes immediately after irradiation; 2 – ROS level in lymphocytes after 1 h after irradiation; 3 – ROS level in lymphocytes after 2 h after irradiation. A – intact lymphocytes; B – UV-irradiated lymphocytes.
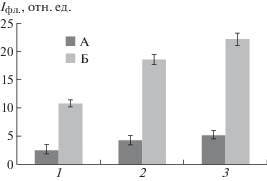
Обнаружено, что через 2 ч после УФ-облучения лимфоцитов наблюдается статистически значимое повышение по отношению к контролю ферментативной активности глутатионредуктазы (с 9 до 15 мкмоль/мин) и снижение – каталазы (со 160 до 130 мкмоль/мин) соответственно.
В ходе проведения проточно-цитофлуориметрического анализа выявлено снижение количества УФ-облученных клеток, находящихся на ранней стадии апоптоза, после добавления кофеина (10–4 моль/л) и генистеина (10–6 моль/л) по сравнению с таковым для фотомодифицированных клеток в отсутствие модификаторов (табл. 1).
Таблица 1.
Данные проточно-цитофлуориметрического анализа количества фосфатидилсерин-позитивных лимфоцитов и лимфоцитов с поврежденной мембраной через 2 ч после УФ-облучения и добавления модификаторов Table 1. Data of flow-cytofluorimetric analysis for the number of phosphatidylserine-positive lymphocytes and lymphocytes with a damaged membrane 2 h after UV-irradiation and the modifiers addition
| Образец | Ранняя стадия апоптоза | Поздняя стадия апоптоза или некроза |
|---|---|---|
| УФ-облучение | 88.5 ± 3.0% | 3.6 ± 2.0% |
| УФ-облучение + верапамил | 87.8 ± 5.0% | 3.7 ± 1.0% |
| УФ-облучение + кофеин | 77.2 ± 5.0%* | 4.0 ± 1.0% |
| УФ-облучение + генистеин | 65.4 ± 3.0%* | 3.3 ± 1.5% |
Нами не были обнаружены статистически значимые отличия уровня экспрессии Fas-рецепторов (CD95) лимфоцитов через 1 ч после УФ-облучения и добавления модификаторов по сравнению с таковым для фотомодифицированных клеток.
В табл. 2 представлены результаты определения количества АФК в лимфоцитарных клетках в присутствии растворов верапамила (10–4 моль/л), кофеина (10–4 моль/л) и генистеина (10–6 моль/л). Обнаружено, что добавление их к нативным лимфоцитам и последующая инкубация в течение 2 ч индуцируют статистически значимое снижение уровня АФК в лимфоцитарных клетках по сравнению с контролем.
Таблица 2.
Влияние верапамила, кофеина, генистеина на уровень АФК в лимфоцитах и интенсивность люминолзависимой хемилюминесценции в модельных системах Table 2. The effect of verapamil, caffeine, genistein on the level of ROS in lymphocytes and the intensity of luminol-dependent chemiluminescence in model systems
| Исследуемый параметр | Контроль | Верапамил | Кофеин | Генистеин |
|---|---|---|---|---|
| Уровень АФК в интактных лимфоцитах (Iфл, отн.ед.) | 7.3 ± 0.5 | 0.5 ± 0.2* | 0.6 ± 0.3* | 0.5 ± 0.3* |
| Уровень АФК в УФ-облученных лимфоцитах (Iфл, отн.ед.) | 23.0 ± 0.9 | 2.0 ± 0.7* | 2.5 ± 0.5* | 3.0 ± 0.6* |
| Интенсивность люминолзависимой хемилюминесценции (Imax, мВ) в условиях экзогенной генерации гидроксильного радикала | 9.0 ± 1.0 | 25.2 ± 0.9* | 5.5 ± 0.8* | 22.0 ± 0.6* |
| (контроль – люминол + + система генерации ОН-радикалов) | ||||
| Интенсивность люминолзависимой хемилюминесценции (Imax, мВ) в присутствии пероксида водорода | 97.0 ± 5.0 | 37.2 ± 4.6* | 21.0 ± 5.5* | 42.0 ± 5.0* |
| (контроль – люминол + + пероксид водорода) |
Выявлено (табл. 2), что указанные соединения вызывают статистически значимое снижение внутриклеточного количества АФК в лимфоцитах через 2 ч после их УФ-облучения по отношению к таковому для фотомодифицированных клеток (контроль).
Установлено (табл. 2), что верапамил и генистеин в условиях экзогенной генерации гидроксильных радикалов индуцируют статистически значимое повышение интенсивности люминесценции люминола (в максимуме) по сравнению с контрольным образцом (люминол + система генерации ОН-радикалов). Кофеин (10–4 моль/л) вызывает статистически значимое снижение интенсивности вспышки люминола по отношению к контролю в присутствии OH-радикалов.
В присутствии пероксида водорода (10–4 моль/л) используемые модификаторы индуцируют статистически значимое снижение значения Imax свечения люминола (табл. 2) по сравнению с контрольным образцом (люминол + Н2О2).
ОБСУЖДЕНИЕ
Анализ полученных результатов позволяет заключить, что активные формы кислорода являются медиаторами УФ-индуцированного апоптоза лимфоцитов человека. Существенный рост внутриклеточной концентрации АФК после воздействия УФ-света на лимфоциты может быть связан со снижением активности и уровня антиоксидантных ферментов и низкомолекулярных антиоксидантов, дезактивирующих свободные радикалы кислорода, а также увеличением продукции АФК в митохондриях. По-видимому, обнаруженное нами падение активности каталазы в ходе реализации УФ-индуцированного апоптоза лимфоцитов приводит к нарастанию уровня H2O2 – регулятора открывания пор в мембранах митохондрий (“депо” проапоптотических факторов) – и способствует усилению процессов программированной клеточной гибели иммуноцитов.
Установлено, что кофеин и генистеин снижают количество клеток, находящихся на ранней стадии апоптоза, инициируемого воздействием УФ-света, и тем самым проявляют антиапоптотический эффект по отношению к фотомодифицированным лимфоцитам.
Вероятно, используемые соединения в вышеназванных концентрациях не влияют на процессы реализации Fas-опосредованного пути УФ-индуцированного апоптоза лимфоцитов. По-видимому, тестируемые нами соединения оказывают влияние на другие механизмы реализации ПКС иммуноцитов, в частности, митохондриальный.
Установлено, что верапамил, кофеин и генистеин снижают уровень активных форм кислорода в интактных и УФ-облученных лимфоцитах.
Результаты экспериментов, направленных на выявление возможной антирадикальной активности модификаторов, позволили уточнить представления о механизмах снижения ими внутриклеточного содержания АФК: за счет их способности улавливать и инактивировать свободные радикалы (ОН-радикалы и пероксид водорода) или опосредованного действия.
Эффекты кофеина в отношении УФ-облученных лимфоцитов (снижение уровня АФК и количества ранних апоптотических клеток), наиболее вероятно, связаны с его антирадикальной активностью. Генистеин, по-видимому, проявляет анти-апоптотическое действие по отношению к фотомодифицированным лимфоцитам за счет снижения уровня H2O2 в иммуноцитах и, опосредованно, путем ингибирования тирозинкиназ.
Полученные нами данные согласуются с результатами ранее проведенных исследований, в которых выявлено радиопротекторное действие кофеина и генистеина. В присутствии кофеина (0.02–1 ммоль/л) обнаружены эффекты уменьшения радиационно-химического выхода пероксида водорода и гидроксильного радикала в водных растворах и образования 8-оксогуанина в растворах ДНК при действии рентгеновского излучения in vitro [17]. Продемонстрировано радиозащитное действие генистеина на организм мышей и крыс, подвергнутых рентгеновскому облучению, по критериям выживаемости, состояния костномозгового кроветворения [18], гематологических показателей и цитокинового статуса [19], системы глутатиона и интенсивности ПОЛ эритроцитов периферической крови [20].
Верапамил (10–4 моль/л) снижает уровень кислородных метаболитов в облученных лимфоцитах и взаимодействует с пероксидом водорода в указанной концентрации, но не вызывает уменьшения количества клеток на ранней стадии УФ-индуцированного апоптоза, что инициирует в дальнейшем проведение экспериментов с применением более высоких его концентраций. Возможно, отсутствие антиапоптотического эффекта верапамила – блокатора кальциевых каналов – обусловлено запуском в условиях УФ-облучения лимфоцитов различных механизмов и путей реализации апоптоза: рецепторопосредованного, р53-зависимого, митохондриального, а также пути, связанного с нарушением гомеостаза кальция. Можно предположить, что блокирование кальциевых каналов плазматических мембран вызывает перераспределение ионов кальция между клеточными компартментами (цитозоль, ЭПР, митохондрии, ядро), усиливающее процессы гибели лимфоцитов.
Антиапоптотический эффект кофеина и генистеина по отношению к УФ-облученным лимфоцитам обусловлен способностью данных веществ подавлять генерирование активных форм кислорода, а также, возможно, ингибированием этими модификаторами с-Jun-сигнального пути, запускающего программированную клеточную гибель (рис. 2).
Рис. 2.
Возможные пути антиапоптотического действия кофеина и генистеина по отношению к УФ-облученным лимфоцитам.
Fig. 2. Possible ways of anti-apoptotic action of caffeine and genistein in relation to UV-irradiated lymphocytes.
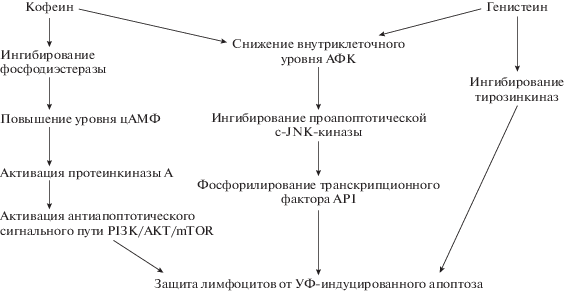
Следовательно, кофеин и генистеин могут быть использованы в качестве агентов, регулирующих (ослабляющих) процессы УФ-индуцированной гибели лимфоцитов человека.
Список литературы
Green D.R., Liambi F. Cell Death Signaling // Gold Spring Harbor. Perspectivesin Biology. 2015. https://doi.org/10/1101/cshperspect.a006080
Мартынова Е.А. Общие представления о роли сфинголипидов в сигнальных путях апоптоза // Патогенез. 2012. Т. 10. № 2. С. 16–28. [Martynova E.A. Obshhie predstavlenija o roli sfingolipidov v signal’nyh putjah apoptoza // Patogenez. 2012. Т. 10. № 2. S. 16–28. (In Russian)]
Артюхов В.Г., Трубицына М.С., Наквасина М.А. и др. Пути реализации апоптоза лимфоцитов человека, индуцированного УФ-светом и активными формами кислорода // Радиац. биология. Радиоэкология. 2011. Т. 51. № 4. С. 425–443. [Artjuhov V.G., Trubicyna M.S., Nakvasina M.A., Solov’eva E.V., Lidohova O.V. Puti realizacii apoptoza limfocitov cheloveka, inducirovannogo UF-svetom i aktivnymi formami kisloroda // Radiac. biologija. Radioekologija. 2011. Т. 51. № 4. S. 425–443. (In Russian)]
Наквасина М.А., Лидохова О.В., Доманская Т.Л. и др. Структурно-функциональные модификации лимфоцитов человека в динамике развития УФ-индуцированного их апоптоза // Радиац. биология. Радиоэкология. 2015. Т. 55. № 6. С. 616–624. [Nakvasina M.A., Lidohova O.V., Domanskaja T.L., Artjuhov V.G., Rjazancev S.V. Strukturno-funkcional’nye modifikacii limfocitov cheloveka v dinamike razvitija UF-inducirovannogo ih apoptoza // Radiac. biologija. Radio-ekologija. 2015. Т. 55. № 6. S. 616–624. (In Russian)]
Degasperi G.R., Velho J.A., Zecchin K.G. et al. Role of mitochondria in the immune response to cancer: A central role for Ca2+ // J. Bioenergetics. 2006. V. 38. P. 1–10.
De Petrillo P.B., Abernethy D.R., Wainer I.W., Andrawis N.S. Verapamil decreases lymphocyte protein kinase C activity in humans // Clin. Pharmacol. & Therap. 1994. V. 55. № 1. P. 44–49.
Devasagayam T.P. Caffeine as an antioxidant: inhibition of lipid peroxidation induced by reactive oxygen species // Biochim. Biophys. Acta. 1996. V. 1282. № 1. P. 63–70.
Geraets L. Caffeine metabolites are inhibitors of the nuclear enzyme poly(ADP-ribose)polymerase-1 at physiological concentrations // Biochem. Pharmacol. 2006. V. 72. № 7. P. 902–910.
Bode Ann M. The enigmatic effects of caffeine in cell cycle and cancer // Cancer Lett. 2007. V. 247. № 1. P. 26–39.
Kim I.G., Kim J.S., Lee J.H., Cho E.W. Genistein decreases cellular redox potential, partially suppresses cell growth in HL-60 leukemia cells and sensitizes cells to γ-radiation-induced cell death // Mol. Med. Rep. 2014. V. 10. № 6. P. 2786–2792.
George J. Genistein induces receptor and mitochondrial pathways and increases apoptosis during BCL-2 knockdown in human malignant neuroblastoma SK-N-DZ cells // J. Neurosci. Res. 2010. V. 88. № 4. P. 877–886.
Лимфоциты. Методы / Под ред. Дж. Клауса. М., 1990. 395 с. [Limfocity. Metody / Pod red. Dzh. Klausa. M., 1990. 395 s. (In Russian)]
Wlodkowic D. Flow cytometry-based apoptosis detection // Meth. Molec. Biol. 2013. V. 559. P. 19–32.
Rastogi R.P., Singh S.P., Häder D., Sinha R.P. Detection of reactive oxygen species (ROS) by the oxidant-sensing probe 2’,7’-dichlorodihydrofluorescein diacetate in the cyanobacterium Anabaena variabilis PCC 7937 // Biochem. Biophys. Res. Commun. 2012. V. 397. № 3. P. 603–607.
Goldstein S., Czapski G. Mannitol as an OH• scavenger in aqueous solutions and in biological systems // Int. J. Radiat. Biol. 1984. V. 46. P. 725–729.
Калаева Е.А., Артюхов В.Г., Калаев В.Н. Теоретические основы и практическое применение математической статистики в биологических исследованиях и образовании. Воронеж, 2016. 284 с. [Kalaeva E.A., Artjuhov V.G., Kalaev V.N. Teoreticheskie osnovy i prakticheskoe primenenie matematicheskoj statistiki v biologicheskih issledovanijah i obrazovanii. Voronezh, 2016. 284 s. (In Russian)]
Попова Н.Р., Гудков С.В., Брусков В.И. Природные пуриновые соединения как радиозащитные средства // Радиац. биология. Радиоэкология. 2014. Т. 54. № 1. С. 38–49. [Popova N.R., Gudkov S.V., Bruskov V.I. Prirodnye purinovye soedinenija kak radiozashhitnye sredstva // Radiac. biologija. Radio-ekologija. 2014. Т. 54. № 1. S. 38–49. (In Russian)]
Гребенюк А.Н., Башарин В.А., Тарумов Р.А. и др. Экспериментальная оценка радиозащитной эффективности генистеина по показателям выживаемости и костномозгового кроветворения мышей, подвергнутых рентгеновскому облучению // Радиац. биология. Радиоэкология. 2013. Т. 53. № 5. С. 468–474. [Grebenjuk A.N., Basharin V.A., Tarumov R.A., Aksenova N.V., Nazarov V.B., Kovtun V.Ju., Cheku-nov I.E. Jeksperimental’naja ocenka radiozashhitnoj jeffektivnosti genisteina po pokazateljam vyzhivaemosti i kostnomozgovogo krovetvorenija myshej, podvergnutyh rentgenovskomu oblucheniju // Radiac. biologija. Radioekologija. 2013. Т. 53. № 5. S. 468–474. (In Russian)]
Гребенюк А.Н., Тарумов Р.А., Башарин В.А. и др. Экспериментальная оценка влияния синтетического генистеина на гематологические показатели и цитокиновый статус облученных крыс // Радиац. биология. Радиоэкология. 2015. Т. 55. № 2. С. 160–168. [Grebenjuk A.N., Tarumov R.A., Basharin V.A., Pastushenkov V.L., Kovtun V.Ju. Jeksperimental’naja ocenka vlijanija sinteticheskogo genisteina na gematologicheskie pokazateli i citokinovyj status obluchennyh krys // Radiac. biologija. Radioekologija. 2015. Т. 55. № 2. S. 160–168. (In Russian)]
Гребенюк А.Н., Тарумов Р.А., Башарин В.А., Ковтун В.Ю. Экспериментальная оценка радиозащитной эффективности синтетического генистеина по показателям системы глутатиона и перекисного окисления липидов в эритроцитах периферической крови облученных крыс // Радиац. биология. Радиоэкология. 2015. Т. 55. № 5. С. 501–506. [Grebenjuk A.N., Tarumov R.A., Basharin V.A., Kovtun V.Ju. Jeksperimental’naja ocenka radiozashhitnoj jeffektivnosti sinteticheskogo genisteina po pokazateljam sistemy glutationa i perekisnogo okislenija lipidov v jeritrocitah perifericheskoj krovi obluchennyh krys // Radiac. biologija. Radioekologija. 2015. Т. 55. № 5. S. 501–506. (In Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


