Радиационная биология. Радиоэкология, 2019, T. 59, № 6, стр. 599-609
ОЦЕНКА РАДИОМОДИФИЦИРУЮЩЕГО ДЕЙСТВИЯ КРЕАТИНА НА ВЫЖИВАЕМОСТЬ, КРЕАТИН-КРЕАТИНКИНАЗНУЮ СИСТЕМУ ПЕЧЕНИ, ЯДЕРНО-ЯДРЫШКОВЫЙ АППАРАТ ГЕПАТОЦИТОВ И КЛЕТКИ ПЕРИФЕРИЧЕСКОЙ КРОВИ КРЫС
Л. С. Нерсесова 1, *, М. С. Петросян 1, Е. М. Каралова 1, А. С. Аветисян 1, Л. О. Аброян 1, Л. А. Акопян 1, З. А. Каралян 1, Ж. И. Акопян 1
1 Институт молекулярной биологии НАН РА
Ереван, Армения
* E-mail: l.nersesova@yahoo.com
Поступила в редакцию 27.03.2019
Аннотация
Kреатинкиназа (КК) с субстратами креатином (Кр) и креатинфосфатом (КФ) образует Кр–КФ–КК-ую систему, которая в энергетическом обмене клетки выполняет наряду с буферной и транспортной ролями и функцию поддержания стабильности митохондриальных мембран, что служит основой протекторного действия этой системы против окислительного стресса. В основе механизма действия рентгеновского облучения на клетку лежит окислительный стресс, и цель данной работы – оценить радиомодифицирующее действие Кр на выживаемость, активность КК и содержание Кр в печени, клетки периферической крови и ядерно-ядрышковый аппарат гепатоцитов при однократном общем облучении крыс в дозе 6.5 Гр. Раствор креатина в дозе 1 г/кг в 0.9%-ной глюкозе, используемый per os за 2 нед до и после облучения, оказывает значительное радиопротекторное действие, повышая выживаемость крыс на 38% и удлиняя среднюю продолжительность жизни на 32%, а также резко уменьшая выраженность постлучевых изменений ядерно-ядрышкового аппарата гепатоцитов и состава клеток крови и стимулируя адаптационный потенциал Кр-КК системы печени.
Kреатинкиназа (КК; НФ 2.7.3.2.) вместе со своими субстратами креатином (Кр) и креатинфосфатом (КФ) образует Кр–КФ–КК-ую систему, которая, как показали исследования последних лет [1–3], выполняет в энергетическом обмене клетки не только буферную и транспортную роли, но и ряд других функций, среди которых особое место занимает функция поддержания стабильности митохондриальных мембран. Как известно, митохондриальная КК продуцируемым в митохондриях АТФ может прямо трансфосфорилировать поступающий из цитоплазмы в митохондрии Кр в КФ, который затем транспортируется обратно в цитоплазму в качестве запасного макроэрга. Поддерживая таким образом необходимые уровни активности дыхательной цепи и окислительного фосфорилирования, Кр обладает антиоксидантными свойствами. Кроме того, митохондриальная КК оказывает протекторное действие на открытие митохондриальных временных проницаемых пор, а следовательно, влияет на процессы апоптоза и некроза [1]. Именно антиоксидантные и антиапоптические свойства Кр лежат в основе его протекторного действия при нейродегенеративных и миопатических заболеваниях, старении и действии стрессорных факторов, как, например, ультрафиолетовое излучение [4], в основе патогенеза которых находятся аналогичные молекулярные механизмы окислительного стресса [1–3, 5]. Основную часть необходимого Кр организм человека получает через пищу, а оставшаяся часть синтезируется в самом организме. Печень – основное место синтеза Кр, который затем через кровь транспортируется в Кр-содержащие ткани, клетки которых поглощают его с помощью специфического Кр-транспортера [5]. Ионизирующее излучение (ИИ) оказывает на клетки как прямое действие, вызывая разрывы химических связей в макромолекулах, в том числе и ферментных белках, так и опосредованное, обусловленное образованием свободных радикалов, которые агрессивно взаимодействуют с макромолекулами [6]. В результате этого имеют место изменения как в уровнях активности, так и в биосинтезе ферментов, что служит основанием для использования анализа активности ферментов для оценки влияния ионизирующего излучения и изучения эффективности различных радиопротекторов [7–10]. Ранее нами было исследовано влияние рентгеновского излучения на активность ряда ключевых ферментов клеточного метаболизма, в том числе и КК, в различных органах и сыворотке крови и на ядерно-ядрышковый аппарат гепатоцитов; наиболее радиочувствительным и адаптабельным ферментом оказалась КК [10]. Учитывая это, а также отмеченные выше антиапоптотические и антиоксидантные свойства Кр, целью данной работы было оценить протекторное действие Кр при однократном общем облучении крыс в дозе 6.5 Гр, равной ЛД70/30, на их выживаемость, популяционный состав клеток периферической крови и гепатоцитов, а также активность КК и содержание Кр в печени.
МАТЕРИАЛЫ И МЕТОДИКА
В двух сериях опытов использовано 60 и 72 белых беспородных крыс-самцов, соответственно, массой 180–210 г, которые содержались в стандартных условиях, в том числе на стандартном рационе питания. Общее однократное облучение крыс проводили в изолированном помещении на рентгеновской установке “РУМ-17” (напряжение 200 кВт, сила тока 20 мА, Cu-Al фильтр; кожно-фокусное расстояние 50 см, мощность дозы облучения 1.78 Гр/мин). В первой серии опытов животные были разделены на одну опытную и две контрольные группы по 15 особей в каждой. Учитывая данные литературы о повышении усвоения креатина, поступающего в организм per os, в присутствии сахаров [11], использовали раствор Кр в 0.9%-ной глюкозе: опытной группе за 2 нед до и через 2 нед после облучения давали per os креатин в 0.9%-ном растворе глюкозы в дозе 1 г/кг веса, а двум контрольным группам – 0.9%-ный раствор глюкозы и воду соответственно. Кроме того, в качестве исходного контроля была использована равноценная по числу крыс группа интактных животных. Пострадиационные эффекты исследовались в 1-е, 7-е, 15-е сутки после лучевого воздействия путем отбора на каждый срок из опытных и контрольных групп по 5 крыс. Во второй серии опытов, посвященной исследованию выживаемости крыс после облучения их в дозе ЛД70/30, равной 6.5 Гр, в присутствии и отсутствие креатина, животные были разделены на шесть групп, по 12 особей в каждой. Крысам первой и второй опытных групп per os в дозе 1 г/кг веса животного вводили креатин в 0.9%-ном растворе глюкозы и в воде соответственно; двум облучаемым контрольным группам – 0.9%-ный раствор глюкозы и воду соответственно. Кроме того, в качестве контроля были использованы две группы интактных животных, получавших раствор креатина в 0.9%-ной глюкозе и воду соответственно. Противолучевые свойства радиопротектора оценивали по выживаемости животных в течение 30 сут после облучения согласно статистическому методу Каплана–Майера программы SPSS 16 [12]. В экстрактах печени и сыворотке крови крыс, выживших в опытных группах через 30 дней после облучения, а также в указанных выше контрольных группах были определены уровни активности КК и содержание Кр. Декапитацию животных проводили на фоне эфирного наркоза. Сыворотку крови получали после ее свертывания путем центрифугирования в рефрижераторной центрифуге при 800 g в течение 20 мин. Печень отмывали от крови охлажденным физиологическим раствором и гомогенизировали в экстрагирующем буферном растворе с pH 7.2 (0.1 моль/л трис – HCl, 5 ммоль/л дитиотреитола и 1 ммоль/л этилендиаминтетраацетата). Экстракты, полученные после центрифугирования гомогенатов при 23 000 g в течение 30 мин, использовали для определения ферментной активности и Кр.
КК-ную активность определяли спектрофотометрически по накоплению продукта реакции креатина [13]. Ферментную активность выражали в мкмоль/г влажной ткани в мин для печени и мкмоль/л мин для сыворотки крови. Содержание креатина в мкг/г влажного веса печени и в мкг/мл сыворотки определяли спектрофотометрически согласно модифицированному методу Эннора и Розенберга [13]. Для наглядного изображения рассчитанные средние и их стандартные отклонения для уровней активности КК и содержания Кр на графиках выражены в % по отношению к контрольному уровню, которым служили соответствующие данные, полученные для интактных животных. Использованные реагенты: креатин моногидрат, креатинфосфат динатриевая соль (тетрагидрат), АДФ натриевая соль, 1-нафтол, диацетил, дитиотрейтол, ЭДТА фирмы “Sigma Aldrich” (Германия), а также 40%-ная глюкоза (ОАО Ереванская ХФФ). Одновременно с приготовлением экстрактов печени и сыворотки крови готовили мазки периферической крови и отпечатки печени. Препараты фиксировали в 96%-ном этиловом спирте в течение 30 мин. Для проведения популяционного анализа мазки клеток периферической крови окрашивали раствором Гимза по Романовскому [14]. От каждого животного исследовалось 50 полей зрения. Данные выражали в процентах. Для оценки ультраструктурных изменений в ядрах гепатоцитов препараты окрашивали реактивом Шиффа по Фельгену в течение 2 ч, предварительно проведя гидролиз клеток в 5Н HCL 60 мин при 220°С [15]. Определение количества ДНК в условно сравнимых единицах при длине волны 575 нм и цитоморфометрию ядер проводили телевизионным методом на сканирующем анализаторе изображений (увеличение 100 × 1.30), созданном на базе микроскопа-фотометра SMP 05 (“OPTON”, ФРГ), оснащенного компьютером. В связи с этим перед сканированием оконтуривали изображения ядер и каждого из ядрышек в тех клетках, где они выявлялись. Измерения в каждом случае производили в 100 ядрах. В качестве диплоидного эталона ДНК использовали лимфоциты периферической крови здоровых крыс. На основании данных по содержанию ДНК в гепатоцитах крыс, соотнесенных к эталону, выявляли распределение гепатоцитов по плоидности (в %) и определяли соотношение эу- и анэуплоидных клеток [15]. Цитоспектрофотометрия ядер гепатоцитов позволила выявить и определить их распределение по классам плоидности с отклонением от среднего значения до 10% для каждого класса. Значения исследованных параметров выражали в единицах плоидности (с). Для статистической обработки данных использован пакет SPSS (Statistical Package for Social Science) [16]. Характер распределения полученных данных определен методом Колмогорова–Смирнова. Сравнительный анализ проведен с использованием непараметрического теста Манна–Уитни. Различия считались значимыми при р < 0.05–0.01. Корреляционный анализ проведен с использованием непараметрического теста Спирмена.
РЕЗУЛЬТАТЫ
Как известно, биохимическим критерием радиационного повреждения ферментов является утрата присущей им активности. Окончательное проявление индуцированного радиацией поражения ферментных молекул in vivo может растягиваться на дни [6]. В связи с этим представляло интерес исследовать влияние рентгеновского излучения на динамику пострадиационных изменений уровней КК-активности и содержания Кр в печени и сыворотке крыс в присутствии и отсутствие природного адаптогена Кр.
Предварительные опыты по выживаемости крыс показали, что: 1) используемый нами препарат в дозах 0.2–2.0 г/кг крысы не токсичен; 2) наиболее эффективная доза креатиновой добавки составляет 1 г/кг веса крысы в 0.9%-ном растворе глюкозы; 3) наиболее эффективный способ введения – за 2 нед до и 2 нед после облучения. На рис. 1 представлены данные по динамике изменений активности КК (А) и содержания креатина (Б) в печени и сыворотке крови крыс после их однократного общего облучения в дозе 4.5 Гр и влиянию креатиновой биодобавки на эти изменения. Как следует из этих данных, в первые пострадиационные сутки в печени крыс только контрольной группы 2, получавших воду, имеет место статистически недостоверное повышение активности КК примерно на 50%, тогда как в опытной группе крыс, получавших Кр в растворе глюкозы, и в группе, получавшей 0.9%-ный раствор глюкозы, активность фермента сохраняется на контрольном уровне (А, а, 1 и 3). Развитие пострадиационных эффектов во времени приводит к постепенному повышению КК активности как в печени крыс контрольных групп, так и опытной группы – до двух и более раз на 15-е сутки. Как видно из представленных данных, в отличие от опытной группы 1, компенсаторное повышение активности КК в контрольных группах 2 и 3 в начальные пострадиационные сроки сменяется к 15-м суткам определенным снижением активности фермента, что, по-видимиму, связано с истощением нативных адаптационных свойств КК. Можно предположить, что резкое повышение активности КК в печени опытных крыс к этому сроку – в 2.5 раза – связано со сменой механизмов адаптации с краткосрочной, основанной на постсинтетической регуляции активности фермента, на долгосрочную, связанную с экспрессией КК, стимулированной, возможно, и Кр-добавкой.
Рис. 1.
Динамика изменений уровней активности КК (А) и содержания креатина (Б) в печени и сыворотке крови крыс после их однократного общего облучения в дозе 4.5 Гр в присутствии и отсутствие креатина. n = 5 для каждой группы животных: 1 – опытная, получавшая креатин в дозе 1 г/кг веса в 0.9%-ном растворе глюкозы; 2 и 3 – контрольные, получавшие соответственно воду и 0.9%-ный раствор глюкозы. Пострадиационные сроки: а – 1-е, б – 7-е, в – 15-е сутки. Пунктирная линия – контрольный уровень (интактные крысы), принятый за 100%. * Отличие от контроля достоверно при р < 0.05–0.01.
Fig. 1. Change dynamics in the creatine kinase activity levels (A) and concentration of creatine (Б) in the liver and blood serum of rats after their exposure to a one-time total radiation in a dose of 4.5 Gy, both in the presence and absence of creatine. n = 5 for the each animal group: 1 – experimental; received a creatine/0.9% glucose supplement in a dose 1g per kg of weight; 2 and 3 – control groups; received water and 0.9% glucose respectively. Post-radiation days: a – 1st, б – 7th, в –15th. Dotted line – control level (intact rats) assumed to be at 100 percent. * Statistical significance is p < 0.05–0.01.
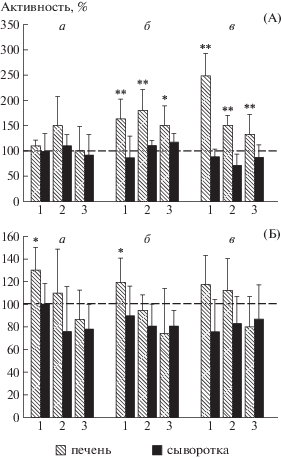
Одновременно с этим в контрольных группах во все сроки содержание креатина в печени достоверно не отличается от контрольного уровня, тогда как в опытной группе во все пострадиационные сроки определяется повышение содержания Кр на 15–25%, обусловленное, по-видимому, обогащением этой группы креатиновой добавкой (рис. 1, Б, 1). При этом корреляционный анализ выявил достоверную связь между указанным повышением содержания Кр в печени и стабильностью уровня активности печеночной КК в первые пострадиационные сутки (р = 0.028; r = 0.972). Наблюдаемые небольшие колебания в уровнях активности КК и в содержании Кр в сыворотке крови животных всех групп во все пострадиационные сроки статистически недостоверны (рис. 1, А и Б). Таким образом, приведенные данные свидельствуют о радиомодифицирующем действии Кр на Кр–КК систему, способствующем адаптации энергетического обмена гепатоцитов к воздействию ИИ.
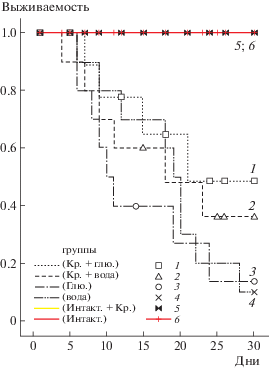
На рис. 2 представлены кривые выживаемости крыс в контрольных и опытных группах при применении креатина в дозе 1 г/кг веса за 2 нед до и через 2 нед после их однократного общего облучения в дозе ЛД70/30 = 6.5 Гр. Сравнительный анализ этих данных показывает, что гибель животных в опытной группе 1, получавших Кр в растворе глюкозы, начинается с 7-го дня после облучения, тогда как в контрольных группах 3 и 4 это имеет место на 2 дня раньше, что свидетельствует о большей резистентности первых к воздействию ИИ; более того, в контрольных группах гибель животных продолжается до 25–28-го дня, тогда как в опытной группе 1 гибель их прекращается уже на 21-й день после облучения, и это при том, что уже с 16-го дня после облучения физическое состояние крыс в этой группе в целом значительно лучше, чем в контрольных. И, наконец, смертность животных в контрольной группе 4, где из 12 крыс выжили только три, значительно превышает смертность крыс в опытной группе 1, в которой из 12 животных выжили восемь. Несколько менее выраженный противолучевой эффект обнаруживается в опытной группе 2, получавшей водный раствор Кр: гибель крыс в данном случае начинается с 6-го дня и заканчивается на 23-й день; из 12 крыс выжило шесть в противовес соответствующей контрольной группе 4, в которой, как было указано выше, из 12 крыс выжили только три. При этом средняя продолжительность жизни павших крыс в группе Кр + 0.9%-ная глюкоза – 21,7 дней, в группе Кр+вода – 18.8 дней, в контрольной группе, получавшей 0.9%-ную глюкозу – 14.7, и в группе, получавшей воду, – 15.4 дней. В группе интактных крыс падежа не было. Радиозащитный эффект Кр, рассчитанный с использованием статистической модели выживаемости Каплана–Мейера, составил для группы 1 по отношению к контрольной группе 4 – 38.6%, а по отношению к контрольной группе 3 – 30.3%. Как и следовало ожидать, учитывая сравнительно худшую усвояемость организмом Кр из водного раствора [11], противолучевая эффективность Кр для опытной группы 2 несколько меньше: в сравнении с соответствующей ей контрольной группой 4 радиозащитный эффект для нее составляет 20.5%. Таким образом, данная серия опытов однозначно свидетельствует о противолучевой эффективности Кр, оказавшегося способным повышать резистентность и адаптабельность организма к ИИ.
Рис. 2.
Кривые выживаемости крыс на 30-е сутки после их однократного общего облучения в дозе 6.5 Гр при применении креатина в дозе1 г/кг веса. Опытные группы 1 и 2 – Кр + 0.9%-ная глюкоза и Кр + вода соответственно; контрольные группы 3 и 4 – 0.9%-ная глюкоза и вода соответственно; 5 группа – интактные крысы, получавшие Кр + 0.9%-ная глюкоза; 6 группа – инактные крысы. n = 12 в каждой группе.
Fig. 2. Graphs for rat survival receiving a creatine supplement in a dose of 1g per kg of weight on the 30th day of exposure to a one-time total radiation in a dose of 6.5 Gy. Experimental groups 1 and 2 – Cr/0.9% glucose and Cr/water respectively; control groups 3 and 4 – 0.9% glucose and water respectively; group 5 – intact rats receiving a Cr/0.9% glucose; group 6 – intact rats. n = 12 for the each group.
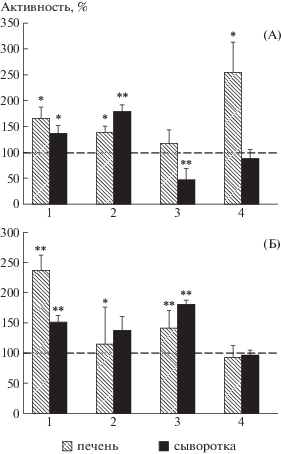
Для оценки адаптационных свойств печеночной Кр–КК системы крыс, выживших через 30 дней после облучения как в опытных, так и в контрольных группах, были определены изменения в уровнях активности КК и содержания Кр в печени и сыворотке крови их. Как следует из рис. 3, в опытных группах 1 и 2, животные которых получали Кр в растворе глюкозы и воды соответственно, как в печени, так и сыворотке крови активность КК и содержание креатина на 30-й день после облучения остаются все еще повышенными (для сравнения рис. 1, в, 15-е пострадиационные сутки). При этом для животных группы 2, получавших водный раствор Кр, это повышение менее выражено. Особый интерес представляют данные относительно контрольных облученных крыс (группа 3), получавших вместо раствора Кр воду, в которой через 30 дней после облучения из 12 животных выжило три крысы. У этих выживших животных определяется достоверно повышенный уровень активности печеночной КК (на 20% по сравнению с интактными крысами) и повышенный уровень содержания Кр как в печени, так и в сыворотке крови. Можно предположить, что в данном случае благодаря нативным адаптационным свойствам Кр-КК системы имели место индуцированные радиационным стрессом эндогенный синтез Кр и экспрессия гена КК, что повысило резистентность выживших крыс к облучению. Что касается падения активности КК в сыворотке крови животных этой группы и повышения содержания Кр в ней (рис. 3, А, Б, 3), между которыми выявилась значимая отрицательная корреляция (r = –0.865, p = 0.05), то это может быть связано с пострадиационными изменениями популяционного состава клеток периферической крови (см. далее). Данные, полученные относительно контрольной группы 4, интактные животные которой получали водный раствор Кр, показывают, что сама по себе длительная креатиновая добавка, по-видимому, стимулирует экспрессию КК в печени интактных крыс, вызывая более чем двукратное повышение ее активности, соизмеримое с таковым в печени облученных крыс, получавших Кр в растворе глюкозы, на 15-е пострадиационные сутки (см. рис. 1, в).
Рис. 3.
Активность КК (А) и содержания креатина (Б) в печени и сыворотке крыс на 30-е сутки после однократного общего облучения их в дозе 6.5 Гр в присутствии и отсутствие креатина. n = 5 для каждой группы крыс, за исключением группы 3: 1 – опытная, получавшая креатин в дозе 1 г/кг веса в растворе глюкозы; 2 – опытная, получавшая водный раствор креатина в дозе 1 г/кг веса; 3 – контрольная облученная группа (n = 3), получавшая воду; 4 – интактная группа животных, получавшая креатин, растворенный в воде. Пунктирная линия – контрольный уровень (интактные крысы), принятый за 100%. *Отличие от контроля достоверно при р < 0.05–0.01.
Fig. 3. Creatine kinase activity levels (A) and concentration of creatine (B) in the liver and blood serum of rats on the 30th day after their exposure to a one-time total radiation in a dose of 6.5 Gy, both in the presence and absence of creatine. n = 5 for the each animal group, with the exception of group 3: 1 – experimental; received creatine/0.9% glucose supplement in a dose 1g per kg of weight; 2 – experimental; received creatine supplement dissolved in water in a dose 1g per kg of weight; 3 – control irradiated group (n = 3), received water; 4 – intact group of animals that received creatine dissolved in water. Dotted line – control level (intact rats) assumed to be at 100 percent. * Statistical significance is p < 0.05–0.01.
Анализ периферической крови, в частности, определение количества лейкоцитов и лейкоцитарной формулы с обращением особого внимания на число лимфоцитов, представляет наиболее объективный признак начала развития острой лучевой болезни. Сначала обнаруживается лейкопения, затем тромбопения и, наконец, эритропения, появляются ранние формы клеток крови, а также патологические и разрушенные клетки. Темп развития этих объективных признаков лучевой болезни зависит от дозы облучения и реактивности организма [17, 18].
Данные об изменении популяционного состава клеток периферической крови крыс, представленные в табл. 1, свидетельствуют о развитии у крыс облученных групп классической формы острой лучевой болезни. Если в контрольной группе интактных крыс полностью отсутствуют ранние формы клеток крови, то в облученных группах появляются монобласты, лимфобласты, метамиелоциты, базофильные и полихроматофильные эритробласты, которые в суммарном количестве у облученного контроля составляют примерно 15%, а содержание ретикулоцитов достигает более половины популяции клеток периферической крови, доходя до 60%. При этом в этой же группе резко, более чем в 4 раза, уменьшается число лимфоцитов, что, как было указано выше, является первым и наиболее объективным признаком лучевой болезни, а количество нейтрофилов увеличивается в среднем в 1.4 раза по отношению к интактному контролю (табл. 1). Сравнительный анализ популяционного состава клеток крови крыс облученного контроля и опытных групп, получавших Кр, показывает, что под действием последнего степень выраженности патологических изменений состава крови значительно уменьшается, хотя в некоторых случаях значимые различия между интактным контролем и опытными группами остаются. Так, у крыс, получавших Кр-добавку в водном растворе и в растворе 0.9%-ной глюкозы, содержание лимфоцитов в крови выше более чем в 1.5 и почти в 3 раза по сравнению с облученным контролем соответственно, что демонстрирует очевидный радиопротекторный эффект Кр. Такой же эффект наблюдается и относительно других видов клеток: количество моноцитов в опытных группах существенно выше по сравнению с облученным контролем, приближаясь к содержанию в крови интактных крыс контроля, что особенно показательно в случае опытной группы облучение + + раствор Кр в глюкозе; уменьшается количество ядерных форм эритробластов, например, в последней опытной группе почти в 7 раз. В результате облучения и гибели значительного количества лимфоцитов соотношение лимфоцитов и нейтрофилов меняется, в результате чего доля нейтрофилов увеличивается в среднем на 25%, а при применении Кр и, в частности, Кр в глюкозе, эти различия сглаживаются, особенно, за счет увеличения количества палочкоядерных нейтрофилов. В опытных группах появляются в незначительном количестве эозинофилы (до 1%) и уменьшается количество патологических и мертвых клеток.
Таблица 1.
Радиомодифицирующее действие креатина на популяционный состав клеток периферичской крови крыс на 30-е сутки после общего однократного рентгеновского облучения в дозе 6.5 Гр Table 1. Radiomodifying effect of creatine on peripheral blood cells of rats on the 30th day after their exposure to a one-time total X-ray radiation in a dose of 6.5 Gy
| Виды клеток | Нативный контроль | Облученный контроль | Облучение + водный раствор Кр | Облучение + + раствор Кр в 0.9%-ной глюкозе |
|---|---|---|---|---|
| Монобласты | 0 | 1.0 ± 0.5×× | 0.8 ± 0.2* | 0.4 ± 0.3** |
| Моноциты | 7.7 ± 0.5 | 0.9 ± 0.4×× | 2.1 ± 0.1** | 10.5 ± 0.5** |
| Лимфобласты | 0 | 0.6 ± 0.1×× | 0.4 ± 0.3 | 0.6 ± 0.5 |
| Лимфоциты | 62.3 ± 2.4 | 14.4 ± 0.7×× | 25.1 ± 0.7** | 41.1+0.8** |
| Метамиэлоциты | 0 | 2.1 ± 0.1×× | 1.2 ± 0.1** | 1.0 ± 0.2** |
| Палочкоядерные нейтрофилы | 5.2 ± 0.9 | 6.9 ± 1.6× | 1.8 ± 0.2** | 8.0 ± 0.7* |
| Сегментоядерные нейтрофилы | 8.5 ± 2.0 | 11.4 ± 0.7× | 2.5 ± 0.1** | 0.6+0.2** |
| Базофильные эритробласты | 0 | 3.4 ± 0.6×× | 1.4 ± 1.2** | 0.6 ± 0.1** |
| Полихроматофильные эритробласты | 1.1 ± 0.4 | 8.0 ± 0.2×× | 4.0 ± 1.4** | 1.5 ± 0.4** |
| Ретикулоциты | 15.2 ± 1.0 | 60.1 ± 5.1×× | 47.7 ± 2.1** | 28.3 ± 2.7** |
| Эозинофилы | 0 | 0 | 1.1 ± 0.3** | 5.0 ± 2.2** |
| Патологические нейтрофилы | 0 | 1.9 ± 0.1×× | 0.7 ± 0.6** | 1.1 ± 0.2** |
| Разрушенные клетки | 0 | 0.7 ± 0.5×× | 0.4 ± 0.3** | 0.6 ± 0.5* |
Анализ изменений в содержании ДНК в ядрах гепатоцитов в норме, после облучения и при действии Кр, не выявил достоверных различий как в среднем содержании ДНК в ядрах и ядрышках гепатоцитов и в их размерах (табл. 2), так и в среднем содержании ядрышек на ядро, а также в распределении ядер гепатоцитов по числу ядрышек в них (табл. 3). Однако при этом было обнаружено значительное падение числа эуплоидных клеток в контрольной группе облученных крыс относительно нативного контроля и протекторное действие Кр в опытных группах на этот параметр при сравнении их с облученным контролем (табл. 2), в связи с чем нами был проведен анализ распределения ядер гепатоцитов по классам плоидности. Применение метода количественной цитохимии позволило получить гистограммы распределения ядер гепатоцитов, окрашенных по Фельгену, по плоидности, дискретные пики которых соответствуют определенным классам плоидности (рис. 4). Полученные в контроле результаты соответствуют литературным данным [10, 18, 19], согласно которым подавляющее число клеток (87%) составляют эуплоидные гепатоциты. Из них, как следует из полученных данных, около 45% популяции приходится на диплоидные гепатоциты, 38% составляют тетраплоидные клетки, 4% популяции – октаплоидные ядра, 6% приходится на гипертетраплоидные и 7% на триплоидные гепатоциты. Наличие синтезирующих ДНК клеток с “промежуточными” между 2с и 4с и 4с и 8с значениями, число которых достаточно низкое (около 13%), скорее всего обусловлено прохождением клетками S-фазы клеточного цикла или задержкой во второй ее половине. Как видно из гистограмм распределения гепатоцитов по классам плоидности (рис. 4), в группе контрольных облученных крыс появляются в большом количестве гиподиплоидные клетки, что свидетельствует о гибели клеток, причем, в основном, за счет гибели эуплоидных гепатоцитов. Водный раствор Кр в значительной степени предотвращает гибель гепатоцитов, о чем свидетельствуют резкое уменьшение (более чем в 3 раза) числа гиподиплоидных клеток по сравнению с облученным контролем и возрастание количества эуплоидных гепатоцитов почти до уровня нативного контроля, в основном за счет резкого увеличения числа тетраплоидных клеток. Раствор Кр в 0.9%-ной глюкозе оказывает более выраженное протекторное действие: полностью отсутствуют гиподиплоидные гепатоциты, а картина распределения ядер по плоидности почти полностью повторяет данные нативного контроля.
Таблица 2.
Радиомодифицирующее действие креатина на среднее содержание ДНК и площадь ядер и ядрышек гепатоцитов крыс на 30-е сутки после общего однократного рентгеновского облучения в дозе 6.5 Гр (усл. ед.) Table 2. Radiomodifying effect of creatine on the average DNA content and the area of the nuclei and nucleoli of rat hepatocytes on the 30th day after their exposure to a one-time total X-ray radiation in a dose of 6.5 Gy (conventional units)
| Группы | Ядро | Ядрышко | % эуплоидных клеток | ||
|---|---|---|---|---|---|
| ДНК | площадь | ДНК | площадь | ||
| Нативный контроль | 98.1 ± 4.1 | 48.3 ± 1.9 | 4.3 ± 0.3 | 2.8 ± 0.2 | 87 |
| Облученный контроль | 110.6 ± 4.2 | 46.2 ± 1.8 | 3.8 ± 0.35 | 2.0 ± 0.17 | 59* |
| Облучение + водный р-ор Кр | 110.7 ± 3.9 | 49.5 ± 1.7 | 4.0 ± 0.32 | 2.3 ± 0.17 | 74× |
| Облучение + р-ор Кр в 0.9%-ной глюкозе | 113.3 ± 3.8 | 51.2 ± 1.9 | 3.7 ± 2.6 | 2.1 ± 1.4 | 78× |
Таблица 3.
Радиомодифицирующее действие креатина на распределение ядер по числу ядрышек гепатоцитов крыс на 30-е сутки после общего однократного рентгеновского облучения в дозе 6.5 Гр (%) Table 3. Radiomodifying effect of creatine on the distribution of nuclei according to the number of nucleoli of rat hepatocytes on the 30th day after their exposure to a one-time total X-ray radiation in a dose of 6.5 Gy (%)
| Группы | 0 ядрышек | 1 ядрышко | 2 ядрышка | Среднее количество ядрышек на ядро |
|---|---|---|---|---|
| Нативный контроль | 19 | 73 | 8 | 0.9 ± 0.05 |
| Облученный контроль | 25 | 67 | 8 | 0.83 ± 0.06 |
| Облучение + водный раствор Кр | 25 | 68 | 7 | 0.82 ± 0.05 |
| Облучение + раствор Кр в 0.9%-ной глюкозе | 22 | 70 | 8 | 0.85 ± 0.05 |
Рис. 4.
Радиомодифицирующее действие креатина на распределение ядер по плоидности в гепатоцитах крыс на 30-е сутки после общего однократного рентгеновского облучения в дозе 6.5 Гр: 1 – нативный контроль; 2 – облученный контроль; 3 – облучение + водный раствор Кр; 4 – облучение + раствор Кр в 0.9%-ной глюкозе.
Fig. 4. Radiomodifying effect of creatine on the distribution of nuclei by ploidy in rat hepatocytes on the 30th day after their exposure to a one-time total X-ray radiation in a dose of 6.5 Gy: 1 – native control; 2 – irradiated control; 3 – irradiation + Cr/water; 4 – irradiation + creatine/0.9% glucose.

ОБСУЖДЕНИЕ
В то время как факт синтеза Кр в печени не вызывает сомнений, о содержании КК и КФ в этом органе имеются противоречивые данные. Большинство исследований свидетельствует о присутствии в печени млекопитающих и особенно человека незначительных количеств КК и КФ [19–22]. С другой стороны, в ряде исследований обнаружены необычно высокие уровни активности КК в печеночной ткани [23–25]. И, наконец, в сыворотке крови пациентов с тяжелыми заболеваниями печени часто обнаруживаются высокие уровни КК-активности, источником которой идентифицируется патологическая печеночная ткань [26–30]. Причиной указанных противоречий многие авторы считают компенсаторное повышение экспрессии КК в патологической печеночной ткани. В поддержку этой гипотезы приводятся следующие факты: в частично гепатоэктомизированной печени крыс обнаруживается повышение активности КК; сверхэкспрессия изоферментов КК для стабилизации энергетического обмена регистрируется в печени трансгенных мышей, подвергнутых кислород-дефицитному или метаболическому стрессу, а также в случаях ускорения регенерации печени после обширной гепатоэктомии, а также повышения толерантности к эндотоксину [21–26].
Известно, что биохимическим критерием лучевого повреждения ферментов является утрата присущей им активности, что служит основанием для использования анализа активности ферментов для оценки влияния ионизирующего излучения и изучения эффективности различных радиопротекторов [6, 8, 10]. Резистентность организмов к воздействию экстремальных факторов, в основе которых окислительный стресс, определяется в значительной степени эффективностью регуляторных механизмов поддержания энергетики клетки [1–3]. КК как ключевой фермент энергетического метаболизма клетки проявляет высокую чувствительность к окислительному стрессу как на посттранскрипционном, так и на генном уровнях [7, 27, 28]. Она вовлечена в немедленную ответную реакцию клетки на воздействие стресса, приводящего ее к энергетическому истощению. В связи с этим уровень активности этого фермента, а также уровни отношений КФ/АТФ и КФ/Кр принято рассматривать как показатели энергетического статуса клетки [1–3]. Как было отмечено выше, основанием для интереса к исследованию противолучевой активности Кр послужило обнаружение его протекторной роли при нейродегенеративных заболеваниях, старении и действии стрессорных факторов, как, например, ультрафиолетовое излучение [4], в основе патогенеза которых лежат аналогичные молекулярные механизмы окислительного стресса [1–3, 5]. На основании многочисленных исследований обсуждаются следующие, не исключающие друг друга, механизмы протекторного действия Кр: 1) механизм поддержания энергетического гомеостаза; 2) механизм поддержания Са2+ гомеостаза; 3) механизм его антиапоптотического действия, который обусловлен совместным участием Кр и митохондриальной КК в процессе ингибирования открытия митохондриальных проницаемых пор, являющегося ранним триггером апоптоза; 4) механизм антиоксидантного действия [1–3, 5]. Таким образом, можно утверждать, что Кр–КФ–КК система улучшает сопротивляемость клеток стрессу, делая их менее восприимчивыми к повреждению. Перечисленные факты и полученные нами данные позволят обсудить влияние ИИ на Кр–КК систему и противолучевые свойства природного адаптогена Кр.
При облучении крыс в поглощенной дозе 6.5–7.0 Гр у животных поражается главным образом кроветворная ткань и развивается костномозговая форма острой лучевой болезни средней степени тяжести, выздоровление после которой затягивается на 4–6 мес. и более. Разгар болезни начинается с 5–10-го дня, длится 2–3 нед и характеризуется угнетением кроветворения, а именно резко выраженным блокированием митозов, нарушением созревания и трансформации клеток, а также повышенным распадом их [17, 18]. Динамика отмеченных выше компенсаторных изменений Кр–КК системы в присутствии и отсутствие Кр как биологической добавки, направленной на поддержание энергетического обмена клеток, в значительной мере совпадает как с указанными сроками развития заболевания, так и с исследованной нами динамикой выживаемости и изменений популяционного состава клеток периферической крови и гепатоцитов крыс, обогащенных Кр. Это свидетельствует о значительных радиопротекторных свойствах последнего. Как показал сравнительный анализ данных, полученных с использованием модели выживаемости крыс после облучения их в дозе ЛД70/30 = 6.5 Гр (рис. 2), гибель животных в опытных группах, получавших Кр, начинается на 2 дня позже и заканчивается на 5–7 дней раньше, чем в контрольных группах, не получавших Кр, что свидетельствует о значительном повышении радиорезистентности крыс, обогащенных Кр. При этом уже с 13-го пост-радиационного дня смертность животных в этих группах резко падает, что совпадает со стабилизацией компенсаторно повышенных уровней активности КК и содержания Кр в печени к 15-му пострадиационному дню в первой серии экспериментов (рис. 1). Количественно менее выраженные компенсаторно повышенные уровни активности КК и содержания Кр в печени и сыворотке крови сохраняются и на 30-е пострадиационные сутки (рис. 3), что хорошо согласуется со сроками окончания разгара заболевания и началом выздоровления и свидетельствует о вовлечении механизмов долговременной адаптации, основанной на сверхэкспрессии КК. Здесь следует отметить данные, свидетельствующие и о нативных адаптационных свойствах Кр–КК системы. Оказалось, что у получавших вместо раствора Кр воду контрольных крыс, выживших через 30 дней после облучения (рис. 3), с высокой степенью достоверности определяется повышенный, по сравнению с интактными крысами, уровень активности печеночной КК (примерно на 20%) и уровень содержания Кр в печени (почти на 40%), что свидетельствует об активации облучением, с одной стороны, эндогенного синтеза Кр и, с другой стороны, экспрессии КК в условиях стресса, как описано это рядом авторов [21, 22, 25, 26]. Данные, полученные относительно контрольной группы интактных животных, получавших водный раствор Кр, показывают, что и в отсутствие сахаров в печени имеет место значительное накопление Кр (почти в 2.5 раза выше контрольного уровня), которое, с другой стороны, может быть обусловлено и активацией эндогенного синтеза Кр.
Что касается радиозащитного эффекта Кр, рассчитанного с использованием статистической модели выживаемости Каплана–Мейера, то он составил для группы, получавшей раствор Кр в 0.9%-ной глюкозе, по отношению к контрольной группе, получавшей вместо Кр воду – 38.6%, а по отношению к контрольной группе, получавшей 0.9%-ный раствор глюкозы – 30.3%. Как и следовало ожидать, учитывая его сравнительно худшую усвояемость клеткой, радиозащитный эффект водного раствора Кр оказался несколько меньшим – 20.5% в сравнении с соответствующей ей контрольной группой. Средняя продолжительность жизни крыс, получавших Кр + глюкоза, составила 21.7 дней, что значительно выше этой величины в 14.7 дней для соответствующей им контрольной группы, получавшей раствор глюкозы. Для крыс, получавших водный раствор Кр, этот параметр меньше и составляет 18.8 дней против соответствующего им контроля, получавших воду – 15.4 дней. Таким образом, приведенные данные однозначно свидетельствует о противолучевой эффективности Кр, оказавшегося способным повышать резистентность и адаптабельность организма к ионизирующему облучению. Радиозащитный эффект Кр подтверждается и данными, полученными относительно действия Кр на пострадиационные изменения популяционного состава клеток периферической крови и гепатоцитов. На 30-е сутки после облучения в облученном контроле сохраняется картина крови, характерная для острой лучевой болезни средней тяжести: резкое, более чем в 4 раза уменьшение содержания лимфоцитов как наиболее объективного признака лучевой болезни; присутствие ранних форм клеток, которые в суммарном выражении в крови контрольных облученных крыс составляют 15% популяции, а количество ретикулоцитов достигает 60% против 15% в нативном контроле; присутствие патологических и разрушенных клеток, которые полностью отсутствуют в нативном контроле (табл. 1). Сравнительный анализ популяционного состава клеток крови крыс облученного контроля и опытных групп, получавших Кр, показывает, что под действием последнего степень выраженности перечисленных патологических изменений состава крови значительно уменьшается, особенно в случае использования Кр в 0.9%-ной глюкозе, когда картина крови почти полностью приближается к исходной. Появление эозинофилов в опытных группах с Кр-добавкой, скорее всего, связано с их основной функцией по уничтожению чужеродных белков, которые возникают в результате распада патологических клеток. Цитоспектрофотометрия ядер гепатоцитов позволила выявить и определить их распределение по классам плоидности с 10%-ным отклонением каждого класса. Как видно из гистограмм распределения гепатоцитов по классам плоидности (рис. 4), в группе контрольных облученных крыс появляются в большом количестве гиподиплоидные клетки, что свидетельствует о гибели клеток, причем, в основном, за счет гибели эуплоидных гепатоцитов. Водный раствор Кр значительно предотвращает гибель гепатоцитов, о чем свидетельствует резкое уменьшение (более чем в 3 раза) числа гиподиплоидных клеток по сравнению с облученным контролем и возрастание количества эуплоидных гепатоцитов почти до уровня нативного контроля, в основном за счет резкого увеличения числа тетраплоидных клеток. Раствор Кр в 0.9%-ной глюкозе оказывает более выраженное протекторное действие: полностью отсутствуют гиподиплоидные гепатоциты, а картина распределения ядер по плоидности почти полностью повторяет данные нативного контроля. Таким образом, очевидно, что Кр-добавка, как и в случае клеток периферической крови, повышает резистентность гепатоцитов к воздействию рентгеновского излучения.
ВЫВОДЫ
1. Кр–КК система печени обладает нативными адаптационными свойствами к повреждающему действию рентгеновского излучения, которые значительно стимулируются Кр-добавкой.
2. Кр-добавка оказывает радиопротекторное действие по критериям выживаемости и средней продолжительности жизни крыс, а также существенно снижает патологические пострадиационные изменения популяционного состава их клеток крови и гепатоцитов в ходе острой лучевой болезни после общего однократного рентгеновского облучения в дозе 6.5 Гр.
3. Радиопротекторная эффективность раствора Кр в 0.9%-ной глюкозе значительно выше его водного раствора.
Список литературы
Wallimann T., Tokarska-Schlattner M., Schlattner U. The creatine kinase system and pleiotropic effects of creatine // Amino Acids. 2011. V. 40. P. 1271–1296.
Schlattner U., Tokarska-Schlattner M., Wallimann T. Mitochondrial creatine kinase in human health and disease // Biochim. Biophys. Acta. 2006. V. 1762. № 2. P. 164–180.
Nersesova L.S. Role of Creatine Kinase and Its Substrates in the Central Nervous System in Norm and in Various Pathologies // J. Evolut. Biochem. Physiol. 2011. V. 47. № 2. P. 140–150.
Lenz H., Schmidt M., Welge V. et al. The creatine kinase system in human skin: protective effects of creatine against oxidative and UV damage in vitro and in vivo // J. Invest. Dermatol. 2005. V. 124. № 2. P. 443–452.
Wyss M., Braissant O., Pischel I. et al. Creatine and creatine kinase in health and disease–a bright future ahead? // Subcell. Biochem. 2007. V. 46. № 17. P. 351.
Куценко С.А. Военная токсикология, радиобиология и медицинская защита. М: Фолиант, 2004. С. 108. [Kutsenko S.A. Voyennaya toksikologiya, radiobiologiya i meditsinskaya zashchita. [Military toxicology, radiobiology and medical protection M: Foliant, 2004. P. 108. (In Russian)]
Catravas G.N., McHale C.G. Changed activities of brain enzymes involved in neurotransmitter metabolism in rats exposed to different qualities of ionizing radiation // J. Neurochem. 1975. V. 24. № 4. P. 673–667.
Бурлаковa Е.Б., Конрадов А.А., Мальцевa Е.Л. Действие сверхмалых доз биологически активных веществ и низкоинтенсивных физических факторов // Хим. физика. 2003. Т. 22. № 2. С. 21–40. [Burlakova E.B., Konradov A.A., Mal’tseva E.L. Deystviye sverkhmalykh doz biologicheski aktivnykh veshchestv i nizkointensivnykh fizicheskikh faktorov. [The effect of ultra low doses of biologically active substances and low rate physical factors] // Khim. fizika – Chemical physics. 2003. V. 22. № 2. P. 21–40. (In Russian)]
Somayaji Y., Vidya V., Vishakh R. et al. Radioprotective effects of diallyl disulphide and Carica papaya (L.) leaf extract in electron beam radiation induced hematopoietic suppression // Cogent Biology. 2016. V. 2. № 1. P. 1–14.
Нерсесова Л.C., Газарянц М.Г., Мкртчян З.C. и др. Влияние ионизирующей радиации на ферментные активности и состояние ядерно-ядрышкового аппарата гепатоцитов крыс // Радиац. биология. Радиоэкология. 2013. Т. 53. № 1. С. 55–62. [Nersesova L.C., Gazaryants M.G., Mkrt·shyan Z.C. et al. Vliyaniye ioniziruyushchey radiatsii na fermentnyye aktivnosti i sostoyaniye yaderno-yadryshkovogo apparata gepatotsitov krys. [Influence of Ionizing Radiation on Enzymatic Activity and State of Nucleus – Nucleolar Apparatus in Rat Hepatocytes]. Radiats. biologiya. Radioekologiya – Radiation Biology. Radioecology. 2013. V. 53. № 1. P. 55–62. (In Russiian)]
Costallat B.L., Miglioli L., Silva Ph. A.C. et al. Insulin resistance with creatine supplementation in laboratory animals // Rev. Bras. Med. Esporte. 2007. V. 13. № 1. P. 18–20.
Goel M.K., Khanna P., Kishore J. Understanding survival analysis: Kaplan–Meier estimate // Int. J. Ayurveda Res. 2010. V. 1. № 4. P. 274–278.
Петрова Т.А., Лызлова С.Н. Оптимизация условий определения активности креатинкиназы колориметрическим методом // Вестн. ЛГУ. 1985. № 24. С. 88–90. [Petrova T.A., Lyzlova S.N. Optimizatsiya usloviy opredeleniya aktivnosti kreatinkinazy kolorimetricheskim metodom [Optimization of conditions for determining the activity of creatine kinase by the colorimetric method] // Vestn. LGU. 1985. № 24. С. 88–90. (In Russsian)]
Ромейс Б. Микроскопическая техника. М: Иностр. лит-ра, 1953. 719 с. [Romeys B. Mikroskopicheskaya tekhnika. [Microscopic technique]. M.: Inostrannaya literaturа, 1953. 719 p. (In Russian)]
Магакян Ю.А., Каралова Е.М. Цитофотометрия ДНК. Ереван, 1989. С. 204. [Magakyan Yu.A., Karalova E.M. TSitofotometriya DNK. [Cytomorphometry of DNA]. Yerevan: 1989. P. 204. (In Russsian)]
Field A. Discovering statistics using IBM SPSS statistics. Los Angeles: SAGE Publications Ltd., 2013. 2617 p.
Киршин А., Бударков В.А. Ветеринарная противорадиационная защита. М.: Агропромиздат, 1990. 207 с. [Kirshin V.A., Budarkov V.A. Veterinarnaya protivoradiatsionnaya zashchita. [Veterinary anti radiation protection]. M.: Agropromizdat, 1990. 207 p. (In Russian)]
Шевцов В.И., Ирьянов Ю.М., Петровская Н.В. и др. Методика моделирования острой лучевой болезни у крыс линии Август // Совр. наукоемкие технологии. 2004. № 1. С. 95. [Shevtsov V.I., Ir’yanov Yu.M., Petrovskaya N.V., Ir’yanova T.Yu., Migalkin N.S., Ocheretina R.Yu. Metodika modelirovaniya ostroy luchevoy bolezni u krys linii Avgust. [Methods of mode-ling acute radiation sickness in August rats]. Sovremennyye naukoyemkiye tekhnologii – Modern high technologies. 2004. № 1. P. 95. (In Russian)]
Cohen S.M. Simultaneous 13C and 31P NMR studies of perfused rat liver // J. Biol. Chem. 1983. V. 258. № 23. P. 14294–14308.
Koretsky A.P., Brosnan M.J., Chen L. et al. NMR detection of creatine kinase expressed in liver of transgenic mice: determination of free ADP levels // Proc. Natl. Acad.Sci. USA. 1990. V. 87. № 8. P. 3112–3116.
Hatano E., Tanaka A., Iwata S. et al. Induction of endotoxin tolerance in transgenic mouse liver expressing creatine kinase // Hepatology. 1996. V. 24. № 3. P. 663–669.
Auricchio A., Zhou R., Wilson J.M. et al. In vivo detection of gene expression in liver by 31P nuclear magnetic resonance spectroscopy employing creatine kinase as a marker gene // Proc. Natl. Acad. Sci. USA. 2001. V. 98. № 9. P. 5205–5210.
Shatton J.B., Morris H.P., Weinhouse S. et al. Creatine kinase activity and isozyme composition in normal tissues and neoplasms of rats and mice // Cancer Res. 1979. V. 39. P. 492–501.
Goullé J.P., Mechard D., Laine G. et al. Répartition isozymique de la créatine kinase dans différents organes humains. Intérêt en pathologie humaine // Ann. Biol. Clin. 1979. V. 37. № 5. P. 303–307.
Malnick S.D., Bass D.D., Kaye A.M. et al. Creatine kinase BB: a response marker in liver and other organs // Hepatology. 1994. V. 19. № 1. P. 261.
Satoh S., Tanaka A., Hatano E. et al. Energy metabolism and regeneration in transgenic mouse liver expressing creatine kinase after major hepatectomy // Gastroenterology. 1996. V. 110. № 4. P. 1166–1174.
Malone J., Ullrich R. Novel radiation response genes identified in gene trapped MCF 10A mammary epithelial cells // Radiat. Res. 2007. V. 167. № 2. P. 176–184.
Aksenov M., Aksenova M., Butterfield D.A. et al. Oxidative modification of creatine kinase BB in Alzheimer’s disease brain // J. Neurochem. 2000. V. 74. № 6. P. 2520–2527.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


