Радиационная биология. Радиоэкология, 2019, T. 59, № 6, стр. 585-591
ОЦЕНКА ЭФФЕКТИВНОСТИ ПРОТИВОЛУЧЕВЫХ ПРЕПАРАТОВ ПО ФОСФОРИЛИРОВАНИЮ ГИСТОНА H2AX И МИКРОЯДЕРНОМУ ТЕСТУ
М. А. Игнатов 1, *, Т. М. Блохина 1, 2, Л. П. Сычева 1, Н. Ю. Воробьева 1, 2, А. Н. Осипов 1, 2, Л. М. Рождественский 1
1 Федеральный медицинский биофизический центр им. А.И. Бурназяна ФМБА России
Москва, Россия
2 Институт химической физики им. Н.Н. Семенова РАН
Москва, Россия
* E-mail: mantroz@yandex.ru
Поступила в редакцию 07.05.2018
Аннотация
В опытах на мышах-самках F1(CBA×C57Bl) сопоставлены показатели повреждения ДНК (γH2AX-позитивные клетки и микроядерный тест) после воздействия рентгеновского излучения на фоне применения противолучевых средств из разных классов. Фосфорилированный гистон H2AX, детектирующий двунитевой разрыв ДНК, определяли в клетках селезенки, а полихроматофильные эритроциты с микроядрами – в костном мозге. В качестве противолучевых средств использовали цитокин беталейкин, α-адреномиметик индралин и нуклеозид рибоксин. По критерию ФИД показатель γH2AX показал более высокую чувствительность по сравнению с МЯ-ПХЭ. Между обоими показателями выявлена значимая степень корреляции в оценке противолучевой эффективности использованных противолучевых средств.
В настоящее время совокупность множества противолучевых средств (ПЛС), выявленных в опытах, главным образом на мелких лабораторных животных, может быть подразделена обобщенно на две большие группы: радиопротекторов/ оксидомодуляторов и стимуляторов радиорезистентности/ цитомодуляторов [1–3].
Первая из этих групп действует на радиационно-химической стадии посредством либо снижения напряжения свободного кислорода, либо увеличения концентрации веществ-восстановителей. Поэтому соединения этой группы должны вводиться непосредственно перед облучением. Наиболее известные ее представители амифостин и индралин.
Другая большая группа ПЛС осуществляет свое действие, в основном, на стадии клеточных эффектов радиационного поражения. Характерной особенностью этой группы ПЛС является широкий диапазон эффективных сроков введения препарата как до облучения (от 0.5 до 20 ч), так и после него (от 0.2 до 2 ч). Наиболее перспективными из этой группы оказались соединения полипептидной природы: цитокины и бактериальные полипептиды. Цитокины, представляющие собой семейство эндогенных полипептидных медиаторов межклеточного взаимодействия, в настоящее время применяются в клинической практике для ослабления побочных эффектов лучевой терапии злокачественных новообразований, например, препарат беталейкин, созданный на основе рекомбинантного ИЛ-1β человека [4–6]. Активно исследуется дериват флагеллина (CBLB502) из жгутика сальмонеллы [7, 8].
В настоящей работе в качестве представительных объектов исследования были выбраны радиопротектор индралин, косвенно относящийся к группе протекторов нуклеозид рибоксин и цитокин беталейкин.
Хотя наиболее универсальным и информатиным показателем оценки эффективности ПЛС остается тест выживаемости, важное значение приобретает и разработка быстрых методов оценки противолучевой эффективности. Представляется логичным искать такие методы среди показателей, отражающих состояние генетических структур как главной мишени лучевого поражения клетки. Именно к таким показателям относятся тест на количество двунитевых разрывов ДНК путем определения фосфорилированного гистона H2AX (γH2AX) [9, 10] и микроядерный тест [11].
В основе теста на γH2AX лежит ответ на индукцию двунитевых разрывов ДНК в результате воздействия ионизирующего излучения и других мутагенов. В клетках включаются сигнальные системы, направленные на репарацию радиационных повреждений ДНК: образуются так называемые радиационно-индуцированные фокусы белков репарации ДНК [12]. Среди белков, участвующих в образовании радиационно-индуцированных фокусов, методически наиболее часто определяется фосфорилированный гистон H2AX (γH2AX). Он фосфорилируется в регионах хроматина фланкирующих двунитевой разрыв ДНК, поэтому количество γH2AX тесно ассоциировано с числом радиационно-индуцированных двунитевых разрывов ДНК [13]. Последние, как известно, связывают с развитием гибели клеток и их злокачественной трансформации.
В основе микроядерного теста лежит регистрация микроядер в полихроматофильных эритроцитах (ПХЭ) костного мозга. Микроядра (МЯ) – небольшие ДНК-содержащие образования, состоящие из ацентрических фрагментов хромосом или отставших на стадии ана-телофазы хромосом [14]. На стадии телофазы эти фрагменты могут включаться в ядра дочерних клеток или образовывать одиночные или множественные микроядра в цитоплазме .
Статистически значимое отличие частоты клеток с микроядрами от уровня контрольных групп при каком-либо воздействии на организм может свидетельствовать о наличии мутагенной или антимутагенной активности.
Задача работы – сопоставление в опыте на мышах F1(СВА×С57BL/6) эффектов противолучевых препаратов по тестам микроядер в полихроматофильных эритроцитах костного мозга (МЯ-ПХЭ) и фосфорилированного гистона (γH2AX) в клетках селезенки с целью оценки их относительной чувствительности и коррелированности.
МАТЕРИАЛЫ И МЕТОДИКА
Животные. В эксперименте использованы конвенциональные животные мыши-самки F1 (СВА×С57Bl/6) в возрасте 2 мес., масса тела составила 18–23 г. Подбор животных в группы осуществляли случайной выборкой, учитывая при этом массу тела. Индивидуальное значение массы тела не отклонялось от среднего значения в группе более чем на 10%. Эвтаназию животных проводили спустя 24 ч после облучения методом цервикальной дислокации.
Облучение. Животных облучали на рентгеновском аппарате РУСТ М-1 (Россия) при мощности дозы 1.1 Гр/мин. Животных размещали в раздельных ячейках планшета.
Противолучевые препараты. Использовали противолучевые препараты из разных групп согласно классификации в работе [15]: цитомодуляторы беталейкин – иммуномодулятор (ФГУП “ГНИИ особо чистых биопрепаратов”, Россия) и рибоксин – нуклеозид инозин (Биннофарм ЗАО, Россия), оксидомодулятор индралин – радиопротектор α-адреномиметик (НПЦ Фармзащита, Россия).
Все противолучевые препараты вводили мышам до начала γ-облучения в дозе 1 Гр: беталейкин (50 мкг/кг) – за 2 ч; рибоксин (300 мг/кг) за 30 мин; индралин (100 мг/кг) за 10 мин.
Цитофлуорометрический анализ γH2AX. Для исследования γH2AX после эвтаназии выделяли селезенки. Селезенку гомогенизировали в охлажденном до 4°С фосфатно-солевом буфере (137 ммоль/л NaCl, 2.7 ммоль/л KCl, 10 ммоль/л Na2HPO4, 2 ммоль/л K2HPO4, рН 7.4, 1 мл буфера на 10 мг ткани лимфоидного органа). Суспензию клеток фильтровали через нейлоновую сетку. Определяли концентрацию клеток в камере Горяева. К 1 мл клеточной суспензии в концентрации 1 × 106 кл/мл добавляли равное количество охлажденного (+4°С) фосфатно-солевого буфера и центрифугировали при 250 g в течение 5 мин. Осадок ресуспендировали в 1.5 мл охлажденного (+4°С) фосфатно-солевого буфера. К суспензии клеток, при постоянном перемешивании на вортексе, добавляли 3.5 мл 95%-ного этанола, охлажденного до –20°С. Образцы хранили при –20°С.
Для проведения цитофлуориметрического анализа отбирали 1 мл суспензии зафиксированных клеток селезенки, добавляли 1 мл охлажденного (+4°С) фосфатно-солевого буфера и центрифугировали при 250 g в течение 5 мин. Отбирали супернатант и ресуспендировали осадок в 1 мл охлажденного (+4°С) фосфатно-солевого буфера с добавление 1% сыворотки крови козла. Центрифугировали при 250 g в течение 5 мин. Повторяли вышеописанную процедуру (ресуспендирование/центрифугирование). Отбирали супернатант и ресуспендировали в 1 мл охлажденного блокирующего буфера (фосфатно-солевой буфер с добавлением 2% сыворотки крови козла) и инкубировали на льду 20 мин. Центрифугировали при 250 g в течение 5 мин, осадок ресуспендировали в 200 мкл раствора антител к γH2AX (Anti-phospho-Histone H2AX Rabbit Monoclonal, “Merck-Millipore”), в фосфатно-солевом буфере в разведении 1:400. Инкубировали 1.5 ч при комнатной температуре и постоянном помешивании на шейкере. Дважды “отмывали” (ресуспендирование и центрифугирование при 250 g в 5 мин) клетки в фосфатно-солевом буфере, содержащей 2% сыворотки крови козла. К осадку добавляли 200 мкл вторичных антител, конъюгированных с флуоресцентным красителем Alexa 488 (Goat anti-Rabbit IgG (H + L), Alexa 488 conjugate, “Merck-Millipore”) в разведении 1:1000. Инкубировали 1 ч при комнатной температуре, постоянном помешивании на шейкере. Дважды “отмывали” клетки в фосфатно-солевом буфере, содержащей 1% сыворотки крови козла при 250 g при 5 мин. Ресуспендировали осадок в 1 мл фосфатно-солевом буфере.
Образцы анализировали на проточном цитофлуориметре FACSCalibur (“BD Biosciences”, США) со скоростью 200 клеток/с. Компьютерную обработку проводили с использованием программы FACStation Software (“BD Biosciences”, США). Анализ клеток в образце проводили по трем параметрам: интенсивность прямого и бокового светорассеяния (FSC/SSC) в линейных координатах и интенсивность флуоресценции Alexa 488 (лазер возбуждения 488 нм, FL1 – эмиссия Alexa 488 – 510–530 нм) в логарифмических единицах. В каждом образце анализировали не менее 100 000 клеток.
Цитогенетический анализ. Препараты клеток костного мозга для учета микроядер приготовлены общепринятым способом [11].
После забоя животных выделяли обе бедренные кости и очищали их от мышц. Для вымывания костного мозга использовали сыворотку крови эмбриональную телячью (“HyClone”, США ). Центрифугировали суспензию при 1000 об./мин в течение 5 мин, супернатант удаляли пипеткой с пластиковым наконечником, осадок осторожно ресуспендировали. Маленькую каплю суспензии помещали на край предметного стекла и делали мазок. Высушивали мазок на воздухе. Фиксировали препараты метанолом в течение 3 мин и окрашивали по методу Романовского–Гимза–Май–Грюнвальд. Высушивали на воздухе.
Микроскопический анализ микроядер в полихроматофильных эритроцитах (МЯ-ПХЭ) проводили слепым методом при световой микроскопии с увеличением 10 × 100 с масляной иммерсией. Анализировали по 1000 полихроматофильных эритроцитов (ПХЭ) от каждого животного. Препараты расшифровывали по окончании микроскопического анализа всего материала.
Статистическая обработка результатов. Статистическую обработку результатов проводили по программе Statistica 6. Значимость различий между сравниваемыми показателями устанавливали по непараметрическому критерию Манна–Уитни.
РЕЗУЛЬТАТЫ
В табл. 1 представлены результаты проточно-цитометрического исследования клеток селезенки, позитивных по γH2AX.
Таблица 1.
Значения (М ± m) γH2AX-позитивных клеток (%) для разных доз облучения и разных экспериментальных групп Table 1. Values of (M ± m) γH2AX-positive cells (%) for different doses of radiation and different experimental groups
| Группы | Дозы, Гр | ||
|---|---|---|---|
| 0 | 1 | 1.5 | |
| Контроль | 3.36 ± 0.46 | 7.62 ± 0.39 | 9.54 ± 0.73 |
| n = 5 | n = 5 | n = 5 | |
| Беталейкин | 2.91 ± 0.38 | ||
| n = 5, p = 0.008 | |||
| Рибоксин | 4.64 ± 0.86 | ||
| n = 5, p = 0.016 | |||
| Индралин | 5.88 ± 1.0 | ||
| n = 5, p = 0.2 | |||
Обработка представленных в табл. 1 данных по программе Statistica 6 показала, что дозовая зависимость γH2AX-позитивных клеток в контроле аппроксимируется линейной связью и имеет следующее аналитическое выражение: у = 3.39 + + 4.14x; r = 0.99, p = 0.02, где y – % γH2AX-позитивных клеток, x – доза облучения, Гр.
В табл. 2 представлены результаты по микроядерному тесту.
Таблица 2.
Значения МЯ-ПХЭ (%) для разных доз облучения и разных экспериментальных групп Table 2. The values of MN-PCE (%) for different doses of radiation and different experimental groups
| Группы | Дозы, Гр | ||
|---|---|---|---|
| 0 | 1 | 1,5 | |
| Контроль | 0.22 ± 0.05 | 1.97 ± 0.38 | 2.34 ± 0.55 |
| n = 8 | n = 10 | n = 5 | |
| Беталейкин | 1.23 ± 0.33 | ||
| n = 10, p =0.27 | |||
| Рибоксин | 1.37 ± 0.32 | ||
| n = 9, p = 0.5 | |||
| Индралин | 1.55 ± 0.35 | ||
| n = 10, p = 0.4 | |||
Зависимость % ПХЭ с МЯ в контроле также аппроксимируется линейной связью и имеет следующее аналитическое выражение: y = 0.29 + + 1.46x, r = 0.69, p = 0.0002, где y – % ПХЭ с МЯ, x – доза облучения, Гр.
Далее, для того, чтобы провести строго количественное сравнение выраженности эффекта препаратов по каждому из использованных показателей, этот эффект выразили в обобщенной форме фактора изменения дозы (ФИД), представляющего отношение равноэффективных доз в опыте и контроле. С этой целью преобразовали полученные аналитические выражения дозовых зависимостей каждого из показателей в форму расчета дозы облучения по определенному в эксперименте эффекту.
Итак, для показателя γH2AX формула расчета равноэффективной дозы в контроле приобретает следующий вид: x = (y – 3.39)/4.14, где y – эффект препарата при дозе облучения 1 Гр, x – равноэффективная доза в контроле (РЭДК), Гр.
Соответственно для показателя МЯ-ПХЭ формула расчета РЭДК получает вид: x = (y – 0.29)/1.46, где y – эффект препарата при дозе облучения 1 Гр, x – равноэффективная доза в контроле (РЭДК), Гр.
Полученные путем указанного расчета значения РЭДК для каждого из препаратов по каждому из показателей эффекта представлены в табл. 3.
Таблица 3.
Равноэффективные дозы в контроле по отношению к разным препаратам и показателям эффекта Table 3. Equally effective doses in control with respect to different drugs and indicators of effect
| Группа | Доза (РЭД/К), Гр | |
|---|---|---|
| γH2AX | МЯ-ПХЭ | |
| Беталейкин | ≤0 | 0.64 |
| Рибоксин | 0.3 | 0.74 |
| Индралин | 0.6 | 0.86 |
Далее, разделив значение полученной организмом дозы облучения в 1 Гр на значение расчетной (по измеренному эффекту) равноэффективной дозы в контроле, получаем значения ФИД для каждого препарата по каждому из использованных показателей. Они представлены в табл. 4. Данные, приведенные в табл. 4, представлены графически на рис. 1
Таблица 4.
Значения ФИД для разных препаратов по тестам анализа γH2AX и МЯ-ПХЭ Table 4. DCF values for different drugs according to tests of the analysis of γH2AX and MN-PCE
| Группа | ФИД | |
|---|---|---|
| γH2AX | МЯ-ПХЭ | |
| Беталейкин | 5.2 | 1.56 |
| Рибоксин | 3.3 | 1.35 |
| Индралин | 1.7 | 1.16 |
Рис. 1.
Сравнительная оценка ФИД по γH2AX и МЯ-ПХЭ для разных противолучевых препаратов (Бл – беталейкин, Риб – рибоксин, Индр – индралин).
Fig. 1. Comparison of evaluation FID γH2AX and MN-PCE for different antiradiation agents (Bl – betaleukin, Rib – riboxinum, Indra – indralin).
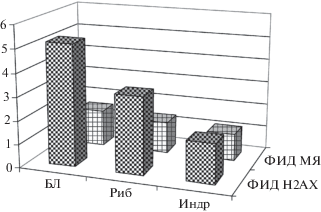
На рис. 1 видно, что значения ФИД для разных препаратов дискретны и не могут быть связаны некой общей зависимостью. Несмотря на это, они позволяют выстроить препараты в порядке убывания или нарастания их эффективности. Важно при этом отметить, что этот порядок оказывается одинаковым по каждому из использованных показателей оценки эффекта.
Таким образом, можно говорить о коррелированности использованных показателей оценки эффекта, несмотря на то, что они были измерены в разных тканях и на разных уровнях биологической организации: молекулярном для γH2AX и клеточном для МЯ-ПХЭ. Чтобы оценить степень предполагаемой коррелированности использованных показателей оценки, был проведен регрессионный анализ связи между усредненными показателями γH2AX и МЯ-ПХЭ с оценкой коэффициента корреляции по Пирсону. В табл. 5 представлены средние значения доли γH2AX- позитивных клеток и доли МЯ-ПХЭ в разных экспериментальных группах.
Таблица 5.
Средние значения доли γH2AX-позитивных клеток и доли МЯ-ПХЭ в разных экспериментальных группах Table 5. Mean values γH2AX-proportion of positive cells and the proportion of MN-PCE in different experimental groups
| Группы | МЯ-ПХЭ, % | γH2AX, % |
|---|---|---|
| Контроль 0 Гр | 0.22 | 3.36 |
| Контроль 1 Гр | 1.97 | 7.62 |
| Контроль 1.5 Гр | 2.34 | 9.54 |
| Беталейкин + 1 Гр | 1.23 | 2.91 |
| Рибоксин + 1 Гр | 1.37 | 4.64 |
| Индралин + 1 Гр | 1.55 | 5.88 |
Данные табл. 5 позволяют рассчитать регрессию показателя МЯ-ПХЭ по показателю γH2AX и представить эту связь графически (рис. 2)
Рис. 2.
Связь средних значений доли γH2AX-позитивных клеток и доли полихроматофильных эритроцитов с микроядрами (МЯ-ПХЭ). Цифры на графике означают: 1 – негативный контроль (0 Гр), 2 – позитивный контроль (1 Гр), 3 – позитивный контроль (1,5 Гр), 4 – беталейкин, 5 – рибоксин, 6 – индралин
Fig. 2. Contact the average values of the share γH2AX-positive cells and the proportion of polychromatic erythrocytes with micronuclei (MN-PCE). Numbers on the graph represent: 1 – negative control (0 Gy), 2 – positive control (1 Gy), 3 – positive control (1.5 Gy), 4 – betaleukin, 5 – riboxinum, 6 – indralin.
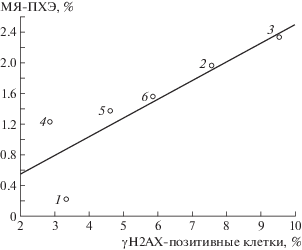
Расположение точек на рис. 2 позволяет предполагать определенную корреляционную связь использованных показателей оценки эффективности различных противолучевых препаратов. С целью измерения степени коррелированности показателей доли γH2AX и МЯ-ПХЭ был проведен регрессионный анализ, который дал следующее аналитическое выражение:
где y – доля МЯ-ПХЭ, %; x – доля γH2AX, %.Результаты корреляционного анализа, таким образом, подтвердили наличие значимой корреляционной связи между показателями γH2AX и МЯ-ПХЭ в разных группах экспериментальных животных.
ОБСУЖДЕНИЕ
Разработка противолучевых средств остается актуальной задачей радиобиологических исследований.
Особенно трудной и пока нерешенной задачей остается разработка противолучевых средств, ослабляющих отдаленные неблагоприятные последствия облучения. Непосредственная оценка таких последствий в виде прежде всего риска раковых заболеваний требует длительных, измеряемых месяцами экспериментов. Поэтому существует необходимость в разработке быстрых ориентировочных методов оценки противолучевой эффективности новых препаратов. Наиболее перспективными в этом плане представляются методы оценки структурного и функционального состояния генетического аппарата клетки, с изменениями деятельности которого и связывают канцерогенный риск радиационных воздействий.
В настоящем исследовании в качестве возможных ориентировочных показателей быстрой оценки эффективности различных противолучевых средств были выбраны показатели структурной целостности ДНК в виде теста оценки уровня двунитевых разрывов в клетках селезенки по количеству фосфорилированного гистона H2AX и микроядерного теста в полихроматофильных эритроцитах костного мозга (МЯ-ПХЭ). Конкретная задача представляемого исследования состояла в сопоставлении относительной чувствительности и коррелированности выбранных показателей оценки противолучевой эффективности препаратов. В качестве таких препаратов были выбраны представители наиболее перспективных для практического использования средств: цитокин/иммуномодулятор беталейкин, радиопротекторы альфа-адреномиметик индралин и нуклеозид рибоксин.
Полученные в данном опыте результаты свидетельствуют о том, что наиболее чувствительным по критерию ФИД оказался тест на γH2AX, который позволил получить значимые различия между контролем и защищенными животными на небольших группах мышей. Наиболее эффективным при этом оказался беталейкин, а разница между индралином и рибоксином была незначимой. Тест на МЯ-ПХЭ дал более низкие оценки эффективности препаратов по критерию ФИД. Важно отметить, что и по этому тесту наиболее эффективным средством оказался беталейкин, а рибоксин и индралин не различались по эффективности. Больший разброс в индивидуальных значениях этого показателя потребует, очевидно, проводить последующие опыты на более крупных выборках.
Проверка коррелированности обоих показателей по средним групповым значениям показала достаточно высокий коэффициент корреляции по Пирсону при регрессионном анализе (0.86) и при уровне значимости меньше 5%. Представляет безусловный интерес продолжение аналогичных опытов в условиях исследования обоих показателей на одном и том же органе или клеточной системе, а также при параллельной оценке сопряженности обоих показателей с отдаленными эффектами канцерогенного риска или иных показателей нестабильности генома.
В одной из работ описанные в научной литературе биомаркеры, касающиеся радиационного воздействия, подразделены на три группы: 1 – полученной дозы или факта самого воздействия в прошлом; 2 – повышенной чувствительности индивида к ионизирующей радиации; 3 – прогнозирования степени тяжести ранних или отдаленных последствий облучения [15]. К последней группе, очевидно, должны быть отнесены маркеры эффективности ПЛС. К какой из перечисленных групп могут (и смогут ли) быть отнесены использованные в данной работе показатели, покажут последующие исследования.
ЗАКЛЮЧЕНИЕ
Наиболее чувствительным по критерию ФИД оказался тест на γH2AX, по которому были получены значимые различия между контролем и частью ПЛС на небольших группах мышей. Тест на МЯ-ПХЭ продемонстрировал более низкие оценки эффективности препаратов.
Несмотря на различия в эффективности препаратов по использованным тестам, между последними была отмечена значимая корреляционная связь. Оценка коррелированности показателей МЯ-ПХЭ и H2AX по индивидуальным значениям суммарно в контрольных и защищенных группах показала значимую (р < 0.05) связь и по регрессионному анализу Пирсона, и по ранговой корреляции Спирмена.
Несмотря на то что ФИД для разных препаратов были рассчитаны для одной дозы облучения (1 Гр), они позволили выстроить препараты в порядке убывания (или нарастания) их эффективности. Важно при этом отметить, что этот порядок (с учетом значимости различий) оказался одинаковым по каждому из использованных показателей оценки эффекта.
Таким образом, можно говорить о коррелированности использованных показателей оценки эффекта, несмотря на то, что они были измерены в разных тканях (селезенка и костный мозг) и на разных уровнях биологической организации (молекулярный) для γH2AX и клеточный) для МЯ-ПХЭ.
Список литературы
Легеза В.И., Владимиров В.Г. Новая классификация профилактических противолучевых редств // Радиац. биология. Радиоэкология. 1998. Т. 38. № 3. С. 416–425 [Legeza V.I., Vladimirov V.G. Novaya klassifikatsiya profilakticheskikh protivoluchevykh sredstv // Radiats. biologiya. Radioekologiya. 1998. V. 38. № 3. P. 416–425. (In Russian)]
Рождественский Л.М. Классификация противолучевых средств в аспекте их фармакологического сигнала и сопряженности со стадией развития лучевого поражения // Радиац. биология. Радиоэкология. 2017. Т. 57. № 2. С. 117–135. [Rozhdestvenskiy L.M. Klassifikatsiya protivoluchevykh sredstv v aspekte ikh farmakologicheskogo signala i sopryazhennosti so stadiyey razvitiya luchevogo porazheniya // Radiats. biologiya. Radioekologiya. 2017. V. 57. № 2. P. 117–135. (In Russian)]
Васин М.В. Средства профилактики и лечения лучевых поражений: Учебное пособие. М., 2000. 264 с. [Vasin M.V. Sredstva profilaktiki i lecheniya luchevykh porazheniy: Uchebnoye posobiye. M., 2000. 264 p. (In Russian)]
Кетлинский С.А., Симбирцев А.С. Цитокины. СПб.: Фолиант, 2008. 552 с. [Ketlinskiy S.A, Simbirtsev A.S. Tsitokiny. SPb.: Izdatel’stvo Foliant, 2008. 552 p. (In Russian)]
Рождественский Л.М. Интерлейкин-1 – центральный провоспалительный цитокин плейотропного действия в аспекте лечения лучевых поражений в эксперименте и клинике // Мед. радиология и радиац. безопасность. 2001. Т. 46. № 4. С. 5–11. [Rozhdestvenskiy L.M. Interleykin-1 – tsentral’nyy provospalitel’nyy tsitokin pleyotropnogo deystviya v aspekte lecheniya luchevykh porazheniy v eksperimente i klinike // Med. radiologiya i radiats. bezopasnost'. 2001. V. 46. № 4. P. 5–11. (In Russian)]
Гребенюк А.Н., Легеза В.И. Противолучевые свойства интерлейкина-1. СПб.: Фолиант, 2012. 216 с. [Grebenyuk A.N., Legeza V.I. Protivoluchevyye svoystva interleykina-1. SPb.: Foliant, 2012. 216 p. (In Russian)]
Krivokrysenko V.I., Shakhov A.N., Gudkov A.V., Feinstein E. Identification of G_CSF and IL_6 as Candidate Biomarkers of CBLB502 Efficacy as a Medical Radiation Countermeasure // JPET Fast Forward. 2012. № 196071. P. 1–46.
Гребенюк А.Н., Аксенова Н.В., Петров А.В. и др. Получение различных вариантов рекомбинантного флагеллина и оценка их радиозащитной эффективности // Вестн.Рос. воен.-мед. академии 2013. № 3 (43). С. 75–80. [Grebenyuk A.N., Aksenova N.V., Petrov A.V. i dr. Polucheniye razlichnykh variantov rekombinantnogo flagellina i otsenka ikh radiozashchitnoy effektivnosti // Vestnik Rossiyskoy voyenno-meditsinskoy akademii. 2013. № 3(43). P. 75–80. (In Russian)]
Воробьёва Н.Ю., Грехова А.К., Трубицина К.Ю и др. Интерлейкин-1b способен снижать проявления отдаленных последствий пролонгированного воздействия низкоинтенсивного γ-излучения // Бюл. эксперим. биологии и медицины. 2015. Т. 160. № 10. С. 474–477. [Vorob’yeva N.YU., Grekhova A.K., Trubitsina K.Yu i dr. Interleykin-1b sposoben snizhat' proyavleniya otdalennykh posledstviy prolongirovannogo vozdeystviya nizkointensivnogo γ-izlucheniya // Byulleten’ eksperimental’noy biologii i meditsiny. 2015. V. 160. № 10. P. 474–477. (In Russian)]
Грехова А.К., Еремин П.С., Осипов А.Н. и др. Замедленные процессы образования и деградации фокусов γН2AX в фибробластах кожи человека, облученных рентгеновским излучением в малых дозах // Радиац. биология. Радиоэкология. 2015. Т. 55. № 4. С. 395–401. [Grekhova A.K., Yeremin P.S., Osipov A.N. i dr. Zamedlennyye protsessy obrazovaniya i degradatsii fokusov γN2AX v fibroblastakh kozhi cheloveka, obluchennykh rentgenovskim izlucheniyem v malykh dozakh // Radiatsionnaya biologiya. Radioekologiya. 2015. V. 55. № 4. P. 395–401. (In Russian)]
Оценка мутагенной активности факторов окружающей среды в клетках разных органов млекопитающих микроядерным методом. Методические рекомендации. Изд. Официальное. М., Межведомственный научный совет по экологии человека и гигиене окружающей среды РФ, 2001. [Otsenka mutagennoy aktivnosti faktorov okruzhayushchey sredy v kletkakh raznykh organov mlekopitayushchikh mikroyadernym metodom. Metodicheskiye rekomendatsii. Izd. Ofitsial’noye. M., Mezhvedomstvennyy nauchnyy sovet po ekologii cheloveka i gigiyene okruzhayushchey sredy RF, 2001. (In Russian)]
Tsvetkova A., Ozerov I.V., Pustovalova M. et al. γH2AX, 53BP1 and Rad51 protein foci changes in mesenchymal stem cells during prolonged X-ray irradiation // Oncotarget. 2017. V. 8. № 38. P. 64317–64329.
Osipov A.N., Grekhova A., Pustovalova M. et al. Activation of homologous recombination DNA repair in human skin fibroblasts continuously exposed to X-ray radiation // Oncotarget. 2015. V. 6. № 29. P. 26876–26885.
Сыпин В.Д., Осипов А.Н., Елаков А.Л. и др. Оценка генетических эффектов хронического воздействия низкоинтенсивного γ-излучения цитогенетическими методами и методом ДНК-комет // Радиационная биология. Радиоэкология. 2003. Т. 43. № 2. С. 156–160. [Sypin V.D., Osipov A.N., Yelakov A.L. i dr. Otsenka geneticheskikh effektov khronicheskogo vozdeystviya nizkointensivnogo γ-izlucheniya tsitogeneti-cheskimi metodami i metodom DNK-komet // Radiatsionnaya biologiya. Radioekologiya. 2003. V. 43. № 2. P. 156–160. (In Russian)]
Brooks A.L. Biomarkers of exposure, sensitivity and disease // Int. J Radiat. Biol. 1999. V. 75. № 12. P. 1481–503.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


