Радиационная биология. Радиоэкология, 2020, T. 60, № 1, стр. 26-33
ОПЫТ ПРИМЕНЕНИЯ СИНГЕННЫХ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК (ММСК) ЖИРОВОЙ ТКАНИ ДЛЯ ЛЕЧЕНИЯ ТЯЖЕЛЫХ РАДИАЦИОННЫХ ПОРАЖЕНИЙ КОЖИ В ЭКСПЕРИМЕНТЕ
Ю. Б. Дешевой 1, *, Т. А. Насонова 1, О. А. Добрынина 1, Р. В. Деев 2, В. Г. Лебедев 1, А. В. Лырщикова 1, Т. А. Астрелина 1, Б. Б. Мороз 1
1 Федеральный медицинский биофизический центр им. А.И. Бурназяна
Федерального медико-биологического агентства России
Москва, Россия
2 Институт стволовых клеток человека
Москва, Россия
* E-mail: iury.deshevoi@yandex.ru
Поступила в редакцию 15.05.2019
Аннотация
Обобщены данные, полученные в экспериментах, где изучалась эффективность сингенных мультипотентных мезенхимальных стволовых клеток (ММСК) жировой ткани при лечении тяжелых лучевых поражений кожи. Опыты проведены на крысах инбредной линии Wistar-Kyoto, которых подвергали локальному воздействию рентгеновского излучения в области спины в дозе 110 Гр (напряжение на трубке 30 кВ, сила тока 6.1 мА, фильтр 0.1 мм Al), при мощности дозы 17.3–20.0 Гр/мин. Локальное облучение приводило к развитию тяжелых длительно (до 3.5 мес.) незаживающих лучевых язв кожи. ММСК вводили под кожу вокруг зоны поражения в различные сроки после облучения: в ранний период до образования язвы, в период сформировавшейся язвы и в периоды активной регенерации в пораженной ткани. Проводили как однократные, так и двукратные трансплантации клеток. Показано, что только двукратное введение ММСК (с интервалом между инъекциями в 1 нед.) усиливает регенераторные процессы и убыстряет заживление лучевых язв. Терапевтический эффект более выражен в условиях двукратного введения ММСК в период, когда лучевая язва уже сформирована и в пораженной коже активизируются регенераторные процессы.
Тяжелые лучевые поражения кожи, встречающиеся в клинической практике, сопровождаются серьезными осложнениями и трудно поддаются стандартным, консервативным способам лечения [1–4]. В связи с этим в последние годы разрабатываются методы клеточной терапии данной патологии.
Имеется целый ряд публикаций, где показана эффективность применения ММСК костного мозга при лечении лучевых ожогов кожи как в эксперименте, так и в клинике [5–13]. Их благоприятное действие чаще проявляется при неглубоких поражениях кожи. Ранее для клинического применения ММСК выделяли, как правило, из костного мозга и пуповинной крови [14, 15]. В настоящее время жировая ткань является альтернативным источником получения ММСК для аутологичных трансплантаций в клинических условиях. В подкожной жировой ткани человека концентрация ММСК на несколько порядков выше, чем в костном мозге, при этом функционально ММСК жира не отличается от ММСК костного мозга [16, 17]. Жировая ткань в значительном количестве может быть легко получена у человека при липоаспирации подкожного жира. Поэтому в настоящих исследованиях для клеточной терапии радиационных ожогов кожи мы применили ММСК, выделенные из жировой ткани.
Поверхностные лучевые ожоги кожи заживают относительно быстро и, как правило, без серьезных осложнений [1–4]. В клинике более актуальным является лечение тяжелых долго незаживающих радиационных поражений кожных покровов. Поэтому для оптимального изучения эффектов клеточной терапии нами разработана экспериментальная модель локального воздействия на кожу относительно “мягкого” рентгеновского излучения, вызывающего развитие тяжелых, долго не заживающих лучевых язв кожи [18].
Целью исследования является обобщение материалов, полученных нами в ряде экспериментов, где изучалась эффективность трансплантации (в разные сроки после локального облучения) сингенных ММСК, выделенных из жировой ткани и культивированных in vitro, при лечении тяжелых лучевых ожогов кожи. Полученные данные могут иметь значение для совершенствования метода клеточной терапии радиационных поражений.
МАТЕРИАЛЫ И МЕТОДИКА
Эксперименты были выполнены на крысах инбредной линии Wistar-Kyoto массой 230–250 г, полученных из питомника лабораторных животных ФИБХ РАН (г. Пущино). Опыты на инбредных животных позволяют проводить трансплантации ММСК в сингенной системе (без отторжения пересаженных клеток). Все процедуры и эксперименты на животных проводили в соответствии с “Правилами лабораторной практики в Российской Федерации”, утвержденными приказом Министерства здравоохранения РФ № 267 от 19.06.2003 г.
Крыс, фиксированных на операционном столике, подвергали локальному воздействию рентгеновского излучения в подвздошно-поясничной области спины на установке ЛНК-268 (РАП 100-10) в дозе 110 Гр (напряжение на трубке 30 кВ, сила тока 6.1 мА, фильтр 0.1 мм Al), при мощности дозы 17.3–20.0 Гр/мин. Площадь поля облучения на поверхности кожи – 8.2–8.5 см2. В этих условиях облучения было изучено глубинное распределение дозы в тканеэквивалентном фантоме. Показано, что доза рентгеновского излучения на глубине 2 мм была порядка 30 Гр, а на глубине 5–10 мм – не более 10 Гр. Такое радиационное воздействие позволяло получать у крыс тяжелые поражения кожи с длительно (до 3.5–4 мес.) незаживающими язвами, без критической лучевой нагрузки на подлежащие ткани [18].
ММСК выделяли из клеток стромальной васкулярной фракции (СВФ) подкожной жировой ткани, полученной из брюшной и паховых областей наркотизированных интактных крыс. Для выделения СВФ предварительно размельченную жировую ткань обрабатывали коллагеназой IA. После центрифугирования и отмывки от фермента получали очищенные клетки СВФ [19, 20]. Далее эти клетки суспендировали в культуральной среде Iscov’MDM + Glutamax + Hepes (Sigma, США), содержащей 15% эмбриональной сыворотки крупного рогатого скота (“HyClone”, США), гентамицин 50.0 мг/л, амфотерицин Б 2.5 мг/л и высаживали в культуральные пластиковые флаконы (Corning) для выделения ММСК и наработки этих клеток in vitro. Культивирование проводили в CO2 инкубаторе (Sanyo, Япония). Клетки формировали на дне флакона монослой и имели фибробластоподобную морфологию. Для клеточной терапии использовали ММСК второго-третьего пассажей. Перед трансплантацией клетки отслаивали со дна флакона (трипсин-ЭДТА), отмывали от фермента, подсчитывали их количество и далее разводили стерильным раствором Хенкса до необходимой концентрации. В большинстве опытов суспензию ММСК (в которой было 87–93% живых клеток) в 1 мл солевого раствора вводили под кожу в 5 точек (по 0.2 мл на точку) вокруг лучевой язвы, отступив 5–7 мм от края очага. И только в одном эксперименте применяли аппликационное нанесение суспензии ММСК в фибриновом клее (Тиссукол, Австрия) на поверхность лучевой язвы, очищенной от струпа. По литературным данным, эффективным количеством трансплантированных ММСК при их местном однократном введении является 1.0–3.0 × 106 клеток [21]. Количество введенных клеток в наших отдельных экспериментах различалось между собой (но в определенных пределах), что будет описано в каждом конкретном случае.
Перед трансплантацией ММСК всех облученных крыс равномерно (в соответствии с размерами язв и их клиническим течением) распределяли в различные группы. Во всех опытах в контрольной и подопытных группах было по 8–10 животных.
Течение лучевого поражения кожи прослеживалось еженедельно индивидуально у каждого животного. Эффективность клеточной терапии оценивали в динамике по изменению клинической картины и площади пораженного участка кожи, вычисляемого с помощью планиметрического метода. Для этого цифровой фотокамерой “Canon” производили фотосъемку лучевой язвы и затем рассчитывали ее площадь с помощью компьютерной программы AutoCad 14.
Патоморфологические исследования динамики течения патологических процессов в облученной коже крыс проводили с использованием рутинных гистологических методов исследований.
Полученный цифровой материал обрабатывали методом вариационной статистики с вычислением средней и стандартной ошибки (M ± m). Достоверность различий оценивали по t-критерию Стьюдента.
РЕЗУЛЬТАТЫ
Клинические проявления поражения кожи после локального рентгеновского облучения крыс в дозе 110 Гр развивались постепенно. После короткого латентного периода, на 8–10-е сут у облученных животных наблюдали симптомы сухого дерматита. К 13–15-м сут сухой дерматит переходил во влажный. К концу 3-й нед. после облучения на коже крыс (в центре зоны облучения) образовывались язвы, покрытые плотным струпом. Затем происходило медленное, постепенное заживление язв с образованием атрофического рубца к 90–110-м сут после облучения, или болезнь приобретала хронический характер.
Морфологическое исследование течения патологических процессов в облученной коже показало, что в центре зоны облучения эпидермис полностью погибал через 7–12 сут после воздействия радиации. Некроз дермы начинался несколько позже и происходил поэтапно, сопровождаясь патологическими изменениями кровеносных сосудов, выраженным отеком и образованием нескольких лейкоцитарных валов. Кроме этого, отмечались дегенеративные изменения кожной мышцы, подкожной клетчатки. Полностью зона некроза кожи (с максимумом в центре зоны облучения) формировалась к 22 –27-м сут после облучения. Картина поражения соответствовала язвенно-некротическим реакциям и характеризовалась наличием выраженных изменений во всех слоях кожи. К 29–34-м сут в периферийных зонах облученной кожи начиналось постепенное восстановление митотической деятельности клеток базального слоя эпидермиса, появлялись признаки снижения воспалительных явлений в дерме и активизации регенерации поврежденных тканей. В процессе развития лучевого поражения кожи в наших экспериментах можно выделить две фазы: фазу деструкции, во время которой происходит образование очага острого лучевого некроза, и фазу репарации, когда в очаге поражения возникают процессы, направленные на ликвидацию повреждений. Разделение это (особенно для периферии зоны поражения) носит чисто условный характер. И в той, и в другой фазах явления деструкции были неотделимы от признаков репарации, и лишь общее направление течения патологического процесса позволяет рассматривать эти фазы отдельно.
В связи с этапным развитием патологического процесса в коже проведена оценка эффективности клеточной терапии в различные сроки после облучения: в ранний период формирования язвы, в период сформировавшейся язвы и в периоды активной регенерации в пораженной ткани. Изучали возможности как однократного, так и двукратного введения ММСК.
Вначале исследовали лечебную эффективность однократной трансплантации клеток, как в ранние, так и в более поздние сроки после локального облучения.
Изучали течение местных лучевых поражений в условиях однократного подкожного введения ММСК через 9 (в дозе 2.0 × 106 клеток) или 21 (в дозе 2.4 × 106 клеток) или 35 (в дозе 1.5 × 106 клеток) сут после облучения животных. На рис. 1 представлены данные изменения площади поражения кожи у разных групп животных после облучения. Показано, что однократное введение сингенных ММСК через 9, или 21, или 35 сут после локального облучения не влияло на скорость заживления лучевых язв.
Рис. 1.
Влияние однократной трансплантации сингенных ММСК на 9-е, или 21-е или 35-е сутки после облучения на заживление лучевых язв. * Статистически значимые различия по сравнению с облученным контролем (р < 0.05).
Fig. 1. The impact of one-time syngeneic transplantation MMSC at 9 or 21 or 35 days after irradiation on healing of radiation ulcers. * Statistically significant differences compared to the irradiated control (р < 0.05).
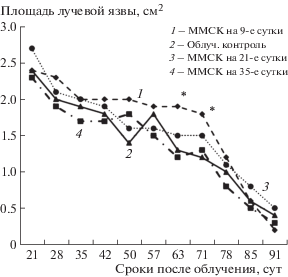
Отсутствие лечебной эффективности было также установлено и при однократной подкожной трансплантации ММСК (в дозе 1.8 × 106 клеток), проведенной через 82 дня после воздействия радиации.
Таким образом, в условиях наших экспериментов не удалось выявить способности однократно трансплантированных ММСК влиять на регенерацию кожи при тяжелых радиационных поражениях. Эта закономерность воспроизводилась при их введении как в ранний, так и в поздние периоды после облучения.
Далее проводилось изучение лечебной эффективности двукратного введения ММСК, проведенного в различные сроки после воздействия радиации.
Вначале исследовали эффективность комбинированного способа трансплантации клеток: раннего (на 9-е сут) подкожного введения (1.3 × × 106 клеток) и более позднего (на 23-и сут) нанесения суспензии ММСК в фибриновом клее (1.2 × 106 клеток) на поверхность лучевой язвы, очищенной от струпа. Интервал между двумя трансплантациями был 2 нед. Существенного влияния на заживление кожи эта процедура не оказывала.
В дальнейшем мы продолжили изучать эффективность двукратных трансплантаций (но с недельным интервалом между инъекциями). Причем ММСК вводили только под кожу вокруг зоны поражения.
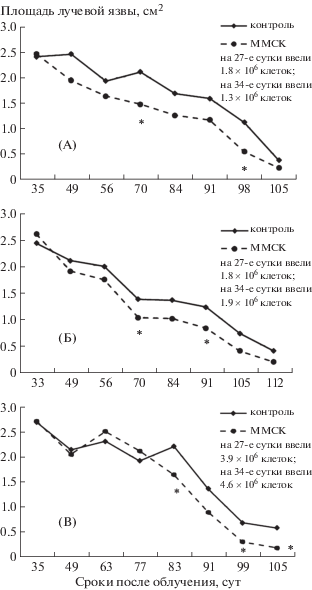
На рис. 2 представлены данные, полученные в трех отдельных экспериментах, где ММСК вводили через 27 и 34 сут после облучения, т.е. в период активизации регенераторных процессов в пораженной коже. Во всех трех опытах отмечено ускорение заживления лучевых язв после трансплантации ММСК. Так, в первых двух опытах, начиная с 49–56-х и по 98–105-е сут после облучения, площадь лучевых язв у леченных животных была на 15–52% меньше, чем у облученного контроля. Такая же тенденция сохранялась в третьем опыте, но эффект наступал позже – после 77-х сут. Специальных исследований по определению степени лечебной эффективности ММСК от числа трансплантированных клеток мы не проводили. Тем не менее в этих трех опытах не выявлено повышения скорости заживления язв при увеличении количества введенных клеток: 1-й опыт – суммарно ввели 3.1 млн клеток; 2-й опыт – суммарно ввели 3.7 млн клеток; 3-й опыт – суммарно ввели 8.5 млн клеток. Следует сказать, что количество трансплантированных клеток в этих опытах укладывалось в так называемый “терапевтический диапазон”. Считается, что у мелких лабораторных животных для проявления лечебного эффекта ММСК при подкожном применении необходимо однократно ввести порядка 1.0–3.0 × 106 клеток на животное [21].
Рис. 2.
Динамика заживления лучевых язв кожи у крыс после локального облучения в условиях двукратной трансплантации ММСК на 27-е и 34-е сутки после воздействия радиации. А, Б, В – три разных эксперимента. * Статистически значимые различия по сравнению с облученным контролем (р < 0.05).
Fig. 2. Dynamics of healing Ray skin ulcers in rats after local irradiation in terms of double transplant MMSC on 27 and 34 days after exposure to radiation. The letters A, B, C are marked with three different experiments. * Statistically significant differences compared to the irradiated control (р < 0.05).
Двукратное подкожное введение ММСК в более поздние сроки после воздействия радиации также оказывало лечебное действие на регенераторные процессы в облученной коже. Данные, представленные на рис. 3–5, показывают, что двукратное (с интервалом в неделю) введение ММСК через 34 –42 или 57–64, а также 84–92 сут после облучения стимулировало заживление лучевых язв. В этих опытах также не отмечено заметного усиления эффективности терапии при увеличении числа пересаженных клеток.
Рис. 3.
Изменения площади лучевых язв кожи у крыс после локального облучения в условиях двукратной трансплантации ММСК жировой ткани на 34-е и 42-е сутки после облучения. * Статистически значимые различия по сравнению с облученным контролем (р < 0.05).
Fig. 3. Changes in ray skin ulcers in rats after local irradiation in terms of double transplant MMSC adipose tissue on 34 and 42 days after exposure. * Statistically significant differences compared to the irradiated control (р < 0.05).
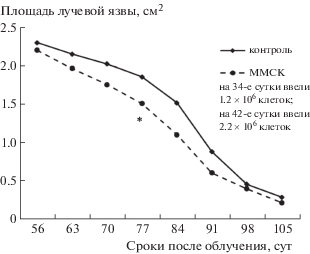
Рис. 4.
Динамика заживления лучевых язв после двукратного введения ММСК жировой ткани на 57-е и 64-е сутки после локального облучения. * Статистически значимые различия по сравнению с облученным контролем (р < 0.05).
Fig. 4. Dynamics of healing radiation ulcers after twice imposing MMSC adipose tissue on 57 and 64 days after local irradiation. * Statistically significant differences compared to the irradiated control (р < 0.05).
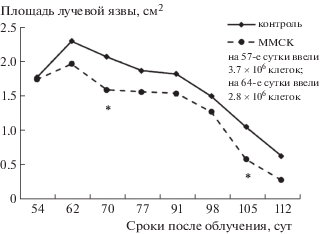
Рис. 5.
Влияние двукратной трансплантации ММСК жировой ткани на 84-е и 92-е сутки после воздействия радиации на динамику заживления лучевых язв кожи. * Статистически значимые различия по сравнению с облученным контролем (р < 0.05).
Fig. 5. The impact of double transplant MMSC adipose tissue on 84 and 92 days after exposure to radiation on the dynamics of healing of radiation ulcers of the skin. * Statistically significant differences compared to the irradiated control (р < 0.05).

Следует обратить внимание на скорость проявления лечебного действия ММСК при разных сроках их трансплантации после облучения: при поздних (57–64 и 84–92 сут) введениях эффект наступал уже через 1 нед. после последней инъекции (рис. 4–5), при трансплантации через 27–34 дня – в двух опытах эффект наступал после 15–22 сут после последней инъекции, а в 3-м эксперименте через 43 дня (рис. 2). Возможно, что терапевтическое действие клеток лучше проявляется в период активных регенераторных процессов, которые наблюдаются в наших условиях экспериментов в более поздние периоды после воздействия рентгеновского излучения.
Степень эффективности клеточной терапии, выявленная в наших опытах, была близка к результатам, опубликованным ранее в обзорной статье [22], где было показано, что ускорение заживления вялотекущих язв кожи (не лучевой этиологии) при местном введении ММСК чаще всего не превышало 20–35% по сравнению с контролем. Совместное применение комплекса методов консервативной терапии (антибиотики, средства, влияющие на воспалительную реакцию, микроциркуляцию и трофику тканей и т.д.) и трансплантации ММСК может позволить добиться значительных успехов в лечении местных лучевых поражений.
Обращает на себя внимание в условиях наших опытов отсутствие лечебной эффективности ММСК при их введении в ранние сроки. Представленные результаты отличаются от полученных нами ранее данных о стимулирующем действии однократно трансплантированных на 7-е или 14-е сут аллогенных ММСК на заживление лучевых язв кожи, образующихся после локального β-облучения крыс в дозе 140 Гр [5]. По-видимому, в условиях локального рентгеновского облучения в дозе 110 Гр (в отличие от воздействия локального β-облучения) отсутствие лечебного эффекта от введения, даже сингенных ММСК, может быть связано только со спецификой динамики процессов поражения и восстановления кожной ткани при данной модели рентгеновского облучения, с более тяжелым течением патологического процесса.
ОБСУЖДЕНИЕ
Механизмы лечебного действия подкожного введения ММСК могут быть связаны с тем, что значительная часть пересаженных клеток длительно остается и функционирует в зоне, близкой к пораженному участку кожи. Установлено, что трансплантированные под кожу ММСК способны дифференцироваться в фибробласты, которые активно участвуют в регенераторных процессах [23–25]. В то же время большинство авторов считают, что благоприятное действие ММСК, в основном, связано с их паракринным влиянием, выработкой различных факторов роста, усилением неоангиогенеза, снижением местной воспалительной реакции [14–17].
Важно отметить, что лечебный эффект проявился только при двукратной трансплантации клеток. Известно, что для реализации своего потенциала трансплантированные ММСК должны попасть в соответствующее микроокружение или создать его [26]. По-видимому, первая трансплантация клеток создает благоприятный плацдарм (микроокружение) для последующей реализации ММСК своего лечебного потенциала в условиях повторной пересадки.
Можно предположить, что заживление лучевых ран является результатом активного взаимодействия трансплантированных ММСК, клеток тканевого микроокружения, а также различных интактных клеток, мигрировавших в зону поражения. Влияние мигрировавших клеток, а также клеток, находящихся с края пораженной зоны в процессе регенерации кожи, велико, так как именно с краев лучевой язвы начинается ее заживление.
Представленные результаты подтверждают данные литературы о возможности использования ММСК жировой ткани для лечения лучевых ожогов в эксперименте и клинике [27–32] и расширяют наше представление об эффективности клеточной терапии при тяжелых радиационных поражениях кожи.
ЗАКЛЮЧЕНИЕ
Таким образом, полученные данные показывают, что сингенные ММСК жировой ткани могут быть эффективны при лечении длительно незаживающих лучевых язв кожи. Клеточная терапия оказывает лечебное действие при подкожном (вокруг зоны поражения) введении ММСК в период заживления сформировавшихся лучевых язв. Трансплантация клеток в это время должна быть как минимум двукратной, с интервалом между инъекциями в 1 нед.
Список литературы
Радиационная медицина: Руководство для врачей-исследователей и организаторов здравоохранения / Под ред. Л.А. Ильина. Т. 2. М.: ИздАТ, 2001. 432 с. [Radiation Medicine: A guide for medical researchers and health care organizers / Ed. L.A. Ilyin. M.: Izdat, 2001. V. 2. 432 p. (In Russian)]
Бушманов А.Ю., Надежина Н.М., Нугис В.Ю. и др. Местные лучевые поражения кожи человека: возможности биологической индикации дозы (аналитический обзор) // Мед. радиология. и радиац. безопасность. 2005. Т. 50. № 1. С. 37–47. [Bushmanov A.Yu, Nadezhina N.M, Nugis V.Yu, Galstyan I.A. Local radiation damage to human skin: the possibility of a biological dose indication (analytical review) // Medical Radiology and Radiation Safety. 2005. V. 50. № 1. P. 37–47. (In Russian)]
Селидовкин Г.Д. Медицинская помощь при радиационной аварии с источником цезия-137 в Бразилии (1987) // Медицинские аспекты аварии на Чернобыльской атомной станции. Киев: Здоровье, 1988. С. 180–185. [Selidovkin G.D. Medical assistance in radiation accidents with source of cesium-137 in Brazil (1987) // Medical aspects of the accident at the Chernobyl nuclear power station. Kiev: Health, 1988. P. 180–185. (In Russian)]
Надежина Н.М., Филин С.В., Сачков А.В. и др. Острые местные лучевые поражения и их последствия (нештатная ситуация при дефектоскопических работах) // Мед. труда и пром. экология. 2004. № 3. С. 40–43. [Nadezhina N.M., Filin S.V., Sachkov A.V., Galstian I.A. Acute local radiation and their consequences (contingency in flaw inspection) // Occupational medicine and Industrial Ecology. 2004. № 3. P. 40–43. (In Russian)]
Мороз Б.Б., Онищенко Н.А., Лебедев В.Г. и др. Влияние мультипотентных мезенхимальных стромальных клеток костного мозга на течение местных лучевых поражений у крыс после локального β-облучения // Радиац. биология. Радиоэкология. 2009. Т. 49. № 6. С. 688–693. [Moroz B.B., Onischenko N.A., Lebedev V.G., Deshevoi Yu.B. et al. Influence of multipotent mesenchymal stromal cells of bone marrow on process the local radiation injury in rats after local β-irradiation // Radiat. Biology. Radioecology. 2009. V. 49. № 6. P. 688–693. (In Russian)]
Котенко К.В., Мороз Б.Б., Надежина Н.М. и др. Трансплантация мезенхимальных клеток при лечении лучевых поражений кожи // Патол. физиология и эксперим. терапия. 2011. № 1. С. 2–7. [Kotenko K.V., Moroz B.B., Nadejina N.M., Deshevoi Yu.B. et al. Mesenchymal stem cells transplantation in the treatment of radiation skin lesions // Pathol. Physiology and Experim.Therapy. 2011. V. 55. №1. P. 2–7. (in Russian) ]
Котенко К.В., Еремин И.И., Мороз Б.Б. и др. Клеточные технологии в лечении радиационных ожогов: опыт ФМБЦ им. А.И. Бурназяна // Клеточная трансплантология и тканевая инженерия. 2012. Т. 7. № 2. С. 97–102. [Kotenko K.V., Eremin I.I., Moroz B.B. at al. Cell technologies in the treatment of radiation burns: experience Burnasyan Federal Medical Biophysical Centre // Cell transplantology and tissue engineering. 2012. V. 7. № 2. P. 97–102. (In Russian)]
Akito S., Akino K., Hiruno A. et al. Proposed regeneration therapy for cutaneous radiation injuries // Acta Med. Nagasak. 2006. V. 51. № 4. P. 50–55.
François S., Bensidhoum M., Mouiseddine M. et al. Local irradiation not only induces homing of human me-senchymal stem cells at exposed sites but promotes their widespread engraftment to multiple organs: a study of their quantitative distribution after irradiation damage // Stem Cells. 2006. V. 24. № 4. P. 1020–1029.
François S., Mouiseddine M., Mathieu N. et al. Human mesenchymal stem cells favour healing of the cutaneous radiation syndrome in a xenogenic transplant mo-del // Ann. Hematol. 2007. V. 86. № 1. P. 1–8.
Mehanni1 S.S., Ibrahim N.F., Hassan A.R. et al. New Approach of Bone Marrow-Derived Mesenchymal Stem Cells and Human Amniotic Epithelial Cells Applications in Accelerating Wound Healing of Irradiated Albino Rat // Int. J. Stem Cells. 2013. V. 6. № 1. P. 45–54.
Lataillade J.J., Doucet C., Bey E. et al. New approach to radiation burn treatment by dosimetry-guided surgery combined with autologous mesenchymal stem cell therapy // Regen. Med. 2007. 2. P. 785–794.
Коноплянников А.Г., Колесникова А.И., Саенко А.С. и др. Кондиционная среда, обладающая лечебным эффектом: Патент РФ № 2292212, январь, 2007. [Konopljannikov A.G., Kolesnikova A.I., Saenko A.S. et al. Conditions medium with therapeutic effect. Patent RU № 2292212 C 1. 27.01. 2007 (In Russian)]
Tuan R.S., Boland G., Tuli R. Adult mesenchymal stem cells and cell-based tissue engineering // Arthritis Res. Ther. 2003. V. 5. № 1. P. 32–45.
Онищенко Н.А. Клеточные технологии и современная медицина // Патологическая физиология и экспериментальная терапия. 2004. № 4. С. 2–11. [Onishhenko N.A. Cellular technology and modern medicine // Pathological Physiology and Experimental Therapy. 2004. № 4. P. 2–11. (In Russian) ]
Терских В.В., Киселева Е.В. Биологические особенности и терапевтический потенциал стромальных клеток жировой ткани: Обзор // Пластическая хирургия и косметология. 2010. № 4. С. 613–621. [Terskikh V.V., Kiseleva E.V. Biological peculiarities and therapeutic potential of stromal cells of adipose tissue. Review // Plastic surgery and cosmetology. 2010. № 4. P. 613–621. (in Russian)]
Bourin P., Bunnell B.A., Casteilla L. at al. Stromal cells from the adipose tissue-derived stromal vascular fraction and cultured expanded adipose tissue-derived stromal/stem cells: a joint statement of the International Federation for adipose therapeutics and the International Society for cellular therapy (ISCT) // Cytothe-rapy. 2013. V. 15. P. 641–648.
Котенко К.В., Мороз Б.Б., Насонова Т.А. и др. Экспериментальная модель тяжелых местных лучевых поражений кожи после действия рентгеновского излучения // Патол. физиология и эксперим. терапия. 2013. № 4. С. 121–123. [Kotenko K.V., Moroz B.B., Nasonova T.A. et al. Experimental model of severe local radiation injuries of the skin after x-rays // Pathol. Physiology and Experim. Therapy. 2013. V. 57. № 4. P. 121–123. (in Russian)]
Bognest A.C., Shandadfar A., Brinchmann J.E. at al. Isolation of stromal stem cells from human adipose tissue // Methods Mol. Biol. 2006. V. 325. P. 35–46.
Bunnell B.A., Flaat M., Gagliard Ch. et al. Adipose-derived stem cells: isolation, expansion and differentiation // Methods. 2008. V. 45. № 2. P. 115–120.
Isakson M., C. de Blacam, Whelan D. et al. Mesenchymal stem cells and cutaneous wound healing: current evidence and future potential. Review article // Hundawi publishing corporation. Stem Cells Int. V. 2015, Art. ID 831095, 12 p. https://doi.org/10.1155/2015/831095
Brower J., Blumberg S., Carroll E. et al. Mesenchymal stem cell therapy and delivery systems in nonhealing wounds // Adv. Skin Wound Care. 2011. Nov. V. 24. № 11. P. 524–532.
Лунёва К.А., Лунёв А.С., Клементьева О.И. и др. Изучение путей миграции мезенхимальных стволовых клеток у животных с экспериментальным лучевым ожогом кожных покровов // Разработка и регистрация лекарственных средств. 2018. № 2. С. 130–134. [Lunyova K.A., Lunyov A.S., Klementyeva O.E., Ternovskaya K.E., Astrelina T.A. Study of the ways of mesenchymal stem cells migration in animals with experimental radiation skin burns // Drug deve-lopment & registration. 2018. № 2. P. 130–134. (In Russian)]
Yaojiong Wu M.D., Liwen Cheng, Paul G. Scott et al. Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis // Stem cells. 2007. V. 25. Issue 10. P. 2648–2659.
Lopez-Iglesias P., Blazquez-Martinez A., Fernandez-Delgado J. et al. Short and long fate of human AMSC subcutaneously injected in mice // World J. Stem Cells. 2011. June 26. V. 3. № 6. P. 53–62.
Чертков И.Л., Фриденштейн А.Я. Клеточные основы кроветворения М.: Медицина, 1977. 272 с. [Chertkov I.L., Fridenshtejn A.Ya. Cellular basis of Hematopoiesis M.: Medicine, 1977. 272 p. (in Russian)]
Rigotti G., Marchi A., Galie M. et al. Clinical treatment of radiotherapy tissue damage by lipoaspirate transplant: a healing process mediated by adipose tissue-derived adult stem cells // Plast. Reconstr. Surg. 2007. V. 119. № 5. P. 1409–1422.
Riccodono D., Agay D., Scherthan H. et al. Application adipose-derived stem cells in treatment of cutaneous radiation syndrome // Health Phys. 2012. V. 103. № 2. P. 120–126.
Akita S., Yoshimoto H., Ohtsuru A. et al. Autologous adi-pose-derived regenerative cells are effective for chronic intractable radiation injuries // Radiat. Prot. Dosim. 2012. V. 151. № 4. P. 656–660.
Forcheron F., Agay D., Scherthan H. et al. Autologous adipose-derived stem cells favour healing in minipig model treatment of cutaneous radiation syndrome // PLOS One. February 2012. V. 7. № 2. e 31694.
Sheng-Ping H., Chun-Hsiang H., Jia-Fwu Sh. et al. Promotion of wound healing using adipose-derived stem cells in radiation ulcer of a rat model // J. Biomed. Sci. 2013. V. 20. № 1. P. 51–61.
Shukla L., Morrison W. A., Shayan R. Adipose-derived stem cells in radiotherapy injury: a new frontier // Frontiers in surgery Reconstructive and Plastic Surgery. January 2015. V. 2. Art. 1. P. 1–12.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


