Расплавы, 2020, № 1, стр. 52-64
Совместное электровосстановление ионов хрома и бора и электрохимический синтез боридов хрома в галогенидно-оксидных расплавах
Х. Б. Кушхов a, М. Адамокова a, О. Б. Ашинова a, *, Р. Х. Карацукова a
a ФГБОУ ВО Кабардино-Балкарский государственный университет им. Х.М. Бербекова
Нальчик, Россия
* E-mail: oksanaashinova@mail.ru
Поступила в редакцию 26.03.2019
После доработки 20.05.2019
Принята к публикации 02.06.2019
Аннотация
Методом циклической вольтамперометрии изучен процесс электровосстановления кислородсодержащих ионов хрома ${\text{CrO}}_{{\text{4}}}^{{{\text{2}}-}}$ и ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{2}}-}}$ и их совместное электровосстановление с фторборат-ионом ${\text{BF}}_{{\text{4}}}^{ - }$ в эквимольном расплаве KCl–NaCl при температуре 1073 К. Показано, что электровосстановление ${\text{CrO}}_{{\text{4}}}^{{{\text{2}}-}}$ и ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{2}}-}}$ происходит в две стадии с образованием на первой стадии оксида хрома Cr2O3. На второй стадии также осаждается Cr2O3 в случае электровосстановления ${\text{CrO}}_{{\text{4}}}^{{{\text{2}}-}}$ и смеси Cr2O3 и металлического хрома в случае электровосстановления ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{2}} - }}.$ Установлено, что фторборат-ион на фоне эквимольного расплава KCl–NaCl может взаимодействовать с ионом ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{2}} - }}$ с образованием оксифторидных комплексов хрома ${\text{Cr}}{{{\text{O}}}_{{\text{2}}}}{\text{F}}_{{\text{4}}}^{{{\text{2}}-}}$ и бора ${\text{BOF}}_{{\text{2}}}^{-},$ BOF. Совместным электровосстановлением оксифторидных комплексов хрома и бора показана возможность осуществление электрохимического синтеза фаз боридов хрома в галогенидно-оксидном расплаве.
ВВЕДЕНИЕ
Соединения металлов с бором – бориды представляют важный и обширный класс неорганических соединений, отличающиеся тугоплавкостью, высокой химической стойкостью в различных агрессивных средах, а также металлоподобностью, выражающейся в их высоких электро- и теплопроводности, магнитных свойствах, в специфической электронной структуре [1, 2].
В частности, бориды хрома, благодаря своим свойствам твердости и износостойкости, жаропрочности и химической инертности, достаточно востребованы в современной технике для изготовления защитных покрытий металлов и керметов, в качестве компонентов и легирующих добавок твердых сплавов [3–6].
Из справочных данных [1] следует, что хром образует с бором ряд соединений – бориды состава Cr3B4, CrB, Cr5B3, Cr2B, CrB4.
Основными методами получения боридов хрома является прямой синтез из элементов в виде спрессованных таблеток в диапазоне температур 1150–1350°С в атмосфере водорода или аргона [7] магниеборотермический метод. Чистота боридов хрома при этом не выше 97%.
Впервые возможность получения боридов хрома электролизом ионных расплавов показана в работах [8, 10]. Бориды хрома получены последовательным изменением содержания оксида Cr2O3 в расплаве, состоящем из CaB4O7, B2O3 CaF2. Позднее в работе [11] упоминается получение боридов хрома состава CrxBy электролизом расплава KCl–KF–Cr2O3–KBF4 при температурах 1023–1073 К и напряжении на ванне 5.0–6.013 В. Электрохимический синтез боридов хрома осуществляли в хлоридно-криолитном расплаве NaCl–Na3AlF6, содержащим хромат натрия и оксид бора [12]. В зависимости от состава и параметров электролиза на катоде осаждались индивидуальные фазы Cr2B, CrB, CrB4 так и их смеси в различном соотношении. Оптимизацию процесса синтеза авторы [12] сводили к определению режимов получения однофазного тетраборида хрома CrB4. Возможность получения боридов тугоплавких металлов, в том числе боридов хрома, электролизом расплавов показана также в работе [13].
Необходимо отметить, что бориды хрома полученные в работе [11], были в значительной степени загрязнены бором, карбидом бора, графитом.
Недостатком работ [9–12], по нашему мнению, является неудачный выбор электролита, т.к. вследствие обменных реакций в расплаве происходит его постепенное перерождение в вязкий тугоплавкий расплав с прогрессивно замедляющейся диффузией ионов хрома и бора. Кроме того, эти электролиты плохо растворимы в воде и получение чистого целевого продукта боридов хрома весьма проблематична.
Цель настоящей работы – исследование возможности совместного электровосстановления ионов бора и хрома и реализация процесса электрохимического синтеза боридов хрома.
МЕТОДЫ ИССЛЕДОВАНИЯ И МЕТОДИКА ЭКСПЕРИМЕНТОВ
Совместное электровосстановление ионов хрома и бора изучали на фоне эквимолярной смеси хлоридов калия и натрия. В качестве источника хрома использовали хромат- и бихромат калия. Источником ионов бора использовали фторборат калия. Использованные в качестве фонового электролита хлориды калия и натрия марки о. с. ч. сушили в вакуумном шкафу при температуре 200°С в течение 5 ч. Затем переплавляли в платиновом тигле. Хромат, бихромат калия, фторборат калия марки х. ч. сушили в вакуумном сушильном шкафу при температуре 200°С в течение 5 ч. Все реактивы хранили в сухом перчаточном боксе марки LabStar.
Для создания рабочей температуры 823–1023 К применяли печь сопротивления шахтного типа, нагревательным элементом, в которой являлись силитовые стержни. Автоматическое регулирование температуры осуществлялось с помощью электронного терморегулятора ОВЕН-ТРМ-1, используя хромель-алюмелевую термопару. Использование различных термоизоляционных материалов в изготовлении печи позволило достичь точность поддержания температуры ±1°С.
Вольтамперные измерения и электролиз проводили в кварцевой герметичной трехэлектродной ячейке в атмосфере очищенного и осушенного аргона (рис. 1).
Рис. 1.
Схема высокотемпературной кварцевой электрохимической ячейки: 1 − кварцевый стакан; 2 − штуцер для вакуумирования ячейки; 3 − фторопластовая втулка; 4 − пробки из вакуумной резины; 5 − загрузочное устройство; 6 − рубашка охлаждения; 7 − серпентиновые шайбы; 8 − электрод сравнения; 9 − рабочий электрод; 10 − токоподводы к аноду; 11 − накопительный вольфрамовый катод; 12 − термопара.
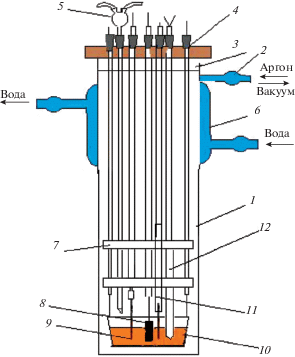
В качестве контейнера для расплава использовался тигель из стеклоуглерода марки СУ-2000, он же являлся вспомогательным электродом. В качестве индикаторного электрода использовали платиновую проволоку d = 0.5–1.0 мм, глубина погружения 1.0–1.5 см. в качестве электрода сравнения применяли платиновую пластинку или проволоку d = 0.5 мм закрученную в спираль для увеличения площади поверхности электрода. Для получения вольтамперных зависимостей использовали электрохимический комплекс Autolab Nova 2013 согласованного с компьютерной системой управления. В качестве источника питания для электролиза применялся источник тока БП-5А.
Для определения фазового, химического, гранулометрического состава катодных осадков использовались рентгенофазовый анализ на дифрактометре D2 Phaser, рентгенофлуоресцентный спектрометр Спектроскан MAKS GV, лазерный анализатор размера частиц Fritsch Analysette-22 NanoTec plus.
Электроосаждение борида хрома проводили в потенцио- и гальваностатическом режимах. После окончания электролиза катодный осадок отмывали в кипящей дистиллированной воде, центрифугировали, высушивали и взвешивали порошок борида хрома.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЯ
Исследование электровосстановления хромат и бихромат-ионов в эквимольном расплаве KCl–NaCl
Вольтамперные зависимости электровосстановления хромат-иона ${\text{CrO}}_{{\text{4}}}^{{{\text{2}} - }}$ на платиновом электроде в эквимольном расплаве KCl–NaCl относительно квазиобратимого платино-кислородного электрода сравнения предоставлены на рис. 2.
Рис. 2.
Вольтамперные зависимости расплава KCl–NaCl (1 : 1)–K2CrO4, полученные при последовательном добавлении хромата калия ${{{\text{С}}}_{{{{{\text{K}}}_{{\text{2}}}}{\text{Cr}}{{{\text{O}}}_{{\text{4}}}}}}}$ ⋅ 104 моль/см3: 1 – фоновый электролит KCl–NaCl; 2 – 1.0; 3 – 2.0; 4 – 3.0; Т = 1023 К, V = 0.1 В/с. Электрод сравнения – платино-кислородный.
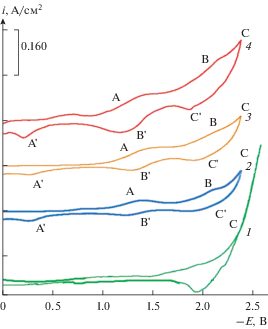
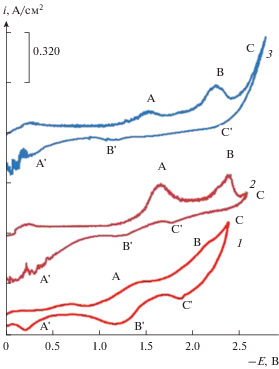
Как видно из рис. 2, при добавлении в расплав хлоридов натрия и калия, хромата калия концентрацией порядка 1.0 ⋅ 10–4 моль/см3 и более, на циклических вольтамперных зависимостях до волны восстановления катионов фонового электролита (волна С) появляются две волны восстановления ионов хрома при потенциалах: –(1.4–1.45) В (волна А) и –(2.1–2.35) В (волна В). На анодной ветви также наблюдается три волны электроокисления продуктов катодного цикла: волна С' (электроокисление щелочных металлов), волны А' и В' (электроокисления продуктов катодного цикла). Как видно из рисунка, потенциалы катодных волн (А и В) и анодных (А и В) сильно различаются по потенциалам. Высоты волн, как первой (волна А) так и второй (волна В), линейно возрастают с увеличением концентрации хромата калия в расплаве (рис. 3).
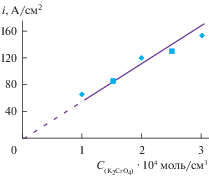
Рис. 3.
Зависимость плотности тока первого катодного пика электровосстановления хромат иона от концентрации в расплаве KCl–NaCl (1 : 1)–K2CrO4 на платиновом катоде. V = 0.1 В/c, Т = 1023 К.
Аналогично, нами изучено электровосстановления бихромат-иона в эквимольном расплаве KCl–NaCl при 1023 К. При добавлении бихромат-иона в эквимольный расплав KCl–NaCl происходит появление в катодном цикле циклической вольтамперограммы также трех хорошо воспроизводимых волн: первая (волна А) при потенциалах: –(1.4–1.5) В, –(1.9–2.1) В – вторая (волна В) и –(2.3–2.4) В – третья (волна С) (рис. 4).
Рис. 4.
Вольтамперные зависимости расплава KCl–NaCl (1 : 1)–K2Cr2O4 полученные при последовательном добавлении бихромата калия ${{{\text{С}}}_{{{{{\text{K}}}_{{\text{2}}}}{\text{C}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}}}}}$ ⋅ 104 моль/см3): 1 – фоновый электролит KCl–NaCl (1 : 1); 2 – 0.5; 3 – 1.0; 4 – 1.5. Электрод сравнения – платино-кислородный.
Отличительная особенность анодного цикла циклической вольтамперограммы (кривая 2) состоит в том, что в областях потенциалов катодных волн на анодном цикле не наблюдаются волны анодного растворения продуктов катодного цикла. Волны анодного растворения наблюдаются в значительно более положительной области потенциалов, положительнее –0.5 В (волны А' и В'). Как видно из рис. 4, при возрастании концентрации бихромат-ионов в расплаве происходит рост первой и второй катодных волн восстановления бихромат-ионов. Можно также заметить, что имеет место небольшое смещение волны в область положительных потенциалов. Причиной может служить изменение потенциала электрода сравнения при повышении концентрации бихромат-ионов, приводящие к изменению концентрации ионов кислорода в расплаве. При концентрациях бихромат ионов больше 1 ⋅ 104 моль/см3 на анодной ветви при потенциалах –(1.5–1.6) В появляется небольшая волна D. По-видимому, появление этой волны связано с растворением металлического хрома, содержащегося в небольшом количестве в катодном осадке выделяющийся на второй волне В.
На рис. 5 представлены циклические вольтамперограммы при разных скоростях поляризации от 0.1 до 1.0 В/с для первой волны А восстановления бихромат-ионов. С увеличением скорости поляризации происходит рост высоты волны восстановления и ее смещение в относительную область потенциалов. Из рис. 5 также видно существенное (~1.0 В) различие в потенциалах пиков катодной волны восстановления и волны окисления продукта катодного цикла. Столь большое различие в потенциалах волн на циклической вольтамперной зависимости может свидетельствовать о необратимости электродного процесса протекающего на первой волне электровосстановления бихромат-ионов.
Рис. 5.
Вольтамперные зависимости расплава KCl–NaCl (1 : 1)–K2Cr2O4, полученные при последовательном увеличении скорости развертки потенциала: 1 – фоновая кривая KCl–NaCl (1 : 1), скорость поляризации: 2 – 0.1; 3 – 0.2 ; 4 – 0.5 ; 5 – 1.5 В/с; ${{{\text{С}}}_{{{{{\text{K}}}_{{\text{2}}}}{\text{C}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}}}}}$ = 1 ⋅ 104 моль/см3, Т = 1023 К. Электрод сравнения – платино-кислородный.
Объяснение природы электродных реакций, протекающих при электровосстановлении хромат- и бихромат-ионов и установлении форм электрохимически активных частиц, участвующих в этих процессах, возможно на основе кислотно-основных равновесий, имеющих место в эквимольном расплаве, содержащем хромат и бихромат-ионы. Как было установлено Ю.К. Делемарским, В.И. Шаповалом, О.Г. Циклаури [14, 15] в хлоридном расплаве KCl–NaCl, содержащем хромат-ион имеет место кислотно-основное равновесие
(1)
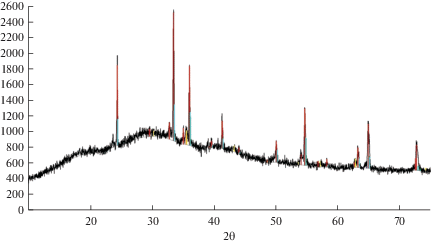
${\text{2CrO}}_{{\text{4}}}^{{{\text{2}}-}} \leftrightarrow {\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{2}}-}} + {{{\text{O}}}^{{{\text{2}}-}}}.$Поэтому в эквимольном расплаве KCl–NaCl–K2CrO4 будут содержаться ионы ${\text{CrO}}_{{\text{4}}}^{{{\text{2}} - }}$ и ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{2}} - }},$ равновесные концентрации этих ионов будут определяться константой устойчивости ${\text{CrO}}_{{\text{4}}}^{{{\text{2}} - }}$ по реакции (1). Потенциостатический электролиз расплава KCl–NaCl (1 : 1)–K2CrO4 (2.0 ⋅ 10–4 моль/см3) при потенциалах первой и второй волн при температуре 1023 К дает один продукт Cr2O3 (рис. 6). Потенциостатический электролиз расплава KCl–NaCl (1 : 1)–K2Cr2O7 (2.0 ⋅ 10–4 моль/см3) при потенциалах первой волны восстановления дает продукт, также состоящий из оксида хрома, а при потенциалах второй волны восстановления дает продукт состоящий из смеси оксидов хрома и металлического хрома (рис. 7).
Рис. 6.
Результаты РФА катодного осадка, полученного электролизом расплава KCl–NaCl–K2CrO4 при потенциале –1.40 В относительно платино-кислородного электрода сравнения. ${{{\text{С}}}_{{{{{\text{K}}}_{{\text{2}}}}{\text{Cr}}{{{\text{O}}}_{{\text{4}}}}}}}$ = 2.0 ⋅ 10–4 моль/см3, Т = 1023 К.
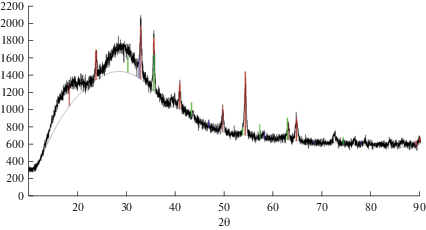
Рис. 7.
Результаты рентгенофазового анализа катодного осадка, полученного электролизом расплава KCl–NaCl–K2Cr2O7 при потенциале –2.10 В относительно платино-кислородного электрода сравнения. ${{{\text{С}}}_{{{{{\text{K}}}_{{\text{2}}}}{\text{Cr}}{{{\text{O}}}_{{\text{4}}}}}}}$ = 2.0 ⋅ 10–4 моль/см3, Т = 1023 К.
На основании результатов анализа циклических вольтамперных зависимостей расплавов KCl–NaCl–K2CrO4 и KCl–NaCl–K2Cr2O7 и кислотно-основных равновесий, реализуемых в этих расплавленных системах можно предположить следующие механизмы электровосстановления хромат и бихромат-ионов.
На первой волне в расплаве KCl–NaCl–K2CrO4:
(2)
${\text{2C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{2}} - }} + {\text{6e}} \to {\text{C}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{2CrO}}_{{\text{4}}}^{{{\text{2}} - }} + {\text{3}}{{{\text{O}}}^{{{\text{2}} - }}},$(3)
${\text{2CrO}}_{{\text{4}}}^{{{\text{2}} - }} + {\text{6e}} \to {\text{C}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{5}}{{{\text{O}}}^{{{\text{2}} - }}},$(4)
${\text{CrO}}_{{\text{4}}}^{{{\text{2}} - }} + {\text{3e}} \to {\text{CrO}}_{{\text{2}}}^{ - } + {\text{2}}{{{\text{O}}}^{{{\text{2}} - }}}.$(5)
${\text{2C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{2}}-}} + {\text{6e}} \to {\text{C}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{2CrO}}_{{\text{4}}}^{{{\text{2}}-}} + {\text{3}}{{{\text{O}}}^{{{\text{2}} - }}}.$Совместное электровосстановления ионов хрома и бора в эквимольном расплаве KCl–NaCl
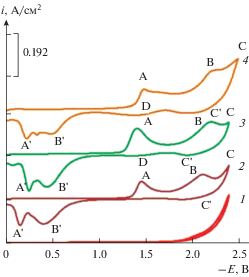
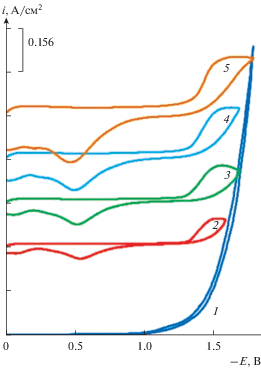
Выше приведенные экспериментальные данные по электровосстановлению кислородсодержащих ионов хрома (${\text{CrO}}_{{\text{4}}}^{{{\text{2}} - }}$ и ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{2}} - }}$) свидетельствует о том, что процесс электровосстановления ионов хрома осуществляется в две стадии. На второй стадии электровосстановления бихромат-иона протекающая при потенциалах близких к потенциалам разложения эквимольной расплавленной смеси хлоридов щелочных металлов возможно выделение металлического хрома. Для электрохимического получения боридов хрома необходимо иметь представление о механизме совместного электровыделение этих элементов из эквимольного расплава KCl–NaCl. В связи с этим, нами были проведены исследования по изучению процесса совместного электровосстановления ионов хрома с фтор-борат-ионами на платиновом электроде в хлоридном расплаве. Эксперименты по изучению процесса совместного электровосстановления бихромат-ионов и тетраборат-ионов проводили следующим образом. В начале в фоновый электролит KCl–NaCl (1 : 1) добавляли дихромат калия K2Cr2O4 получили вольтамперные зависимости электровосстановления ионов ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{2}} - }}.$ Затем в расплав KCl–NaCl–K2Cr2O4 добавляли KBF4 и получали вольтамперные в зависимости от совместного электровосстановления ионов ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{2}} - }}$ и ${\text{BF}}_{{\text{4}}}^{ - }.$ Результаты вольтамперометрических измерений совместного электровосстановления ионов бора и дихромат-ионов на платиновом электроде в эквимольном расплаве KCl–NaCl представлены на рис. 8. Как видно, из рисунка (кривая 2) при добавлении KBF4 происходит возрастание и смещение первой (волна А) и второй (волна В) волны электровосстановления бихромат-ионов в область более отрицательных потенциалов. По-видимому, смещение потенциалов в отрицательную область связано с изменением потенциала электрода сравнения при введении в расплав фторбората калия. Волны восстановления бихромат-ионов становятся более выраженными, на них появляются диффузионные пики.
Рис. 8.
Вольтамперные зависимости расплава KCl–NaCl–K2Cr2O4–KВF4 полученные на платиновом электроде относительно квазиобратимого платино-кислородного электрода сравнения при последовательном добавлении бихромата калия 1 – ${{{\text{С}}}_{{{{{\text{K}}}_{{\text{2}}}}{\text{C}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}}}}}$ = 3 ⋅ 10–4 моль/см3; 2 – ${{С}_{{{\text{KВ}}{{{\text{F}}}_{{\text{4}}}}}}}$ = 1 ⋅ 10–4 моль/см3; 3 – ${{С}_{{{\text{KВ}}{{{\text{F}}}_{{\text{4}}}}}}}$ = = 2 ⋅ 10–4 моль/см3; Т = 1023 К, V = 0.1 В/с.
При увеличении концентрации фторбората калия высота первой волны А уменьшается, а вторая волна В растет. В анодном цикле циклической вольтамперограммы с добавлением KBF4 высоты волн А и В анодного растворения уменьшаются (кривая 2), а при увеличении концентрации KBF4 волна В вообще исчезает (кривая 3). Растворение продукта катодного цикла происходит при потенциалах положительнее –0.5 В, хотя при потенциалах –1.1–1.0 В имеется очень слабо выраженная волна В'.
Изменение вольтамперных зависимостей электровосстановления бихромат-ионов при введении фторборат ионов можно объяснить на основе кислотно-основных взаимодействий в расплаве KCl–NaCl–K2Cr2O4–KBF4. Бихромат-ион может взаимодействовать с ионом ${\text{KBF}}_{{\text{4}}}^{-}$ по следующей реакции
(8)
${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{2}}-}} + {\text{4BF}}_{{\text{4}}}^{-} = {\text{2Cr}}{{{\text{O}}}_{{\text{2}}}}{\text{F}}_{{\text{4}}}^{{{\text{2}}-}} + {\text{2BOF}}_{{\text{2}}}^{-} + {\text{BOF}} + {\text{B}}{{{\text{F}}}_{{\text{3}}}}.$Электрохимические реакции, которые протекают на катоде, можно записать следующим образом
(9)
${\text{Cr}}{{{\text{O}}}_{{\text{2}}}}{\text{F}}_{{\text{4}}}^{{{\text{2}}-}} + {\text{6е}} \to {\text{Cr}} + {\text{4}}{{{\text{F}}}^{-}} + {\text{2}}{{{\text{O}}}^{{{\text{2}}-}}},$(10)
${\text{BOF}}_{{\text{2}}}^{-} + {\text{3e}} \to {\text{B}} + {{{\text{O}}}^{{{\text{2}}-}}} + {\text{2}}{{{\text{F}}}^{-}},$Поскольку потенциалы восстановление оксифторидных комплексов хрома и бора существенно различаются (более 0.7 В), следовательно, синтез боридов хрома возможен в кинетическом режиме. Для подтверждения возможности получения боридов хрома в галогенидно-оксидном рапславе KCl–NaCl–K2Cr2O4–KBF4 нами проведен потенциостатический электролиз при потенциалах завершения второй волны восстановления. Концентрация бихромата калия и фторбората калия в расплаве изменялись в интервале 1.0–5.0 мол. %. Потенциал электролиза составлял 2.5–2.7 В относительно платино-кислородного электрода. Для накопительного электролиза в качестве катода применяли вольфрамовую проволоку диаметром 3.0 мм. Как показали проведенные электролизы материал катода платина или вольфрам не влияет на состав катодного продукта. Анодном и одновременно контейнером для расплава служил стеклоуглеродный тигель. Температура электролиза 1023 К. Потенциостатический электролиз продолжительностью 1.0 ч приводит к образованию на катоде металло-солевого осадка в виде “груши”. По окончании электролиза катодный осадок отмывали от электролитов в кипящей дистиллированной воде, фильтровали, высушивали при температуре 150°С.
Полученные порошки катодных осадков подвергнуты рентгенофазовому анализу на порошком дифрактометре D2 PHASER. Результаты анализа представлены на рис. 9.
Рис. 9.
Рентгеннограмма катодного продукта, полученного при совместном электрохимическом восстановлении ионов хрома и бора из электролита NaCl–KCl–K2Cr2O7–KBF4, при Т = 1073 К, Е = –2.7 В, ${{{\text{С}}}_{{{{{\text{K}}}_{{\text{2}}}}{\text{C}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}}}}}$ = = 3.0 мол. %, ${{{\text{С}}}_{{{\text{KB}}{{{\text{F}}}_{{\text{4}}}}}}}$ = 3.0 мол. %.
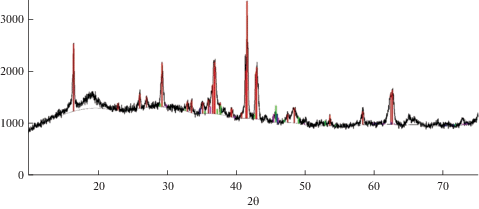
Результаты РФА подтверждают, что катодный осадок состоит из смеси фаз боридов хрома CrB2, Cr5B3, Cr2B3.
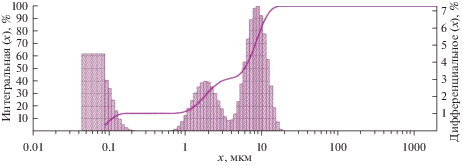
Исследование гранулометрического состава катодных осадков на лазерном анализаторе размера частиц показал, что синтезированные порошки боридных фаз хрома состоят из трех фракций: первая – 35–200 нм; вторая – 0.7–4.0 мкм; третья – 4.0–20 мкм (рис. 10).
Рис. 10.
Гранулометрический анализ катодного продукта, полученного при электрохимическом восстановлении ионов хрома и бора из электролита NaCl–KCl–K2Cr2O7–KBF4, при Т = 1073 К, Е = –2.7 В, ${{{\text{С}}}_{{{{{\text{K}}}_{{\text{2}}}}{\text{C}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}}}}}$ = = 3.0 мол. %, ${{{\text{С}}}_{{{\text{KB}}{{{\text{F}}}_{{\text{4}}}}}}}$ = 3.0 мол. %. Катод – вольфрамовая проволока, анод – графитовый тигель.
ЗАКЛЮЧЕНИЕ
1. Показано, что электровосстановление ионов ${\text{CrO}}_{{\text{4}}}^{{{\text{2}}-}}$ и ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{2}}-}}$ в эквимольном расплаве NaCl–KCl происходит в две стадии с образованием на первой стадии Cr2O3. На второй стадии также осаждается Cr2O3 в случае электровосстановления ${\text{CrO}}_{{\text{4}}}^{{{\text{2}}-}}$ и смеси Cr2O3 и металлического хрома в случае электровосстановления ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{2}}-}}.$
2. Установлено, что фторборат-ион на фоне эквимольного расплава NaCl–KCl может взаимодействовать с ионом ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{2}}-}}$ с образованием оксифторидных комплексов хрома ${\text{Cr}}{{{\text{O}}}_{{\text{2}}}}{\text{F}}_{{\text{4}}}^{{{\text{2}}-}}$ и бора ${\text{BOF}}_{{\text{2}}}^{-},$ BOF. Показано, что совместным электровосстановлением оксифторидных комплексов хрома и бора возможно осуществление электрохимического синтеза в кинетическом режиме фаз боридов хрома.
Список литературы
Самсонов Г.В., Серебрякова Т.И., Неронов В.А. Бориды. М. Атомиздат, 1975.
Самсонов Г.Б., Марковский Л.Я., Жигач А.Ф., Валяшко М.Г. Бор, его соединения и сплавы. Киев, изд. АН УССР, 1960.
Kiessling R. The binary system chromium-boron. I phase analysis and structure of the zeta-andtheta-phases // Acta Chem Scand. 1949. 3. P. 595–602
Cеребрякова Т.И., Неров В.А., Пешев П.Д. Высокотемпературные бориды. М. Металлургия, 1991.
Серебрякова Т.И., Самсонов Г.В. Исследование условий получения боридов хрома // Журнал прикладной химии. 1967. 60. № 1. С. 3–8.
Серебрякова Т.И., Конвенская Б.А. Физические сывойства боридных фаз хрома // Изв. АН СССР. Неорганические материалы. 1966. 2. № 12. С. 2134–2138.
Самсонов Г.В., Марковский Л.Я. Химия боридов // Успехи химии. 1956. 25. № 2. С. 190–241.
Эпельбаум В.А., Севастьянов Н.Г., Гуревич М.А., Ормонт Б.Ф., Жданов Г.С. О фазах, образующихся в системе Cr–B // ЖНХ. 1958. 3. № 11. С. 254–255.
Andrieux M.L. Su la preparation et les propriety des borides de columbium // Comptes rendus Acod. Sci.Paris. 1927. 184. P. 91–92.
Andrieux L., Marion S. Preparation des borides de chrome par electrolysis ingle // Comptes rendus Acad. Sci.Paris. 1953. 236. P. 805–809.
Miller G. Electrolytic Production of Boron // J. Electrochem. Soc. 1959. 106. № 9. P. 815–818.
Малышев В.В., Кушхов Х.Б., Шаповал В.И. Электролитические порошки силицидов и боридов хрома // Порошковая металлургия. 1994. № 1. С. 11–15.
Kaptay G., Kuznetsov S.A. High-temperature electrochemical syntheses of borides from ionic melts // Plasmas and Ions. 1999. № 2. P. 45–56.
Шаповал В.И., Делимарский Ю.К., Циклаури О.Г. Изучение кинетики электровосстановления хроматов в расплаве NaCl–KCl // Укр. хим. журн. 1974. 40. № 9. С. 941–945.
Делимарский Ю.К., Шаповал В.И., Циклоури О.Г., Василенко В.А. Потенциометрическое изучение кислотно-основных реакций по Люксу в расплавленной эвтектике хлоридов калия и натрия // Укр. хим. журн. 1974. 40. № 1. С. 8–13.
Дополнительные материалы отсутствуют.


