Расплавы, 2020, № 6, стр. 578-588
Электрохимический синтез графена в расплавленных солях
В. А. Елшина a, Л. А. Елшина a, *
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: yolshina@ihte.uran.ru
Поступила в редакцию 07.07.2020
После доработки 18.07.2020
Принята к публикации 20.07.2020
Аннотация
Исследована растворимость порошкообразного карбида бора в хлоридном расплаве в температурном интервале 793–903 К. Показано, что что при длительных выдержках карбида бора в солевом расплаве не образуются пленки углерода, содержание ионов бора В3+ определяется количеством кислорода, адсорбированного на поверхности порошка карбида бора. Образование углерода в расплаве, содержащем В4С, проходит на поверхности титана в бестоковом режиме, однако, при этом образуются грубые осадки, состоящие из многослойного графена и графита. Посредством электрохимического синтеза в расплавленных хлоридах щелочных металлов получены бездефектные пленки графена двухслойного графена большой площади – до 1000 мкм2. Для анализа чистоты углеродной фазы применялся метод спектроскопии комбинационного рассеяния света. Характерные пики идентифицированные на полученных спектрах позволяют отнести изучаемую структуру к аллотропной модификации углерода, находящегося в sp 2-гибридизированном состоянии. Численные характеристики хорошо выраженных и симметричных линий рассеяния первого и второго порядка позволяют идентифицировать образованные на поверхности титанового анода углеродные пленки как двуслойный графен с малым числом дефектов. Морфология образующейся пленки графена может быть тщательно проконтролирована при помощи параметров процесса осаждения: температуры синтеза, концентрации добавки карбида бора и плотности приложенного анодного тока. Процесс хорошо воспроизводим, имеет довольно низкую температуру синтеза – до 973 К, не требует использования дорогих реактивов, протекает в одну стадию.
ВВЕДЕНИЕ
Графен является одним из самых перспективных материалов в области наноэлектроники и спинтроники вследствие комплекса присущих ему электрических, оптических и механических свойств. Практическое использование графена в настоящее время сдерживается отсутствием технологий воспроизводимого получения графена в виде пленок или покрытий значительной площади (100 × 100 мкм).
Существующие в настоящее время методы синтеза графена можно разделить на три группы: механическое или химическое расслоение, рост графена из органических прекурсоров, а также стимулированный рост графена на различных подложках.
Применение методов механического расслоения графита позволяет получать пленки графена с линейными размерами около 10 мкм, выход бездефектного графена ничтожно мал [1, 2]. Химическое расслоение терморасширенного графита заключается в обработке сильными кислотами с целью разрушения межслойных связей в графите с последующим быстрым нагревом СВЧ волнами, например [3–5]. Недостатком этого высокопроизводительного метода синтеза графена является деструкция кристаллической решетки графена, что ведет к сильному ухудшению его электрических свойств.
Осуществлен синтез нанолент графена длиной до 12 нм путем конденсации бензола на металлических подложках. Однако в настоящее время этот метод синтеза очень сложен, имеет ограничения в растворимости органических макромолекул и побочные реакции при увеличении молекулярного веса молекул [6, 7].
Метод химического газофазного осаждения (CVD) является основным методом для выращивания поликристаллических пленок графена большой площади. Его основные стадии заключаются в осаждении графенового слоя на медную или никелевую [8] подложку и его последующем переносе на диэлектрическую подложку. Несмотря на сложность второй стадии, с помощью CVD-метода было произведено несколько квадратных метров графена. Однако, данный процесс является очень дорогостоящим из-за большого потребления энергии и удаления медного слоя.
Другим хорошо описанным в литературе методом синтеза графена является термическое разложение подложки карбида кремния (SiC) [9]. Двумя основными недостатками этого метода являются высокая стоимость SiC-пластин и использование высоких температур (выше 1273 К), поэтому использование графена на SiC, вероятно, будет ограниченным.
Известно [10], что материал подложки также оказывает влияние на морфологию и свойства образующихся графеновых слоев.
По словам Нобелевского лауреата К. Новоселова [11], отсутствие технологии получения графена, которая могла бы найти промышленное применение, делают затруднительным применение графена в реальных электрофизических и электрохимических устройствах в связи со сложностью создания стандартизированного метода получения графена заданной размерности, толщины и дефектности.
За последние годы был проведен ряд исследований получения углеродных покрытий и наноматериалов, в том числе нанотрубок, из расплавленных солей [12, 13]. К основным методам синтеза углеродных материалов в расплавленных солях нужно отнести либо электролиз углеродных (графитовых) электродов в расплавленных солях, в частности хлорида лития [13–15], либо катодное восстановление карбонатных ионов или диоксида углерода на фоне расплавленных хлоридов или фторидов щелочных металлов [16–20]. Однако этими методами графеновые слои в расплавленных галогенидах щелочных металлов не были получены.
Наши предыдущие исследования были посвящены электрохимическому синтезу в расплавленных солях допированного бором графена на поверхности платины [21], а также синтезу иерархически структурированных углеродных гибридных пленок на поверхности расплавленного цинка [22].
Предлагаемый новый способ получения графена основан на электрохимическом окислении карбида бора в расплавленном электролите, состоящем из галогенидов щелочных металлов, на поверхности титана.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Окисление карбида бора в хлоридном расплаве
Исследования взаимодействия карбида бора со смесью расплавленных хлоридов щелочных металлов были проведены в температурном интервале 793–903 К. Как известно, В4С является одним из самых термодинамически устойчивых соединений (плавится выше 2723 К). Разложения карбида бора на бор и углерод по реакции (1) в указанном температурном интервале не происходит (табл. 1). Однако порошок карбида бора окисляется кислородом воздуха даже при пониженном давлении кислорода. В [23] рассчитана термодинамическая вероятность протекания различных реакций в системе В4С–О2 при давлении кислорода 1.3 ⋅ 10–3 кПа. Показано, что в процессе окисления В4С возможно образование, наряду с конденсированными (В2О3, В, С), целого ряда газообразных (СО, СО2, В2О2, ВО, ВО2) продуктов.
Таблица 1.
Значения энергий Гиббса для реакций (1)–(5)
| Реакция | ΔG793 К, кДж/моль | ΔG843 К, кДж/моль |
ΔG903 К, кДж/моль |
|---|---|---|---|
| В4С = 4В + С (1) | 60.454 | 60.307 | 60.107 |
| В4С + 4О2 = 2В2О3 + СО2 (2) | –2476.112 | –2453.915 | –2431.94 |
| В4С + 3О2 = 2В2О3 + С (3) | –2080.604 | –2058.32 | –2036.265 |
| В4С + 6Cl2 = 4BCl3 (г) + С (4) | –1391.355 | –1384.363 | –1369.39 |
| В4С + 12Cl– – 12ē = 4BCl3 (г) + С (5) | –1603.505 | –2028.113 | –2652.675 |
Порошкообразный мелкодисперсный карбид бора (размер зерна около 100 мкм), который использовался в исследованиях, адсорбирует на своей поверхности кислород воздуха. Как показывают расчеты энергии Гиббса, окисление карбида бора адсорбированным кислородом, протекающее по реакции (2) (табл. 1) с образованием оксида бора и диоксида углерода термодинамически более выгодно во всем температурном интервале, чем реакция (3), согласно которой окисление карбид-иона проходит с образованием углерода. Была рассчитана и энергия Гиббса реакции окисления карбид-иона в составе карбида бора газообразным хлором (реакция (4)). Как показывают расчеты, такая реакция менее термодинамически вероятна, чем окисление газообразным кислородом при тех же температурах. Следовательно, нет необходимости в добавлении дополнительного окислителя – газообразного хлора – для получения углерода окислением карбида бора, что существенно упрощает схему получения углеродных материалов в расплавленных солях.
Были проведены “холостые” эксперименты длительностью до 5 ч по взаимодействию порошка карбида бора с расплавленным хлоридным электролитом под атмосферой аргона, однако, при этом не было отмечено образование углерода в объеме солевого электролита.
Содержание ионов бора в застывшем солевом плаве после 5-часовой выдержки порошка карбида бора контролировали при помощи химико-аналитического метода. Для определения содержания бора навеску соли растворяли при нагревании с обратным холодильником, после чего анализировали на оптическом эмиссионном спектрометре “iCAP 6300 Duo” (США). Очевидно, что скорости взаимодействия карбида бора с кислородом воздуха в среде расплавленных хлоридов по реакциям (2), (3) невелики, что, в конечном счете, выражается в очень малых содержаниях ионов бора в хлоридном расплаве. По данным химического анализа при 863 К из 0.2 мас. % В4С, внесенного в расплав в виде навески, за 5 часов в растворенное состояние переходит лишь 6.4 ⋅ 10–4 мас. % В3+, а при 903 К – 7.6 ⋅ 10–4 мас. % В3+.
Большая часть навески карбида бора остается на дне солевого электролита в виде черного порошка, что связано, вероятно, с тем фактом, что количество адсорбированного поверхностью частиц порошка карбида бора кислорода невелико, а окисление карбид-ионов без присутствия металлической подложки в расплаве солей протекает по реакции (2) с образованием оксида углерода.
Теоретическое обоснование метода
Расчет энергий Гиббса реакций взаимодействия титана с карбидом бора, в том числе в присутствии кислорода, представлены в табл. 2. Продукты взаимодействия в вышеперечисленных реакциях соответствуют тем, которые были определены в реально проведенных экспериментах. Все вышеперечисленные реакции термодинамически возможны, однако, самое низкое значение энергии Гиббса было рассчитано для реакции (6), в которой не участвует кислород. Следовательно, процесс выделения углерода при взаимодействии титана с карбидом бора в присутствии кислорода термодинамически более выгоден, и эта реакция может проводиться в стационарном режиме при температурах 793–903 К.
Таблица 2.
Значения энергии Гиббса реакций (6)–(11)
| Реакция | ΔG793 К, кДж/моль | ΔG843 К, кДж/моль |
ΔG903 К, кДж/моль |
|---|---|---|---|
| 2Ti + B4C = 2TiB2 + C (6) | –474.421 | –473.138 | –471.851 |
| 3Ti + B4C = 2TiB2 + TiC (7) | –649.912 | –647.795 | –645.242 |
| 3Ti + B4C + O2= 2TiB2 + TiO2 + C (8) | –1273.78 | –1265.38 | –1256.98 |
| 5Ti + B4C + O2= 4TiB + TiO2 + C (9) | –1371.26 | –1363.65 | –1356.04 |
| 2Ti +2 B4C + O2= TiC + TiO2 + C + 8B (10) | –853.967 | –844.84 | –835.972 |
| 2Ti + 6B4C + $4{\text{Cl}}_{{({\text{a}})}}^{ - }$ + O2 –4ē = TiCl4(г) + TiO2 + 6C + 24B (11) | –1081.00 | –1196.41 | –1339.32 |
Однако, несмотря на большое отрицательное значение энергии Гиббса вышеприведенных реакций, этот процесс никогда не был реализован на практике. Очевидно, что протекание этого процесса затруднено наличием на поверхности титана плотных оксидных пленок вследствие высокого сродства к кислороду. Активация поверхности титана, выражающаяся в разрушении оксидного слоя на металлической подложке, может осуществляться либо хлорид-ионами в солевом расплавленном электролите, либо анодной поляризацией титана или циркония в хлоридном расплаве, что еще ускоряет процесс образования боридного покрытия на титане, порошков диоксидов титана либо циркония, бора, а также различных видов углерода по уравнениям реакций (6)–(11).
Кроме того, при анодной поляризации титана в расплаве, содержащем частицы карбида бора, могут протекать электрохимические реакции (11), а также:
либо(13)
$4{{{\text{B}}}_{{\text{4}}}}{\text{C}} - 9\bar {e} \to 3{{{\text{B}}}^{{3 + }}} + 4{\text{C}} + {{{\text{В}}}_{{{\text{13}}}}}{{{\text{С}}}_{{\text{2}}}}{\text{.}}$Протекание этих электрохимических реакций на практике означало бы образование больших количеств ионов бора в солевом расплавленном электролите и выделение большего количества углерода, чем в стационарных условиях.
Поэтому взаимодействие титана с хлоридным расплавом, содержащем от 0.1 до 1.0 мас. % карбида бора, в температурном интервале 793–873 К изучали как в стационарных условиях, так и при анодной поляризации титана.
Техника эксперимента
Для исследований использовали образцы из фольги из технического титана ВТ1 размером 1 × 1 см, а также цилиндрические образцы “йодидного” титана высотой 0.8 см и диаметром 1 см. Карбид бора представлял собой мелкодисперсный порошок со средним размером зерна 100 мкм. Исследования проводили в высокотемпературной электрохимической кварцевой ячейке [24]. Предварительно переплавленную хлоридную смесь тщательно измельчали, к ней добавляли навеску карбида бора (0.1–1.0 мас. %), помещали в кварцевую пробирку, закрывали плотной пробкой из вакуумной резины, воздух откачивали, после чего воздушное пространство пробирки заполняли высокочистым аргоном. Металлический электрод помещали в хлоридную смесь, содержащую карбид бора, а затем либо выдерживали в расплаве 1–5 ч без тока, либо анодно поляризовали после установления потенциала коррозии (примерно в течение 1 ч) в гальваностатическом режиме.
Остывший солевой плав растворяли в дистиллированной воде, продукты взаимодействия титана или циркония с карбидом бора анализировали при помощи рентгенофазового анализа на рентгеновской установке “RIGAKU” DNAX 2200PC, сканирующей электронной микроскопии при помощи сканирующего электронного микроскопа “GSM-5900 LV” и Рамановской спектроскопии на Рамановском микроскопе-спектрометре “Renishaw-1000”.
Образование пленок графена происходит аналогично при малых концентрациях карбида бора в хлоридном расплаве и плотностях анодного тока, образуемые при этом пленки графена прозрачны на поверхности раствора и плохо заметны невооруженным глазом.
Полученные пленки графена были затем перенесены для дальнейших исследований на металлические фольги (титан либо кремний).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез пленок графена идет в процессе окисления карбида бора в расплавленной среде галогенидов щелочных металлов кислородом воздуха, адсорбированным на поверхности частиц карбида бора, по реакциям (8)–(10) и при температуре 843–973 К. Процесс проводится в атмосфере аргона с целью контролирования скорости взаимодействия и выделения графена.
Процесс окисления карбида бора идет в одну стадию, необходимости в дополнительном окислителе нет.
Рентгенофазовое определение состава продуктов высокотемпературного взаимодействия титана с расплавленным хлоридным электролитом, содержащим от 0.1 до 1 мас. % карбида бора, показало, что состав твердых продуктов коррозии титана практически не зависит от содержания карбида бора в исходном расплаве. Основными продуктами взаимодействия являются диборид титана, преимущественно образующийся на титановой поверхности при температурах 793–813 К, порошок диоксида титана в объеме электролита при всех исследованных температурах и на поверхности титана при температурах выше 843 К, а также углерод, который может образовываться на поверхности анода и в расплаве в различных модификациях (рис. 1). После проведения процесса застывший солевой плав растворяют в дистиллированной воде: частицы непрореагировавшего карбида бора оседают на дно, частицы оксида титана находятся в растворе в виде взвеси, а чрезвычайно легкие и тонкие, не видимые глазом пленки графена находятся на поверхности раствора. С поверхности раствора пленку графена осторожно помещают на твердый носитель (в данном случае титановую пластинку).
Рис. 1.
Рентгеновская дифрактограмма продуктов взаимодействия титана в хлоридном расплаве, содержащем B4C.
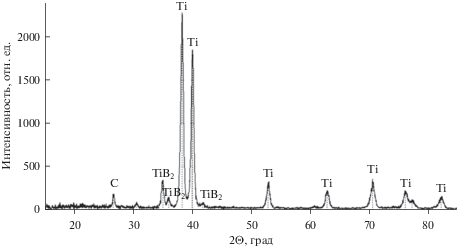
На рентгеновской дифрактограмме (рис. 1) продуктов взаимодействия, помимо пиков титана (металла подложки) и диборида титана на 35°(100), 36°(111) и 41.8°(210) имеется пик углерода на 26.2°(200) с уширением, что может свидетельствовать о высокой степени дисперсности получаемого углерода.
В зависимости от условий получения (температура эксперимента, содержание карбида бора в хлоридном расплаве, плотность анодного тока) в объеме солевого электролита могут быть образованы пленки углерода с различной морфологией.
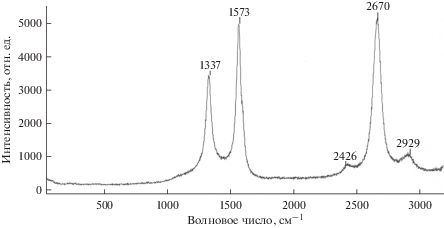
Анодная поляризация титана в хлоридном расплаве, содержащем карбид бора, при температуре 843 К приводит к образованию в объеме расплава плоских прозрачных пленок углерода (рис. 2). Размеры пластинок графена довольно значительны: 25 × 35 мкм. Проведенное Рамановское исследование полученных образцов графена показало наличие характеристических пиков: G – на 1573.72 см–1, D – 1337.29 см–1, 2D – 2670.73 см–1 (рис. 3). Все пики хорошо выражены, симметричны. По соотношению интенсивностей линий 2D и G, равному 1, определено, что был образован двуслойный графен [25]. Соотношение пиков D и G равно 0.6, что является свидетельством образования качественного, бездефектного графена. Размер графеновой пленки, количество слоев в ней не зависят от геометрии или размеров используемого титанового электрода: аналогичные пленки были получены как на плоских, так и на цилиндрических образцах.
Рис. 2.
SEM-изображение пленки графена, полученного после анодной поляризации титана в хлоридном расплаве с 0.5 мас. % B4C при 843 K, плотность тока 2 мА · см–2.

Поскольку нет данных о соответствии размеров пленок графена ни размерам титанового электрода, ни частиц карбида бора невозможно было сделать вывод, где на самом деле формируется графен: либо он образуется на поверхности титановой пластинки или частиц карбида бора и затем ввиду плохой адгезии отшелушивается и переходит в расплав, либо происходит полная деструкция поверхности частиц карбида бора, вследствие которой в объеме солевого электролита происходит самосборка углеродных атомов с образованием пленок графена, т.е. “free-standing” образование. В действительности углерод обнаруживается после электрохимического эксперимента и на поверхности титанового анода, и на поверхности порошинок карбида бора.
Плотности анодного тока, при которых на поверхности титана образуются пленки двуслойного графена, составляют величины от 0.1 до 3.0 мА · см–2. При более низких плотностях тока или бестоковой выдержке циркония в расплаве, содержащем карбид бора, образуются многослойные либо дефектные пленки углерода, а при более высоких плотностях тока образуется волокнистая структура углерода (рис. 4).
Рис. 4.
Изображение во вторичных электронах углеродных волокон, образованных на титановом аноде при плотности тока 5 мА · см–2 при температуре 973 К.

В ряде случаев пленки графена не были удалены с поверхности раствора на металлические пластинки, а слиты вместе с оксидной взвесью, отфильтрованы, высушены вместе с бумажным фильтром и затем исследованы при помощи сканирующей электронной микроскопии и Рамановской спектроскопии.
Проведенный анализ порошка диоксида титана образованного в качестве побочного продукта взаимодействия, показал, что при внимательном рассмотрении порошкового продукта в его составе легко заметить пластинки графена с характерными углами 120°, представляющие собой правильные шестиугольники (рис. 5). Эти пленки графена очень тонкие, прозрачные, через них просвечивают более глубокие слои продуктов взаимодействия. Это может быть свидетельством того факта, что образование пленок графена происходит в объеме электролита, а также то, что пленки графена, образованные в расплаве, достаточно прочные, они не разламываются при отмывании их от хлоридного расплава, фильтровании с порошком диоксида циркония и последующем отделении от бумажного фильтра. Рамановский спектр пленок, графена, отфильтрованных вместе с оксидным порошком и отмытых затем от этого порошка, ничем не отличается от снятого на поверхности металлической фольги, на которую были нанесены с поверхности раствора.
Таким образом, при электрохимическом окислении частиц карбида бора на титановом электроде в хлоридном расплаве были получены пленки двуслойного графена значительной площади, которые не были связаны с какой-либо подложкой и были зафиксированы в свободном состоянии.
Металлическая титановая подложка необходима для того, чтобы на ее поверхности проходило электрохимическое или химическое окисление карбида бора с образованием атомов углерода, который вероятно, затем самоорганизуется в хлоридном расплаве с образованием бездефектных пленок однослойного графена значительной площади, который затем может быть выделен в свободном виде, не будучи связанным с металлической подложкой.
ВЫВОДЫ
Предложен электрохимический способ получения графена, при анодной гальваностатической поляризации титана или циркония в расплаве хлоридов щелочных металлов, содержащем до 1.0 мас. % порошка карбида бора при температуре 843–873 К в атмосфере аргона [26]. Толщина, площадь и количество слоев графена могут быть проконтролированы при помощи температуры процесса и плотности анодного тока: так при малых поляризациях (менее 0.1 мА · см–2) и бестоковой 2–4 ч выдержке в расплаве образуется пленка многослойного графена, а при анодной поляризации с плотностью тока 0.1–3.0 мА · см–2 – двуслойного графена значительной площади. Процесс прекрасно воспроизводится, качество образующегося графена не меняется от серии опытов. Предлагаемый метод электрохимического синтеза дешевле и проще известных способов синтеза графена и может быть легко реализован на практике для получения больших площадей высококачественного графена.
В работе использовано оборудование Центра коллективного пользования “Состав вещества” ИВТЭ УрО РАН. Работа выполнена в соответствии с бюджетным планом Института по теме АААА-А19-119020190042-7.
Список литературы
Meier J.C., Geim A.K., Katsnelson M.I., Novoselov K.S., Obergfell D., Roth S. et al. On the roughness of single- and bi-layer graphene membranes // Solid State Communications. 2007. 143. P. 101–109.
Dideikin A.T, Sokolov V.V, Sakseev D.A, Baidakova M.V, Vul’ A.Y. Free graphene films obtained from thermally expanded graphite // Tech. Phys. 2010. 55. P. 1378–1381.
Liu Ch., Hu G., Gao H. Preparation of a few-layer and single-layer graphene by exfoliation of expandable graphite in supercritical N,N-dimethylformamide // J. Supercritical Fluids. 2012. 63. P. 99–104.
Hernandez Y., Nicolosi V., Lotya M., Blighe F.M., Sun Zh., De S. et al. High-yield production of graphene by liquid phase exfoliation of graphite // Nature Nanotech. 2008. 2. P. 563–568.
Krishnamoorthy K., Kim G.-S., Kim S.J. Graphene nanosheets: Ultrasound assisted synthesis and characterization // Ultrasound Sonochemistry. 2013. 20. P. 644–649.
Yang X.Y. Two-dimensional graphene nanoribbons // Chem. Soc. 2008. 130. P. 4216–4217.
Wu J.S., Pisula W., Mullen K. Graphene as potential material for electronics // Cem. Rev. 2007. 107. P. 718–747.
Batzill M. The surface science of graphene: Metal interfaces, CVD synthesis, nanoribbons, chemical modifications, and defects // Surface Science Reports. 2012. 67. P. 83–115.
Duraia El-Shazly M., Mansurov Z., Tokmoldin S. Formation of graphene by thermal annealing of a graphite layer on silicon substrate in vacuum // Vacuum. 2011. 86. P. 232–234.
Soldano C., Mahmood A., Dujardin E. Production, properties and potential of grapheme // Carbon. 2010. 48. P. 2127–2150.
Novoselov K.S., Fal’ko V.I., Colombo L., Gellert P.R., Schwab M.G., Kim K. A roadmap for grapheme // Nature. 2012. 490. P. 192–200.
Massot L., Chamelot P., Bouyer F., Taxil P. Studies of carbon nucleation fenimena in molten alkaline fluoride media // Electrochimica Acta. 2003. 48. P. 465–471.
Gabor T., Karman F.H., Sytchev J., Kalman E., Kaptay G. The separation of carbon nanotubes from chlorides // Carbon. 2009. 47. P. 1195–1198.
Kamali A.R., Schwandt C., Fray D.J. On the oxidation of electrolytic carbon materials // Corrosion Science. 2012. 54. P. 307–313.
Kamali A.R., Schwandt C., Fray D.J. Effect of the graphite electrode material on the characteristics of molten salt electrolytically produced carbon nanomaterials // Materials Characterization. 2011. 62. P. 987–994.
Massot L., Chamelot P., Taxil P. Preparation of tantalum carbide films by reaction of electrolytic carbon coating with tantalum substrate // J. Alloys and Compounds. 2006. 424. P. 199–203.
Song Q., Wang Y., Shang X., Li Z. Electrochemical deposition of carbon films on titanium in molten LiCl-KCl-K2CO3 // Thin Solid Films. 2012. 520. P. 6856–6863.
Lv W.Y., Zeng C.I. Preparation of cohesive graphite films by electroreduction of ${\text{CO}}_{{\text{3}}}^{{{\text{2}} - }}$ in molten Na2CO3–NaCl // Surface and Coating Technology. 2012. 206. P. 4287–4292.
Kamali A.R., Divitini G., Schwandt C., Fray D.J. Correlation between microstructure and thermokinetic characteristics of electrolytic carbon nanomaterials // Corrosion Sciences. 2012. 64. P. 90–97.
Novoselova I.A., Oliinyk N.F., Volkov S.V., Konchits A.A., Yanchuk I.B., Yefanov V.S., Kolesnik S.P., Karpets M.V. Electrolytic synthesis of carbon nanotubes from carbon dioxide in molten salts and their characterization // Physica E. 2008. 40. P. 2231–2237.
Yolshina L.A., Vovkotrub E.G., Yolshina V.A., Murzakaev A.M. A novel electrochemical method for the synthesis of boron doped graphene in the molten salt electrolyte // Synthetic Metals. 2015. 205. P. 85–91.
Yolshina V.A., Yolshina L.A., Elterman V.A., Vovkotrub E.G., Shatunova A.A., Pryakhina V.I., Khlebnikov N.A., Tarakina N.V. Synthesis of and characterization of freestanding, high-hierarchically structured graphene-nanodiamond films // Materials and Design. 2017. 135. P. 343–352
Войтович Р.Ф. Окисление карбидов и нитридов. Киев: Наук. Думка, 1981.
Yolshina L.A., Malkov V.B., Yolshin A.N. The influence of formation conditions on the electrochemical behavior of lead oxide in sulfuric acid // J. Power Sources. 2009. 191. P. 36–41.
Shivaraman S., Chandrashekhar M.V.S., Boeckl J.J., Spencer M.G. Thickness Estimation of Epitaxial Graphene on SiC Using Attenuation of Substrate Raman Intensity // J. Electro. Mater. 2009. 38. P. 725–730.
Елшина Л.А. Электрохимический способ получения графена. Патент 2 500 615 РФ.
Дополнительные материалы отсутствуют.