Расплавы, 2021, № 1, стр. 10-20
Коагуляционный механизм взрывной кристаллизации переохлажденных жидкостей
В. Д. Александров a, *, С. А. Фролова a
a Донбасская национальная академия строительства и архитектуры
Макеевка, ДНР
* E-mail: primew65@mail.ru
Поступила в редакцию 05.06.2020
После доработки 27.06.2020
Принята к публикации 17.07.2020
Аннотация
На основании термограмм нагревания и охлаждения различных веществ проанализировано явление взрывной кристаллизации переохлажденных жидкостей. В качестве доказательства явления взрывной кристаллизации приведены соответствующие термограммы в координатах температура – время для теллура, висмута, воды и уксусной кислоты. На схематической кривой охлаждения продемонстрированы различные структурные перестройки, происходящие в жидкой фазе, а также этапы затвердевания: образования зародышей кристаллов, их коагуляции и последующей изотермической кристаллизации. Взрывная кристаллизация на втором этапе характеризуется быстрым подъемом температуры из области переохлаждения до температуры плавления со скоростями, превышающими скорости охлаждения (т.е. теплоотвода) на два-три порядка. Сделана попытка объяснения явления взрывной кристаллизации с позиций известных положений кластерно-коагуляционной модели кристаллизации и теории цепных реакций. Расчетами установлено, что критические размеры зародышей кристаллов сопоставимы с размерами элементарных ячеек соответствующих кристаллических решеток, а работа их образования – с энергиями межмолекулярных связей. На основании расчетов теплоты, выделяющейся при образовании зародышей, а также межфазной поверхностной энергии, выделяемой при коагуляции зародышей кристаллов, выдвинута гипотеза о том, что “строительным” материалом роста кристаллов наряду с молекулами, могут служить кристаллоподобные кластеры и устойчивые зародыши кристаллов. Показано, что при образовании зародышей и их коагуляции выделяемая энергия эквивалентна квантам электромагнитного излучения, которая способна к активации появления новых центров кристаллизации, размножения и коагуляции зародышей. Расчеты показали, что при коагуляции множества зародышей выделяется энергия, достаточная для быстрого прогрева вещества из области переохлаждения до температуры плавления. По аналогии с известной диаграммой теплового взрыва построена и проанализирована подобная диаграмма зависимости тепловыделения и теплоотвода от времени для процесса взрывной кристаллизации. Найдены критические значения начала взрывного процесса и скорости охлаждения жидкой фазы. Дана оценка завершающей стадии равновесной кристаллизации после взрывной.
ВВЕДЕНИЕ
При исследовании процессов кристаллизации переохлажденных жидкостей простых веществ, химических соединений и сплавов сплошь и рядом обнаруживаются явления взрывной кристаллизации [1–8]. Тепловые эффекты взрывного типа основаны на энергии, выделяющейся в результате химических либо ядерных реакциях. Для осуществления таких реакций необходима активация процесса либо за счет повышения температуры, либо облучения и других воздействий. При кристаллизации подобные реакции отсутствуют. Кроме того, взрывная кристаллизация наступает при понижении температуры и происходит самопроизвольно. Для адаптации известных положений теории взрывных процессов к взрывной кристаллизации необходимо: во-первых, определиться с типами размножающихся частиц; во-вторых, с причинами их размножения; в-третьих, с источниками энергии для этого процесса.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
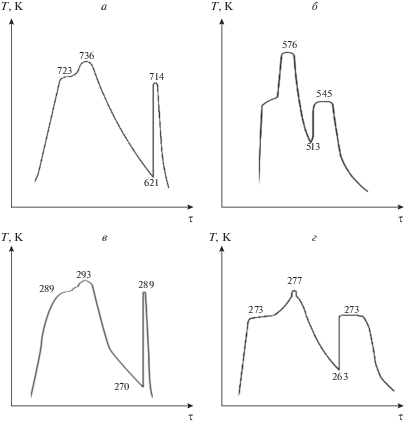
Приведем ряд последовательно записанных термограмм в координатах температура Т – время τ, характеризующих взрывную кристаллизацию для капель теллура (а) [5], висмута (б) [3], воды (в) [6] и уксусной кислоты (г) [7] (рис. 1).
Несмотря на разные методики и условия экспериментов все эти термограммы характеризуют взрывной характер кристаллизации. Об этом свидетельствуют участки быстрого подъема температуры из переохлажденной области до температуры плавления со скоростями 50–100 К/с, превышающие скорости охлаждения расплавов на несколько порядков. Согласно рис. 1 при охлаждении капель этих веществ с нормальными скоростями охлаждения фиксируются переохлаждения ~100 К для теллура, ~30 К для висмута, ~10 К для воды, ~25 К для уксусной кислоты относительно соответствующих температур плавления TL = 723; 545; 273; 289 К.
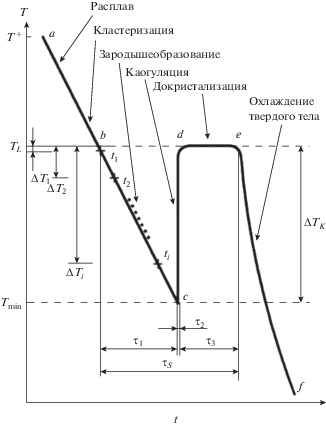
Проследим за ходом охлаждения расплава по пути abcdef по схематичной термограмме охлаждения (рис. 2), характеризующей различные изменения в структуре жидкой фазы и неравовесно-взрывной характер кристаллизации.
При охлаждении перегретого расплава имеет место обратный процесс формирования кластеров вплоть до температуры плавления. Особый интерес представляет структура частиц при переходе жидкости в переохлажденное состояние. С термодинамических позиций [11, 12], как только расплав охлаждается ниже TL, при любом переохлаждении $\Delta {{T}^{ - }}$ возникают условия образования кристаллических зародышей. Это условие определяется разностью свободных энергий Гиббса ΔGLS между жидкой GL и твердой GS фазами, напрямую зависящая от величины переохлаждения. Если проследить за охлаждением по линии bc (рис. 2), то в каждый момент времени в пределах инкубационного периода τ1 должен идти непрерывный процесс зародышеобразования. В работе [13] установлено, что критические размеры lk и работы Ak их образования выражаются следующими формулами:
(1)
${{l}_{k}} = \frac{{4{{\sigma }_{{LS}}}}}{{{{\rho }_{S}}\Delta {{H}_{{LS}}} - {{c}_{P}}\Delta \rho ({{T}_{L}} - \Delta {{T}^{ - }})}},$(2)
${{A}_{k}} = \frac{{32\sigma _{{LS}}^{3}}}{{{{{({{\rho }_{S}}\Delta {{H}_{{LS}}} - {{c}_{P}}\Delta \rho ({{T}_{L}} - \Delta {{T}^{ - }}))}}^{2}}}},$Как показали расчеты для некоторых веществ (олово, висмут, вода, нафталин, дифенил, уксусная кислота и др.) по формулам (1) и (2), величины lk и Ak оказались слабо зависящими функциями от $\Delta {{T}^{ - }}.$ Кроме того, значения lk достаточно близки к параметрам соответствующих кристаллических решеток, а Ak к энергиям связей между молекулами. Например, для олова в интервале переохлаждений от 0 до 100 К величины lk меняются от 0.613 до 0.604 нм, а для висмута – от 0.484 до 0.474 нм. Для сравнения приведем параметры решеток тетрагонального олова a = 0.583 нм, с = 0.318 нм и ромбоэдрического висмута a = 0.475 нм [14]. Получается, что в некоторых случаях зародыш кристалла может состоять всего из одной или двух элементарных ячеек.
Учитывая малый размер зародышей, примем за “строительные кирпичики” роста кристаллов наряду с молекулами кристаллоподобные кластеры и зародыши кристаллов. Вначале рассчитаем теплоту Q1, выделяющуюся при образовании одного зародыша кристалла размером в одну элементарную ячейку на примере висмута по формуле $Q = \Delta {{H}_{{LS}}}\rho {{V}_{{{\text{ЯЧ}}}}},$ где $\Delta {{H}_{{LS}}}$ – энтальпия кристаллизации, ρ – плотность кристалла, ${{V}_{{{\text{ЯЧ}}}}}$ – объем ячейки. Для висмута $\Delta {{H}_{{LS}}}$ = 54.7 ⋅ 103 Дж/кг, ρ – 10.7 ⋅ 103 кг/м3, ${{V}_{{{\text{ЯЧ}}}}} = {{a}^{{\text{3}}}}$ (а = 0.475 ⋅ 10–9 м) [14]. Откуда получаем Q1 = 0.75 ⋅ 10–19 Дж или 0.47 эВ.
Согласно рис. 2 в переохлажденном расплаве постепенно идет накопление подобных зародышей и их рост за время τ1 (по пути от точки b до точки c). Из-за медленного формирования зародышей и частичной их аннигиляции теплота зародышеобразования п-го числа зародышей недостаточна для чувствительного прогрева переохлажденного расплава. Когда же концентрация зародышей некоторого критического значения, они начинают коагулировать. В этом случае за счет резкого сокращения общей поверхности зародышей может выделяться значительное количество внутренней межфазной поверхностной энергии, что в конечном итоге может привести к резкому подъему температуры от Tmin до TL (по пути c → d).
Далее рассчитаем теплоту, выделяющуюся при коагуляции зародышей для того же висмута.
Допустим, что зародыш кубической формы имеет линейный размер, сопоставимый с параметрами элементарной ячейки. Межфазная поверхностная энергия на границе подобного кристалла с жидкостью будет равна ${{W}_{{\text{з}}}} = 6l_{k}^{2}{{\sigma }_{{LS}}},$ где lk – критический размер зародыша, σLS – удельная поверхностная энергия. В качестве примера выберем висмут, для которого lk = 0.485 нм, а σLS = 54.4 ⋅ 10–3 Дж/м2. Межфазная поверхностная энергия одной грани такого кубика будет равна ${{W}_{1}} = l_{k}^{2}{{\sigma }_{{LS}}}$ ≈ 1.28 ⋅ 10–20 Дж или 0.08 эВ. Если две подобные грани двух соседних зародышей объединятся, то энергия, выделяющаяся за счет сокращения их общей поверхности, будет равна W12 = 2W1 ≈ ≈ 2.56 ⋅ 10–20 Дж. Эта энергия эквивалентна энергии кванта электромагнитного излучения с длиной волны ~7.32 мкм, что соответствует инфракрасной области спектра [8]. При объединении таких зародышей по всем граням исходного зародыша высвободится энергия в 6 раз больше ~11.55 ⋅ 10–20 Дж или 0.72 эВ. Этой энергии достаточно для образования пяти новых зародышей, т.к. работа образования одного зародыша равна ~3.1 ⋅ 10–20 Дж или 0.19 эВ. Таким образом, данный процесс со временем может прогрессировать, обеспечивая увеличению концентрации активных центров.
Энергия Ei, высвобождающаяся при коагуляции зародышей, должна способствовать активации “замороженных” кластеров в активные, активных кластеров в устойчивые зародыши, а также стимулировать коагуляцию соседних зародышей. В инкубационный период эти переходы могут происходить медленно, т.к. часть активных частиц дезактивируется, либо исчезает за счет их превращения в устойчивые зародыши, а зародышей в более крупные кристаллиты. В конце инкубационного периода процесс накопления активных кластеров и зародышей кристаллов резко возрастает, что приводит к их коагуляции и взрывной кристаллизации.
Т.о. процессы зародышеобразования и массовой кристаллизации можно уподобить цепной реакции с автономными и разветвляющимися “звеньями”, в которой исходным “материалом” служат кластеры, а продуктами реакции – зародыши и их группировки. В этой связи попытаемся адаптировать основные положения теории цепных реакций [15] к процессу кристаллизации переохлажденной жидкости. Согласно этой теории скорость реакции определяется формулой (3):
(3)
${{U}^{ + }} = \frac{{{{U}_{0}}}}{{\beta - \delta }}\left( {1 - {{e}^{{{{ - (\beta - \delta )t} \mathord{\left/ {\vphantom {{ - (\beta - \delta )t} {{{\tau }_{0}}}}} \right. \kern-0em} {{{\tau }_{0}}}}}}}} \right),$При β > δ из уравнения (3) следует, что со временем имеем постоянную скорость
(4)
${{U}^{ + }} \to {{{{U}_{0}}} \mathord{\left/ {\vphantom {{{{U}_{0}}} {\left( {\beta - \delta } \right)}}} \right. \kern-0em} {\left( {\beta - \delta } \right)}}.$(5)
${\text{При}}\,\,\beta < \delta \,\,\,\,{{U}^{ + }} \approx \frac{{{{U}_{0}}}}{{\delta - \beta }}\left( {{{e}^{{{{(\delta - \beta )t} \mathord{\left/ {\vphantom {{(\delta - \beta )t} {{{\tau }_{0}}}}} \right. \kern-0em} {{{\tau }_{0}}}}}}} - 1} \right),$(6)
${\text{или}}\,\,{{U}^{ + }} \approx \frac{{{{U}_{0}}}}{{\delta - \beta }}{{e}^{{{{(\delta - \beta )t} \mathord{\left/ {\vphantom {{(\delta - \beta )t} {{{\tau }_{0}}}}} \right. \kern-0em} {{{\tau }_{0}}}}}}}$Тепловой эффект цепной реакции при кристаллизации представим в виде
где ΔHLS – скрытая теплота кристаллизации, m – масса вещества.Подставляя выражение (6) в (7), получают [17]
(8)
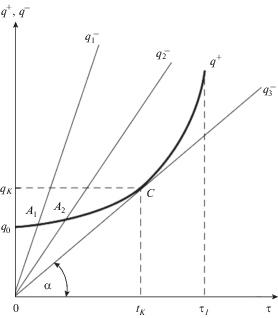
${{q}^{ + }} = \frac{{{{U}_{0}}\Delta {{H}_{{LS}}}m}}{{\delta - \beta }}{{e}^{{{{(\delta - \beta )t} \mathord{\left/ {\vphantom {{(\delta - \beta )t} {{{\tau }_{0}}}}} \right. \kern-0em} {{{\tau }_{0}}}}}}}.$Рис. 3.
Зависимость теплоприхода ${{q}^{ + }}$ и теплоотвода $q_{1}^{ - },$ $q_{2}^{ - },$ $q_{3}^{ - }$ от времени t протекания цепной реакции.
Упростив формулу (8) при условии δ > β, φ > 0, получим
(9)
${{q}^{ + }} = {{q}_{0}}{{U}^{{{{\varphi t} \mathord{\left/ {\vphantom {{\varphi t} {{{\tau }_{0}}}}} \right. \kern-0em} {{{\tau }_{0}}}}}}},$Из (9) видно, что при t → 0, q → q0, а при t → ∞, q+ → ∞.
Одновременно с тепловыделением происходит теплоотвод. Согласно закону Ньютона [18] скорость теплоотвода
где S – площадь стенки сосуда, χ – коэффициент теплопередачи, T0 – температура окружающей среды.Свяжем перепад температур T – T0 со скоростью охлаждения υохл = (T – T0)/t. Тогда получим
В зависимости от скорости охлаждения (при S = const, χ = const), будет меняться наклон прямых ${{q}^{ - }} = f\left( t \right),$ показанных на рис. 3 (линии $q_{1}^{ - },$ $q_{2}^{ - },$ $q_{3}^{ - }$). Если совместить эти линии с кривой ${{q}^{ + }}\left( t \right),$ получим известную диаграмму теплового взрыва по Семенову [15]. Если в работах [15–18] эта диаграмма строится в координатах q – температура T, то в нашем случае ее строим в координатах q – время t. Пересечение графиков ${{q}^{ + }}\left( t \right)$ и $q_{1}^{ - }\left( t \right)$ в точке A1 означает, что теплоприход и теплоотвод равны между собой, т.е. ${{q}^{ + }} = {{q}^{ - }}.$ Следовательно, в точке A1 можно приравнять уравнения (9) и (10):(12)
$\frac{{{{q}_{0}}}}{\varphi }{{e}^{{{{\varphi t} \mathord{\left/ {\vphantom {{\varphi t} \tau }} \right. \kern-0em} \tau }}}} = S\chi {{\upsilon }_{{{\text{охл}}}}}t.$При дальнейшем уменьшении скорости охлаждения точка пересечения Ai смещается до касания в точке C. Условие касания графиков ${{q}^{ + }}\left( t \right)$ и ${{q}^{ - }}\left( t \right)$ в точке C является критическим, которое разделяет спокойную реакцию (СР) от теплового взрыва (ТВ). Условие касания определяется не только равенством (12), но и равенством производных левой и правой частей этого выражения ${{(d{{q}^{ + }})} \mathord{\left/ {\vphantom {{(d{{q}^{ + }})} {dt}}} \right. \kern-0em} {dt}}$ и ${{(d{{q}^{ - }})} \mathord{\left/ {\vphantom {{(d{{q}^{ - }})} {dt}}} \right. \kern-0em} {dt}}{\text{:}}$
(13)
$\frac{{{{q}_{0}}}}{{{{\tau }_{0}}}}{{e}^{{{{\varphi t} \mathord{\left/ {\vphantom {{\varphi t} {{{\tau }_{0}}}}} \right. \kern-0em} {{{\tau }_{0}}}}}}} = S\chi {{\upsilon }_{{{\text{охл}}}}}.$(14)
${{t}_{k}} = {{{{\tau }_{0}}} \mathord{\left/ {\vphantom {{{{\tau }_{0}}} \varphi }} \right. \kern-0em} \varphi }.$Подставляя (14) в (13), находим “критическое” значение начала взрывного процесса в точке C.
(15)
$q_{k}^{ + } = {{{{q}_{0}}e} \mathord{\left/ {\vphantom {{{{q}_{0}}e} \varphi }} \right. \kern-0em} \varphi },$“Критическую” скорость охлаждения для начала ВК определяем из равенства (12) с учетом (14)
(16)
$\upsilon _{{{\text{охл}}}}^{ + } = {{{{q}_{0}}e} \mathord{\left/ {\vphantom {{{{q}_{0}}e} {{{\tau }_{0}}S\chi }}} \right. \kern-0em} {{{\tau }_{0}}S\chi }},$Проведем параллель между рассмотренными цепными реакциями и процессами образования и коагуляции зародышей кристаллов из переохлажденного состояния в соответствии с термограммой охлаждения (рис. 2). По мере охлаждения расплава из точки b до точки c за инкубационный период τ1 происходит накопление зародышей в объеме V вещества. Зависимость скорости зародышеобразования I от переохлаждения $\Delta {{T}^{ - }}$ дается уравнением [19, 20].
(17)
$I = {{I}_{0}}\exp \left[ {{{ - \left( {\Delta G + \Delta {{G}_{{\eta }}}} \right)} \mathord{\left/ {\vphantom {{ - \left( {\Delta G + \Delta {{G}_{{\eta }}}} \right)} {RT}}} \right. \kern-0em} {RT}}} \right],$При непрерывном возникновении зародышей (рис. 2) в метастабильной области нарастает степень кристалличности $\eta = {{{{V}_{x}}} \mathord{\left/ {\vphantom {{{{V}_{x}}} V}} \right. \kern-0em} V}$ (где Vx – объем, занимаемый зародышами). В данном случае можно использовать уравнение Аврами–Колмогорова [21]
для нахождения константы зародышеобразования Z и показателя Аврами $\nu .$Например, по термограмме на рис. 2, схожей с экспериментально наблюдаемой для олова массой 2 г [1], путем измерения ${{\eta }_{i}}$ на линии bc за промежуток времени ti и их подстановки в уравнение (18) были вычислены значения Z = 2.35 ⋅ 10–3 и $\nu $ = 1.66. Степени кристалличности τi определяли из термограммы из отношения ${{\eta }_{i}} = {{{{t}_{i}}} \mathord{\left/ {\vphantom {{{{t}_{i}}} {{{\tau }_{1}}}}} \right. \kern-0em} {{{\tau }_{1}}}},$ где 0 < ti ≤ ${{\tau }_{1}}.$ Например, при скорости охлаждения ~0.11 К/с ηi = 65 с.
При коагуляции зародышей за время τ2 их число в объеме Vk стремительно уменьшается, образуя начальный твердый конгломерат. Процесс объединения зародышей (на участке cd) за время от ${{\tau }_{1}},$ до ${{\tau }_{1}}$ + ${{\tau }_{2}}$ можно описать уравнением [22]:
(19)
${{n}_{k}} = {{n}_{{k0}}} \cdot \exp \left( {{{ - K} \mathord{\left/ {\vphantom {{ - K} {\left( {t - {{\tau }_{1}}} \right)}}} \right. \kern-0em} {\left( {t - {{\tau }_{1}}} \right)}}} \right),$(20)
$K = \frac{{\ln \left( {{{{{c}_{p}}\Delta {{T}^{ - }}} \mathord{\left/ {\vphantom {{{{c}_{p}}\Delta {{T}^{ - }}} {\Delta {{H}_{{LS}}}}}} \right. \kern-0em} {\Delta {{H}_{{LS}}}}}} \right)}}{{{{\tau }_{2}}}}.$Вернемся к рис. 2 и рассмотрим причину резкого скачка температуры от Tmin до TL на втором этапе кристаллизации за время ${{\tau }_{2}}.$ Самопроизвольный быстрый скачок температуры может быть следствием определенной экзотермической реакции, наподобие рассмотренной выше цепной реакции взрывного типа. Такой адиабатный эффект можно объяснить тепловыделением за счет излишней межфазной энергии при коагуляции частиц. В работе [23] дана оценка энергии объединения n зародышей кубической формы с размером ребра lk, соответствующего размеру критического зародыша. Расчеты на примере олова показали, что этой энергии достаточно, чтобы прогреть образец массой ~2 г на величину ~20 К, т.е. от точки c до точки d (рис. 2), что достаточно близко к экспериментально наблюдаемым [4].
Завершающая стадия затвердевания относится к изотермическому процессу докристаллизации оставшейся части 1 – ηk расплава по пути de (рис. 2), происходящей за счет поглощения оставшихся и вторичных зародышей за время ${{\tau }_{3}}.$
Список литературы
Шкловский В.А., Кузьменко В.М. Взрывная кристаллизация аморфных веществ // Успехи физических наук. 1989. 57. № 2. С. 311–338.
Скрипов В.П., Коверда В.П. Спонтанная кристаллизация переохлажденных жидкостей. М.: Наука, 1984.
Александров В.Д. Кинетика зародышеобразования и массовой кристаллизации переохлажденных жидкостей и аморфных сред // Сб. избр. трудов. Донецк: Донбасс, 2011.
Александров В.Д., Баранников А.А. Исследование влияния термической предыстории капель олова и свинца на их кристаллизацию методом циклического термического анализа // Химическая физика. 1998. 17. № 10. С. 140–147.
Александров В.Д., Петренко В.И. Новые экзо- и эндотермические эффекты в расплаве теллура, обнаруженные методом ЦТА // Расплавы. 1988. 2. № 5. С. 29–34.
Александров В.Д., Баранников А.А. Термические эффекты при кристаллизации капель воды в естественных условиях // Журн. физической химии. 2000. 74. № 4. С. 595–599.
Александров В.Д., Постников В.А., Щебетовская Н.В. Исследование предкристаллизационных переохлаждений капель уксусной кислоты // Вестник Новгородского гос. университета. 2014. № 61. С. 64–68.
Шибков А.А., Желтов М.А., Королев А.А., Майоров А.В. Электромагнитная и акустическая эмиссия при взрывной кристаллизации переохлажденной капли воды // Вестник тамбовского гос. ун-та. 1999. 4. С. 395–398.
Дутчак Я.И. Рентгенография жидких металлов. Львов: Вища школа. 1977.
Скрышевский А.Д. Структурный анализ жидкостей и аморфных тел. М: Высш. школа. 1980.
Chalmers B. Principles of Solidification. New York. London. Sidney: John Wiley Sons/Inc. 1968.
Perepezko I.H. Nucleation in undercooled liquids // Materials Science and Engineering. 1984. 65. I. № 1. P.125–135.
Александров В.Д., Покинтелица Е.А. Метод расчета размеров зародышей при гомогенной кристаллизации из переохлажденной жидкости // Журн. физической химии. 2016. 90. № 9. С. 1385–1388.
Дриц М.Е. Свойства элементов: Справочник. М.: Металлургия. 1985.
Семенов Н.Н. Цепные реакции. Л.: Госхимтехиздат. 1934.
Акулов Н.С. Теория цепных реакций. М.-Л.: Гостехиздат. 1951.
Андреев К.К., Беляев А.Ф. Теория взрывчатых веществ. М.: Оборонгиз. 1960.
Тотай А.В., Казаков О.Г. Теория горения и взрыва. М.:Юрайт. 2018.
Volmer M. Kinetik der Phasenbildung. Dreseden-Leipzig, Steinkopf. 1982.
Christian J. W. The theory of Transformations in Metals and Alloys. P.1. Equilibrium and General Kinetic Theory. Pergamon Press. 1975.
Wunderlich B. Macromolecular Physics. Vol. 2 Crystal Nucleation, Annealing. Academic Press. A Subsidiary of Harcourt Brace Sovanovich, Publishers. 1975.
Стромберг А.Г., Семченко Д.П. Физическая химия. М.: Высшая школа. 2001.
Александров В.Д., Зозуля А.П., Соболев А.Ю. Анализ кинетики зародышеобразования и массовой кристаллизации переохлажденного расплава в соответствии с термограммами плавкости // Расплавы. 2018. № 3. С. 350–358.
Дополнительные материалы отсутствуют.