Расплавы, 2021, № 1, стр. 46-54
Термодинамические характеристики расплавов бинарной системы Al–Hf
И. О. Гилев a, *, А. Б. Шубин a, П. В. Котенков a
a Институт металлургии Уральского отделения РАН
Екатеринбург, Россия
* E-mail: i.o.gilev@yandex.ru
Поступила в редакцию 29.07.2020
После доработки 07.10.2020
Принята к публикации 16.10.2020
Аннотация
Изучены термодинамические характеристики расплавов системы алюминий–гафний. Проведен анализ известных $({{\Delta }_{f}}H_{{298}}^{0})$ и расчет неизвестных ($(S_{{298}}^{0}),$ $(H_{{298}}^{0} - H_{{{\text{\;}}0}}^{0}),$ Cp(T) и Cp(liq)) термодинамических свойств конгруэнтно плавящихся соединений Al3Hf, Al2Hf, AlHf и Al2Hf3. Значения стандартных энтальпий образования интерметаллидов были заимствованы из литературы, где были рассчитаны на основе полуэмпирической модели Миедема, и составили –142.4, –134.1, –100.6, –225 кДж/моль для каждого из интерметаллидов, соответственно. Результаты анализа и расчетов были использованы при термодинамическом моделировании (ТМ) расплавов системы Al–Hf. В качестве расчетного инструмента при ТМ применялся программный комплекс “TERRA”. При моделировании состава и термодинамических характеристик расплавов в качестве расчетной была использована модель идеальных растворов продуктов взаимодействия (ИРПВ). На основе данной модели была изучена термодинамика жидких растворов в системе алюминий–гафний. Моделирование проводилось в исходной среде аргона при общем давлении 105 Па. Исследована область температур и составов, соответствующая жидкому состоянию данной системы 2100–2300 К. Сопоставление полученных результатов с результатами моделирования в приближении идеального раствора, позволило определить избыточные интегральные термодинамические характеристики расплавов данной системы (энтальпия, энтропия, энергия Гиббса). Показано, что энтальпии смешения закономерно уменьшаются по абсолютному значению с ростом температуры. Найденные значения сравнивались с известными данными интегральных энтальпий смешения для расплавов алюминия с другими переходными элементами III–IV группы (Sc, Ti, Zr). Установлено, что образование жидких сплавов систем Al–Hf, Al–Sc, Al–Ti и Al–Zr сопровождается значительным выделением тепла. Экстремальное значение интегральной энтальпии смешения сплава Al–Hf находится на одном уровне с той же величиной для сплава Al–Ti и по модулю не превышает –32 кДж/моль. Компоненты систем Al–Sc и Al–Zr проявляют склонность к более сильному взаимодействию, ΔHmix достигает значения –45 кДж/моль. Использованная при ТМ модель ИРПВ позволила адекватно описать термодинамические свойства расплава алюминий–гафний.
ВВЕДЕНИЕ
Последнее десятилетие большое внимание уделяется изучению влияния переходных металлов (ПМ) на структуру и свойства алюминиевых сплавов. Малые добавки переходных элементов III–IV группы, таких как Sc, Hf, Ti и Zr, способны улучшить физические и механические свойства алюминия и его соединений [1–5]. Например, выделение большой объемной доли вторичных алюминидов (Al3Sc, Al3Hf, Al3Zr, Al3Ti), при термообработке или деформации, обеспечивает повышение прочности материалов и сдерживание процессов рекристаллизации при их нагревании [6, 7]. Получение двух- и многокомпонентных алюминиевых сплавов требует знания комплекса их физико-химических свойств.
Термодинамические характеристики бинарных систем Al–ПМ в твердом состоянии достаточно широко изучены [8–10], тогда как в жидком – практически не исследованы. В ряде работ имеются данные по сплавам отдельных составов [10–12], но в большинстве случаев присутствует систематическое расхождение для различных методов измерения, что обуславливает необходимость проведения критической оценки термохимических свойств фаз и термодинамических характеристик расплавов систем Al–ПМ.
Настоящая работа посвящена изучению термодинамики жидких растворов Al–Hf во всей области составов на основе модели идеальных растворов продуктов взаимодействия (ИРПВ), частного случая модели ассоциированных растворов Пригожина и Дефея. В качестве расчетного инструмента моделирования использовался программный комплекс “Terra”, содержащий в своей базе данных термодинамические свойства для наиболее распространенных веществ в виде полиномов, описывающих температурную зависимость приведенной энергии Гиббса.
РАСЧЕТ ТЕРМОДИНАМИЧЕСКИХ ХАРАКТЕРИСТИК
Согласно диаграмме состояния в системе Al-Hf образуется семь интерметаллидов: Al3Hf, Al2Hf, Al3Hf2, AlHf, Al3Hf4, Al2Hf3, AlHf2, при этом только Al3Hf, Al2Hf, AlHf и Al2Hf3 плавятся конгруэнтно [13]. В связи с тем, что моделирование проводилось для температур превышающих температуру плавления, соединения, плавящиеся инконгруэнтно, не учитывались.
Для определения полного комплекса термохимических характеристик системы Al–Hf, предварительно был произведен расчет термодинамических свойств индивидуальных веществ и продуктов их взаимодействия: стандартная энтальпия образования при 298.15 К $({{\Delta }_{f}}H_{{298}}^{0});$ стандартная энтропия при 298.15 К $(S_{{298}}^{0});$ изменение энтальпии при нагреве вещества от 0 до 298.15 К $(H_{{298}}^{0} - H_{{{\text{\;}}0}}^{0});$ температура разложения вещества (Tф. п); энтальпия разложения вещества (ΔHф. п); зависимость удельной теплоемкости от температуры (Cp(T)) при постоянном давлении 0.1 МПа; а так же Cp(liq) при Т > Tф. п.
Описанный набор данных для металлического алюминия и гафния имеется в базе данных программного комплекса Terra и совпадает с общепринятыми справочными значениями. Для определения термодинамических характеристик интерметаллидов, образующихся в системе Al–Hf, были приняты значения ${{\Delta }_{f}}H_{{298}}^{0},$ рассчитанные в работе [14] на основе полуэмпирической модели Миедема. Несмотря на приближенность применяемой авторами методики, значения интегральных теплот образования ряда соединений в достаточной степени согласуются с данными, экспериментально полученными в трудах Мешеля и Клеппа [15] методом калориметрии.
Дальнейшая оценка проводилась при помощи расчетных методик, подробно изложенных в работах [16, 17], в соответствии с которыми:
1) Величина $S_{{298}}^{0}$ может быть представлена как аддитивная сумма энтропий составляющих систему исходных компонентов.
2) Для определения значения $H_{{298}}^{0} - H_{{{\text{\;}}0}}^{0}$ возможно применение уравнения:
где $С_{{298p}}^{0}$ – удельная теплоемкость при постоянном давлении для температуры 298.15 K (рассчитывается аддитивно).3) Оценка ΔHф. п основана на использовании соотношения:
При этом, для конгруэнтно плавящихся интерметаллидов Tф. п соответствует температуре плавления и определяется исходя из фазовой диаграммы, а $\Delta {{S}_{{{\text{ф}}{\text{.}}{\kern 1pt} \,{\text{п}}}}}$ = $\Delta S$ плавления (на один моль соединения) определяется по формуле:
Для определения температурной зависимости удельной теплоемкости применимо правило Нейманна–Коппа. Зависимость Cp(T) была представлена в виде стандартного полинома:
Cp(liq) при Т > Tф. п рассчитывали по уравнению [16]:
Термохимические свойства соединений системы Al–Hf, принятые для расчетов, приведены в табл. 1.
Таблица 1.
Термодинамические характеристики соединений системы Al–Hf, принятые для расчетов
| ИМС | –Δf$H_{{298}}^{0}$, кДж/моль | $S_{{298}}^{0}$ Дж/моль ⋅ K | $H_{{298}}^{0} - H_{0}^{0}$, Дж/моль | Тф.п, K | ΔHф.п, Дж/моль | Cp(T) = a + by + cy2 + dy3 + e ⋅ 105T –2, y = T ⋅ 10–3 |
Cp(liq) при T > Tпл(разл), Дж/моль ⋅ K | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| a | b | c | d | e | |||||||
| Al3Hf | 142.4 | 128.61 | 14 721 | 1863 | 83 394 | 24.49 | 219.49 | –156.79 | 37.96 | 19.57 | 146.4 |
| Al2Hf | 134.1 | 100.26 | 11 090 | 1923 | 64 040 | 28.90 | 135.07 | –91.53 | 21.45 | 11.49 | 111.3 |
| AlHf | 100.6 | 71.91 | 7460 | 2073 | 45 276 | 28.27 | 64.97 | –39.75 | 9.01 | 5.10 | 78.0 |
| Al2Hf3 | 225 | 187.38 | 18 750 | 1863 | 100 718 | 69.29 | 165.70 | –104.53 | 25.31 | 14.11 | 192.8 |
ТЕРМОДИНАМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
При термодинамическом моделировании была использована модель идеальных растворов продуктов взаимодействия, согласно которой состав ассоциатов, входящих в раствор, тождествен составу реально существующих соединений в соответствии с диаграммой состояния [18]. Сравнивая результаты для модели ИРПВ с результатами моделирования в приближении идеального раствора (ИР), можно найти избыточные термодинамические функции расплава.
Моделирование проводилось в исходной среде аргона при общем давлении 105 Па. Исследовалась область температур и составов, соответствующая жидкому состоянию системы Al–Hf, согласно фазовой диаграмме: T = 2100–2300 К, 0 ≤ xHf ≤ 1, где xHf – исходное содержание гафния в расплаве. При моделировании учитывали термодинамические функции следующих элементов и соединений: газообразных Al, Al2, Hf, Ar, а так же конденсированных Al, Hf, Al3Hf, Al2Hf, AlHf, Al2Hf3. В состав идеального раствора были включены только чистые Al и Hf. В модели ИРПВ наряду с Al и Hf в состав раствора были включены ассоциаты, соответствующие соединениям Al3Hf, Al2Hf, AlHf, Al2Hf3.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
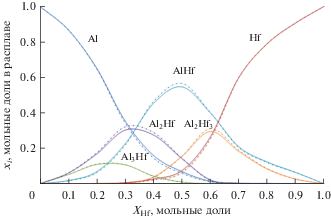
На рис. 1 представлены концентрационные зависимости составляющих расплавов Al–Hf. Видно, что кривые активностей для алюминия и гафния имеют характерный вид для систем с сильным взаимодействием компонентов. При повышении температуры количество атомов алюминия и гафния в расплаве увеличивается (а значит, растут и активности Al и Hf), тогда как содержание ассоциатов снижается.
Рис. 1.
Мольно-долевой состав расплавов гафний–алюминий в модели ИРПВ: при Т = 2100 К (штрих-пунктирные линии) и Т = 2300 К (сплошные линии).
Интегральные избыточные энтальпия $\left( {\Delta H_{{{\text{инт}}}}^{{{\text{изб}}}}} \right)$ и энтропия $\left( {\Delta S_{{{\text{инт}}}}^{{{\text{изб}}}}} \right)$ смешения, были найдены из данных термодинамического моделирования, как разность энтальпии (энтропии) рассчитанной в модели ИРПВ и той же величины, определенной в модели ИР:
Интегральная избыточная энергия Гиббса образования сплава была найдена из уравнения:
В табл. 2 представлен массив расчетных данных об избыточных функциях исследованной системы при температурах 2100, 2200, 2300 К.
Таблица 2.
Зависимость избыточных интегральных термодинамических функций от состава и температуры в системе Hf–Al
| XHf | 2100 К | 2200 К | 2300 К | |||
|---|---|---|---|---|---|---|
| –$\Delta H_{{{\text{инт}}}}^{{{\text{изб}}}}$, Дж/моль | –$\Delta G_{{{\text{инт}}}}^{{{\text{изб}}}}$, Дж/моль | –$\Delta H_{{{\text{инт}}}}^{{{\text{изб}}}}$, Дж/моль | –$\Delta G_{{{\text{инт}}}}^{{{\text{изб}}}}$, Дж/моль | –$\Delta H_{{{\text{инт}}}}^{{{\text{изб}}}}$, Дж/моль | –$\Delta G_{{{\text{инт}}}}^{{{\text{изб}}}}$, Дж/моль | |
| 0.1 | 9066 | 12 182 | 8895 | 12 334 | 8733 | 12 494 |
| 0.2 | 17 872 | 22 909 | 17 526 | 23 158 | 17 199 | 23 420 |
| 0.3 | 25 526 | 30 959 | 24 994 | 31 229 | 24 495 | 31 523 |
| 0.4 | 29 959 | 35 273 | 29 287 | 35 540 | 28 659 | 35 839 |
| 0.5 | 31 303 | 36 544 | 30 601 | 36 809 | 29 949 | 37 105 |
| 0.6 | 29 318 | 34 328 | 28 688 | 34 582 | 28 103 | 34 863 |
| 0.7 | 22 460 | 27 412 | 22 015 | 27 657 | 21 604 | 27 923 |
| 0.8 | 14 902 | 18 596 | 14 610 | 18 778 | 14 341 | 18 974 |
| 0.9 | 7338 | 9226 | 7194 | 9320 | 7060 | 9419 |
В соответствии с данными, приведенными в табл. 2, энтальпии смешения закономерно уменьшаются по абсолютному значению с ростом температуры.
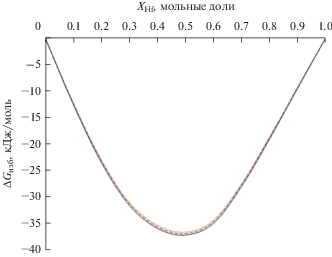
На рис. 2 представлены концентрационные зависимости интегральной избыточной энергии Гиббса при различных температурах. Точка XHf = 0.5 соответствует составу интерметаллида AlHf. Из зависимости видно, что максимум оказывается незначительно сдвинут в сторону меньшей концентрации гафния. Полученный результат согласуется с данными ТМ (см. рис. 1): содержание ассоциата AlHf в расплаве максимально, а значит и его образование вносит наибольший вклад в энергетику. Из рисунка следует, что температура вносит незначительный вклад в изменение энергии Гиббса, а значит и энтальпии.
Рис. 2.
Интегральная избыточная энергия Гиббса в системе гафний–алюминий при различных температурах: T = 2100 K (точки), T = 2200 K (пунктирная линия), T = 2300 K (сплошная линия).
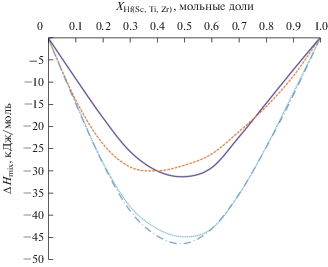
На рис. 3 представлены расчетные концентрационные зависимости интегральных энтальпий смешения (ΔHmix) в системах Al–Hf (эта работа), Al–Sc [21], Al–Ti [22 ] и Al–Zr [23 ] . Показано, что образование жидких сплавов данных систем сопровождается значительным выделением тепла. При этом экстремальные значения интегральных энтальпий смешения сплавов Al–Hf и Al–Ti находятся на одном уровне, и по модулю не превышают –32 кДж/моль. Тогда как компоненты систем Al–Sc и Al–Zr проявляют склонность к более сильному взаимодействию, ΔHmix достигает значения –45 кДж/моль.
ЗАКЛЮЧЕНИЕ
Проанализированы литературные данные по энтальпиям образования бинарных сплавов Al–Hf. Проведен полуэмпирический расчет ряда термодинамических свойств интерметаллидов в данной системе. Полученные данные были использованы для расчета комплекса термодинамических характеристик жидких сплавов алюминий-гафний в области выше линии ликвидус (2100–2300 К). Показано, что образование жидкого сплава системы Al–Hf сопровождается значительным выделением тепла (ΔHmix = = –31 303 Дж/моль). Кривая концентрационной зависимости интегральной избыточной энергии Гиббса проходят через экстремум при XHf ≈ 0.5, что соответствует составу интерметаллида AlHf. Таким образом, использованная при ТМ модель ИРПВ позволила адекватно описать термодинамические свойства расплава алюминий–гафний, тем не менее, требуются уточнения по выбору его составляющих.
Работа выполнена в рамках государственного задания ИМЕТ УрО РАН с использованием оборудования ЦКП “Урал-М”.
Список литературы
Belov N.A., Alabin A.N., Matveeva I.A., Eskin D.G. Effect of Zr additions and annealing temperature on electrical conductivity and hardness of hot rolled Al sheets // Transactions of Nonferrous Metals Society of China (English Edition). 2015. 25. P. 2817–2826.
Захаров В.В. О совместном легировании алюминиевых сплавов скандием и цирконием // Металловедение и термическая обработка. 2014. 708. № 6. С. 3–8.
Захаров В.В. О легировании алюминиевых сплавов переходными металлами // Металловедение и термическая обработка. 2017. 740. № 2. С. 3–8.
Knipling K.E., Dunand D.C., Seidman D.N. nucleation and precipitation strengthening in dilute Al–Ti and Al–Zr alloys // Metallurgical and Materials Transactions A. 2007. 38A. P. 2552–2563.
Ghosh G., Asta M. First-principles calculation of structural energetics of Al–TM (TM = Ti, Zr, Hf) intermetallics // Acta Mater. 2005. 53. P. 3225–3252.
Popova E., Kotenkov P., Shubin A., Gilev I. // Met. Mater. Int. 2019. Published online. https://doi.org/10.1007/S12540-019-00397-X
Knipling K.E., Dunand D.C., Seidman D.N. Precipitation evolution in Al–Zr and Al–Zr–Ti alloys during isothermal aging at 375–425°C // Acta Materialia. 2008. 56. P. 114–127.
Cacciamani G., Riani P., Borzone G. et al. Thermodynamic Measurements and Assessment of the Al–Sc System // Intermetallics. 1999. 7. P. 101–118.
Пягай И.Н., Вахобов А.В. Энтальпии образования алюминидов в системе Al–Sc // Металлы. 1990. № 5. С. 55–56.
Бодряков В.Ю., Замятин В.М., Московских О.П. и др. Энтальпия и теплоемкость многокомпонентных алюминиевых сплавов в твердом и жидком состояниях // Расплавы. 1997. № 3. С. 3–9.
Ghosh G., van de Walle A., Asta M. First-principles calculations of the structural and thermodynamic properties of bcc, fcc and hcp solid solutions in the Al–TM (TM = Ti, Zr and Hf) systems: A comparison of cluster expansion and supercell methods // Acta Materialia. 2008. 56. № 13. P. 3202–3221.
Balducci G., Ciccioli A., Gigli G., Gozzi D., Anselmi-Tamburini U. Thermodynamic study of intermetallic phases in the Hf-A1system // J. Alloys and Compounds.1995. 220. P. 117–121.
Murray J.L., McAlister A.J., Kahan D.J. The Al–Hf (Aluminum-Hafnium) System // J. Phase Equilibria. 1998. 19. P. 376–379.
Wang T., Jin Z., Zhao J.-C. // J. Phase Equilibria. 2002. 23. № 5. P. 416–423. https://doi.org/10.1361/105497102770331361
Meschel S.V., Kleppa O.J. Standard enthalpies of formation of 5d aluminides by high-temperature direct synthesis calorimetry // J. Alloys and Comp. 1993. 197. № 1. P. 75–81.
Моисеев Г.К., Ватолин Н.А., Маршук Л.А., Ильиных Н.И. Температурные зависимости приведенной энергии Гиббса некоторых неорганических веществ // Альтернативный банк данных АСТРА.OWN. Екатеринбург: УрО РАН. 1997.
оисеев Г.К., Ватолин Н.А. Некоторые закономерности изменения и методы расчета термохимических свойств неорганических соединений. Екатеринбург: Изд. УрО РАН. 2001
Моисеев Г.К., Вяткин Г.П. Термодинамическое моделирование в неорганических системах. Челябинск: Изд-во ЮурГУ. 1999.
Шубин А.Б., Шуняев К.Ю., Куликова Т.В. К вопросу о термодинамических свойствах жидких сплавов алюминия со скандием // Металлы. 2008. № 5. С. 9–14.
Sheng-chao D., Xiao S., Wen-sheng Y., Han-jie G., Jing G. Determination of thermodynamic properties in full composition range of Ti–Al binary melts based on atom and molecule coexistence theory // Trans. Nonferrous Met. Soc. China. 2018. 28. P. 1256–1264.
Fischer E., Colinet C. // J. Phase Equilib. Diffus. 2015. 36. P. 404–413. https://doi.org/10.1007/S11669-015-0398-Y
Дополнительные материалы отсутствуют.