Расплавы, 2021, № 1, стр. 65-78
Влияние KI на взаимодействия в системах KF–KCl, содержащих K2SiF6 и SiO2
А. В. Исаков a, *, А. О. Худорожкова a, Э. Г. Вовкотруб a, А. С. Воробьев a, А. А. Редькин a, Ю. П. Зайков a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: isakov@ihte.uran.ru
Поступила в редакцию 30.06.2020
После доработки 18.07.2020
Принята к публикации 29.07.2020
Аннотация
Исследовано взаимодействие KI с солевыми системами KF–KCl–K2SiF6 и KF–KCl– K2SiF6–SiO2. Методом КР спектроскопии изучены системы KF–KCl и KF–KCl–KI содержащие K2SiF6 и SiO2. Показано, что добавление KI в расплавы KF–KCl–K2SiF6 и KF–KCl–K2SiF6–SiO2 приводит к появлению в образцах твердых плавов группировок, содержащих связи Si–I. Установлено, что значительная часть диоксида кремния из расплавов KF–KCl–K2SiF6–SiO2 и KF–KCl–KI–K2SiF6–SiO2 кристаллизуется в виде силикатных структур характерных для фазы K2SiO3 (K2O · SiO2). Результаты КР спектроскопии согласуются с данными рентгенофазового анализа расплавов KF–KCl и KF–KCl–KI, содержащих K2SiF6 и SiO2. Выявлено, что поле кристаллизации K3SiF7 сохраняется при добавлении KI в расплавы KF–KCl–K2SiF6 и KF–KCl–K2SiF6–SiO2. При введении KI в расплав характерным является выделение его в отдельную фазу в процессе кристаллизации. Пики слабой интенсивности отвечающие кристаллизации фазы α-SiO2 обнаружены для систем KF–KCl–K2SiF6–SiO2 и KF–KCl–KI–K2SiF6–SiO2. Выполнено исследование расплавов KF–KCl–KI–K2SiF6 и KF–KCl–KI–K2SiF6–SiO2 методом синхронного термического анализа. Установлено, при температурах до 473 K наблюдаются фазовые переходы, вероятно связанные с преобразованием структур ${\text{Si}}{{{\text{I}}}_{x}}{\text{F}}_{y}^{{z - }}$ в структуры, содержащие ${\text{SiF}}_{{\text{6}}}^{{{\text{2}} - }},$ что согласуется со сведениями о термической устойчивости смешанных галогенидов кремния.
ВВЕДЕНИЕ
Электроосаждение из расплавов солей характеризуется относительно простым аппаратурным оформлением и не требует значительных затрат на подготовку сырья и материалов. Реализация электрохимической ячейки с растворимым анодом позволяет реализовать процессы синтеза материалов и наноструктур без выделения газовых продуктов. Однако чтобы внедрить перечисленные преимущества на практике требуется формирование и обобщение комплекса фундаментальных знаний. Одним из основных результатов, которые необходимы для верного понимания электродных реакций, является представление о структуре комплексных группировок потенциалопределяющих ионов. Объем необходимых знаний помимо структуры комплексных группировок должен включать и данные о физико-химических свойствах. Совокупность этих данных позволяет наиболее точно определить механизмы взаимодействия отдельных компонентов с расплавами растворителями.
В последнее время, процессы, основанные на принципах электрокристаллизации из расплавов солей, внедряются для получения новых функциональных материалов [1, 2]. Знания в области электрокристаллизации позволили синтезировать структуры и материалы, открывающие новые возможности повышения эффективности конструкций аэрокосмической отрасли, химических источников тока, фотоэлектрических преобразователей.
Значительный прогресс достигнут в области электрокристаллизации кремниевых пленок в расплавах галогенидов щелочных металлов, содержащих соединения кремния [2–5]. В работе [4] показана принципиальная возможность синтеза тонких пленок кремния n-типа из расплавов KF–KCl, содержащих K2SiF6, и изложены результаты исследования фотопроводимости таких структур.
Расплавы на основе KF–KCl, KF–KCl–KI, содержащие K2SiF6 и SiO2, являются перспективными для формирования новых способов получения кремниевых структур заданного состава и морфологии. Однако до недавнего времени оптимизацию составов расплавов было сложно проводить без понимания изменений объемно-транспортных свойств, структуры и состава соединений кремния.
На сегодняшний день стали доступными данные по температурам ликвидуса расплавленных смесей KF–KCl–KI [6, 7] и KF–KCl–KI–K2SiF6 [8]. Экспериментально подтверждена эвтектика для системы KF–KCl–KI состава 25KF–34KCl–41KI (мол. %) с температурой плавления 750 K. Имеются данные по электропроводности расплавов KF–KCl–KI и KF–KCl–KI–K2SiF6. В работе [8] показано, что повышение концентрации KI, K2SiF6 и SiO2 приводит к снижению электропроводности расплава KF–KCl–KI–K2SiF6. При этом в абсолютных величинах для диапазонов 0–75 мол. % KI и 0–5 мол. % K2SiF6 это влияние сопоставимо. В целом достигнутые результаты уже можно применять для выбора составов расплавов с опорой на известные подходы к формированию компактных слоев [9]. Выявленные закономерности коррелируют с имеющимися экспериментальными фактами. Введение добавок KI к расплаву KF–KCl–K2SiF6 [3] приводило к появлению более компактных осадков. Однако коэффициенты диффузии и количество центров нуклеации изменялись не так явно, как морфология осадка. Тем не менее, без понимания структуры комплексов кремния электродные реакции могут быть записаны только в общем виде.
Анализ существующих подходов и имеющегося задела позволяет сделать вывод о том, что для выявления механизма взаимодействия соединений кремния в KF–KCl–KI–K2SiF6 и KF–KCl–KI–K2SiF6–SiO2 расплавах не хватает данных о структуре комплексных группировок в них.
Целью работы было расширение представлений о структуре расплавов KF–KCl–KI содержащих K2SiF6 и SiO2 и формирование комплекса данных, направленных на выявление механизмов взаимодействия соединений кремния в расплавах системы KF–KCl–KI–K2SiF6 и KF–KCl–KI–K2SiF6–SiO2.
Формирование комплекса данных на основе результатов физических методов позволит сформировать исходные данные для определения и уточнения структуры комплексов в расплавленном состоянии для систем KF–KCl–KI–K2SiF6 и KF–KCl–KI–K2SiF6–SiO2. Комплекс данных позволит подключить расчетные методы для определения механизимов взаимодействий в средах для получения кремния и наноматериалов на его основе. Поведение расплавов комплексом физических методов должно быть исследовано для того, чтобы установить возможные преобразования, протекающие в расплавах. Это позволит уточнить данные для расчетов, что снизит вероятность появления несоответствий в математических моделях физических взаимодействий.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Изучение проводили в расплавах, приготовленных из индивидуальных солей: KF · HF (99.97 мас. %), KCl (99.90 мас. %) производства Реахим, KI (99.9 мас. %) производства Химреактивснаб. В качестве соединений кремния использовали K2SiF6 (99.9 мас. %, Химреактивснаб) и SiO2 (99.999 мас. %, АО Русский магний).
Хлорид калия сушили в стеклоуглеродном тигле под вакуумом при температуре 923 K в течение 4 ч. Затем соль плавили и выдерживали при 1073 K в течение часа, после чего охлаждали. Затем плав направляли на зонную плавку. На установке зонной плавки одновременно приготавливали 2.5 кг индивидуальной соли. Для этого расплавленную зону (размером 2–3 см) проводили через лодочку длинной 0.5 м со скоростью 3 см/ч. После чего получали слитки оптически прозрачного KCl. Непрозрачные хвосты отсекали. Полученный реактив использовали для исследований.
Для того чтобы подготовить иодид калия, выполнен термодинамический анализ поведения кислородных примесей в процессе йодирования KI кристаллическим йодом с последующим переплавом. Выбрана температура йодирования 723 K. Иодид калия для удаления кислородных примесей йодировали с использованием кристаллического йода. Смесь йода и иодида калия помещали в стеклоуглеродный контейнер с закрытый крышкой и вели процесс йодирования при 723 К до испарения йода. По завершении процесса иодирования KI переплавляли и выдерживали при 1073 K в течение 30 мин. Затем плав остужали до комнатной температуры. Плав хранили в сухом боксе.
Следует отметить, что зонная перекристаллизация к KI так же может быть применена, однако процесс требовал несравнимо с KCl тщательной подготовки аргона. При этом при пропускании значительных объемов аргона (99.9998%) образование раствора йода и последующее его высвобождение при переплаве наблюдалось и образец требовал повторной операции по иодированию.
Для удаления оксидной примеси гексафторсиликат калия смешивали с 2 мас. % NH4F в стеклоуглеродном тигле и в течение 6 ч выдерживали при Т = 673 K. Реакция взаимодействия:
(1)
$4{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{F}} + {\text{Si}}{{{\text{O}}}_{2}} = 4{\text{N}}{{{\text{H}}}_{{\text{3}}}}{\kern 1pt} \uparrow + {\text{ Si}}{{{\text{F}}}_{4}}{\kern 1pt} \uparrow + {\text{ }}2{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \uparrow {\kern 1pt} .$Диоксид кремния предварительно сушили в кварцевом стакане при температуре 773 K в течение 3 ч в атмосфере воздуха.
Образцы расплавов для исследований готовили следующим образом. Подготовленный хлорид калия смешивали с калием фтористым кислым в необходимом соотношении и переплавляли на воздухе. Расплав KF–KCl выдерживали на воздухе в течение 3 ч. Фторид водорода удалялся из расплава вследствие термического разложения KF · HF. Далее KF–KCl расплав замораживали и направляли на приготовление исследуемых расплавов в атмосфере аргона. В условиях инертной атмосферы производили расплавление KF–KCl, после этого в расплав вводили шихту, содержащую KI, K2SiF6, SiO2 в требуемом соотношении.
Подготовленные образцы расплавов направляли на исследование. Химический состав солей контролировали при помощи метода эмисионной спектроскопии с индуктивно-связанной плазмой на спектрометре iCAP 6300 DuoThermoscientific.
Исследование структуры соединений кремния проводили при помощи метода спектроскопии комбинационного рассеяния (КР) используя Raman микроскоп, спектрометр RENISHAWU1000 (Renishaw, UK) с конфокальным микроскопом LeicaDML. Длина волны лазера для исследований составляла 514.5 см–1 (мощность 20 мВ). Измерение проводили в диапазоне 50–1900 см–1, время экспозиции составляло 30–120 с. Спектральное разрешение составляло ±2 см–1, а точность волнового числа около ±3 см–1. Лазерный луч имел фокусное пятно диаметром ~1 мкм.
Рентгенофазовое исследование образцов расплавов KF–KCl–KI–K2SiF6 и KF–KCl–KI–K2SiF6–SiO2проводили, используя Rigaku D/MAX–2200VL/PC. Мощность рентгеновской трубки 2 кВт. Ускоряющее напряжение 20–60 кВ. Ток трубки 5–100 мА. Диапазон углов 2θ от –10° до 158°. Точность измерения углового положения 0.0005°.
СТА (синхронный термический анализ). Исследование поведения расплавов при плавлении проводили методом СТА. Синхронный термический анализ электролита проводили при помощи термического анализатора TA 499C Jupiter (NETZCH, Германия), с диапазоном рабочих температур от 153 до 1923 K. Синхронный термический анализ включал два метода: дифференциальную сканирующую калориметрию (ДСК) и термогравиметрию (ТГ). Анализ проводили в контейнере из платинородиевого сплава при скорости нагрева 10°C/мин.
Расчеты устойчивости комплексных группировок кремния проводили с применением квантовохимического подхода, изложенного в литературе [11–14].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Расплавы KF–KCl–KI, содержащие K2SiF6 и SiO2, являются перспективными для синтеза кремниевых пленок. Химическое взаимодействие кремниевых соединений приводит к установлению равновесия, в результате которого происходит образование комплексных группировок, содержащих кремний. Для того, чтобы прояснить процессы, имеющие место при растворении кремниевых соединений в расплавах KF–KCl–KI–K2SiF6 и KF–KCl–KI–K2SiF6–SiO2 и получить исходные данные для моделирования было выполнено исследование при помощи метода КР спектроскопии.
КР спектры расплавов KF–KCl–KI–K2SiF6 и KF–KCl–KI–K2SiF6–SiO2 были зарегистрированы, чтобы определить структуру комплексных группировок кремния. Для того что бы выявить влияние KI на структуру в соответствующих условиях спектры систем KF–KCl–K2SiF6, KF–KCl–K2SiF6–SiO2 так же были зарегистрированы, для выявления различия в химических преобразованиях.
Исследования проводили в расплавах с мольным соотношением KF/KCl равном 2. Соотношение KF/KCl равное 2 выбрано исходя из сведений о большей растворимости SiO2 в таких расплавах, для того, чтобы получить более четкий сигнал при исследовании различными методами.
На рис. 1 представлены Raman спектры расплавов KF–KCl и KF–KCl–KI, содержащих K2SiF6 и SiO2.
Рис. 1.
Данные КР спектроскопии расплавов, мол. %: 1 – ([66.6KF–33.4KCl]–55KI)–10K2SiF6; 2 – ([66.6KF–33.4KCl]–55KI)–10K2SiF6–3SiO2; 3 – [66.6KF–33.4KCl]–10K2SiF6; 4 – [66.6KF–33.4KCl]–10K2SiF6–3SiO2.
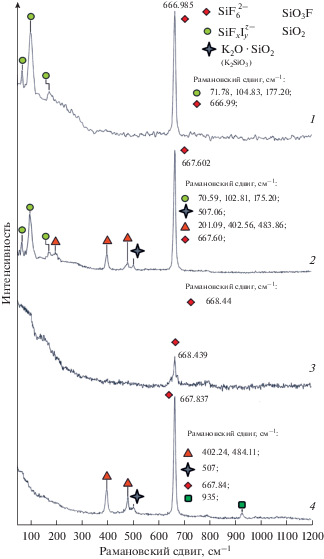
Кривая 1 (рис. 1) представляет собой КР спектр расплава, мол. %: ([66.6KF–33.4KCl]–55KI)–10K2SiF6. На спектре зарегистрированы колебательные полосы в районе 75, 101, 177 см–1 связаны с колебанием Si–I [15]. Максимумы колебаний находились в пределах неопределенности измерений. Однако непостоянное значение максимумов согласно данным в [15] может быть объяснено повышением межкристаллитного давления и некоторым несовершенством структуры образцов расплавов. Помимо этого, искажения могут быть вызваны значительным размером связей Si–I от 2.68 до 3.02 Å [15]. Колебательная полоса с максимумом около 667 см–1 соответствует колебаниям связей Si–F [16] в группировках [SiF6]2–.
Несмотря на то, что соединения типа SiFxIу могут быть синтезированы [17], доступных данных по КР спектроскопии не обнаружено. При этом количество типов колебаний Si–I позволяет предполагать наличие группировок [SiFxIy]z– согласно результатам исследований [17] эти структуры могут быть подобны йодосиланам SiFI3, SiF2I2. Для расплавленного состояния эти структуры будут выражены в комплексах типа [SiF4I2]2–, [SiF3I3]2–.
Таким образом, показано, что при взаимодействии K2SiF6 c раплавом KF–KCl–KI при кристаллизации могут быть сформированы комплексные кремниевые структуры [SiF6]2–, [SiFxIy]z–.
Одним из самых распространенных соединений кремния является SiO2. Добавки SiO2 к расплавам KF–KCl–K2SiF6 при электролизе позволяют изменять внешний вид осадка. Добавки диоксида кремния к расплаву – одна из возможностей менять морфологическое устройство катодного осадка.
Для того чтобы прояснить процессы взаимодействия SiO2 и KF–KCl–KI–K2SiF6,образцы расплавов KF–KCl–KI–K2SiF6–SiO2 были подвергнуты исследованиям (спектр 2, рис. 1).
Добавка к расплаву вызвало появление дополнительных колебательных полос с максимумами около 204, 402, 485 см–1, что согласно [18, 19] соответствует колебаниям связи Si–O в трехмерной сетке диоксида кремния. Выявлена колебательная полоса около 507 см–1 характерная для колебаний связи K–O в фазе K2SiO3 [20]. Силикат калия может быть продуктом взаимодействия оксида кремния и фторида калия [21]. Других колебательных полос не выявлено. Наличие силикатных группировок согласуется с данными [16]. Следует отметить, что в образце KF–KCl–KI–K2SiF6–SiO2 сохранились группы [SiF6]2–, [SiFxIy]z– характерные для расплавов не содержащих SiO2.
Таким образом, установлено, что при кристаллизации раславов KF–KCl–KI–K2SiF6–SiO2 диоксид кремния кристаллизуется в виде отдельной фазы. Для образцов KF–KCl–KI–K2SiF6–SiO2 характерными являются группировки [SiO4]4– (трехмерной сетки SiO2), и [SiF6]2– (K2SiF6), [SiFxIy]z– (йодосилановые группы).
Для выявления влияния KI были выполнены исследования расплавов KF–KCl–K2SiF6, KF–KCl–K2SiF6–SiO2, в составе которых отсутствовал иодид калия. Выявлено, что отсутствие KI приводит к прекращению регистрации колебательных полос, отвечающих группировкам [SiFxIy]z–.
Остальные группы [SiO4]4– (трехмерной сетки SiO2), [SiF6]2– сохраняются, в том числе обнаруживаются колебания связи Si–F (при 935 см–1) характерных группировок [SiO3F]3– [20]. Это согласуется с данными работы [16], где показано, что растворение трехмерной сетки SiO2 в расплавах KF–KCl–K2SiF6 протекает за счет разрыва связи Si–O и образования связей Si–F. Полученные результаты по различным составам расплавов обобщены в табл. 1.
Таблица 1.
Данные максимумов колебательных полос спектроскопии КР для расплавов KF–KCl и KF–KCl–KI, содержащих K2SiF6 и SiO2
| № | Состав расплава, мол. % | Соединения/ группировки | Максимумы колебательных полос, см–1 | ||
|---|---|---|---|---|---|
| 1 | ([66.6KF–33.4KCl]–55KI)–10K2SiF6 | [SiF6]2– | 668 | – | – |
| [SiFxIy]z– | 71 | 103 | 177 | ||
| 2 | ([66.6KF–33.4KCl]–55KI)–10K2SiF6–3SiO2 | [SiFxIy]z– | 668 | – | – |
| [SiFI3] | 71 | 103 | 177 | ||
| SiO2 | 402 | 485 | – | ||
| K2O · SiO2 | 507 | – | – | ||
| SiO2 | 201 | – | – | ||
| 3 | [66.6KF–33.4KCl]–10K2SiF6 | [SiF6]2– | 668 | – | – |
| 4 | [66.6KF–33.4KCl]–10K2SiF6–3SiO2 | [SiF6]2– | 668 | – | – |
| [SiO3F]3– | 935 | – | – | ||
| SiO2 | 402 | 485 | – | ||
| K2O · SiO2 | 507 | – | – | ||
Таким образом, выявлено, что при взаимодействии K2SiF6 c расплавами KF–KCl–KI происходит растворение с образованием [SiF6]2– и кремниевых группировок типа [SiFxIy]z–. При взаимодействии SiO2 cрасплавами KF–KCl–KI–K2SiF6 происходит разрушение трехмерной сетки диоксида кремния исоединения кремния стабилизируются в форме [SiO4]4–, [SiO3F]3–.
Для того чтобы дополнить результаты исследований и выявить дополнительную информацию, необходимую для определения механизмов растворения, расплавы систем KF–KCl–KI–K2SiF6, KF–KCl–KI–K2SiF6–SiO2, KF–KCl–K2SiF6, KF–KCl–K2SiF6–SiO2 были подвергнуты исследованиям при помощи рентгенофазового анализа.
Фазовый состав расплавов KF–KCl и KF–KCl–KI с добавками K2SiF6 и SiO2 исследовали при помощи рентгенофазового анализа. На рис. 2. представлены данные рентгенофазового анализа расплавов (KF–KCl)эвт и (KF–KCl–KI)эвт с добавлением K2SiF6 и SiO2.
Рис. 2.
Дифрактограммы расплавов, мол. %: 1 – (KF–KCl–KI)эвт–10K2SiF6; 2 – (KF–KCl–KI)эвт–10K2SiF6–SiO2(нас); 3 – (KF–KCl)эвт–10K2SiF6; 4 – (KF–KCl)эвт–10K2SiF6–SiO2(нас).

Выявлено, что расплавы кристаллизуются в виде многофазных твердых плавов белого матового цвета.
Выявлено, что K2SiF6, растворенный в расплавах, кристаллизуется в виде отдельной фазы. Система KF–KCl–K2SiF6 характеризуется наличием области кристаллизации гептафторсиликата калия. Наличие K3SiF7 может быть зарегистрировано фазовым анализом в системе KF–KCl–K2SiF6. Добавка K2SiF6 к (KF–KCl–KI)эвт также приводила к кристаллизации K3SiF7. Таким образом, показано, что система KF–KCl–KI–K2SiF6 обладает полем кристаллизацииK3SiF7. При этом в процессе кристаллизации происходит выделение K3SiF7 по схеме:
(2)
${\text{KF}} + {{{\text{K}}}_{{\text{2}}}}{\text{Si}}{{{\text{F}}}_{6}} \to {{{\text{K}}}_{{\text{3}}}}{\text{Si}}{{{\text{F}}}_{7}}.$Такой путь взаимодействия согласуется с тем, что в работах [16] при получении сплошных осадков из системы KF–KCl–K2SiF6 не отмечалось потери концентрации. Практически наличие K3SiF7 (Tmelt = 1133 K [18]) может говорить о том, что некоторое количество времени после расплавления больших объемов должно пройти для гомогенизации расплавов KF–KCl–K2SiF6 и KF–KCl–KI–K2SiF6 со значительным содержанием кремния, прежде чем может быть начато воспроизводимое получение кремниевых структур.
Установлено, что диоксид кремния может кристаллизоваться отдельной фазой. Присутствие фазы определить удалось, однако такой метод не подходит для контроля содержания SiO2 в расплаве.
В расплавах KF–KCl–KI–K2SiF6 и KF–KCl–K2SiF6, содержащих диоксид кремния, фиксировали пики, отвечающие фазе SiO2 слабой интенсивности. Вместе с тем, данные расплавы являлись насыщенными по SiO2. Это говорит о том, что лишь незначительная часть заданного SiO2 при охлаждении обратно кристаллизуется в оксидную фазу, обладающую выраженной кристаллической структурой. Остальная часть заданного в расплав кремния не отображается на дифрактограмме. Это связано с тем, что SiO2 выпадает в виде аморфной фазы (вероятно, как SiO2, так и нестехиометрические силикаты калия). Это согласуется с данными работы [15], где отмечено, что кристаллизация силикатов щелочных металлов и фазы оксида кремния не происходит после прокаливания вплоть до 800°C. При этом добавление оксидов металлов в силикат натрия приводит к кристаллизации оксида кремния в виде α-кристобалита [22 ] .
Продукты взаимодействий при кристаллизации K2SiF6 и SiO2, растворенные в расплавах KF–KCl–K2SiF6 и KF–KCl–KI–K2SiF6, представлены в табл. 2.
Таблица 2.
Образование фаз при кристаллизации SiO2 и K2SiF6 из растворов в расплавах солей
| № | Расплав, мол. % | Содержание, мол. % | Фазы в составе плава* | |
|---|---|---|---|---|
| K2SiF6 | SiO2 | |||
| 1 | (KF–KCl)эвт–K2SiF6 | 10 | – | KF, KCl, K3SiF7 |
| 2 | (KF–KCl)эвт–K2SiF6–SiO2 | 10 | нас. | KF, KCl, K3SiF7, α-SiO2 |
| 3 | (KF–KCl–KI)эвт–K2SiF6 | 10 | – | KF, KCl, KI, K3SiF7 |
| 4 | (KF–KCl–KI)эвт–K2SiF6–SiO2 | 10 | нас. | KF, KCl, KI, K3SiF7, α-SiO2 (кристобалит)a |
| 5 | ([66.6KF– 33.4KCl]–55KI)–K2SiF6 | 10 | – | KF, KCl, KI, K3SiF7 |
| 6 | ([66.6KF–33.4KCl]–55KI)–K2SiF6–SiO2 | 10 | 3 | KF, KCl, K3SiF7, α-SiO2 |
| 7 | [66.6KF– 33.4KCl]–K2SiF6 | 10 | – | KF, KCl, KI, K3SiF7 |
| 8 | [66.6KF–33.4KCl]–K2SiF6–SiO2 | 10 | 3 | KF, KCl, KI, K3SiF7, α-SiO2 |
Таким образом, при замораживании расплавов KF–KCl–K2SiF6, KF–KCl–KI–K2SiF6, KF–KCl–K2SiF6–SiO2, KF–KCl–KI–K2SiF6–SiO2 показано, что оксид кремния и соединения с ним кристаллизуются в виде рентгеноаморфной фазы, а K2SiF6 перекристаллизовывается в K3SiF7. Методом рентгенофазового анализа фаз, содержащих одновременно кремний и йод, не обнаружено. Однако методом КР спектроскопии выявлены группировки, обладающие связью Si–I. В виду слабой чувствительности метода, можно предполагать, что таких соединений менее 2.5–5%. Также малое количество может служить свидетельством того, что группировки типа [SiFxIy]z– термодинамически не очень устойчивы и формируются в результате процессов быстрого охлаждения расплавов.
На основании проведенных исследований может быть сформирован список группировок (табл. 1), являющийся результатом взаимодействий соединений кремния в расплавах KF–KCl–KI–K2SiF6 и KF–KCl–KI–K2SiF6–SiO2, энергию связи и термическую устойчивость которых необходимо проверить, для того, чтобы определить механизмы взаимодействий.
Для уточнения механизма взаимодействий соединений кремния в расплавах KF–KCl–KI–K2SiF6, KF–KCl–KI–K2SiF6–SiO2 были проведены ДСК и ТГ исследования совместно с масс-спектроскопическими исследованиями газовой фазы над расплавом при 296–1023 К.
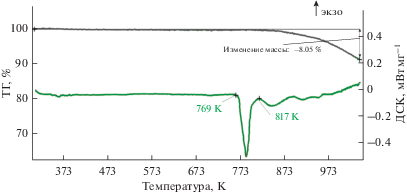
На рис. 3 представлены типичные данные ДСК, ТГ расплава ([66.6KF–33.4KCl]–55KI)–10K2SiF6 и данные масс-спектроскопии газовой фазы над исследуемым расплавом.
Рис. 3.
Результаты анализа ДСК, ТГ расплава ([66.6KF–33.4KCl]–55KI)–10K2SiF6 и масс-спектроскопии газовой фазы.
Согласно полученным данным ДСК (рис. 3) температура плавления смеси ([66.6KF–33.4KCl]–55KI)–10K2SiF6 составила 768.5 K (495.2°C) (температура пика плавления 511.5 K), температура ликвидуса смеси 793 K (520°C), что хорошо согласуется с данными [7]. Установлено, что температуры начала пиков связны с началом плавления и температурой первичной кристаллизации совпадают в пределах погрешности измерений.
В образцах наблюдаются колебания теплового потока приблизительно до 473 K (200°C). Заметной убылью массы эти процессы не сопровождаются. Это может быть связано с разложением фаз типа K2SiFxIу, что отчасти может зависеть от склонности к диспропорционированию йодофторсилановых групп SiF2I2 и SiFI3 (кип. 453 K (180°C)) вплоть до температуры кипения [19]. Соединения SiF2I2 и SiFI3 не являются продуктами реакций в расплавленном состоянии, количество твердой фазы меньше предела определения РФА, однако они зафиксированы КР спектроскопией. Такое малое количество может быть объяснено взаимодействием SiF4, растворенного в расплаве, с KI. В предельном случае (когда протекает нацело) оно может выражаться реакцией:
Расчеты показали, что ΔG реакции (3), становится отрицательным при охлаждении до температуры 628 K (355°C) и уже при 473 K (200°C) составляет –1040.072 кДж/моль. Таким образом, очень вероятно, что колебания теплового потока связаны с промежуточными продуктами реакции (3). Это подтверждается результатами расчетов устойчивости структурных единиц, обнаруженных КР спектроскопией. Результаты квантовохимического моделирования представлены в табл. 3.
Таблица 3.
Результаты исследования термической устойчивости фторидно-иодидных комплексов кремния при разных температурах (T)
| No. | Состав комплекса | Т, K | Энергии связей, эВ |
Средняя длина связи Si–F, Å |
Средняя длина связи Si–I, Å |
|---|---|---|---|---|---|
| 1 | [SiF3I3]2– | 453 | –108.982 | 1.710 | 2.962 |
| 2 | 850–1073 | Распадается на SiF3I и 2I– | |||
| 3 | [SiF4I2]2– | 850–1073 | Распадается на SiF4 и 2I– | ||
Плавление расплавов ([66.6KF–33.4KCl]–55KI)–10K2SiF6 сопровождалось потерей массы, которая достигала 6.7%. Потеря массы расплава (регистрируемая) происходит после прохождения температуры ликвидуса. Это связано с испарением веществ с поверхности зеркала расплава.
После прохождения пика 883 K (560°C) наблюдали отклонение теплового потока в эндотермическом направлении. Подобное отклонение наблюдали в работе [23 ] и связывали с реакцией:
(4)
$3{{{\text{K}}}_{{\text{2}}}}{\text{Si}}{{{\text{F}}}_{6}} = 2{{{\text{K}}}_{{\text{3}}}}{\text{Si}}{{{\text{F}}}_{7}} + {\text{Si}}{{{\text{F}}}_{{4({\text{г}})}}}.$Согласно (4), возможно образование K3SiF7 с температурой плавления 1133 K [23 ] . Однако, тот же эффект возможно связан с реакцией термического разложения гексафторсиликата:
(5)
${{{\text{K}}}_{{\text{2}}}}{\text{Si}}{{{\text{F}}}_{6}} = 2{\text{KF}} + {\text{Si}}{{{\text{F}}}_{{4({\text{г}})}}}.$Несмотря на неопределенность механизма разложения соединения K2SiF6, по возрастанию ионного тока все же понятно, что продуктом разложения является SiF4. Следует отметить, что потеря массы расплава не может быть полностью связана с реакциями разложения, заметный вклад при измерениях вносит образование паров. Пары оседают на холодных частях прибора, и их состав не может быть детектирован данной методикой.
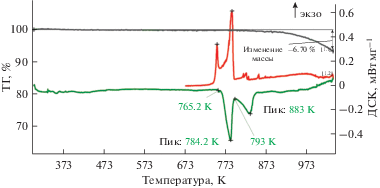
Типичные данные ДСК и ТГ расплава KF–KCl–KI–K2SiF6, содержащего SiO2, представлены на рис. 4.
Температура ликвидуса расплава ([66.6KF–33.4KCl]–55KI)–10K2SiF6–3SiO2 составила 817 K (544°C). Введение SiO2 повышает температуру ликвидуса расплавов KF–KCl–KI–K2SiF6. После добавления SiO2 наблюдается увеличение потери массы, связанное с выделением SiF4, за счет взаимодействия диоксида кремния с фторидом калия [21]. Сопоставление полученных данных и данные [21] реакция взаимодействия SiO2 может быть записана:
(6)
$4{\text{KF}} + 3{\text{Si}}{{{\text{O}}}_{2}} = 2{{{\text{K}}}_{2}}{\text{Si}}{{{\text{O}}}_{3}} + {\text{Si}}{{{\text{F}}}_{4}}{\kern 1pt} \uparrow {\kern 1pt} .$При температурах жидкого расплава реакция (6) протекает влево ΔG при 873 K (550°C) составляет –686.363 кДж/моль.
Протекание реакции (6) подтверждается наличием пика фазы силиката калия на Raman спектрах.
Таким образом, ДСК и ТГ расплавов показывают, что растворенный K2SiF6 в расплаве KF–KCl–KI–K2SiF6 разлагается с выделением тетрафторида кремния. Методом термогравиметрии расплава установлено, что добавка диоксида кремния приводит к дополнительному увеличению потери массы расплава за счет дополнительного выделения тетрафторида кремния через механизм образования силикатных структурных единиц, что подтверждается термодинамическими расчетами. Установлено, что добавка SiO2 в расплав KF–KCl–KI–K2SiF6 приводит к увеличению потери массы после плавления. Однако, преобразование фторидно-иодидных структур во фторидные, по-видимому, происходит в состоянии твердого плава, что согласуется с данными квантово-химических расчетов.
ВЫВОДЫ
На основании проведенных исследований может быть сформирован список группировок, являющийся результатом взаимодействий соединений кремния в расплавах KF–KCl–KI–K2SiF6 и KF–KCl–KI–K2SiF6–SiO2, энергию связи и термическую устойчивость которых необходимо проверить, для того, чтобы определить механизмы взаимодействий. Такие группировки будут представлять собой:
–KF–KCl–KI–K2SiF6: [SiF7]3–; [SiF6]2–; [SiFxIy]z– ([SiF4I2]2–; [SiF3I3]2–);
–KF–KCl–KI–K2SiF6–SiO2: [SiF7]3–; [SiF6]2–; [SiFxIy]z– ([SiF4I2]2–; [SiF3I3]2–); [SiO4]4–; [SiO3F]3–.
Однако исследования систем KF–KCl–KI, содержащих K2SiF6 и SiO2, показывают, что содержание фаз, включающих связи Si–I меньше предела определения метода рентгенофазового анализа. Показано, что при добавлении KI в системы KF–KCl, содержащие K2SiF6 и SiO2, сохраняется поле кристаллизации гептафорсиликата калия. Установлено, что при перекристаллизации расплавов KF–KCl–K2SiF6–SiO2, KF–KCl–KI–K2SiF6–SiO2 большая часть диоксида кремния кристаллизуется в виде силиката калия.
Выполнено исследование расплавов KF–KCl–KI–K2SiF6 и KF–KCl–KI–K2SiF6–SiO2 методом синхронного термического анализа. Установлено, при температурах до 473 K наблюдаются фазовые переходы, вероятно связанные с преобразованием структур ${\text{Si}}{{{\text{I}}}_{x}}{\text{F}}_{y}^{{z - }}$ в структуры, содержащие ${\text{SiF}}_{{\text{6}}}^{{{\text{2}} - }},$ что согласуется со сведениями о термической устойчивости смешанных галогенидов кремния и с расчетами устойчивости группировок кремния (с применением квантово-химического подхода).
Таким образом, установлено, что в исследуемых системах йод не входит в состав комплекса кремния в расплавленном состоянии, а влияние на структуру осадков реализуется за счет изменения физико-химических свойств расплавов.
Работа выполнена при финансовой поддержке Российского научного фонда, проект № 18-73-00227.
Список литературы
Huang Y., Bai S., Zhang H., Ye Y., Zhu L. Electrocrystallization of iridium on the graphite, rhenium and iridium electrode from the NaCl–KCl–CsCl–IrCl3 molten salts // International J. Refractory Metals and Hard Materials. 2018. 72. P. 263–269.
Yasuda K., Maeda K., Nohira T., Hagiwara R., Homma T. Silicon Electrodeposition in Water-Soluble KF–KCl Molten Salt: Optimization of Electrolysis Conditions at 923 K // J. Electrochem. Soc. 2016. 163. P. D95.
Isakov A.V., Zhang X., Jiang S., Zaykov Yu.P. Electrochemical obtaining of fine SI films in KF–KCl–KI–K2SiF6 melts // Tstevn. Met. 2017. 11. P. 49–54.
Зайков Ю.П., Жук С.И., Исаков А.В., Гришенкова О.В., Исаев В.А. Электроосаждение кремния из расплава KF–KCl–KI–K2SiF6 // Расплавы. 2016. № 5. С. 441–445.
Zou X., Ji L., Ge J., Sadoway D.R., Yu E.T., Bard A.J. Electrodeposition of crystalline silicon films from silicon dioxide for low-cost photovoltaic applications // Nature Communications. 2019. 10. P. 5772.
Yasuda K., Maeda K., Nohira T., Hagiwara R., Homma T. Silicon Electrodeposition in Water-Soluble KF–KCl Molten Salt: Investigations on the Reduction of Si(IV) ions // J. Electrochem. Soc. 2016. 163. P. D95–D99.
Khudorozhkova A.O., Isakov A.V., Red’kin A.A., Zaikov Y.P. // Russian Metallurgy. 2019. 8. P. 830–834. https://doi.org/10.1134/s0036029519080081
Sangster J.M., Pelton A.D. Critical Coupled Evaluation of Phase Diagrams and Their Thermodynamic Properties of Binary and Ternary Alkali Salt Systems. Special Report to the Phase Equilibria Program, Part D: The 60 Ternary Common-Ion Systems Involving (Li, Na, K, Rb, Cs) and (F, Cl, Br, I) //American Ceramic Soc. Westerville, Ohio. 1987. P. 2–181.
Khudorozhkova A., Isakov A., Apisarov A., Redkin A., Zaikov Yu. // J. Chem. Eng. Data 2020. https://doi.org/10.1021/acs.jced.9b01161
Барабошкин А.Н. Электрокристаллизация металлов из расплавленных солей М.: Наука, 1976.
Machado K., Zanghi D., Sarou-Kanian V., Cadars S., Burbano M., Salanne M., Bessada C. Study of NaF–AlF3 Melts by Coupling Molecular Dynamics, Density Functional Theory and NMR Measurements // J. Phys. Chem. C 2017. 121. № 19. P. 10289–10297.
Vorob’ev A.S., Isakov A.V., Galashev A.Y., Zaikov Yu.P. DFT-based calculations of silicon complex structures in KF–KCl–K2SiF6 and KF–KCl–K2SiF6–SiO2 melts // J. Serb. Chem. Soc. 2019. 84. № 10. P. 1129–1142.
Vorob'ev A.S., Suzdaltsev A.V., Pershin P.S., Galashev A.E., Zaikov Y.P. Structure of MF–AlF3–ZrO2 (M = K, Na, Li) ionic melts // J. Molecular Liquids. 2020. 299. P. 112241.
Vorob’ev A.S., Suzdal’tsev A.V., Galashev A.E. Binding Energies in the Molten M–Al–Zr–O–F Systems (M = Li, Na, K) // Russian Metallurgy. 2019. № 8. P. 781–786.
Shimizu H., Kume T., Kuroda T., Sasaki S., Fukuoka H., Yamanaka S. High-Pressure Raman study of iodine-doped silicon clathrate I8Si44I2 // Phus. Rev. B. 2003. 212102. P. 1–4.
ZaykovYu.P., Isakov A.V., Zakiryanova I.D, Chemezov O.V., RedkinA.A. Interaction between SiO2 and a KF–KCl–K2SiF6 melt // J. Phys. Chem. B. 2014. 118. № 6. P. 1584–1588.
Брауэр Г. Руководство по неорганическому синтезу. Т. 3. М.: Мир, 1985.
Frezzotti M.L., Tecce F., CasagliA. Raman spectroscopy for fluid inclusion analysis // J. of Geochemical Exploration. 2012. 112. P. 1–20.
Mysen B.O., Virgo D. Interaction Between Fluorine and Silica in Quenched Melts on the Joins SiO2–AlF3 and SiO2–NaF Determined by Raman Spectroscopy // Phys. Chem. Minerals. 1985. 12. P. 77–85.
Malfait W.J., Zakaznova-Herzog V.P., Halter W.E. Quantitative Raman spectroscopy: High-temperature speciation of potassium silicate melts // J. Non-Crystalline Solids. 2007. 353. P. 4029–4042.
Чернов Р.В., Мошненко В.М. Изучение растворимости двуокиси кремния во фторидных расплавах щелочных металлов // Украинский химический журн. 1976. 42. № 11. С. 1137–1139.
Дополнительные материалы отсутствуют.